通过粗壮脉纹孢菌发酵改善豆粕营养结构的研究
任志青,邓泽元,宋沥文,杨建远,2,刘 蓉,范亚苇,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.九江学院药学与生命科学学院,江西九江 332000)
通过粗壮脉纹孢菌发酵改善豆粕营养结构的研究
任志青1,邓泽元1,宋沥文1,杨建远1,2,刘蓉1,范亚苇1,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.九江学院药学与生命科学学院,江西九江 332000)
以粗壮脉纹孢菌发酵豆粕为研究对象,探讨豆粕在发酵过程中主要营养成分及其抗营养因子的变化情况。研究结果表明,随着发酵时间的延长,粗纤维降解率和粗蛋白含量总体呈上升趋势,粗脂肪含量呈下降趋势,可溶性总糖含量则先呈下降趋势,下降至谷底后又逐渐增加,这些变化规律是由粗壮脉纹孢菌产的纤维素酶引起的;类胡萝卜素含量随着发酵时间的延长而上升,植酸含量下降至12 h后趋于稳定,胰蛋白酶抑制剂活性降低至在48 h后检测不出。发酵豆粕营养成分和抗营养因子的变化规律为豆粕的进一步加工提供了理论依据。
粗壮脉纹孢菌,豆粕,营养成分,抗营养因子
豆粕是以大豆为原料提取豆油后经过热处理与干燥所得到的一种副产品[1]。豆粕因其蛋白含量丰富,价格低廉,产量高,成为优良的植物蛋白饲料。豆粕是我国畜禽最为广泛使用的优质植物蛋白质原料,大约85%的豆粕都被用作牲畜与家禽的饲料[2]。研究表明,豆粕内含的多种氨基酸在不额外加入动物性蛋白的情况下就足以满足家禽和家畜对营养的需求。豆粕的主要成分为:粗蛋白43.0%~48.0%,脂肪1.0%~2.0%,碳水化合物10.0%~15.0%,多种矿物质(如钙、磷、铜、铁等),少量的维生素(如A,B,B2),以及动物体内必需的氨基酸,尤其是其他植物性饲料易缺的赖氨酸,其含量高达2.5%~2.8%[3]。但豆粕中的抗营养因子会抑制动物体内某些消化酶的活性并与营养物质发生一系列化学反应,降低饲料利用率,造成消化不良,或者破坏动物的器官,从而影响禽畜,特别是幼龄禽畜的生长[4],是限制豆粕利用的关键问题。通过微生物发酵,可以提高豆粕的营养物质,同时还可以降低抗营养因子含量或活性,使豆粕的利用率大大地提高了。用于发酵的微生物种类较多,目前国内外多使用霉菌属、酵母菌属、芽抱杆菌属和乳酸菌属等。尹慧君[5]研究了米曲霉A-9005、黑曲霉AS3.350、枯草芽孢杆菌1389分别发酵豆粕,只是测定了发酵前后的部分营养成分和抗营养因子,有的抗营养因子并未完全消除。大部分文献[6-8]研究微生物发酵豆粕主要集中在发酵前和发酵后两个阶段的成分对比,对发酵过程中豆粕营养成分和抗营养因子变化的报道还较少。本实验室团队研究了粗壮脉纹孢菌发酵豆渣、米糠、啤酒糟、红薯渣、山药皮等原料,能产生高活力纤维素酶和高产量的类胡萝卜素,而且发现该菌体生长所需的营养条件简单、原料成本低、发酵周期短、实际生产过程容易控制,极具开发价值[9-10]。不过并未对粗壮脉纹孢菌发酵豆粕进行研究,该菌是否能消除豆粕中抗营养因子以及改善豆粕的营养结构还尚待研究。所以本研究利用产纤维素酶和类胡萝卜素能力较强的粗壮脉纹孢菌(Neurosporacrassa)发酵豆粕,通过对发酵过程中营养成分及抗营养因子的测定,全面了解发酵过程中粗壮脉纹孢菌发酵豆粕的情况,旨在提高豆粕的营养价值,降低豆粕中抗营养因子的含量或活性,为粗壮脉纹孢菌发酵豆粕生产高附加值饲料提供参考依据。
1 材料与方法
1.1材料与仪器
豆粕由江西茂昌实业有限公司提供,大豆提取豆油后的副产品,其主要成分为粗蛋白,脂肪和碳水化合物;粗壮脉纹孢菌(NeurosporacrassaCGMCC 3088)由本实验室筛选保存;Na-苯甲酰-DL-精氨酸-对硝基酰胺盐酸盐(BAPNA)、植酸二钾盐Sigma试剂;胰蛋白酶(酶活≥3000 units/mg)Aladdin试剂;硫酸、盐酸、丙酮、无水乙醇、无水乙醚、苯酚、葡萄糖等均为分析纯试剂。
AR323CN型电子天平奥豪斯仪器(上海)有限公司;722G型可见光分光光度计上海精密科学仪器有限公司;KDY-9820型凯氏定氮仪厦门精艺兴业科技有限公司;SXT-06型索氏抽提器上海洪纪仪器设备有限公司;LDZX-50KBS型立式压力蒸汽灭菌器上海申安医疗器械厂;SHZ-D(Ⅲ)型循环水式真空泵巩义市英峪华仪器厂;TDL-5-A型离心机上海安亭科学仪器厂;HWS-150型恒温恒湿箱上海精宏实验设备有限公司;PHS-25型数显pH计上海智城分析仪器制造有限公司。
1.2实验方法
1.2.1发酵豆粕的制备豆粕经过烘干、粉碎、过60目筛后,与水以1∶2.5(m/v)的比例充分混合并搅拌,于121 ℃灭菌30 min,按豆粕质量分数的2%接种粗壮脉纹孢菌,在30 ℃、湿度为70%的条件下发酵(每隔12 h取一次样),在45 ℃下烘干至恒重,粉碎后备用。
1.2.2营养成分的测定
1.2.2.1豆粕回收率豆粕灭菌接种后每隔12 h取1次样品,于45 ℃下烘干至恒重,称其质量。回收率计算公式如下:

1.2.2.2粗蛋白含量的测定采用凯氏定氮法(GB 5009.5-2010)测定。
1.2.2.3粗脂肪含量的测定采用索氏抽提法(GB/T 5009.6-2003)测定。
1.2.2.4可溶性总糖的测定采用苯酚-硫酸法测定[11]。
1.2.2.5粗纤维的测定及粗纤维降解率的计算[12]豆粕经粗壮脉纹孢菌发酵后,以粗纤维降解率为指标考察粗纤维降解效果,其计算公式如下:
式中,m0表示培养基发酵前粗纤维总质量(g);m表示培养基发酵后粗纤维总质量(g)。
1.2.2.6类胡萝卜素含量的测定[10]用0.8 mol/L的HCl溶液将烘干粉碎的0.5000 g发酵豆粕润湿,后用水洗至中性,离心取其滤渣。加入10 mL丙酮,浸提30 min,离心取其上层清液。重复提取一次,所得提取液与第一次的提取液合并。用丙酮将提取液定容25 mL,调至分光光度计波长为461 nm,测定其吸光度。类胡萝卜素含量的计算公式:
类胡萝卜素含量(μg/g干物质)=(A×V×D)/(0.16×W)
式中,A表示类胡萝卜素最大吸收波长下的吸光值;V表示提取所用的容积体积(mL);D表示测定试样时的稀释倍数;W表示培养物的质量(g);0.16为类胡萝卜素的克分子消光系数。
1.2.3抗营养因子的测定
1.2.3.1植酸含量的测定采用三氯化铁比色法[13]。配制0.1 g/L植酸标准溶液液。取0.1 g/L植酸标准溶液0.0、0.2、0.4、0.6、0.8、1.0、1.4 mL于10 mL玻璃试管中,分别加蒸馏水3.0、2.8、2.6、2.4、2.2、2.0、1.6 mL,加1 mL 0.03% FeCl3·6H2O-0.3%磺基水杨酸,摇匀,于分光光度计500 nm下测定吸光度。以植酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线。准确称取2.000 g样品,加入40 mL 1.2% HCl-10% Na2SO4溶液于室温下搅拌浸提2 h,4000 r/min离心30 min,取上清液于4 ℃冰箱中备用。取3 mL样品稀释液加1 mL 0.03% FeCl3·6H2O-0.3%磺基水杨酸试剂,混匀后于500 nm波长下测定吸光度。利用植酸标准曲线回归方程即可求得溶液中植酸的含量。
1.2.3.2脲酶活性的测定[14]准确称取经干燥粉碎的发酵豆粕0.200 g,装入比色管中,加入10 mL 0.5 mol/L尿素缓冲液(pH7.0),迅速盖上盖子剧烈摇动。然后将比色管置于(30±5) ℃的恒温水浴锅中,30 min。另称取等量试样放入另一支比色管中,加入10 mL 0.05 mol/L磷酸缓冲液(pH7.0),混合均匀,置于水浴锅中,30 min,为空白对照,每隔5 min,摇匀一次,30 min后,取出比色管将上清液倒入小烧杯中,取出5 min时,用pH计测pH。计算公式:脲酶活性=样品使尿素分解后样液的pH-空白样液的pH。
1.2.3.3胰蛋白酶抑制剂活性的测定待检样品的准备:参照赵元[15]等,取0.5 g样品,溶解50 mL蒸馏水中,200 r/min震荡30 min。取10 mL上清液,加入相同体积的Tris-CaCl2缓冲液,振荡2~3 min,过滤。用蒸馏水稀释滤液,保证胰蛋白酶的抑制率达到30%~70%,从而使胰蛋白酶抑制剂(Trypsin inhibitor,简称TI)的相对标准差达3.5%。处理样品为0.5~1.5 mg/mL。
测定方法参考Liu和Markalds[16]方法,进行TI活性检测。取1.0 mL样品稀释液,加入0.5 mL胰蛋白酶溶液和2 mL BAPNA溶液,10 min后,用30%的醋酸终止反应(0.5 mL),然后测410 nm处的吸光度(As410)。利用测定胰蛋白酶的活性,进而推算样品中胰蛋白抑制因子的含量。以蒸馏水替代样品,得到相应的吸光度(Ar410)作为对照值。活性计算:胰蛋白酶抑制剂活性(TUI/mg样品)=[(Ar410-As410)×100]/mg样品。
1.3数据统计分析
采用SPSS13.0对实验结果进行分析处理。以p<0.05为显著标准平均值,采用One-way ANOVA模型的Duncan氏法多重比较分析固态发酵工艺对豆粕各营养成分和抗营养因子的影响,结果用“平均值±标准差”表示。
2 结果与分析
2.1营养成分的变化
2.1.1豆粕回收率的变化粗壮脉纹孢菌可利用豆粕进行增殖。测定发酵豆粕的回收率,可以反映粗壮脉纹孢菌在不同时期对豆粕的利用情况。从图1可以看出,整个发酵过程大致可以分为3个阶段:第1阶段:前12 h,豆粕消耗速度很快,回收率快速降至86.6%,表明此时间段粗壮脉纹孢菌快速利用豆粕进行增殖;同期观察菌体生长情况,可以看见大量菌丝生成。第2阶段:12~84 h,此阶段豆粕培养基消耗速度减缓,回收率从86.6%逐渐降至76.5%。第3阶段:发酵84~96 h后,回收率变化较小,从75.6%降至74.5%。总之,豆粕的回收率在70%以上,说明粗壮脉纹孢菌对豆粕的消耗量较小。
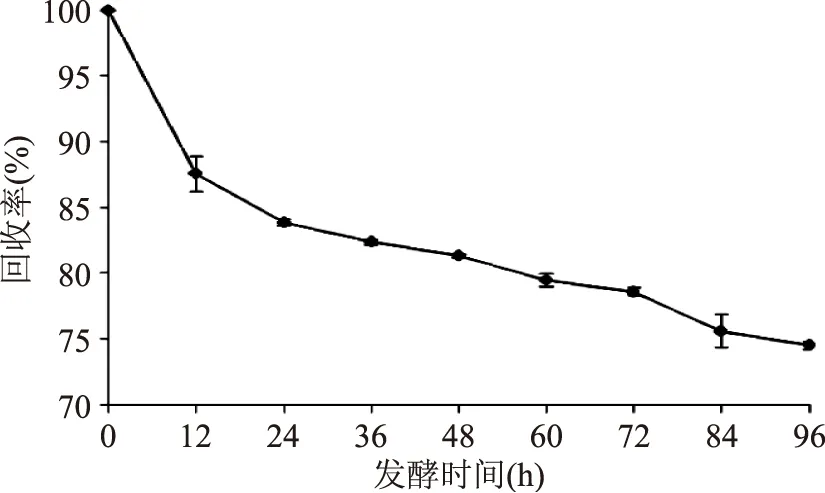
图1 发酵过程中培养基回收率的变化Fig.1 Changes of the mediumrecovery rate in fermentation process
2.1.2粗蛋白含量的变化本实验采用凯氏定氮法测定粗壮脉纹孢菌发酵豆粕过程中粗蛋白的含量,新鲜豆粕粗蛋白含量约为50.39 g/100 g,发酵96 h粗蛋白含量上升至61.19 g/100 g,提高了约11 g/100 g,有显著性差异。
由图2可知,发酵0~12 h,粗蛋白含量快速上升。发酵12~84 h,粗蛋白含量增速减缓,并在60 h时达到稳定。发酵84~96 h,粗蛋白含量急剧上升。原因可能是在发酵过程中,菌体通过消耗豆粕中的蛋白质、脂肪和碳水化合物等生长繁殖,由于粗壮脉纹孢菌的生长导致发酵豆粕中菌体蛋白质合成大量增加,提高了发酵豆粕中蛋白质的含量。其次发酵过程中消耗部分碳源,使其碳水化合物比例下降,从而提升了粗蛋白含量的比例。
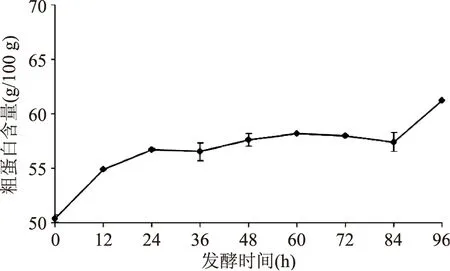
图2 发酵过程中粗蛋白含量的变化Fig.2 Changes of the crude proteincontent in fermentation process
2.1.3粗脂肪含量的变化从图3可以看出,发酵前12 h,粗脂肪含量随着培养时间的增加而减少,从2.44 g/100 g减少到最低点1.38 g/100 g;12~36 h后,粗脂肪含量变化不大,维持在1.5 g/100 g左右,发酵48 h后又开始上升,60 h时达到1.96 g/100 g。在60~84 h阶段,粗脂肪含量急剧下降达到最低值0.90 g/100 g。84~96 h后又上升到1.11 g/100 g。总体趋势看粗脂肪含量比发酵前有所下降,原因可能是发酵前期,由于菌体繁殖生长需要消耗能源,部分脂肪分解产生能量供菌体生长需要,部分脂肪合成菌体组成成分,脂肪含量相对减少,而发酵后期,脂肪含量变化趋于平缓;其次,发酵过程中豆粕的其它主要成分蛋白质和碳水化合物等一直在变化中,所以后期脂肪的相对含量变化没有规律。
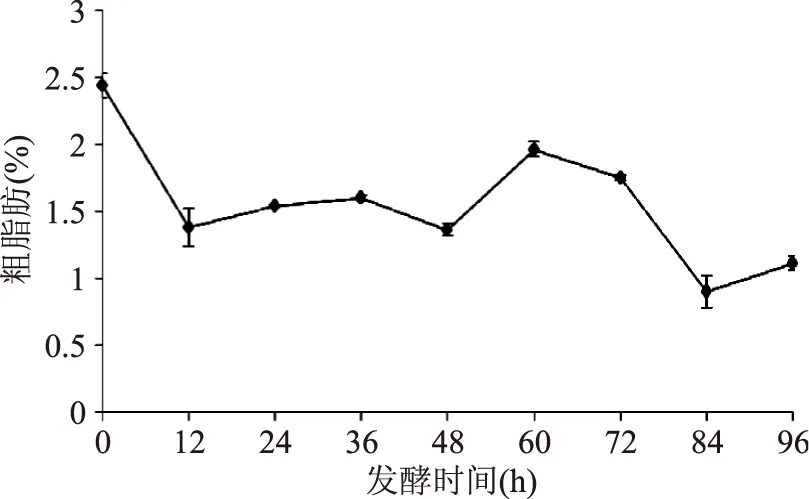
图3 发酵过程中粗脂肪含量的变化Fig.3 Changes of the crude fat content in fermentation process
2.1.4可溶性总糖含量的变化可溶性总糖含量变化如图4所示,可溶性总糖含量在前24 h内未有明显变化,基本稳定在21.84 g/100 g左右;在24~60 h内,可溶性总糖含量显著下降,最低至2.04 g/100 g;在60 h以后,可溶性总糖含量缓慢上升,至9.24 g/100 g,84 h后含量趋于平稳,基本不变。在24~60 h内,导致可溶性总糖含量显著下降的原因是粗壮脉纹孢菌繁殖发酵过程中消耗糖类所致。粗壮脉纹孢菌发酵过程中可产生纤维素酶,一般在发酵60~84 h内达到峰值[17]。在本实验中,60 h后总糖含量开始上升,发酵产生的纤维素酶降解纤维素产生单糖并且产生的单糖含量大于消耗的单糖含量,总体上可溶性总糖含量增加。到84 h后,纤维素酶活性降低,故可溶性总糖含量不再增加,趋于平稳。
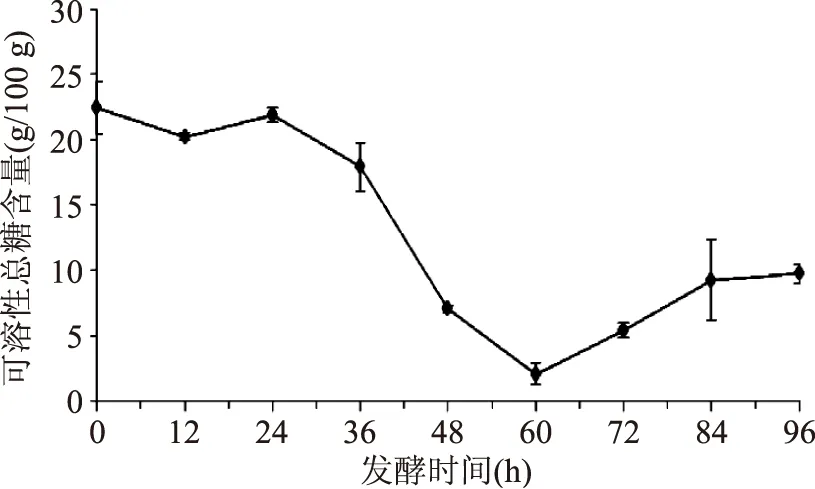
图4 发酵过程中可溶性总糖含量的变化Fig.4 Changes of the total solublesugar content in fermentation process
2.1.5粗纤维降解率的变化如图5所示,0~24 h阶段,粗纤维以很快的速度被降解了,降解率至44.33%;24~84 h,粗纤维降解率随着发酵时间缓慢增长,从48.11%缓慢增至69.46%,此时粗壮脉纹孢菌对豆粕中的粗纤维降解能力逐渐减弱;84~96 h,粗纤维降解率达到稳定状态,96 h的粗纤维降解率为71.62%,此阶段豆粕中粗纤维基本不被降解。这一变化过程同豆粕回收率的变化相似,表明发酵前24 h,粗壮脉纹孢菌利用豆粕快速增殖,同时菌丝能够分泌纤维素酶降解豆粕中的纤维素。

图5 发酵过程中粗纤维降解率的变化Fig.5 Changes of the degradation rate of crude fiber in fermentation process
2.1.6类胡萝卜含量的变化豆粕中基本不含类胡萝卜素,李红艳等[18]研究粗壮脉纹孢菌经生长后,孢子中可产生一定量的类胡萝卜素。如图6所示,前36 h类胡萝卜素含量呈缓慢上升趋势,最高达到23.125 μg/g。随着发酵时间的增加,在36~48 h内,类胡萝卜素含量急剧增加,最高达到70.625 μg/g。其后,在48~60 h内,类胡萝卜素含量下降到39.063 μg/g。发酵至60 h后,类胡萝卜素含量变化不大,基本稳定在47 μg/g左右。高氧、强光、碳源或氮源的缺乏、水分的缺乏等外界刺激条件可诱导粗壮脉纹孢菌产生大量的类胡萝卜素[19]。在本实验中,36~48 h内类胡萝卜素含量显著增加可能与碳源、氮源及水分的缺乏有关;在60 h后,类胡萝卜素含量降低至基本不变,可能原因是类胡萝卜素具有还原性,部分被氧化,并且氧气的减少会影响粗壮脉纹孢菌产生类胡萝卜素。
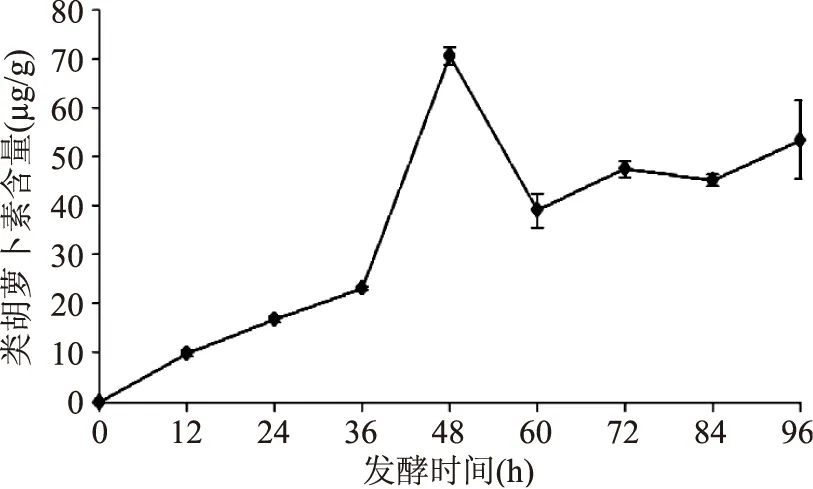
图6 发酵过程中类胡萝卜素含量的变化Fig.6 Changes of carotenoids content in fermentation process
2.2抗营养因子
抗营养因子(植酸、脲酶、胰蛋白酶抑制剂)在发酵过程中的变化如表1所示。发酵过程中,0~12 h,植酸含量迅速从6.90 g/100 g减少至1.36 g/100 g,呈显著性差异,说明粗壮脉纹孢菌能很好地降解植酸;12 h以后,植酸含量变化趋于稳定。Skrede等[20]报道,乳酸菌发酵谷物可以显著降低植酸含量。本研究中豆粕经粗壮脉纹孢菌发酵48 h后,植酸含量迅速从6.90 g/100 g减少至1.16 g/100 g,表明粗壮脉纹孢菌也能很好地降解植酸。
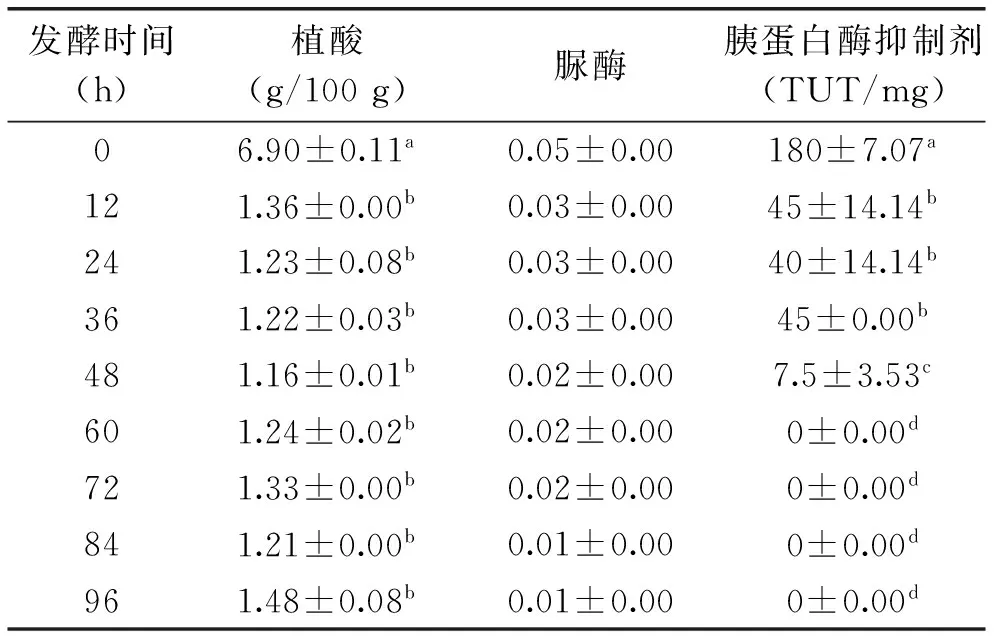
表1 抗营养因子在发酵过程中的变化
注:角标含有不同字母的每列数据之间差异显著(p<0.05)。
发酵过程中,脲酶活性有所降低,脲酶活性由0.05降低到0.01,但无显著性差异。本实验检测出的脲酶活性较小,推测是由于实验所用原料是高温豆粕,脲酶在豆粕加工中活性已基本被破坏。
发酵过程中,0~12 h,胰蛋白酶抑制剂活性迅速从180 TUI/mg降低到45 TUI/mg,说明粗壮脉纹孢菌能快速降解胰蛋白酶抑制剂;至60 h以后,胰蛋白酶抑制剂活性检测不出,表示粗壮脉纹孢菌能完全
降解胰蛋白酶抑制剂。Hackler等[21]研究认为,大豆产品中胰蛋白酶抑制剂90%以上的活性被消除,方可认为其是安全的。刘海燕[22]报道,乳酸菌发酵72 h后,豆粕中胰蛋白酶抑制剂活性仅为发酵前的1%。本实验中豆粕经粗壮脉纹孢菌发酵48 h后胰蛋白酶抑制剂已经检测不出,表明粗壮脉纹孢菌能完全降解胰蛋白酶抑制剂。
3 结论
通过追踪粗壮脉纹孢菌发酵豆粕的过程探讨豆粕在发酵过程中营养成分和抗营养因子的变化,研究结果表明:通过粗壮脉纹孢菌发酵可以改善豆粕营养成分和降低抗营养因子活性或含量,使豆粕中粗蛋白含量增加,增加粗纤维降解率,明显增加类胡萝卜素含量,抗营养因子植酸含量和胰蛋白酶抑制剂活性显著降低,脲酶活性下降,为豆粕的进一步加工提供了理论依据。
粗壮脉纹孢菌发酵豆粕过程中产生的高活力纤维素酶能降解粗纤维,使之适口性更佳。并且发酵过程中蛋白质含量和类胡萝卜素含量均升高,大大提高了豆粕作为饲料的营养价值和生物抗氧化性。抗营养因子含量或活性的降低,合理地改善了豆粕的营养结构,使其利用率大大提高,具有一定的环境与社会经济效益。发酵48 h的豆粕中类胡萝卜素含量达到最高点,粗蛋白含量和纤维素降解率也较高,同时抗营养因子含量或活性较低,故发酵48 h的豆粕最适合用来饲养家禽。
[1]刘祥,唐洪峰,郑明立,等. 豆粕的品质鉴定与掺假识别[J]. 河南畜牧兽医,2005,26(7):31-32.
[2]刘海燕,魏炳栋,闫晓刚. 微生物发酵豆粕研究进展[J]. 动物营养学报,2012,24(1):35-40.
[3]何斌,李多伟,王晓燕. 豆粕有效成分的研究进展[J]. 西北药学杂志,2012(1):86-88.
[4]宁蕾,庞新华. 抗营养因子对动物饲养的影响及降消措施[J]. 农业研究与应用,2013(3):38-42.
[5]尹慧君. 豆粕发酵前后营养价值变化的研究[D]. 济南:齐鲁工业大学,2011.
[6]戚薇,唐翔宇,王建玲,等. 益生菌发酵豆粕制备生物活性饲料的研究[J]. 饲料工业,2008,29(5):21-24.
[7]吴胜华,李吕木,张邦辉,等. 多菌种固态发酵豆粕生产小肽饲料[J]. 食品与发酵工业,2008,34(10):113-115.
[8]Hong K J,Lee C H,Kim S W. Aspergillus oryzae GB-107 fermentation improves nutritional quality of food soybeans and feed soybean meals[J]. Journal of Medicinal Food,2004,7(4):430-435.
[9]杨风玲. 粗壮脉纹孢菌发酵农副产品生产类胡萝卜素的研究[D]. 南昌:南昌大学,2014.
[10]杨婷婷,蒋海伟,贺玉珊,等. 混菌固态发酵山药皮产类胡萝卜素的工艺研究[J]. 食品工业科技,2014,35(7):236-239.
[11]曾艳,李玲,聂礼飞,等. 野西瓜低聚糖的提取及含量测定[J]. 生物技术,2009,19(2):67-70.
[12]叶俊,李静,范亚苇,等. 粗壮脉纹孢菌发酵豆渣过程中营养成分变化的研究[J]. 中国食品学报,2013,13(12):217-221.
[13]傅启高,李慧荃. 三氯化铁比色法测定植酸含量的研究[J]. 营养学报,1997,19(2):216-220.
[14]李素芬,霍贵成,杨丽洁,等. 黑龙江省主要大豆品种中胰蛋酶抑制因子含量研究[J]. 中国饲料,2001(5):8-9.
[15]赵元,秦贵信,王涛,等. 不同大豆加工制品中主要抗营养因子免疫及抑制活性的比较[J]. 大豆科学,2008,26(6):930-934.
[16]Liu K,Markakis P. An improved colorimet ric met hod for determining antit ryptic activity in soybean products[J]. Cereal Chemistry,1989,66(5):415-422.
[17]刘沛毅,邓泽元,杨建远,等. 粗壮脉纹胞菌复合多菌种发酵茶粕产纤维素酶的研究[J]. 食品科学,2014,35(1):174-179.
[18]李红艳,邓泽元,范亚苇,等. 粗壮脉纹孢菌发酵豆渣所产类胡萝卜素的研究[J]. 食品工业科技,2009,30(4):160-162.
[19]杨风玲,邓泽元,叶俊,等. 粗壮脉纹孢菌发酵产类胡萝卜素的研究进展[J]. 食品与发酵工业,2012,11:115-119.
[20]Skrede G,Storebakken T,Skrede A,et al. Lactic acid fermentation of wheat and barley whole meal flours improves digestibility of nutrients and energy in Atlantic salmon(SalmosalarL.)diets[J]. Aquaculture,2002,210(1):305-321.
[21]Hackler L R,BUREN J P,Steinkraus K H,et al. Effect of heat treatment on nutritive value of soymilk protein fed to weanling rats[J]. Journal of Food Science,1965,30(4):723-728.
[22]刘海燕. 乳酸菌发酵豆粕及其功效研究[D]. 长春:吉林农业大学,2012.
Study on fermented byNeurosporacrassato improve structural style of soybean meal nutrition
REN Zhi-qing1,DENG Ze-yuan1,SONG Li-wen1,YANG Jian-yuan1,2,LIU Rong1,FAN Ya-wei1,*
(1.State Key Lab of Food Science and Technology,Nanchang University,Nanchang 330047,China2.College of Pharmaceutical and Life Sciences,Jiujiang University,Jiujiang 332000,China)
The objective of this study was to evaluate the change rules of nutritional components and anti-nutritional factors inNeurosporacrassafermentation process of soybean meal. The results indicated the degradation rate of crude fiber and the crude protein content were increased along with fermentation time growing. The crude fats were decreased. The total soluble sugar were decreased to a bottom and then increased later. These changes were caused by cellulase produced byNeurosporacrassa. The content of carotenoids increased with the extension of fermentation. The content of phytic acid declined,and reached to steady state after 12 h. The activity of trypsin inhibitor decresed,and could not be detected after 48 h. The change rules of nutrition components and anti-nutritional factors inNeurosporacrassafermentation of soybean meal would provide a theoretical basis for the further processing of soybean meal.
Neurosporacrassa;soybean meal;nutritional components;anti-nutritional factors
2015-12-18
任志青(1990-),女,硕士研究生,主要从事微生物发酵方面的研究,E-mail:15279115063@163.com。
范亚苇(1969-),女,副教授,主要从事食品营养与微生物方向研究,E-mail:fanyw6601@sina.com。
食品科学与技术国家重点实验室基金项目(SKLF-ZZA-201303);江西省科技厅项目(20133BBF60002);江西省教育厅科学技术研究项目(GJJ14147)。
TS210.9
B
1002-0306(2016)12-0222-05
10.13386/j.issn1002-0306.2016.12.034

