紫薯花色苷的超滤和树脂联用纯化工艺
苏 鹤,杨瑞金,赵 伟,华 霄,张文斌
(1.江南大学食品学院,江苏无锡 214122;2.食品科学与技术国家重点实验室,江苏无锡 214122)
紫薯花色苷的超滤和树脂联用纯化工艺
苏鹤1,杨瑞金2,*,赵伟1,华霄1,张文斌1
(1.江南大学食品学院,江苏无锡 214122;2.食品科学与技术国家重点实验室,江苏无锡 214122)
利用超滤和大孔树脂联用的方法对紫薯花色苷粗提液进行了纯化,考查了不同截留分子量超滤膜对花色苷粗提液的纯化效果。结果表明:截留分子量为10 ku的膜可有效透过花色苷和截留大分子物质,花色苷的透过率为86.54%,蛋白质截留率为93.67%,透过液的可溶性固形物含量降低了14.29%,透光率提高了23.78%。通过对6种不同极性的大孔吸附树脂对超滤透过液中花色苷的吸附及解吸能力的考查,发现LS-305的吸附性能较好。其动态吸附及解吸条件为:上样流速5.2 BV/h,上样量35 BV;60%乙醇洗脱体积为9 BV可洗脱完全。花色苷产品色价由纯化前的1.59提高到纯化后的32.89。HPLC分析表明超滤和树脂联用纯化方法未对紫薯花色苷成分造成影响。
紫薯,花色苷,超滤,大孔树脂,纯化
近年来,由于合成色素的安全性受到质疑,因此天然色素的开发及应用越来越受到社会关注[1-3]。花色苷由于其色泽鲜亮自然,无毒无害,并且具有保健作用,可作为一种天然水溶性色素而受到广泛的关注[4-5]。花色苷广泛存在于植物的根、茎、叶、花和果实中,它是花青素与一个或者多个糖分子通过糖苷键结合而形成的化合物。葡萄、草莓、樱桃、蓝莓、紫薯等都含有花色苷,但由于紫薯产量高,易栽培,花色苷含量高,成为获取天然花色苷色素的理想原料[6]。
天然花色苷类色素色泽亮丽,安全性高,然而生产成本高和稳定性差,两者是制约天然花色苷类色素商品化和产业化的“瓶颈”[7],因而开发一条成本低、安全性高、可工业化的工艺路线很有意义。紫薯花色苷色素为水溶性,通常采用溶剂法提取,然而溶剂法提取得到粗提液中含有较多的杂质,如蛋白质、糖、淀粉等,极大的影响了花色苷的品质和稳定性,需要对其进行纯化[8]。超滤是一种膜分离技术,能耗小,不发生相变,整个过程是连续的,安全有效,可以除去提取液中的大分子物质,同时避免花色苷的变性和损失,保证天然色素的活性[9]。因而可将超滤技术运用于紫薯花色苷粗提液进行初步纯化。大孔树脂吸附法具有选择性好、吸附容量大等优点,因此在天然产物工业化提取分离中应用广泛[10]。经过超滤的初步纯化再经大孔树脂进一步精制可得到纯化的花色苷。
本文研究了超滤和大孔树脂联用对紫薯花色苷粗提液进行纯化的工艺,确定其最佳工艺条件,旨在为紫薯花色苷色素的工业化生产提供理论指导。
1 材料与方法
1.1材料与仪器
紫薯购自无锡当地市场;大孔树脂AB-8、LS-303、LS-305陕西蓝深特种树脂有限公司;大孔树脂D101、NKA-Ⅱ、DM130郑州勤实科技有限公司。
UV-1100 分光光度计上海美谱达仪器有限公司;SHA-2A型冷冻水浴恒温振荡器江苏金坛亿通电子有限公司;Pellicon切向流超滤系统美国密理博公司;SHZ-D(III)型循环水式真空泵巩义市予华仪器有限责任公司;RV 10旋转蒸发仪德国IKA-Werke公司;101-1-BS电热恒温鼓风干燥箱上海跃进医疗器械厂;BS2202 S和BS 224 S精密天平赛多利斯科学仪器(北京)有限公司;QYC-2102 全温培养摇床上海新苗医疗器械制造有限公司;FE20实验室pH计梅特勒-托利多仪器(上海)有限公司;WYA-2W双目阿贝折光仪上海索光光电技术有限公司;BS-100A 自动部分收集器、HL-2B 恒流泵上海沪西仪器设备厂;超高效液相色谱仪:Waters Acquity UPLC型美国Waters公司。
1.2实验方法
1.2.1紫薯花色苷提取工艺流程鲜紫薯→清洗、去皮→切成3~4 mm厚的片状→柠檬酸溶液浸提(柠檬酸浓度为1.6%,温度60 ℃,料液比为1∶10,振荡提取2 h)→200目滤布过滤→花色苷粗提取液。
1.2.2理化指标的测定总糖含量的测定采用苯酚-硫酸法[11];蛋白质含量测定采用考马斯亮蓝法[12];花色苷含量的测定采用pH示差法[13];可溶性固形物使用阿贝折光仪直接测定。透光率采用670 nm下的透光率值[14]。
1.2.3超滤渗透通量及效果的测定分别使用截留分子量为10、5、3、1 ku的超滤膜对紫薯花色苷提取液进行膜分离,操作条件为:室温,压力为1.379×105Pa。每次操作得到同样体积透过液,测定各膜超滤过程中渗透通量的变化,并测定各膜对蛋白质截留率、总糖截留率、花色苷透过率及透过液中固形物含量和透光率的变化。
渗透通量是指一定操作条件下,每单位时间内水或溶液通过单位膜面积的透过量:
J=V/At
式中:J为渗透通量(L/m2·h);V表示透过液的体积(L);A为超滤膜面积,均为0.1 m2;t表示透过所需的时间(h)[15]。
1.2.4大孔树脂进一步精制花色苷
1.2.4.1大孔树脂的预处理选取6种不同极性的大孔吸附树脂,其中D101为非极性,NKA-Ⅱ为极性,AB-8、LS-303、LS-305和DM130为弱极性,将所需大孔树脂经无水乙醇浸泡24 h后,用去离子水洗至中性,备用。
1.2.4.2大孔树脂的筛选-吸附与解吸性能准确称取经过预处理的湿树脂0.50 g,置于250 mL锥形瓶中,加入100 mL花色苷超滤后透过液,在20 ℃、120 r/min下,摇床中振摇24 h至树脂充分吸附饱和,测定吸附前后花色苷的浓度。另称取充分吸附饱和的树脂0.50 g,加入100 mL 60%乙醇溶液在20 ℃、120 r/min下解吸24 h,测定解吸前后花色苷的浓度。各树脂的吸附率(A)、吸附量(qe)、解吸率(D)和解吸量(qd)分别按式(1)~(4)计算:
(1)
(2)
(3)
(4)
其中:C0、Ce-吸附前和吸附后提取液中花色苷的浓度(mg/L);Vi-加入的花色苷提取液的体积(mL);m-树脂的质量(g);Cd-解吸液中花色苷的浓度(mg/L);Vd-解吸液的体积(mL)。
1.2.4.3大孔树脂LS-305吸附动力学称取大孔树脂0.50 g,置于250 mL锥形瓶中,加入100 mL花色苷超滤后透过液,在20 ℃、120 r/min下,摇床中振摇进行吸附,每1 h取样0.5 mL测定花色苷浓度,直至吸附平衡。绘制花色苷的静态吸附动力学曲线。
1.2.4.4解吸液乙醇浓度的选择称取已经吸附饱和的大孔树脂若干份,每份0.50 g,分别加入100 mL体积分数为30%、40%、50%、60%、70%和80%乙醇溶液作为解吸液,20 ℃、120 r/min振摇12 h至解吸达到平衡,测定其花色苷浓度,计算解吸率。
1.2.4.5大孔树脂LS-305动态泄露曲线将经过预处理的LS-305湿树脂湿法上柱,用5倍柱体积的去离子水冲洗柱子[16],分别以1.0、1.5、2.0 mL/min流速将紫薯花色苷超滤后透过液通过树脂柱,每10 mL分管收集流出液,测定各管中溶液的花色苷浓度,以流出液体积和流出液中花色苷浓度作图,绘制不同上样流速下LS-305树脂的动态吸附泄露曲线。
1.2.4.6大孔树脂LS-305洗脱曲线将吸附花色苷至饱和的LS-305树脂柱,用去离子水洗至流出液无色,再用60%的乙醇溶液进行洗脱,将洗脱流速分别设置为 1.0、1.5、2.0 mL/min,每10 mL收集一管,测定其中花色苷的浓度,以洗脱液体积和洗脱液中花色苷浓度作图,绘制不同洗脱流速下LS-305树脂的动态洗脱曲线。
1.2.5花色苷产品色价的测定将经过超滤和大孔树脂纯化后收集所得洗脱液,旋转蒸发回收乙醇,所得浓缩液经冷冻干燥得纯化后的花色苷样品。准确称取0.05 g左右干燥后的花色苷样品,用pH为3.0的柠檬酸-磷酸氢二钠缓冲液溶解并定容至100 mL,在520 nm波长下测定样品的吸光值,由下式计算色价:
色价=A/m
式中:A-吸光值;m-称取的花色苷样品质量(g)。
1.2.6HPLC对纯化前后花色苷成分的分析精确称取经超滤和大孔树脂纯化后制备的花色苷色素样品,配制成35 mg/mL的溶液。色谱条件:采用BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱;以乙腈为流动相A,2%甲酸为流动相B,梯度洗脱:梯度洗脱:0~0.1 min,2% A,0.1~20 min,2%~20% A,20~25 min,20%~80% A,25~26 min,80%~2% A。流速0.3 mL/min,进样量1 μL,检测波长为花色苷的特征吸收波长520 nm。
2 结果与分析
2.1紫薯花色苷粗提液成分分析
超滤前紫薯花色苷粗提液成分如表1所示。由表1可知,粗提取液中含有较多的蛋白质和糖类杂质,透光率不高,需要对其进行进一步纯化。

表1 紫薯花色苷粗提液成分
2.2超滤膜的选择
截留分子量为10、5、3和1 ku的超滤膜的渗透通量和对蛋白质截留率、总糖截留率、花色苷透过率及固形物含量、透光率的变化结果分别如图1和表2所示。由图1可以看出,随着时间的延长,各膜的渗透通量先减小然后趋于稳定。由表2可以看出,超滤对于蛋白质能够有效截留,而对于分子量相对较小的糖类的去除率较低;超滤后溶液的固形物含量均降低,透光率大大增加,所得透过液澄清透明。以上结果表明,截留分子量为10 ku的超滤膜通量大,且能有效脱除大部分的胶质、蛋白等大分子,提高花色苷溶液的澄清度。

图1 不同超滤膜的渗透通量随时间的变化Fig.1 The change of permeation flux of different ultrafiltration membrane
2.3树脂的筛选及吸附与解吸性能的测定
6种大孔吸附树脂对紫薯花色苷的吸附率、解吸率和吸附量与解吸量如图2(A和B)所示。由图2(A)可知,LS-305大孔树脂对紫薯花色苷的吸附率与解吸率均最高,因此可选用LS-305树脂对花色苷进行后续吸附分离实验。通过图2(B)可得LS-305对花色苷的吸附量达(10.64±0.01)mg/g湿树脂,解吸量达到(10.35±0.03)mg/g湿树脂。紫薯花色苷分子结构中含有较多的羟基和糖苷链,具有一定的极性,LS-305本身是弱极性树脂,与花色苷极性最为相近,在吸附过程中最易于和花色苷结合[17]。
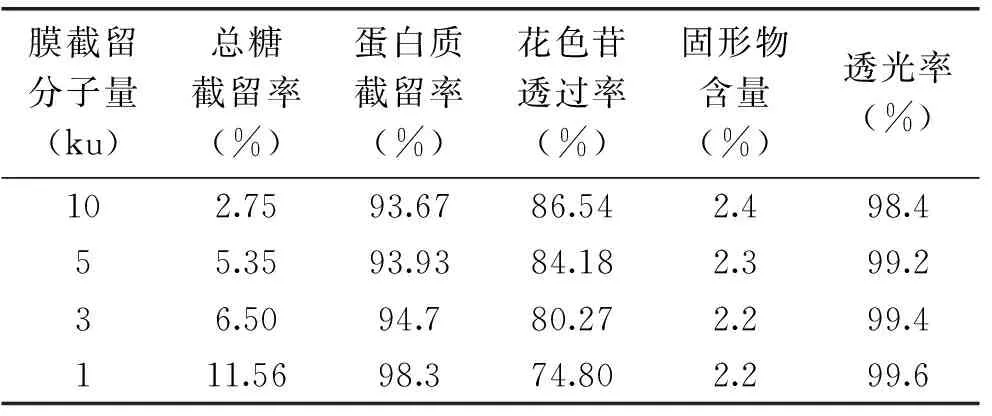
表2 不同超滤膜对花色苷提取液的超滤效果

图2 不同树脂对花色苷的吸附与解析性能Fig.2 Absorption and desorption capabilities of macroporous resins to anthocyanins
2.4大孔树脂LS-305的吸附动力学曲线
LS-305对花色苷的吸附动力学曲线如图3所示。由图3可知,吸附量随着吸附时间的延长而增加,当吸附时间达到6 h后吸附量缓慢增加,逐渐趋于平衡。
2.5解吸液乙醇浓度的选择
不同乙醇浓度的解吸液对花色苷的解吸效果如图4所示。由图4可知,随着乙醇体积分数的增大,解吸率呈现先增大再减小的趋势,当乙醇浓度为60%时达到最大值。这可能是由于乙醇体积分数增大,溶液极性不断减小的原因,在60%时的极性与花色苷最为接近,因此对花色苷的解吸效果最好[10]。
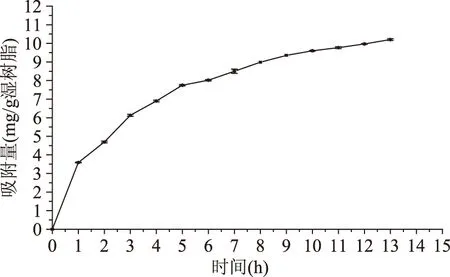
图3 大孔树脂LS-305的吸附动力学曲线Fig.3 Static absorption dynamics curve of macroporousresins to anthocyanins
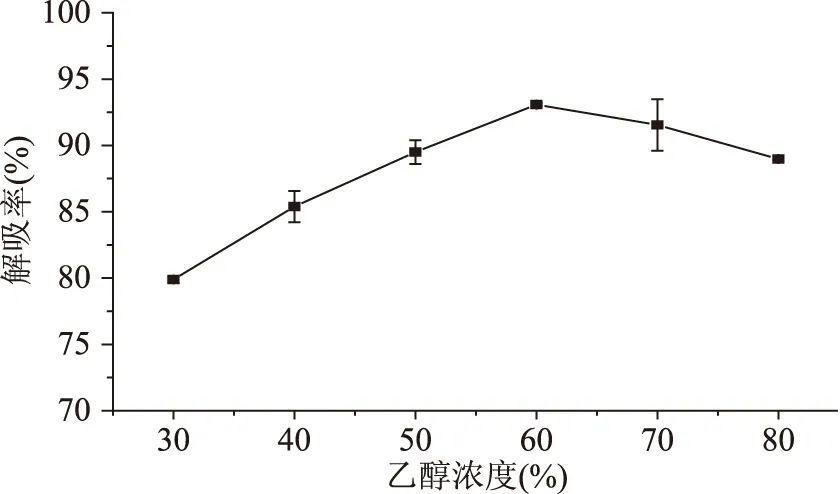
图4 不同乙醇浓度解吸液对花色苷的解吸率影响Fig.4 Effect of ethanol concentration on desorption ratio of macroporous resins
2.6LS-305的动态吸附泄露和动态洗脱曲线
2.6.1LS-305的动态吸附泄露曲线LS-305的动态泄露曲线如图5所示。当流出液浓度达到上样原液浓度的10%时可视为动态泄漏点,以泄漏点出现最迟的吸附流速为宜[18]。由图5可看出,当流速越快,泄漏点出现的越早,由于流速越快导致样液与花色苷接触时间短,不能够及时吸附导致泄露。为了保证最佳的吸附效果,可选择1.0 mL/min(5.2 BV/h)的流速。在此条件下上样体积达到400 mL即35 BV时达到泄露点,可停止上样,吸附量为6.26 mg/g湿树脂。
图5 不同上样流速下的动态吸附泄露曲线Fig.5 Breakthrough curve of dynamic adsorption under different flow rate
2.6.2LS-305的动态洗脱曲线LS-305的动态洗脱曲线如图6所示。由图6可看出,当流速为1 mL/min时,洗脱液的峰值浓度最高,峰型较窄;随着流速的升高,峰值浓度下降,且洗脱速度较慢。由于当流速为1 mL/min时,洗脱的花色苷量较多且较为集中,容易收集,因此选择较慢的洗脱流速1 mL/min较好。在此条件下,洗脱体积为100 mL左右(9 BV)时,可基本将吸附的花色苷洗脱完全。
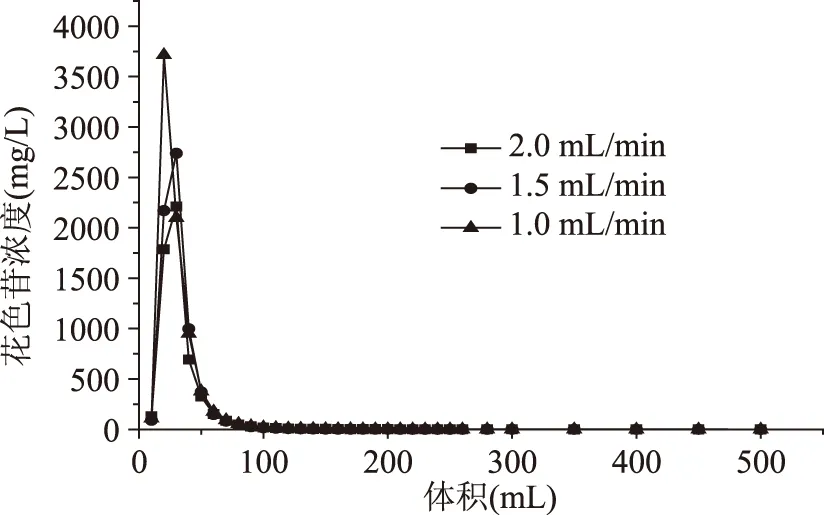
图6 不同流速下的动态洗脱曲线Fig.6 Dynamic desorption curve under different elution rate
2.7纯化花色苷产品分析
2.7.1纯化花色苷产品色价未经过纯化的花色苷粗提取液经过冻干后很黏,粘结成块状,不成粉状颗粒,色价仅为1.59。经过超滤和大孔吸附树脂纯化后的花色苷提取液经过冻干后呈细小粉状颗粒,粘度较小,色价为32.89,比原来提高了20.69倍。
2.7.2纯化前后花色苷成分对比图7是花色苷粗提液(A)及纯化后(B)的HPLC图。由图7(A)和(B)对比可以看出,紫薯花色苷主要由12种不同结构类型的花色苷成分组成,纯化前后花色苷的成分类型未发生明显变化,因此经过超滤和大孔树脂联用的纯化工艺未对紫薯花色苷的成分造成影响。
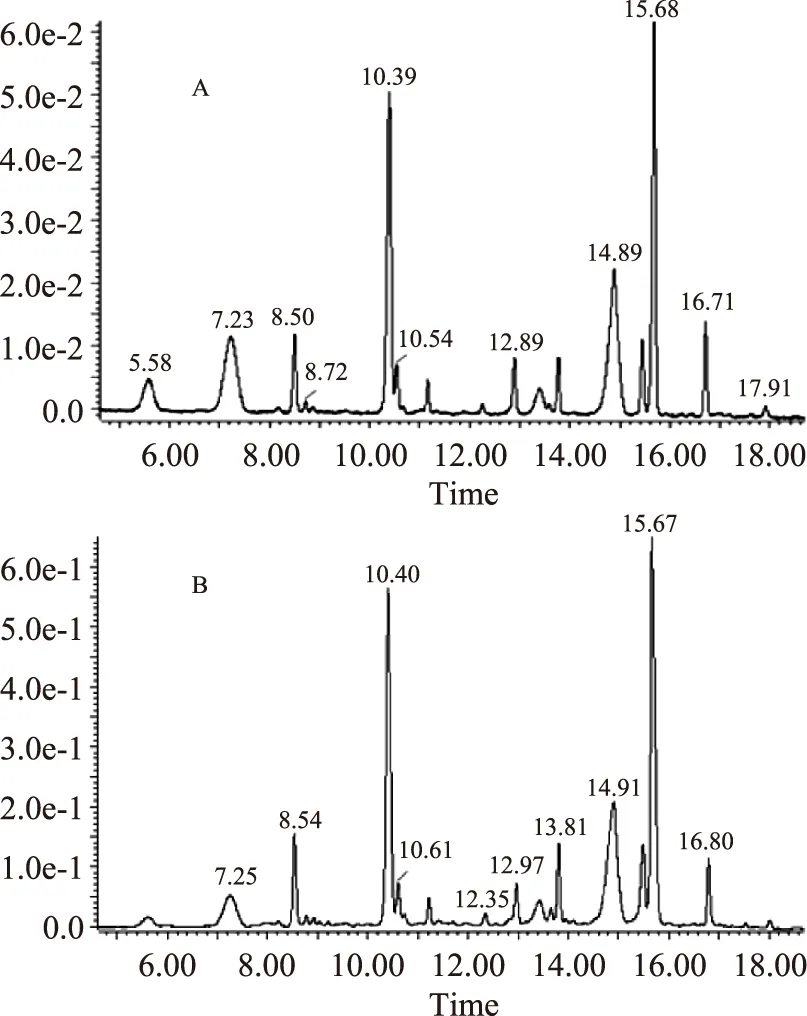
图7 花色苷粗提液(A)及纯化后(B)的HPLC图Fig.7 HPLC chromatogram of purple sweet potato anthocyanins before(A)and after(B)purification注:检测波长为花色苷的特征吸收波长520 nm。
3 结论
对紫薯花色苷的纯化工艺进行了研究,结果表明,截留分子量10 ku超滤膜可有效透过花色苷和截留蛋白质等大分子杂质。花色苷透过率为86.54%,对蛋白质截留率为93.67%。透过液透光率提高了23.78%,可溶性固形物含量降低了14.29%。透过液用大孔树脂LS-305树脂柱进一步进行吸附分离,然后用60%乙醇溶液洗脱,最后再经浓缩和冷冻干燥后,得到色价为32.89的花色苷产品。经过HPLC分析,花色苷的主要成分未发生变化。以上结果表明,超滤和大孔树脂联用的纯化方法可以制得较高色价的紫薯花色苷产品。
[1]Wu Y,Wang Y,Zhang W,et al. Extraction and preliminary purification of anthocyanins from grape juice in aqueous two-phase system[J]. Separation and Purification Technology,2014,124:170-178.
[2]Giusti MM,Wrolstad RE. Acylatedanthocyanins from edible sources and their applicationsin food systems[J].Biochemical Engineering Journal,2003,14(3):217-225.
[3]鲍诚,李玲,汤海宾,等. 紫甘薯花色苷酶法提取及纯化[J]. 食品科学,2012,33(16):59-62.
[4]施鹏飞,肖海峻,罗红霞,等. 响应面分析法优化紫薯花青素提取工艺[J]. 食品工业科技,2014,35(20):322-326.
[6]刘洁,叶婷婷. 酶-微波辅助提取紫薯花青素的工艺研究[J]. 广州化工,2012,40(21):60-62.
[7]王宏兹,李进伟,范柳萍. 超声-微波协同萃取法提取紫薯色素[J]. 安徽农业科学,2010,38(33):18664-18666.
[8]季秀玲. 紫薯花色苷纯化工艺研究[D].南昌:江西农业大学,2014.
[9]万莹,杨青,谢鑫,等. 膜技术用于紫薯花色苷色素分离纯化的工艺研究[J].中国食品添加剂,2012,2:86-89.
[10]刘艳杰,张健,宋晓秋. 大孔树脂纯化紫薯花色苷的研究[J].上海应用技术学院学报:自然科学版,2012,12(1):13-17.
[11]王文平,郭祀远,李琳,等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学,2007,28(4):276-279.
[12]王孝平,邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J].天津化工,2009(3):40-42.
[13]Jungmin L,Durst RW,Wrolstad RE. Determination of Total Monomeric Anthocyanin Pigment Content of Fruit Juices,Beverages,Natural Colorants,and Wines by the pH Differential Method:Collaborative Study[J]. Journal of AOAC International,2005,88(5):1269-1278.
[14]谢捷,刘小景,朱兴一,等. 壳聚糖澄清甜叶菊水提液及其澄清机理探讨[J]. 食品科学,2011,32(20):1-6.
[15]陈钰,潘晓琴,钟振声,等. 马铃薯淀粉加工废水中超滤回收马铃薯蛋白质[J]. 食品研究与开发,2010,31(9):37-41.
[16]Chandrasekhar J,Madhusudhan MC,Raghavarao KSMS. Extraction of anthocyanins from red cabbage and purification using adsorption[J]. Food and Bioproducts Processing,2012,90(4):615-623.
[17]朱洪梅,韩永斌,顾振新,等. 大孔树脂对紫甘薯色素的吸附与解析特性研究[J]. 农业工程学报,2006,22(5):153-156.
[18]米聪. 紫薯中花色苷的提取纯化及稳定性研究[D].厦门:集美大学,2014.
Purification of anthocyanins from purple sweet potato by combination of ultrafiltration and macroporous resin
SU He1,YANG Rui-jin2,*,ZHAO Wei1,HUA Xiao1,ZHANG Wen-bin1
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China; 2.State Key Laboratory of Food Science & Technology,Jiangnan University,Wuxi 214122,China)
The anthocyanins extract from purple sweet potato was purified using ultrafiltration and macroporous resin. The effect of different molecular weight cutoff(MWCO)ultrafiltration membranes to remove the macromolecular substances was investigated. The results showed that the 10 ku membrane could effectively remove the macromolecular substances in the extract. The protein entrapment rate was 93.67%,and the anthocyanins through rate was 86.54%. The soluble solids content was reduced by 14.29%,and light transmittance increased by 23.78%. The adsorption and desorption ability for anthocyanins of six kind of macroporous resins were evaluated. It turned out that LS-305 was the most suitable resin for anthocyanins. The dynamic adsorption and desorption conditions as follows:flow rate of 5.2 bed volume(BV)/h,the sample volume of 35 BV,60% ethanol used to elute the anthocyanins,and volume of 9 BV could elute anthocyanins completely. As a result,the color value of the anthocyanins from purple sweet potato increased from 1.59 to 32.89 after purification. HPLC analysis showed that ultrafiltration and macroporous resin did not affect the anthocyanins component.
purple sweet potato;anthocyanins;ultrafiltration;macroporous resin;purification
2015-11-27
苏鹤(1990-),女,硕士,研究方向:食品加工与配料,E-mail:suhe0719@163.com。
杨瑞金(1964-),男,博士,教授,研究方向:食品加工新技术,E-mail:yrj@jiangnan.edu.cn。
中央高校基本科研业务费专项资金资助(JUSRP51501)。
TS255.1
A
1002-0306(2016)10-0268-05
10.13386/j.issn1002-0306.2016.10.046
——以渤海S油田为例

