L-赖氨酸免疫磁性微球制备及其应用研究
李鹤,徐丹,李晓凤(西华大学食品与生物工程学院,四川成都610039)
L-赖氨酸免疫磁性微球制备及其应用研究
李鹤,徐丹,李晓凤
(西华大学食品与生物工程学院,四川成都610039)
采用化学共沉淀法制备Fe3O4纳米微粒,并对其粒径大小、磁响应性和磁分散性进行综合分析。利用反向悬浮包埋法,以Fe3O4纳米微粒为载体制备L-赖氨酸高分子微球,并将其运用于猪血清中蛋白的分离。以猪血清蛋白偶联率为指标,通过正交试验优化L-赖氨酸高分子微球作用于猪血清蛋白的最佳作用条件。结果表明:最佳作用条件为反应温度40℃,作用时间3h,血清用量20mL,在此条件下测得猪血清蛋白的偶联率达到18.59%。
Fe3O4纳米微粒;L-赖氨酸;猪血清蛋白;偶联率
1 材料与方法
1.1材料与仪器
1.1.1设备
JJ-1型精密增力电动型搅拌器:上海雷韵试验仪器制造有限公司;JY92-2D型超声波细胞粉碎机:宁波
纳米微粒是指颗粒尺寸为纳米量级的超细微粒,它的尺度大于原子簇(cluster),小于通常的微粉,一般在1 nm~200 nm之间。纳米微粒具有巨大的比表面积、表面原子数、表面能和表面张力。当小粒子尺寸进入纳米量级(1 nm~200 nm)时,其本身具有量子尺寸效应,小尺寸效应,表面效应和宏观量子隧道效应,因而展现出许多特有的性质,在热、磁、光、敏感特性和表面稳定性等方面展现出有别于常规粒子的特性[1-2]。
磁性高分子微球具有很好的磁性,在磁场作用下可定向运动到特定部位,或迅速从周围介质中分离出来,且质轻,易加工,流动性好,在细胞生物学(细胞分离、细胞标记等),生物医学(靶向药物、临床诊断等)和生物工程(酶的固定化等)等诸多领域展现了广阔的研究和应用前景[3-4]。尤其是纳米级磁性高分子微球,由于粒径小,比表面积大,可偶联的生物分子容量大,且能分散在体系中不易沉降,非常适合在生物体系中使用。这些性能使其具有广阔的应用前景,因而在生化分离、新芝生物科技股份有限公司;752型紫外可见分光光度计:上海昂拉仪器有限公司;ZK-82B型真空干燥箱:上海精密仪器仪表有限公司;ME100系列生物显微镜:浙江赛因科学仪器有限公司。
1.1.2试剂
FeCl2·4H2O、FeCl3·6H2O、NaOH、聚乙二醇(PEG)、氯化钠、碳酸氢钠、磷酸钾、乙腈、溴化氰(CNBr)、琼脂糖、四硼酸钠、二氯乙烷、司班-80、液体石蜡、环氧氯丙烷、十六醇、柠檬酸三钠、L-赖氨酸盐酸盐(C6H14N2O2·HCl)等(均为分析纯):购于成都科龙试剂化学试剂厂。Sepharose 4B:上海荣君生物医药科技有限公司。
1.2方法
1.2.1Fe3O4纳米粒子的制备
1.2.1.1Fe3O4纳米粒子的制备[8-9]
采用化学共沉淀法,将0.8 mol/L FeCl2溶液与0.8 mol/L FeCl3溶液各50 mL加入三颈瓶中,搅拌,混合均匀,加热并冷凝回流;升温至50℃时,缓慢滴加6 mol/L的NaOH溶液80 mL,再加热至80℃熟化30 min,搅拌,冷却;加入表面活性剂聚乙二醇(PEG),降至室温后,抽滤,用去离子水洗涤,真空干燥,即得纯黑色的Fe3O4粒子。该反应的方程式为:
FeCl2+2FeCl3+8NaOH=Fe3O4↓+8NaCl+4H2O(1)
1.2.1.2Fe3O4纳米粒子的磁悬浮性的测定
利用ME100系列生物显微镜初步测定粒子粒径;用752型紫外可见分光光度计测定粒子磁悬浮性及磁响应性[10]。在1500高斯的磁铁环境下沉降10 min后,吸取试管1/2处溶液,检测其透光率,透光率值间接反映磁响应效果。其中,透光率越高则磁响应性越高;自然条件下沉降5 h后,吸取试管1/2处溶液,检测其透光率,透光率值间接反映磁分散效果,如果透光率越低则磁悬浮性越好。
1.2.2Fe3O4纳米粒子制备条件优化
改变电动搅拌器转速、表面活性剂聚乙二醇(PEG)加入量并测定微球粒径、磁悬浮及磁响应性进行试验,以Fe3O4纳米粒子的粒径为指标,筛选得到Fe3O4纳米粒子制备的优化条件,试验因素水平见表1。

表1 Fe3O4纳米粒子制备因素水平表Table 1 The factors and levels of preparation of Fe3O4nanoparticles
1.2.3L-赖氨酸高分子微球的合成
1.2.3.1琼脂糖凝胶Sepharose 4B的活化
在通风橱内称取0.566 g溴化氰,加12 mL乙腈,加盖后温和摇动,使之溶解。将Sepharose 4B用G3砂芯漏斗抽干,加入5 mol/L的磷酸钾溶液并搅拌,滴加CNBr-乙腈溶液,10 min内滴完,再搅拌10 min,然后洗净,将湿凝胶冰箱备用。
1.2.3.2CNBr-琼脂糖4B与L-赖氨酸盐酸盐的偶联[11-12]
取L-赖氨酸1.125 g溶于36 mL 0.2 mol/L NaHCO3溶液中,混合均匀。取样0.5 mL加入4.5 mL蒸馏水于280 nm波长测其吸光度为0.212。量取上述溶液32 mL,将已活化好的湿凝胶4 g溶于其中,得溶液(A液)35 mL,室温下用磁力搅拌2 h,然后放入4℃冰箱中过夜。
次日,将上述溶液用G3砂芯漏斗抽滤,再用每升含0.2 mol NaCl 0.01 mol/L的磷酸钾溶液100 mL冲洗凝胶,共得液体(B液)129.5 mL,取样在280 nm波长处测吸光度为0.112,然后再用每升含0.15 molNaCl的0.01 mol/L的磷酸钾溶液150 mL冲洗凝胶,收集得到的洗液共374 mL(C液),取样在280 nm波长处测吸光度为0.125。
1.2.3.3L-赖氨酸高分子微球的制备
利用反向悬浮包埋法制备L-赖氨酸高分子微球。先将水相(L-赖氨酸-Sepharose 4B1.0 g、0.5 g铁磁粉、5 mL、100 g/L的NaOH、50 mg NaBH4)混合均匀,70℃溶胀2 h,然后将水相迅速转移至有机相(18mL液体石蜡、12 mL二氯乙烷、1.0 mL司班-80、1.0 mL环氧氯丙烷)中并加入0.2 g十六醇,70℃恒温加热并搅拌4 h。抽滤并用水、体积分数为20%的乙醇水溶液、水依次洗涤以除去残留的有机相,真空干燥得到产物,放入冰箱备用。
1.2.4L-赖氨酸高分子微球分离猪血清蛋白条件优化
按表2,取一定量L-赖氨酸高分子微球与猪血清蛋白充分混合,水浴,在280 nm处测定其吸光度。在前期单因素试验的前提下,以对试验影响因素较大的反应温度、作用时间以及血清量进行三因素三水平的正交试验,试验因素水平见表2。
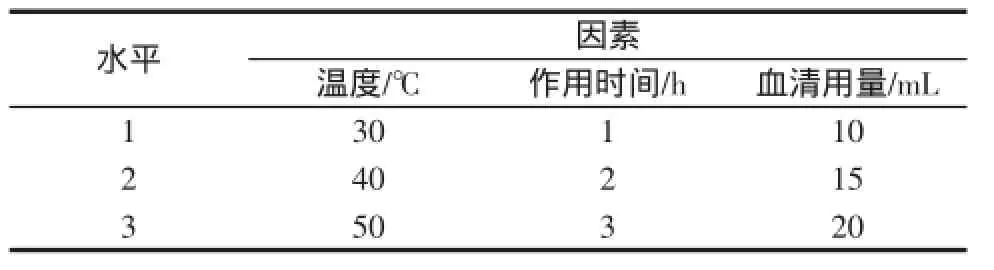
表2 正交试验因素水平表L9(33)Table 2 The factors and levels of orthogonal experiment

2 结果与讨论
2.1Fe3O4纳米粒子的性能表征
2.1.1Fe3O4纳米粒子的粒径分析
利用显微镜,在目测尺的辅助下,放大1 000倍,用目测尺测量Fe3O4纳米粒子的粒径。为了尽量减小试验误差,本试验采用多次测量取其平均值,试验所测得的粒径数据见表3,在不同PEG添加量及不同转速下的Fe3O4纳米粒子粒径大小的曲线图如图1所示。
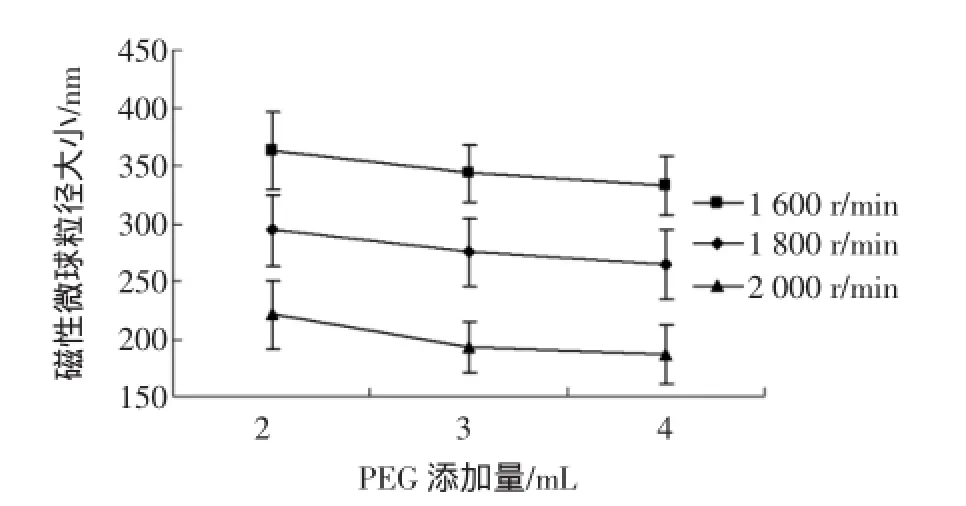
图1 不同转速及PEG添加量对Fe3O4磁性微球粒径大小影响Fig.1 Effects of different rotational speed and PEG addition on Fe3O4magnetic microspheres particle size
表面活性剂在纳米粉体分散中起到的作用主要有两方面:一是在纳米微粒表面吸附,形成表面膜,防止颗粒再团聚;二是形成的表面膜亲油基部分与介质相容性好,亲和力强。由图1可知,在转速一定的情况下,随着PEG用量的增加,Fe3O4纳米粒子的直径也跟着变小;当PEG用量一定的情况下,随着转速的增加,Fe3O4纳米粒子的直径越来越小。这是因为在初始阶段,液滴的存在是一个动态的过程,液滴不断被聚并又不断的重新生成,搅拌速度增大,剪切力增大,反应体系处于湍流状态,液滴周围存在这较强的压力波动和相对速度波动,当液滴和周围液体相对速度达到足以使液滴边缘不稳定时,小液滴就会从大液滴上脱离,形成若干个小液滴[13]。
2.1.2Fe3O4纳米粒子的磁响应及磁分散测定
透光率值可以间接地反映磁响应和磁分散效果,将在不同PEG添加量和不同转速下得到的Fe3O4纳米粒子分别称取1.0 g放入试管中,再加入20 mL无水乙醇,在1 500高斯的磁铁环境下沉降10 min,测定Fe3O4纳米子粒的磁响应性,在自然条件下沉降5 h Fe3O4纳米子粒的磁分散性,其试验结果的平均值见表4。不同转速及PEG添加量对Fe3O4磁性微球磁响应和磁分散性的影响分别如图2和图3所示。
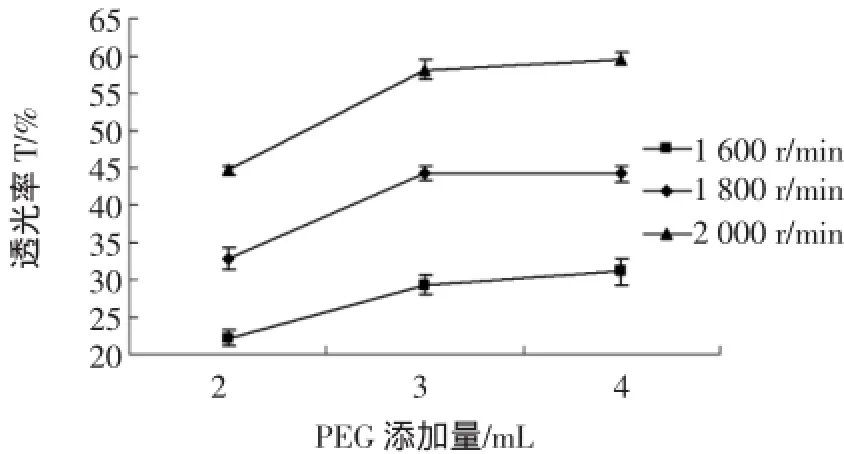
图2 不同转速及PEG添加量对Fe3O4磁性微球磁响应的影响Fig.2 Effects of different rotational speed and PEG addition on Fe3O4magnetic microspheres magnetic responsivity
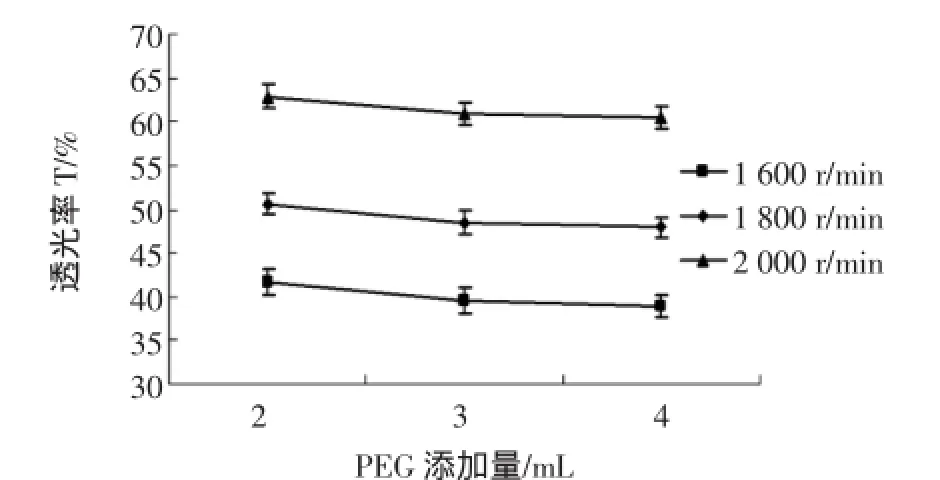
图3 不同转速及PEG添加量对Fe3O4磁性微球磁分散的影响Fig.3 Effects of different rotational speed and PEG addition on Fe3O4magnetic microspheres magnetic dispersion
由图2可知,在PEG用量一定的情况下,转速越大,透光率越大,则表明Fe3O4纳米粒子的磁响应性越好;在转速一定的情况下,随着PEG剂用量的增加,透光率越来越大,则所制得的Fe3O4纳米粒子的磁响应性就越好;当PEG添加量高于3 mL时,曲线趋于缓和,表明此时PEG添加量对Fe3O4纳米粒子吸光度的影响越来越小,即对制得产品的磁响应性影响也越来越小。
由图3可知,在PEG用量一定的情况下,转速越大,透光率越大,则表明Fe3O4纳米粒子的磁分散性越好;在转速一定的情况下,随着PEG剂用量的增加,透光率呈略微下降趋势,但其变化幅度不大,即PEG添加量对Fe3O4磁性微球磁分散的影响不大。
综上所述,Fe3O4磁性微球的制备条件为PEG添加量为3 mL及搅拌转速为2 000 r/min,能使Fe3O4磁性微球具有较好的响应性和分散性。
2.2L-赖氨酸在高分子微球合成中的偶联率计算
对合成L-赖氨酸高分子微球过程中的吸光值进行测定,其结果见表3,并按公式(1)计算得到CNBr-琼脂糖4B与L-赖氨酸盐酸盐的偶联率=17.88%。
2.3L-赖氨酸高分子微球分离猪血清蛋白正交试验结果分析
将新鲜猪血离心后,在280 nm下用752型紫外可见分光光度计测定其血清的吸光度,吸光度值为2.699,根据公式(1),其正交试验结果见表4,正交试验结果分差分析见表5。

表3 CNBr-琼脂糖4B与L-赖氨酸盐酸盐的偶联中各种溶液的吸光度值Table 3 The absorbance values of various of solution in the coupling between CNBr-Sepharose 4B and L-lysine hydrochloride

表4 L-赖氨酸高分子微球分离猪血清蛋白正交试验结果Table 4 The results of orthogonal experiment of IgG Separation with L-lysine polymer microsphere

表5 正交试验的方差分析Table 5 Orthogonal analysis of variance
从表5可以看出影响血清蛋白偶联率的主次因素为C(血清用量)>B(作用时间)>A(温度);根据各因素的主次关系和最大K值对应的水平选出最佳试验方案为C3B3A2,整理顺序得A2B3C3。即反应温度为40℃、作用时间3 h、血清用量20 mL。
2.4验证试验
将反应温度设定为40℃、作用时间为2 h、血清用量20 mL进行3组验证试验,试验结果如表6所示。
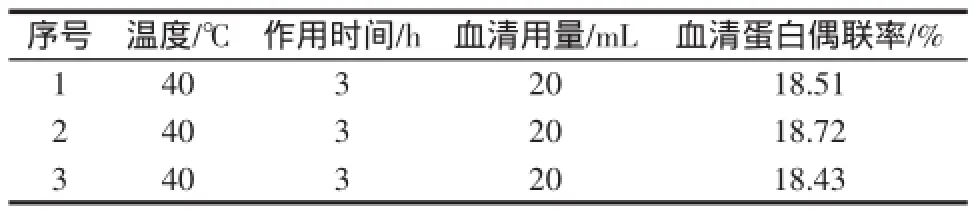
表6 验证试验结果Table 6 The results of verification test
验证试验结果表明:在反应温度为40℃、作用时间2 h、血清用量20 mL时,其血清蛋白偶联率为18.55%,与正交试验中最优结果相差不大,综合考虑,可确定反应温度为40℃、作用时间2h、血清用量20mL为最佳作用条件。
3 结论
采用化学共沉法制备Fe3O4纳米粒子,表面活性剂聚乙醇(PEG)用量为3mL、电动搅拌器转速2000r/min时,制得的Fe3O4纳米粒子具有较好的磁响应性和磁分散性、且粒径达到200 nm以内,在显微镜观察下呈均匀分布状态。
采用Fe3O4磁性微球作载体制备L-赖氨酸高分子微球,将其运用于猪血清中蛋白的分离,并采用正交试验对其最佳作用条件进行了优化,得到最佳作用条件为反应温度为40℃、作用时间3 h、血清用量20 mL,在此条件下测得血清蛋白的偶联率达到18.59%。
[1]张立德,牟季美.纳米材料和纳米结构[M].北京:科学出版社,2002:68-104
[2]李学忠.国外纳米材料制备及应用领域评述[M].厦门:中国电子学会,1997:1-6
[3]吴颉,王君,景小燕,等.磁性高分子微球的制备及应用[J].化工新型材料,2002,30(8):23-26
[4]丁小斌,孙宗华,万国祥.磁性高分子微球的制备与应用研究进展[J].化学通报,1997(1):1-5
[5]谢钢,张秋禹,李铁虎.磁性高分子微球[J].高分子通报,2001,12 (9):38-43
[6]Matsunaga T,Kawasaki M,Yu X,et al.Chemiluminescence enzyme immunoassay using bacterial magnetic particles[J].Analytical Chemistry,1996,68(20):3551-3554
[7]Solé S,Alegret S,Céspedes F,et al.Flow injection immunoanalysis based on a magnetoimmunosensor system[J].Analytical Chemistry,1998,70(8):1462-1467
[8]靳艳巧.高分子磁性微球的制备及应用[D].武汉:武汉理工大学,2004
[9]赵长杰.Fe3O4纳米粒子的制备、包覆及IgG吸附性能研究[D].哈尔滨:哈尔滨工业大学,2014
[10]李玉珍,刘学涌,陈晓凯,等.两亲磁性高分子微球与人血清白蛋白的相互作用[J].中国医学杂志,2004,39(9):682-684
[11]冯万祥,赵伯龙.生化技术[M].长沙:湖南科技出版社,1989:202-208
[12]王期中,张顺龙.提高人血丙种球蛋白制品稳定性方法的研究[J].中国生化药物杂志,2001,22(1):23-24
[13]靳艳巧,李曦,张超灿.微悬浮聚合法制备聚苯乙烯磁性微球的研究[J].高分子材料科学与工程,2006,22(6):87-89
Research on the Separation of L-lysine Immunomagnetic Microspheres Serum Protein
LI He,XU Dan,LI Xiao-feng
(School of Food and Biological Engineering,Xihua University,Chengdu 610039,Sichuan,China)
This experiment used chemical Co-precipitable to get Fe3O4particles,then analyzed its particle size,magnetic response and magnetic dispersion.Use Fe3O4nanoparticles as carriers for the preparation of L-lysine polymer microsphere by reverse suspension method,which was applied to the separation of pig serum protein.Coupled rate with the pig's serum was used as a target to optimize the technical conditions through the orthogonal experiments.The results showed that the best condition was as follow,the reaction temperature was 40℃,the reaction time was 3 h and the serum dosage was 20 mL,under these conditions the serum protein coupling rate could reach to 18.59%.
Fe3O4particles;L-lysine;pig'sserumproteins;coupledrate靶向制剂、固定化酶、免疫分析、催化研究等方面有极为广泛的应用[4-5]。Nakamura等[6]把细菌磁微球用于分离血清中免疫球蛋白IgG的含量。Fabregas等[7]将IMMS用磁场固定在一个平板换能器上,制得一种新型免疫传感器,并将其应用于流动分析系统,能够分离出样品中微摩尔级浓度的兔抗IgG。免疫高分子磁性微球具有巨大的应用前景和潜力,但国内的研究水平与国际水平相比还有很大的差距。本试验采用化学共沉淀法制备Fe3O4粒子,并对其磁响应性、磁分散性和粒径大小进行综合分析,得到纳米分散的Fe3O4粒子。利用反向悬浮包埋法将L-赖氨酸包裹于Fe3O4粒子磁性微球表面,得到L-赖氨酸高分子磁性微球,并将其运用于猪血清中蛋白的分离,优化其最佳工艺条件,为L-赖氨酸高分子磁性微球的制备及其应用提供一定的理论参考。
10.3969/j.issn.1005-6521.2016.15.031
四川省大学生创新创业训练计划项目(201510623055)
李鹤(1982—),女(白),讲师,硕士,研究方向:食品生物技术。
2015-08-10

