挤压大米蛋白-葡聚糖接枝复合物的功能性质及结构表征
张焕丽,肖志刚,2,*,马慧,聂文文(.沈阳师范大学粮食学院,辽宁沈阳0034;2.东北农业大学食品学院,黑龙江哈尔滨50030)
挤压大米蛋白-葡聚糖接枝复合物的功能性质及结构表征
张焕丽1,肖志刚1,2,*,马慧1,聂文文1
(1.沈阳师范大学粮食学院,辽宁沈阳110034;2.东北农业大学食品学院,黑龙江哈尔滨150030)
为了研究挤压和糖接枝改性的方法对大米蛋白功能性及结构的变化的影响,本文研究了不同挤压条件下挤压的大米蛋白与葡聚糖的糖接枝反应,分析了不同挤压改性的大米蛋白对糖接枝反应接枝度的影响,根据单因素试验优化反应条件,在挤压温度90℃、大米蛋白水分含量35%,螺杆转速200 r/min的条件下挤压的大米蛋白与葡聚糖接枝得到的复合物,接枝度最大为(17.6±0.3)%,试验测定接枝度为(17.6±0.3)%共聚物的溶解性和乳化性及表面疏水性。结果表明,与天然大米蛋白相比,挤压的大米蛋白与葡聚糖接枝复合物的溶解性在较宽的范围内显著增加,增加了8.4%~76.6%,乳化性和乳化稳定性分别增加了62.2%和73.9%,表面疏水性降低了69.5%。同时,试验通过傅里叶红外光谱、SDS-PAGE电泳、扫描电镜等方法和手段分析了大米蛋白亚基结构及表面结构特征。结果表明,挤压糖接枝反应显著改变了蛋白亚基结构,α-螺旋、β-转角和无规卷曲结构含量分别增加了24.4%、26.0%和19.9%,而β-折叠结构含量减少了15.0%,SDS电泳分析结果显示挤压后大米蛋白与葡聚糖接枝反应物的条带51.0 ku和80 ku~82 ku亚基带变得模糊,并且在分离胶和浓缩胶分理处出现大分子量分子,说明有共价连接大分量聚集物生成,扫描电镜分析了表观结构变化,表明挤压和糖接枝对蛋白结构改变显著。
大米蛋白;葡聚糖;糖接枝反应;挤压;功能性质;结构表征
大米蛋白是一种具有低致敏性和高生物效价等特性的优质蛋白,但由于大米蛋白含有75%~90%的疏水性谷蛋白,使大米蛋白的应用受到限制[1-4],因此,如何改变以谷蛋白为主的大米蛋白的溶解性和乳化性,已成为提高其在食品工业应用生产价值的关键。
目前有研究报导,经过脱氨基、美拉德反应及磷酸化反应改性可显著降低大米蛋白的疏水性并改善其溶解性与乳化性[5-11],其中美拉德反应改性法因其天然无污染等优点受到研究者青睐。但湿法糖接枝反应只适用于单糖,而干热法反应时间长、反应慢、工作效率低,因此为了改善美拉德反应进程,管军军[12]等利用微波法促进大豆蛋白与糖的接枝反应,提高了大豆蛋白的溶解性和乳化性,王中江等[13]借助超声法加速绿豆蛋白与糖接枝反应,提高产物的功能性,赵新淮[14]等研究了转谷氨酰胺酶促进酪蛋白与氨基葡萄糖化学交联反应改善其功能性质,但是以上方法不易于控制,且不适用于工业连续化生产,因此,寻求一种快速便捷适用于工业化连续生产的方法至关重要。
挤压技术因其具有高效率、用时短、操作简单且经济环保的特点,被广泛应用于工业生产中。同时,挤压也被应用于蛋白的物理改性方面,蛋白在挤压机内的高温、高压、高剪切力及高能量水分子的协同作用下,其高级结构去折叠、线性化和再交联,蛋白空间构象改变,并且适度的挤压能够改善蛋白的吸水性、乳化性等物理性质[15-17],但挤压后蛋白分子聚集溶解性严重降低,因此本文旨在研究挤压法与糖接枝复合改性条件对大米蛋白功能性和结构的影响,并采用傅里叶红外光谱法、聚丙烯酰胺凝胶电泳及扫描电子显微镜等技术手段对挤压大米蛋白与葡聚糖接枝复合物的结构特性进行研究,同时从分子水平了解结构变化与功能性质间的关系,为改善大米蛋白的功能性质及扩大大米蛋白的应用提供理论参考。
1 材料与方法
1.1材料与试剂
大米蛋白(蛋白含量82.5%):江西金农生物科技有限公司;OPA:Sigma公司;8-苯胺基-1-萘磺酸(ANS-NH4);葡聚糖2万、赖氨酸、十二烷基硫酸钠(SDS)、硼砂、磷酸氢二钠、磷酸二氢钠等均为分析纯。
1.2仪器设备
DS56-Ⅲ型双螺杆挤压膨化机(螺杆直径为25mm,长径比为16∶1机筒加温区段为三段,圆形摸头内径为4 mm):济南赛信膨化机械有限公司;F-4500荧光分光光度计:日本HITACHI公司;SDS-PAGE电泳仪:美国Bio-rad公司;Hitachi S-3400扫描电子显微镜:日立高新技术公司;MAGNA-IR560傅立叶变换红外光谱系统:美国尼高力公司;FD5-3型冷冻干燥机:美国SIM公司等。
1.3方法
1.3.1挤压大米蛋白制备
根据试验要求将原料进行调质过夜,固定喂料速度为10 kg/h,进行不同条件的挤压试验。挤压温度试验:将挤压机螺杆转速调到200 r/min,将调质成水分含量为35%大米蛋白送入喂料器,分别在挤压机滚筒温度为80、90、100、110、120℃条件下挤压制备挤压大米蛋白;挤压物料水分含量试验:将挤压机螺杆转速设置为200 r/min,挤压机中间区域的滚筒温度90℃,在此条件下将调质成水分含量为15%、25%、35%、45%、55%的样品送入喂料器进行挤压制备挤压大米蛋白;挤压螺杆转速试验:将调质成水分含量为35%大米蛋白送入喂料器在机螺杆转速为160、200、240、280、320 r/min条件下挤压制备挤压大米蛋白。挤压后的样品:对挤压处理的样品,常温干燥后,用粉碎机粉粹后过筛100目,备用。
1.3.2大米蛋白与葡聚糖接枝复合物的制备
通过前期试验及参考文献,确定配制蛋白质浓度为10 g/L的大米蛋白与葡聚糖溶液,用0.2 mol/L NaOH调节pH至10.5,葡聚糖按照与蛋白配比为1∶1(质量比)添加,反应体系充分混匀后,100℃水浴反应1 h,反应结束后立即冰浴终止反应,将反应液调到中性,透析24 h,冷冻干燥得到产物。
1.3.3接枝度的测定
采用Church等(1983)的邻苯二甲醛(OPA)法测定游离氨基含量[18]。测定时,量取OPA试剂4 mL于试管中,注入200 μL样品液,混匀后于35℃反应2 min,在340 nm下测其吸光值A340。以赖氨酸作标准曲线,根据ΔA计算样品中自由氨基含量,接枝度(DG)计算公式:
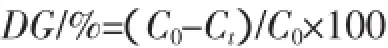
式中:C0为接枝反应前溶液中自由氨基含量,mol/L;Ct为接枝反应后溶液中自由氨基的含量,mol/L。
1.3.4溶解性的测定
按照Bradford法[19]测定,利用牛血清蛋白(BSA)做标准曲线,测定595 nm处吸光值,根据样品中蛋白含量和溶液中蛋白含量计算溶解性,以氮溶解指数表示(NSI%)。
1.3.5乳化性及乳化稳定性的测定
参考Pearce浊度法[20],并略有改动:配制0.1%的样品溶液25 mL于pH 7.0,0.1 mol/L的磷酸盐缓冲液中。取25 mL样品溶液加入8 mL大豆油,室温下于高速匀浆机中10 000 r/min均质1 min,形成乳浊液。均质结束后,分别在0 min与10 min从底部吸取100μL样品,加入10mL0.1%SDS稀释,于500nm处测定吸光度值(测定3次),乳化活性指数(Emulsification Activity Index,EAI)按下式计算:式中:EAI为乳化活性指数,m2/g;N为稀释倍数;φ为体系中油相所占分数;C为蛋白浓度,g/mL;L为是比色池光径(1 cm)。

乳化稳定性(Emulsification Stability Index,ESI)按下式计算:

式中:ESI为乳化稳定性指数,min;A0为0 min时的吸光度值;ΔT为测定乳化性的两次时间间隔,本试验取10 min;A10为10 min时的吸光度值。
1.3.6表面疏水性的测定
采用8-苯胺基-1-萘磺酸(ANS)荧光探针法进行测定[21],激发波长和吸收波长分别是390 nm和470 nm,以蛋白质浓度对荧光强度作图,以线性回归斜率作为表面疏水性指标(H0)。
1.3.7傅里叶红外光谱仪
用P2O5充分干燥冻干后的样品,称取样品1 mg与100 mg KBr研磨、再混匀、最后进行压片,进行傅里叶变换红外光谱(FTIR)测定。检测波数范围4 000 cm-1~400 cm-1吸收光谱,分辨率为4 cm-1,波数精度为0.01 cm-1,环境温度25℃,扫描次数64次。
1.3.8聚丙烯酰胺凝胶(SDS-PAGE)电泳
采用SDS-PAGE非连续凝胶电泳对样品进行分析,浓缩胶和分离胶的质量分数分别为4.0%和12%,考马斯亮蓝R-250染色蛋白质Laemml的方法[22]。
1.3.9扫描电镜(微观结构分析)
用导电双面胶将样品固定在样品台上,将少许样品撒在双面胶上,吹去多余的粉末,在真空下喷金后置于扫描电子显微镜中观察并拍摄样品形貌照片。
1.4数据处理分析
本研究中采用IBM SPSS Statistics 22软件对数据进行处理,用OriginPro.8.5软件绘图。
2 结果与分析
2.1单因素试验
2.1.1挤压温度对大米蛋白与葡聚糖接枝复合物接枝度的影响
在挤压温度80℃~120℃,大米蛋白水分含量35%,螺杆转速200 r/min条件下挤压大米蛋白,然后将挤压大米蛋白与葡聚糖按比例为1∶1(质量比),pH 10.5,水浴温度90℃条件下反应60 min,制备的挤压大米蛋白与葡聚糖接枝物,挤压大米蛋白与葡聚糖接枝物的接枝度测定结果见表1。
由表1可见,随着挤压温度的升高,挤压的大米蛋白与葡聚糖接枝物的接枝度先增加后减小,在挤压温度为90℃条件下挤压的大米蛋白与葡聚糖的接枝物,接枝度有最大值(17.5±0.3)%,这可能是由于大米蛋白在挤压机内,受到挤压、剪切、高压等作用,蛋白变性,蛋白分子部分聚集和展开,使游离氨基部分暴露,在与葡聚糖接枝反应时,利于糖接枝反应进行,而当挤压温度过高时,蛋白变性程度变大,蛋白聚集程度变大,蛋白与蛋白之间发生交联,因此与葡聚糖接枝反应时,不利于接枝反应的进行[16-17],所以选择最适宜的挤压温度为90℃。

表1 挤压温度对大米蛋白与葡聚糖接枝复合物接枝度的影响Table 1 Effect of barrel temperature on the degree of substitution of extruded rice protein-dextran conjugates
2.1.2挤压大米蛋白水分含量对大米蛋白与葡聚糖接枝复合物接枝度的影响
不同水分含量挤压的大米蛋白与葡聚糖接枝复合物接枝度测定结果见表2。

表2 挤压物料水分含量对大米蛋白和葡聚糖接枝复合物接枝度的影响Table 2 Effect of moisture on the degree of substitution of extruded rice protein-dextran conjugates
由表2结果可知,随着大米蛋白水分含量的升高,挤压的大米蛋白与葡聚糖接枝物接枝度先增加后减小,在大米蛋白水分含量为35%时,挤压的大米蛋白与葡聚糖接枝物接枝度有最大值(17.0±0.3)%,可能是因为水分较低时,大米蛋白的粘滞性较大,在挤压机中停留时间长,受高温高压作用变性程度大,蛋白发生部分分解,内部的基团暴露,利于与葡聚糖接触反应,而当水分过大,水分子润滑作用使物料粘度下降,流动阻力减少,使物料在挤压机内部停留时间较少,变性程度小[31],不利于与糖接枝反应,因此挤压蛋白水分含量对蛋白变性程度影响很大,因此选择挤压蛋白水分含量为35%的挤压大米蛋白与葡聚糖接枝反应。
2.1.3挤压螺杆转速对大米蛋白与葡聚糖接枝复合物接枝度的影响
不同螺杆转速条件下挤压的大米蛋白与葡聚糖接枝复合物接枝度测定结果见表3。
由表3可知,随着挤压螺杆转速的升高,挤压大米蛋白与葡聚糖接枝复合物接枝度先增加后减小,在挤压螺杆转速为200 r/min条件下挤压的大米蛋白与葡聚糖接枝复合物接枝度有最大值(17.3±0.3)%,可能是因为转速低时,蛋白受到挤压作用,能量聚集,蛋白分子部分聚集和降解程度小,而增大转速,物料停留时间短,高螺杆转速,蛋白挤压受到更强的压力,因此蛋白变性严重,蛋白分子聚集程度过大[15],不利于后来与葡聚糖接枝反应进行,所以选择挤压螺杆转速为200 r/min的挤压大米蛋白与葡聚糖接枝反应。

表3 挤压螺杆转速对大米蛋白和葡聚糖接枝复合物接枝度的影响Table 3 Effect of screw speed on the degree of substitution of extruded rice protein-dextran conjugates
2.1.4挤压改性的大米蛋白与葡聚糖接枝复合物的制备
根据上述研究,在挤压温度90℃,螺杆转速200 r/ min,挤压水分含量35%条件下制备挤压大米蛋白,按照1.3.2的方法,挤压大米蛋白与葡聚糖配比为1∶1(质量比),pH为10.5,温度为90℃,反应时间60 min进行糖接枝反应制备挤压大米蛋白与葡聚糖接枝复合物,接枝度为(17.6±0.3)%,相同的反应条件下比与天然大米蛋白与葡聚糖接枝复合物接枝度提高了50%,可能是由于挤压的剪切、碰撞、高压等作用力使大米蛋白结构发生改变,蛋白质发生聚集和部分降解,使一部分氨基暴露,因此在与葡聚糖接枝反应,加速了蛋白与糖接枝反应的进行[16-17]。通过对该条件制备的挤压大米蛋白与葡聚糖接枝复合物与天然大米蛋白和挤压大米蛋白进行对比,分析挤压大米蛋白接枝复合物的功能特性及结构变化。
2.2产物的功能性质
2.2.1溶解性的测定结果
天然大米蛋白、挤压大米蛋白、挤压大米蛋白与葡聚糖接枝复合物的溶解性见图1。
由图1可知,与天然大米蛋白相比,挤压大米蛋白的溶解性在较宽pH值范围内显著降低,而挤压大米蛋白与葡聚糖接枝复合物在较宽pH范围内,溶解性显著提高8.4%~76.6%。可能是由于大米蛋白在挤压的高压、高剪切力条件下使大米蛋白分子分子结构改变,蛋白质分子部分地展开或聚集,使内部部分疏水基团暴露,大米蛋白质分子通过非共价相互作用形成大分子聚集体,蛋白溶解性表现降低趋势[23],但挤压后的大米蛋白,由于蛋白结构发生变化,暴露了利于与葡聚糖进行接枝反应的氨基基团,使接枝反应顺利进行,多糖多羟基的引入,能够使蛋白亲水性增加,改变蛋白的溶解性[24],因此适当的挤压条件改性大米蛋白与葡聚糖接枝反应,能够一定程度改变原有大米蛋白蛋白的溶解性。

图1 不同处理样品的溶解性Fig.1 Plots of solubility of samples obtained at different modified methods
2.2.2挤压改性的大米蛋白与葡聚糖接枝复合物的乳化性
天然大米蛋白、挤压大米蛋白、挤压大米蛋白与葡聚糖接枝复合物的乳化性及乳化稳定性结果见图2。
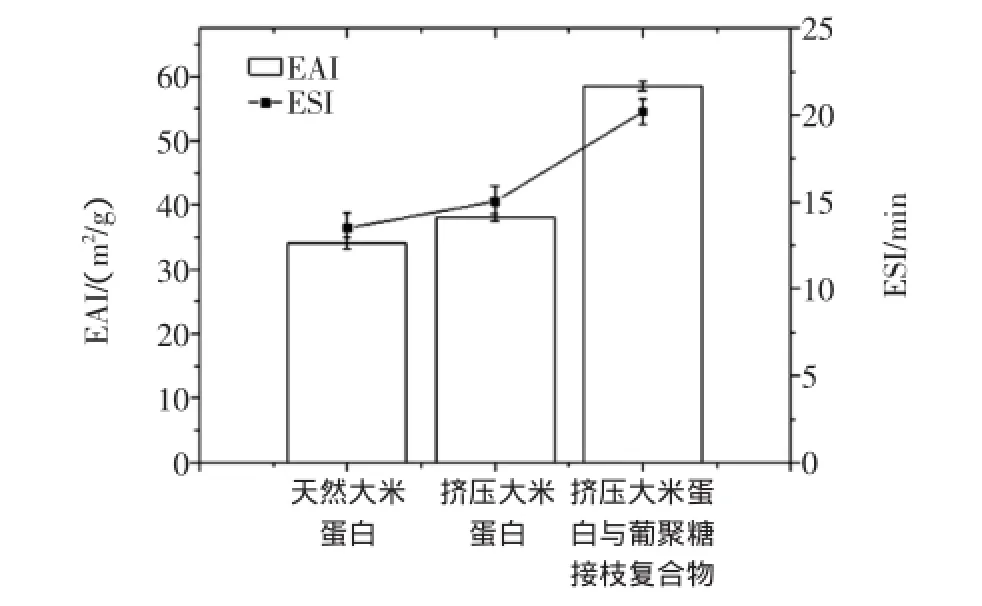
图2 不同处理样品的乳化性和乳化稳定性Fig.2 Plots of EAI and ESI of samples obtained at different modified methods
由图2可知,与天然大米蛋白相比,挤压大米蛋白的乳化活性及乳化稳定性提高,而挤压大米蛋白与葡聚糖接枝复合物的乳化活性大幅提高,提高了62.2%,挤压大米蛋白与葡聚糖接枝复合物乳化稳定性增高了73.9%。大米蛋白分子中因含有大量的疏水性氨基酸,高含量的疏水性氨基酸之间通过疏水作用相互靠近,生成大量的二硫键,导致蛋白分子聚集沉淀,从而影响的大米蛋白乳化性,但是蛋白经过挤压机的碰撞及高压作用可能使蛋白发生部分降解或二硫键断裂,大米蛋白的结构受到一定程度的破坏,其间可能发生二硫键存在状态的变化以及蛋白质颗粒的聚集、解聚现象,其次级键被打开,使蛋白分子进一步伸展,极性,原先包埋在分子内部的疏水性基团暴露,增强了亲油性,从而增加了乳化性,糖接枝反应,引入多羟基,分子表面形成水化层,增加了蛋白结构中的亲水性羟基基团数量,蛋白质部分可有效地吸附在油/水界面上,从而增加了接枝物的乳化活性,而葡聚糖具有大分子的空间稳定作用,使得蛋白分子受到阻碍,不易靠近而聚集沉淀[11],降低界面的张力起到稳定乳状液的作用[24-25],因此经过挤压改性后的大米蛋白进行糖接枝反应能够更好的改善疏水性大米蛋白乳化性和乳化稳定性。
2.3接枝复合物的结构表征
2.3.1挤压改性的大米蛋白与葡聚糖接枝复合物的表面疏水性
利用荧光探针ANS法检测挤压的大米蛋白与葡聚糖的接枝复合物在pH 7.0时的表面疏水指数,如图3所示。
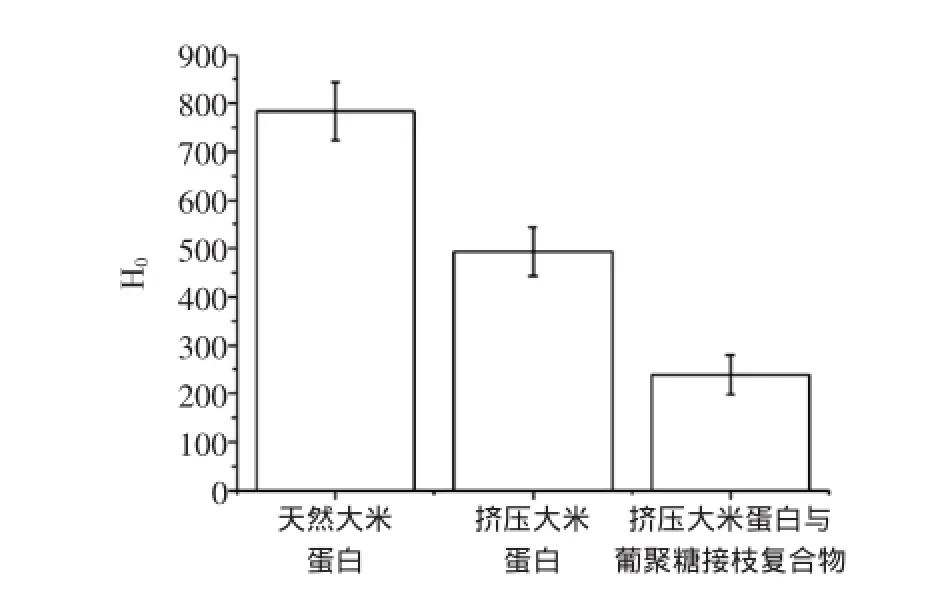
图3 不同处理样品的表面疏水性Fig.3 Plots of surface hydrophobicity(H0)of samples obtained at different modified methods
由图3可知,与天然大米蛋白相比,挤压大米蛋白的疏水性降低39.6%,而挤压的大米蛋白与葡聚糖接枝复合物的疏水性降低69.5%;可能是因为原蛋白表面带有较多的电荷,蛋白质-水相互作用较大,而蛋白经挤压后,蛋白质分子部分聚集和降解,使疏水基团向分子内部引入,表面疏水性变小,而当葡聚糖接枝到挤压大米蛋白上,多羟基的引入使亲水性基团的数量增多,蛋白质-水静电相互作用降低而蛋白质内疏水相互作用占优势地位,表面疏水基团进一步向分子内聚集,从而形成更加有序的蛋白结构,致使蛋白质表面疏水性指数大幅降低[26-27],从而影响了蛋白的溶解及乳化性能。
2.3.2挤压改性的大米蛋白与葡聚糖接枝复合物的红外分析
本试验利用傅里叶红外光谱法,对天然大米蛋白、挤压大米蛋白和挤压大米蛋白与葡聚糖接枝复合物FT-IR光谱进行分析,见图4。
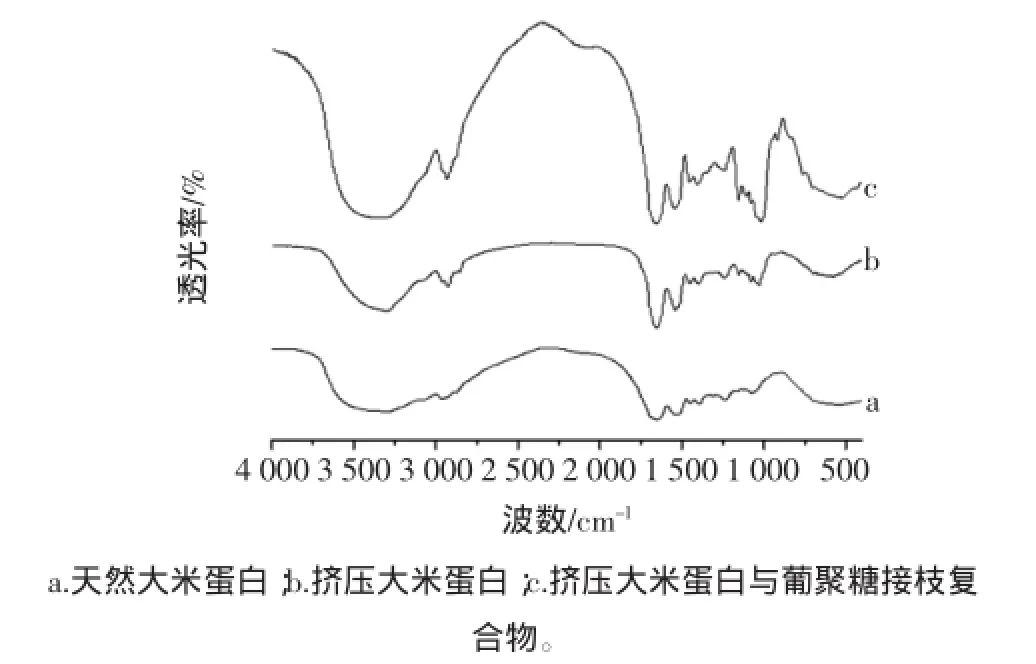
图4 不同处理样品的傅里叶红外光谱分析图谱Fig.4 Plots of Fourier transform infrared spectroscopy of samples obtained at different modified methods
由图4可以看出,与葡聚糖接枝后的大米蛋白的红外光谱既具有蛋白的酞胺化合物的吸收带特征峰,又具有糖的特征吸收峰[25],复合产物在在3 350 cm-1附近存在由O-H和N-H形成的较宽的吸收带,这是由于新物质共价交联反应出现了新的N-H键,在1651 cm-1(酰胺I)处有强烈的C=O的伸缩振动,说明此处基团发生了反应,此振动可形成β-转角,1 539(酰胺Ⅱ)N-H键伸缩振动增强存在N-H的变角振动,其属于β-折叠,是由伸展的多肽链组成的,在1 153 cm-1(酰胺Ⅲ)处峰属于N-H变角振动和C-N伸缩振动所形成的α-螺旋和无规则卷曲;同时在1020 cm-1出现了较强的吸收,这可能是由于羟基的接入而出现的O-H弯曲振动[28],在2 926 cm-1范围内出现的通常为-CH2和-CH3的饱和C-H反射峰[29],通过对产物红外图谱的分析,可以推断出,挤压的大米蛋白与葡聚糖发生了接枝反应,通过共价结合生成共聚物。
为了进一步定量分析样品的结构变化,本试验利用多峰分析peakfitv4.12软件对蛋白质的FT-IR光谱进行二阶导数IR去卷积光谱拟合分析得到了蛋白质二级结构的定性定量信息结果见表4。
由表4可知,与天然大米蛋白相比,挤压的大米蛋白α-螺旋、β-转角和无规卷曲结构分别增加了14.5%、14.6%、30.5%,β-折叠结构含量减少了14.6%,挤压糖接枝α-螺旋、β-转角和无规卷曲结构含量分别增加了24.4%、26.0%和19.9%,而β-折叠结构含量减少了15.0%,这可能是由于挤压处理产生的剪切、碰撞等物理作用,使一部分蛋白分子发生聚集,造成二级结构含量发生变化,这种变化与蛋白质的重聚集有关,研究表明由于氢键作用,β-折叠结构易存在于蛋白质聚集体内部,挤压大米蛋白的β-折叠结构含量的降低,也表明了蛋白发生了部分降解[15-16],从而证实了这种变化,而糖接枝反应增加了α-螺旋、β-转角等有序二级结构,同时β-折叠向无规则卷曲转化。
2.3.3挤压改性的大米蛋白与葡聚糖接枝复合物的电泳分析

表4 不同处理样品的二级结构含量分析Table 4 The content of second research of samples obtained at different modified methods
为了进一步研究挤压的大米蛋白与葡聚糖接枝复合物亚基结构的变化,对天然大米蛋白、挤压大米蛋白、挤压的大米蛋白与葡聚糖接枝复合物样品进行SDS-PAGE分析(图5)。
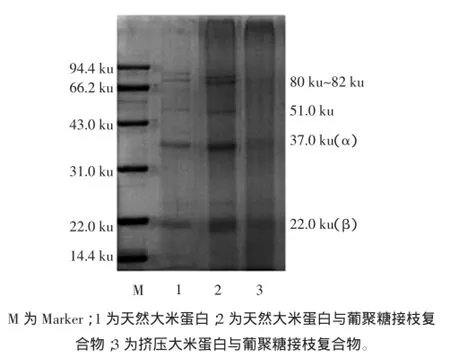
图5 不同处理样品的电泳图Fig.5 Plots of SDS-PAGE of samples obtained at different modified methods
由图5可以看出,天然大米蛋白的SDS-PAGE电泳图很清晰地显示出大米蛋白(图5,带1)各亚基的条带大概分布在22.0、37.0、51.0 ku和80 ku~82 ku,挤压大米蛋白(图5,带2)则没有表现出明显不同,仍具有典型的条带,挤压后的大米蛋白与葡聚糖接枝复合物(图5,带3)的条带51.0 ku和80 ku~82 ku亚基带变得模糊,并且在分离胶和浓缩胶分理处出现大分子量分子,表明挤压的大米蛋白与糖接枝反应作用改变了蛋白的亚基结构[30],而大米蛋白疏水性的减弱,这表明挤压造成的蛋白分子聚集可能由共价键连接,可能挤压作用,蛋白分子聚集,使疏水性基团向分子内部引入[31],而糖接枝反应则改变了蛋白的亚基结构,大分子量接枝物出现,也从侧面说明了挤压后的大米蛋白,能够促进接枝反应的进行,蛋白结构改变有利于蛋白分子和多糖的结合,从而改变了接枝产物的溶解性和乳化性能。
2.3.4挤压改性的大米蛋白与葡聚糖接枝复合物电镜分析
通过SEM观察蛋白表面结构从而对其结构进行分析,本试验对天然大米蛋白、挤压大米蛋白、挤压的大米蛋白与葡聚糖接枝复合物SEM观察结果见图6。

图6 不同处理样品的SEM图Fig.6 Plots of Size exclusion chromatography of of samples obtained at different modified methods
图6显示:天然大米蛋白表面呈块状的颗粒状(图6,a),挤压的大米蛋白会呈现出整片的片层结构及多孔结构(图6,b),这可能是因为大米蛋白在温度、转速、剪切力的综合作用下,内部结构发生了一定的变化[32],维持蛋白质分子高级结构的非共价键可能被破坏,蛋白质分子之间发生各种化学作用,形成聚合体结构,同时也说明大米蛋白在挤压过程中发生不同程度的降解及聚合,其天然有序结构被打破,蛋白质分子间相互降解及聚合,形成纤维片状结构[12],而挤压大米蛋白与葡聚糖接枝复合物(图6,c)展现出更无序和不规则的的碎片结构,挤压糖接枝改变了大米蛋白的表面结构,多糖分子的引入,使大米蛋白原有的刚性结构消失,肽链伸展,分子扩散开来,改变结构[14],因此高疏水性的大米蛋白在经过挤压后,更有利于与葡聚糖接枝反应,并且挤压后进行糖接枝反应的接枝复合物的功能性提高,也说明了挤压对大米蛋白改性有一定的作用。因此挤压糖接枝改善大米蛋白的溶解性和乳化性可能与挤压后蛋白结构变化有很大关系。
3 结论
在挤压温度90℃、大米蛋白水分含量35%,螺杆转速200 r/min条件下挤压的的大米蛋白与葡聚糖接枝反应得到的接枝复合物,接枝度最大为(17.6±0.3)%,同时,该接枝复合物与天然大米蛋白相比,在较宽pH范围内,溶解性显著提高8.4%~76.6%,乳化性和乳化稳定性分别增加了62.2%和73.9%,表面疏水性降低了69.5%,表明了,挤压糖接枝反应能够提高大米蛋白的溶解性和乳化性。通过傅里叶红外光谱结果分析表明,挤压糖接枝反应显著的改变了蛋白亚基结构,α-螺旋、β-转角和无规卷曲结构含量分别增加了24.4%、26.0%和19.9%,而β-折叠结构含量减少了15.0%;SDS电泳结果分析显示,挤压的大米蛋白与葡聚糖接枝复合物的分子量为51.0 ku与80 ku~82 ku亚基带变得模糊,并且在分离胶和浓缩胶分理处出现大分子量分子,说明大米蛋白与葡聚糖发生了共价结合;扫描电镜分析了蛋白的表观结构变化,表明挤压和糖接枝对蛋白结构改性显著。因此,适当的挤压条件挤压改性大米蛋白与葡聚糖进行接枝反应得到的接枝产物具有良好的乳化性能,能够为大米蛋白应用与工业化生产提供理论基础,因此挤压糖接枝改性对提高大米蛋白的应用价值有一定的意义。
[1]Shih F F,Daigle K W.Preparation and characterization of rice protein isolates[J].Journal of Oil&Fat Industries,2000,77(8):885-889
[2]Juliano B O,Antonio A A,Esmama B V.Effects of protein content on the distribution and properties of rice protein[J].Nutrition Reviews,1973,24(3):295-306
[3]郭兴凤,张娟娟.大米蛋白功能性研究进展[J].粮食与油脂,2008 (3):1-3
[4]肖莲荣,任国谱.大米蛋白改性研究进展[J].食品与发酵工业,2012,38(2):151-156
[5]布冠好,朱婷伟,陈复生,等.大豆蛋白-乳糖复合物的结构及功能特性研究[J].中国粮油学报,2014,29(7):40-44
[6]董建云,钟昔阳,罗水忠,等,谷氨酰胺转氨酶对小麦蛋白凝胶性的影响研究[J].中国粮油学报,2014,29(12):5-10
[7]Liu Y,Zhao G,Zhao M,et al.Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J].Food Chemistry,2012,131(3):901-906
[8]Mu L,Zhao M,Yang B.Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J].Journal of Agricultural &Food Chemistry,2010,58:4494-4499
[9]Li Y,Zhong F,Ji W,et al.Functional properties of Maillard reaction products of rice protein hydrolysates with mono-,oligo-and polysaccharides[J].Food Hydrocolloids,2013,30(1):53-60
[10]Paraman I,Hettiarachchy N S.Hydrophobicity,solubility,and emulsifying properties of enzyme-modified rice endosperm protein[J]. Cereal Chemistry,2007,84(4):343-349
[11]Spotti M J,Martinez M J,Pilosof A M R,et al.Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems[J].Food Hydrocolloids,2014,39:223-230
[12]Guan J J,Zhang T B,Hui M,et al.Mechanism of microwave-accelerated soy protein isolate-saccharide graft reactions[J].Food Research International,2011,44(9):2647-2654
[13]Wang Z J,Han F F,Sui X N,et al.Effect of ultrasound treatment on the wet heating Maillard reaction between mung bean[Vigna radiate (L.)]protein isolates and glucose and on structural and physicochemical properties of conjugates[J].Journal of the Science of Food and Agriculture,2015,96(5):1532-1540
[14]Jiang S j,Zhao X H.Transglutaminase-induced cross-linking and glucosamine conjugation of casein and some functional properties of the modified product[J].International Dairy Journal,2011,21(4):198-205
[15]Selling G W,Utt K D.Effect of multiple extrusion passes on zein[J]. Polymer Degradation and Stability,2013,98(1):184-189
[16]赵学伟,魏益民,张波.挤压对小米蛋白溶解性和分子量的影响[J].中国粮油学报,2006,21(2):39-43
[17]房岩强,魏益民,张波.蛋白质结构在挤压过程中的变化[J].中国粮油学报,2013,20(5):100-104
[18]Church F C,Swaisgood H E,Porter D H,et al.Spectrophotometric Assay Using o-Phthaldialdehyde for Determination of Proteolysis in Milk and Isolated Milk Proteins[J].Journal of Dairy Science,1983,66(6):1219-1227
[19]Compton S J,Jones C G.Mechanism of dye response and interference in the Bradford protein assay[J].Analytical Biochemistry,1985,151(2):369-374
[20]Pearce K N,Kinsella J E.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Journal of Agricultural&Food Chemistry,1978,26(3):716-723
[21]Pasdar N A,Chan E C L.Comparison of protein surface hydrophobicity measured at various pH values using three different fluoresent probes[J].Journal of Agricultural&Food Chemistry,2000,48(48):328-334
[22]Laemmli U K.Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4[J].Nature,1970,227(5259):680-685
[23]郑喜群,马艳秋,刘晓兰,等.挤压膨化对玉米醇溶蛋白结构特性的影响[J].华南理工大学学报(自然科学版),2014,42(3):131-136
[24]Zhao J,Tian Z,Chen L.Effects of deamidation on aggregation and emulsifying properties of barley glutelin[J].Food Chemistry,2011,128:1029-1036
[25]纪崴.酶法及美拉德反应改进大米蛋白功能性质的研究[D].无锡:江南大学,2009
[26]许晶,齐宝坤,赵青山,等.大豆分离蛋白结构特性与表面疏水性的关系[J].中国粮油学报,2015,30(8):32-41
[27]Afizah M N,Rizvi S S H.Functional properties of whey protein concentrate texturized at acidic pH:Effect of extrusion temperature[J]. LWT-Food Science and Technology,2014,57(1):290-298
[28]Chang Y H,Cui S W,Roberts K T,et al.Evaluation of extrusionmodified fenugreek gum[J].Food Hydrocolloids,2011,25(5):1296-1301
[29]卢雁,张玮玮,王公轲.FTIR用于变性蛋白质二级结构的研究进展[J].光谱学与光谱分析,2008,28(1):88-93
[30]Buckow R,Wendorff J,Hemar Y.Conjugation of bovine serum albumin and glucose under combined high pressure and heat[J].Journal of Agricultural&Food Chemistry,2011,59(8):3915-3923
[31]Osen R,Toelstede S,Wild F,et al.High moisture extrusion cooking of pea protein isolates:Raw material characteristics,extruder responses,andtextureproperties[J].Journal of Food Engineering,2014,127:67-74
[32]Chen F L,Wei Y M,Zhang B.Chemical cross-linking and molecular aggregation of soybean protein during extrusion cooking at low and high moisture content[J].LWT-Food Science and Technology,2011,44(4):957-962
The Function Properties and Structural Characterization of Extruded Rice Protein-Dextran Conjugates
ZHANG Huan-li1,XIAO Zhi-gang1,2,*,MA Hui1,NIE Wen-wen1
(1.College of Grain Science and Technology,Shenyang Normal University,Shenyang 110034,Liaoning,China;2.College of Food Science,Northeast Agricultural University,Harbin 150030,Heilongjiang,China)
molecular weight changes and apparent characterization of rice protein by the methods and means of Fourier infrared spectrum and SDS-PAEG electrophoresis and SEM,the results analysis showed that extrusion and grafting reaction changed the structure of protein subunits significantly,the content of α-helix and β-turn and random coil increased by 24.4%,26.0%and 19.9%,respectively,and β-sheet structure content decreased by 15.0%,significantly,SDS electrophoresis analysis results showed that the extruded rice protein and dextran conjugates the line of 51.0 ku and 80 ku-82 ku become blurred,a high molecular weight appeared in the region between acrylamide separating gel with acrylamide stacking gel,indicated molecular weight have happened a big weight aggregates of covalent connection,the SEM analysis of the apparent structure,indicated the graft reaction and s extrusion modified protein structure significantly.
riceprotein;dextran;graftingreaction;extrusion;functionalproperties;structuralcharacterization
10.3969/j.issn.1005-6521.2016.15.029Abstract:In order to prepare a high solubilizing and emulsibity rice protein,the method wet-heating grafting reaction of extruded rice protein and dextran was ultilized to study the influence of barrel temperature,the material moisture content and screw speed on the degree of substitution.The optimal process conditions were determined through single factor experiment analysis:barrel temperature 90℃,35%moisture content of material,screw speed 200 r/min,Under this condition,the degree of substitution reached at(17.6±0.3)%.The solubility and emulsification,surface hydrophobicity of extruded rice protein-dextran conjugates on the degree of substitution of(17.6±0.3)%was investigated,the results showed that compared with the native rice protein,the solubility of extruded rice protein and dextran conjugates increased significantly in a wide range,increased by 8.4%-76.6%,the emulsification activity and emulsification stability increased by 62.2%and 73.9%,respectively,the surface hydrophobicity decreased by 69.5%.Meanwile,experiment analyzed subunit structure and
国家星火重点项目(2015GA650007);辽宁省高等学校优秀科技人才支持计划(第一层次)资助专项(LR2015062);辽宁省组织部“百千万人才工程”百层次人选资助专项(2013B028)
张焕丽(1992—),女(汉),在读硕士研究生,研究方向:生物化工。
2016-03-01

