痤疮患者血清H2S水平检测及与IL-6和TNF-α水平的相关性
王 玉 黄 霞 余晶晶,2
痤疮患者血清H2S水平检测及与IL-6和TNF-α水平的相关性
王玉1黄霞1余晶晶1,2
目的:检测痤疮患者血浆H2S水平及确定与IL-6和TNF-α水平的相关性。方法:采用亚甲基染色法检测67例痤疮患者(轻度31例、中度21例、重度15例)及20名健康体检者血清H2S水平,ELISA检测血清IL-6和TNF-α水平。结果: 痤疮患者血清H2S平均水平为(13.79±4.19)μmmol/L,显著低于对照组的(22.23±4.52)μ mmol/L(P<0.001);血清IL-6及TNF-α平均水平分别为(89.72±31.68)pg/mL及(61.17±23.81)pg/mL,高于对照组的(27.32±4.26)pg/mL和(22.73±14.33 pg/ mL)(P<0.001)。痤疮患者血浆H2S水平与IL-6和TNF-α浓度均呈显著负相关(均P<0.001)。结论:血浆H2S可能参与痤疮炎症的发病过程。
痤疮; 硫化氢; IL-6; TNF-α
痤疮是最常见的慢性炎症性毛囊皮脂腺疾病,大量实验和临床资料都表明,炎症反应在痤疮发病机制中扮演着重要的作用[1,2]。痤疮丙酸杆菌释放许多炎症趋化因子,吸引了淋巴细胞、中性粒细胞和巨嗜细胞等炎症细胞在局部的聚集,诱导局部炎症反应和机体免疫反应[3,4],其详细的机制尚不清楚。内源性硫化氢(hydrogen sulfide,H2S)是一种最新发现的气体信号分子,新的研究显示H2S参与炎症反应[5,6]。本研究拟通过检测痤疮患者血浆H2S、IL-6和TNF-α的含量,观察H2S在痤疮中的生成变化,探讨H2S变化与炎症介质的相关性,为痤疮发病提供新的理论依据和治疗靶点。
1 资料与方法
1.1临床资料 选择2013年9月至2014年9月在本科就诊尚未经过治疗的痤疮患者67例,年龄16~35岁,男女不限;痤疮严重程度参照Pillsbury分类法并略做修改[7],即将III度和IV度合并为重度组,将患者分为三组即轻度组31例、中度组21例和重度组15例。排除自身免疫性、药物性及系统性使用糖皮质激素等药物的疾病患者。收集正常健康体检者20名作为正常对照组。本实验经本院伦理委员会审核通过。研究对象签署知情同意书。四组人员年龄、性别等无显著性差异(P>0.05)。
主要试剂 人IL-6和TNF-α双抗体夹心酶联免疫试剂盒由检测试剂由美国R&D Systems Inc生产,北京瑞尔欣德生物工程有限公司分装。NaHS购自sigma公司。余为市售化学分析纯。
1.2方法
1.2.1标本采集及处理 痤疮组和健康体检正常人均于早晨空腹时采肘静脉血2~3 mL于肝素抗凝管中,低温离心10 min(3000 r/min),吸取上清液,EP管密封分装2份置-70℃冰箱保存待检。
1.2.2血浆H2S检测 应用亚甲基蓝法测定血浆硫化氢[8]。将100 μL血浆加入含5%醋酸锌100 μL的EP管中,充分混匀后加入100 μL NaOH(5 mol/L)。4℃离心10 min(12000 g)。小心吸去上清,加入500 μL去离子水冲洗,4℃离心10 min(12000 g),吸弃上清,依次加入5%醋酸锌溶液100 μL,0.2%N,N二甲基对苯二胺100 μL,20%三氯乙酸100 μL,充分混匀后4℃离心5 min(12000 g)。取上清200 μL,加10%硫酸铁铵10 μL,充分振荡,静置5~15 min。取200 μL溶液于96孔板,根据光谱扫描结果于665 nm测定其吸光度。根据标准曲线换算溶液中H2S浓度。
1.2.3IL-6和TNF-α检测 应用人IL-6和TNF-α酶联免疫试剂盒(美国R&D Systems Inc.)测定血浆标本中的IL-6和TNF-α,按说明书操作。
1.2.4统计学方法 所有数据均以均数±标准差(-x± s)表示,数据处理及制图采用GraphPad Prism 5 Demo统计软件分析,两组间比较采用不配对t检验,多组间采用方差检验,相关性关系用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1痤疮患者血浆H2S水平的变化 本实验条件下,正常对照组血浆H2S浓度是(22.23±4.52)μmmol/L,痤疮患者血浆H2S水平显著降低(13.79± 4.19)μmmol/L,两组比较差异有统计学意义(P<0.001)。痤疮患者轻度组、中度组及重度组血浆H2S浓度分别是(18.04±4.24)μmmol/L,(11.65±2.03)μmmol/L和(10.03±3.19)μmmol/L。各组血浆H2S浓度均显著低于对照组,差异有统计学意义(均P<0.001)。轻度组显著高于中度组及重度组,差异有统计学意义(均P<0.001)。结果见图1、2。
2.2痤疮患者血清中IL-6及TNF-α水平 痤疮组及轻度组、中度组和重度组患者血清IL-6及TNF-α水平均显著高于对照组,差异有统计学意义(均P<0.01)。重度组血清IL-6及TNF-α水平又显著高于轻度组及中度组(均P<0.01),结果见表2。
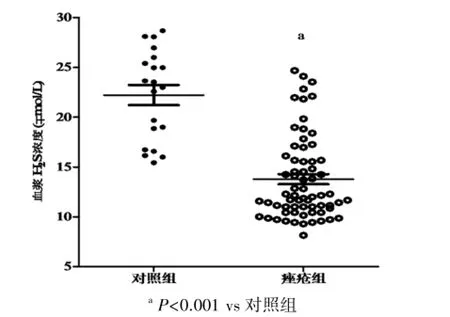
图1 痤疮患者血浆H2S水平的变化
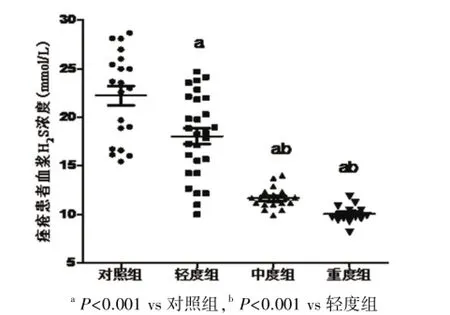
图2 不同严重程度痤疮患者血浆H2S水平比较
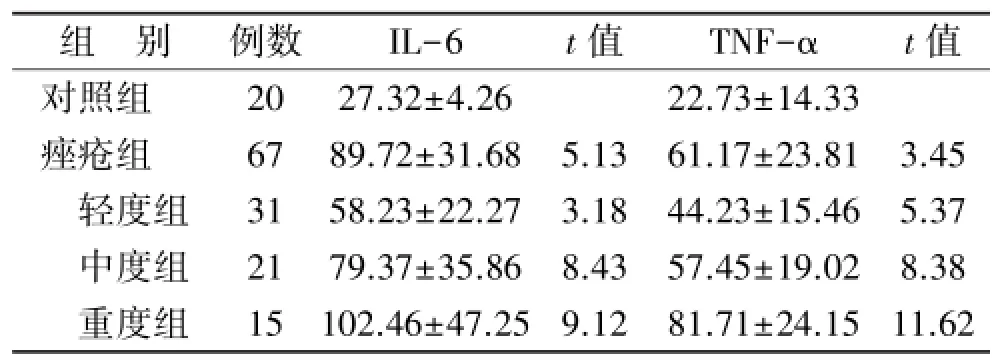
表1 对照组和痤疮组血清IL-6和TNF-α比较(-x±s,pg/mL)
2.3痤疮患者血浆H2S水平与IL-6和TNF-α相关性分析 痤疮患者血浆H2S浓度与IL-6呈显著负相关(R=-0.45,P<0.01),与TNF-α呈显著负相关(R=-0.51,P<0.001)。
3 讨论
痤疮是一种慢性炎症反应性疾病,其炎症是丙酸杆菌及皮脂分解产物导致机体免疫应答作用的结果。痤疮丙酸杆菌刺激角质细胞产生前炎症因子如IL-6、IL-8和TNF-α等是启动机体免疫应答反应的关键[3,9]。H2S是新发现的内源性气体信号分子,近年的研究显示H2S在调节机体生理功能等多个方面具有与NO及CO极为相似的特性[10]。随着对H2S深入的研究和探讨,发现H2S参与多种炎症疾病的病理生理过程[11]。然而,H2S是否也参与了痤疮的发病尚不清楚。
本文检测了67例痤疮患者血浆H2S及IL-6和TNF-α浓度,并分析患者血浆H2S水平与IL-6和TNF-α浓度的相关性。结果显示,轻度组、中度组及重度组痤疮患者血浆H2S浓度均显著低于对照组,且与疾病严重程度相关;各组患者血清中IL-6和TNF-α浓度显著高于对照组。说明H2S,IL-6和TNF-α参与了痤疮的发病过程。国内外文献均证实痤疮患者血浆IL-6和TNF-α水平升高,参与了痤疮发病的病理生理过程[3]。痤疮患者血浆H2S水平降低的原因尚不清楚。伍蕊等检测支气管哮喘患者血浆H2S浓度发现,无论是哮喘缓解期或是急性发作期中轻度、中度和重度组的血浆H2S水平均较对照组降低[12]。然而,黄惊鸿发现重症急性胰腺炎患者血浆H2S水平较对照组显著增加[14]。斯伟宏等也发现急性腹膜炎患者血浆H2S水平较对照组也显著增加[14]。H2S在不同炎症疾病中的不同变化的原因尚不清楚,有学者认为H2S气体信号分子的生物活性效应及其机制可能具有细胞和疾病特异性[15]。
本研究还发现,血浆H2S水平与IL-6和TNF-α水平呈显著负相关。痤疮发病时,H2S的生成变化与IL-6和TNF-α之间的关系尚不清楚。有文献报道H2S可能作为一种炎症介质,诱导中性粒细胞凋亡、抑制内皮黏附分子及淋巴细胞表达方式而参与炎症因子介导的感染性疾病的发生与发展[16]。另有研究发现,外源性给予NaHS,能够降低TNF-α诱导的细胞黏附分子(ICAM-1)和血管细胞黏附分子(VcAM-1)基因表达水平,减轻TNF-α诱导的血管内皮细胞炎症信号和功能障碍[17,18];减少心肌缺血再灌注损伤大鼠的核因子-κBp65从细胞质到细胞核的亚基易位,降低心肌细胞间黏附分子基因表达和多形核白细胞积聚,降低心肌组织白(细胞)介素6、TNF-α和髓过氧化酶活性[16,19]。释放H2S的5-氨基水杨酸衍生物ATB-429能减轻小鼠结肠炎模型中的白细胞渗出。痤疮发病时H2S生成减少是否导致炎症因子增加而促进了痤疮的炎症过程,需进行深入研究。
总之,目前关于内源性H2S对痤疮的生物学效应以及在皮肤炎症性疾病中的作用研究甚少。增加H2S的生成是否能够治疗或缓解痤疮等局部炎症性皮肤疾病需要进一步的研究。
[1]Grange PA,Weill B,Dupin N,et al.Does inflammatory acne result from imbalance in the keratinocyte innate immune response?[J].Microbes and Infection,2010,12(14-15): 1085-1090.
[2]Larson SK,Dawson AL,Dunnick CA,et al.Acne vulgaris: pathogenesis,treatment,and needs assessment[J].Dermatologic Clinics,2012,30(1):99-106.
[3]Tanghetti EA.The role of inflammation in the pathology of acne[J].J Clin Aesthet Dermatol,2013,6(9):27-35.
[4]Toyoda M,Morohashi M.Pathogenesis of acne[J].Med E-lectron Microsc,2001,34(1):29-40.
[5]Gemici B,Elsheikh W,Feitosa KB,et al.H2S-releasing drugs:anti-inflammatory,cytoprotective and chemopreventative potential[J].Nitric Oxide,2015,46:25-31.
[6]Wallace JL,Ianaro A,Flannigan KL,et al.Gaseous mediators in resolution of inflammation[J].Semin Immunol,2015,27(3):227-33.
[7]赵辨.临床皮肤病学[M].3版.南京:江苏科学技术出版社,2001.935-938.
[8]郑扬,廖锋,杜军保,等.改良亚甲基蓝法测定血浆硫化氢[J].生理学报,2012,64(6):681-686.
[9]Silva JB,Oliveira SK,Campos IA,et al.Propionibacterium acnes-killed attenuates the inflammatory response and protects mice from sepsis by modulating inflammatory factors[J].Braz J Infect Dis,2013,17(1):20-26.
[10]Wang R.Two's company,three's a crowd:can H2S be the third endogenous gaseous transmitter?[J].FASEB J,2002,16:1792-1798.
[11]花旺,陈其.硫化氢在炎症中的作用研究进展[J].国际儿科学杂志,2010,37(2):212-213.
[12]伍蕊,姚婉贞,陈亚红,等.支气管哮喘患者血浆中硫化氢的变化及其意义[J].北京大学学报(医学版),2008,40(5):505-508.
[13]黄惊鸿,卢根林,斯伟宏,等.硫化氢在重症急性胰腺炎患者血浆中的表达及意义[J].中国中西医结合外科杂志,2012,18(1):25-27.
[14]斯伟宏.硫化氢在急性腹膜炎患者血浆中的表达及意义[J].温州医学院学报,2012,42(2):181-182.
[15]Li T,Zhao B,Wang C,et al.Regulatory effects of hydrogen sulfide on IL-6,IL-8 and IL-10 levels in the plasma and pulmonary tissue of rats with acute lung injury[J].Exp Biol Med(Maywood),2008,233(9):1081-1087.
[16]Sivarajah A,Collino M,Yasin M,et al.Anti-apoptotic and anti-inflammatory effects of hydrogen sulfide in a rat model of regional myocardial I/R[J].Shock,2009,31(3):267-274.
[17]Hegde A,Bhatia M.Hydrogen sulfide in inflammation: friend or foe?[J].Inflamm Allergy Drug Targets,2011,10(2):118-122.
[18]Pan LL,Liu XH,Gong QH,et al.Hydrogen sulfide attenuated tumor necrosis factor-α-induced inflammatory signaling and dysfunction in vascular endothelial cells[J].PLoS One,2011,6(5):e19766.
[19]Sodha NR,Clements RT,Feng J,et al.Hydrogen sulfide therapy attenuates the inflammatory response in a porcine model of myocardial ischemia/reperfusion injury[J].J Thoracic Cardiovascular Surgery,2009,138(4):977-984.
(收稿:2015-09-05 修回:2015-10-20)
Detection of hydrogen sulfide and its correlation with interleukin 6 and tumor necrosis factor-α in patients with acne
WANG Yu1,HUANG Xia1,YU Jingjing1,2.
1.Department of Dermatology,Shiyan People's Hospital,Hubei 442000,China;2.Hubei University of Medicine,Shiyan 442000,China
Corresponding author:YU Jingjing,E-mail:13317283066@163.com
Objective:To detect the level of hydrogen sulfide(H2S)and to determine the relationship between serum H2S level and the levels of IL-6 and TNF-α among the patients with acne vulgaris.Methods: The level of H2S in 67 patients with acne vulgaris(31 patients with mild acne,21 with moderate acne and 15 with severe acne)and 20 normal controls was detected by methylene blue staining.The level of IL-6 and TNF -α were detected by ELISA.Results:The average level of H2S in the patients with acne was(13.79±4.19)μmmol/L,which was lower than that in controls(22.23±4.52)μmmol/L.The average levels of IL-6 and TNF-α were(89.72±31.68)pg/mL and(61.17±23.81)pg/mL,which was higher than those in controls(27.32±4.26)pg/mL and(22.73±14.33)pg/mL.The H2S level of patients was negatively correlated with the levels of IL-6 and TNF-α(P<0.001).Conclusion:H2S may be associated with the inflammation reaction in the course of acne.
acne;hydrogen sulfide;IL-6;TNF-α
1湖北省十堰市人民医院皮肤科,442000 2湖北医药学院,442000
余晶晶,E-mail:13317283066@163.com

