番茄红素的抗氧化活性研究
刘国安,薛 莹,马 伟,李贵琛,吴亚楠
(西北师范大学生命科学学院,甘肃兰州 730070)
番茄红素的抗氧化活性研究
刘国安,薛莹,马伟,李贵琛,吴亚楠
(西北师范大学生命科学学院,甘肃兰州730070)
番茄红素是最主要的类胡萝卜素,且具有多种生理活性.为了促进番茄红素在医药方面的应用,通过铁氰化钾法、脱氧核糖降解法、邻苯三酚自氧化法以及硫代巴比妥酸比色法检测番茄红素的还原力,以及对羟自由基、超氧阴离子的清除作用和对脂质过氧化的抑制作用;用MTT法、SDS-PAGE法以及毛细管电泳检测番茄红素对细胞、蛋白质以及DNA氧化损伤的保护作用,用槲皮素为对照,研究番茄红素的抗氧化活性.结果表明,番茄红素具有一定的还原力和较强的自由基清除能力,对羟自由基和超氧阴离子的EC50分别为0.02和69.31 μmol·L-1;抑制脂质过氧化的IC50为20.8 μmol·L-1,在浓度为5 μmol·L-1时对细胞、DNA的氧化损伤具有明显保护作用,且活性均比槲皮素强.表明番茄红素具有较强抗氧化活性.
番茄红素;自由基;抗氧化;损伤保护
活性氧(Reactive oxygen species, ROS)被认为是引起癌症、心脑血管疾病以及其他慢性病的重要因素[1,2].正常生理水平下,活性氧的产生和清除处于一个平衡状态.在生物体中,活性氧的水平由一个复杂的氧化防御系统网调控,这个防御系统可以使生物分子受到的氧化损伤最小化.在一些人类疾病中,由于“氧化-抗氧化”平衡被打破,向“氧化”一方倾斜,使得机体内氧化胁迫水平上升[1].活性氧引起的氧化胁迫可导致糖类、蛋白质、脂质和DNA等大分子的损伤,破坏其功能,并引起一系列如癌症、衰老以及心血管等疾病[3].番茄红素(Lycopene)是广泛存在于番茄类以及其他可食用果蔬和植物中的一种重要类胡萝卜素.有关番茄红素抗氧化作用的研究有较多文献报道,但都不够全面[4].流行病学研究发现,大量食用番茄会使癌症发生率降低,并且可以预防一些心血管疾病[5,6].近年来,大部分对于抗氧化的新药物研究开始聚焦于日常人类膳食中可摄取的天然产物上,因为这些产物很少表现出严重的副作用,并且可以有效作用于有关肿瘤发生的分子靶点[7,8],所以,在细胞和生化水平研究番茄红素的活性,有助于深入认识其作用机理.本文测定了番茄红素的还原力、清除自由基和抑制脂质过氧化的能力及对H2O2造成细胞毒性的保护作用,并通过毛细管电泳(Capillary electrophoresis,CE)检测了其对细胞内DNA损伤标志物8-OH-dG含量的影响,以期深入揭示其抗氧化活性并为在医药方面的应用提供理论依据.
1 材料与方法
1.1材料
番茄红素购自南京森贝加公司,槲皮素、AAPH(2,2′-azobis(2-methylpropionamidine)dihydrochloride,即: 2,2′-偶氮二异丁基脒二盐酸盐)、琼脂糖、8-OH-dG标准品均购自Sigma公司,脱氧核糖购自Bio Rad,十二烷基磺酸钠(SDS)购自Serva,恶性胶质瘤细胞U87引自兰州大学生命科学学院,DMEM培养基(Dulbecco’s modified eagle medium)购自美国Gibco,新生牛血清为杭州四季青公司产品,其余试剂皆为国产分析纯.
紫外-可见光分光光度计(HITACHI U-1800),台式冷冻高速离心机(Allegra 64R Beckman),CO2培养箱(Precision Scientific,美国),超净工作台(苏净集团,江苏),倒置显微镜(Olympus CKX41SF,日本),P/ACE MDQ型毛细管电泳仪(Beckman Coulter,美国)
1.2方法
1.2.1还原力测定抗氧化剂可将Fe3+还原成Fe2+,并与铁氰化钾生成可溶性的在700 nm处有最大光吸收的蓝色配合物KFe[Fe(CN)6].所以还原力越强,测得吸光值越大.采用Oyaizu测定还原力的方法[8],稍加修改.取不同浓度的(1,10,100 μmol·L-1)番茄红素样品溶液1 mL,加入0.2 mol pH=6.6的磷酸盐缓冲液和1% 铁氰化钾(K3Fe(CN)6)溶液各2.5 mL并混合均匀,置于50 ℃水浴中保温20 min,加入2.5 mL 10%的三氯乙酸,混合物4 000 r·min-1离心10 min.取上清2.5 mL,加入2.5 mL蒸馏水和1 mL 0.1%的三氯化铁溶液.静置10 min后在700 nm处检测吸光值.
1.2.2羟自由基清除能力测定采用脱氧核糖降解法,在体系中依次加入1 160 μL pH=6.5的磷酸盐缓冲溶液(Phosphate buffered saline,PBS),580 μL的EDTA-Na2(1 mmol·L-1)溶液和380 μL FeCl3(1 mmol·L-1)溶液,振荡摇匀.依次加入750 μL脱氧核糖溶液(20 mmol·L-1)、100 μL 30%过氧化氢溶液和各浓度的抗氧化剂,以30 μL的抗坏血酸(10 mmol·L-1)溶液启动Fenton反应并振荡摇匀.将反应混合液置于50 ℃水浴中30 min,取出冷却至室温,再加入500 μL 2.8%的三氯乙酸(Trichloroacetic acid solution,TCA)溶液终止反应,500 μL 1%的显色剂硫代巴比妥酸(2-Thiobarbituric acid,TBA)于100 ℃水浴显色30 min.待冷却至室温后,532 nm处检测吸光值.清除率(%)=[1-A1/A0]×100(A0为未加清除剂的吸光值;A1为加入清除剂的吸光值).
1.2.3超氧阴离子清除能力测定取0.5 mL不同浓度样品,加入4.43 mL pH=8.2的Tris-HCl(50 mmol·L-1)缓冲液后,加入70 μL邻苯三酚溶液(10 mmol·L-1),立刻计时并迅速摇匀,在反应启动后每隔30 s检测相应325 nm处的吸光值,至4.5 min为止.对照管用70 μL盐酸(10 mmol·L-1)代替邻苯三酚溶液.超氧阴离子清除率(%)=[1 -(A1-A2)/ A0]×100(A0为未加清除剂的吸光值;A1为加入清除剂的吸光值;A2为未加邻苯三酚的吸光值).
1.2.4对脂质过氧化的抑制用硫代巴比妥酸比色法,参考刘国安等[10]的方法提取微粒体,稀释至0.3~0.5 g·L-1.取300 μL微粒体加入100 μL PBS及300 μL蒸馏水,再加入不同浓度的样品100 μL,阳性对照用蒸馏水代替.用200 μL Vc/Fe2+启动反应,37 ℃孵育1 h,加入1 mL 20% TCA终止反应,再与1.5 mL 0.67%的TBA混匀,沸水浴1 h,离心30 min,取上清液在532 nm处检测吸光值.
1.2.5检测对蛋白氧化降解的保护作用取200 mL BSA(5 mg·L-1),加入400 μL AAPH(50 mmol·L-1)构成损伤模型反应体系.对照和加入5,50,500 μmol·L-1番茄红素以及50 μmol·L-1槲皮素的测试组在37 ℃孵育24 h,加入200 μL 4%的BHT终止反应.依常规进行SDS-PAGE电泳、染色、脱色并拍照.
1.2.6细胞培养瘤细胞U87培养于DMEM完全培养基中,内含10%新生牛血清和链霉素(100 μg·mL-1)及青霉素(100 U·mL-1),培养于5% CO2饱和湿度恒温箱(37 ℃),取对数生长期细胞用于实验.
1.2.7MTT比色法检测番茄红素对H2O2引起U87细胞损伤的保护作用取对数生长期的U87细胞,以1×105个·mL-1的浓度接种于96孔板中,每孔100 μL,孵育24 h,保护组加入不同浓度番茄红素,使终浓度为0.5,1,5,25 μmol·L-1,孵育2 h后加入终浓度为100 μmol·L-1的H2O2;对照组、损伤组分别加入含10%新生牛血清的DMEM完全培养基和终浓度为100 μmol·L-1的H2O2,孵育24 h,每孔加入20 μL MTT(5 mg·L-1),37 ℃孵育4 h,吸去上清,加入150 μL DMSO,振荡10 min溶解结晶,用酶标仪在490 nm波长处检测每孔的吸光值(A),并以对照组百分比表示细胞活性. 细胞生长率(%)=(A1-A0)/(A-A0)×100,其中,A0为空白组吸光值;A为对照组吸光值;A1为实验组吸光值.
1.2.8毛细管电泳检测番茄红素对U87细胞DNA损伤的保护作用取对数生长期的U87细胞,以1×105个·mL-1的浓度接种于6孔板中,每孔100 μL,孵育24 h.保护组加入不同浓度的番茄红素,使终浓度为1,5,10 μmol·L-1,孵育2 h,加入终浓度为100 μmol·L-1的H2O2;对照组、损伤组分别加入含10%牛血清的DMEM完全培养基和终浓度为100 μmol·L-1的H2O2,孵育24 h,用天根 DP304-02 DNA提取试剂盒提取DNA,测定DNA纯度并进行上样前处理,进行毛细管电泳检测.检测条件:25 ℃,20 kV,进样20 s;检测10 min;pH9.0硼酸-氢氧化钠(10 mmol·L-1)为电极缓冲液.结果以检测得峰面积带入线性回归方程y=1245x-50176,相关系数R2=0.966,得到8-OH-dG含量(x为8-OH-dG标准品浓度,y为峰面积).
1.2.9数据处理所有实验重复3次,实验结果以平均值±标准差表示,用t检验进行差异显著性分析,P<0.05为有统计学意义.
2 结果与分析
2.1番茄红素的还原力
槲皮素是常见的膳食抗氧化剂之一[11],本文以槲皮素为参照,对比番茄红素的活性.表1是不同浓度番茄红素的还原力,可看到随着浓度的增高,还原力也不断增高,在测试范围内呈正相关,并且在100 μmol·L-1时吸光值达到0.0943.但与10 μmol·L-1槲皮素相比活性较弱.

表1 番茄红素的还原力
2.2番茄红素清除自由基的作用


表2 番茄红素清除自由基的能力
2.3番茄红素对脂质过氧化的抑制作用
表3表明番茄红素对大鼠肝微粒体脂质过氧化有抑制作用,半抑制浓度(Half maximal inhibitory concentration,IC50)为20.8 μmol·L-1,其抑制作用较槲皮素(IC50为27.33 μmol·L-1)强,显示出良好的抗氧化活性.

表3 番茄红素对脂质过氧化的抑制作用
2.4番茄红素对蛋白质氧化损伤的保护作用
图1是番茄红素和槲皮素保护由AAPH 引起的BSA氧化损伤的保护作用结果.与对照相比,BSA与AAPH在37 ℃作用后,通过SDS-PAGE凝胶电泳条带明显变浅,说明牛血清蛋白被氧化降解.向体系中加入不同浓度番茄红素后,随着浓度的增加,BSA的降解被抑制.根据条带的深浅可看出,5 μmol·L-1的番茄红素具有一定的保护作用,50 μmol·L-1时保护作用更强;而500 μmol·L-1与50 μmol·L-1组结果相似,都具有较强的保护作用并且与对照组条带相近.同时,相同浓度下,50 μmol·L-1槲皮素处理组抑制蛋白降解的效果较弱,表明该体系中番茄红素比槲皮素具有更强的保护作用.

图1 番茄红素对AAPH引起BSA氧化降解的保护作用
2.5番茄红素对H2O2引起U87细胞损伤的保护作用
H2O2是有机体的氧化代谢产物,同时是一种活性氧.用100 μmol·L-1H2O2损伤U87细胞或预先加入不同浓度番茄红素处理,通过观察细胞活力评估番茄红素的保护作用.由图2可知,槲皮素和0.5,1,5 μmol·L-1番茄红素单独作用于U87细胞时,对细胞生长率并无太大影响,与对照相比无显著差异.而25 μmol·L-1番茄红素对U87细胞有一定的生长抑制作用,生长率为76.60%.100 μmol·L-1H2O2可导致细胞生长率急剧降低至66.28%.在用待测样进行预处理后,0.5 μmol·L-1番茄红素无保护作用,槲皮素、1 μmol·L-1、5 μmol·L-1番茄红素使细胞活性升高,其中1 μmol·L-1番茄红素的保护作用很微弱,与H2O2损伤组相比差异不显著,5 μmol·L-1番茄红素的保护作用强,达到97.39%,与损伤组相比差异极显著(P<0.01),且使细胞生长率水平与对照达到同一水平;同时,与同浓度槲皮素(5 μmol·L-1)相比,番茄红素保护能力更强,与损伤组相比差异极显著.高剂量番茄红素保护组的细胞活性(54.79%)甚至低于H2O2损伤组,不但无保护作用,还表现出一定的促氧化作用.
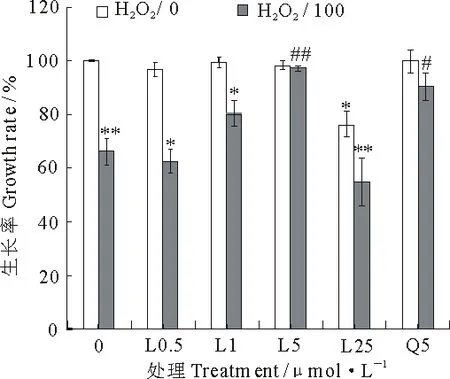
图2 番茄红素对U87细胞氧化损伤的保护作用
L.番茄红素;Q.槲皮素; *P<0.05,**P<0.01与对照组相比;#P<0.05,##P<0.01与损伤组相比.
L.Lycopene;Q.Quercetin;*P<0.05,**P<0.01 compared with control;#P<0.05,##P<0.01 compared with injury group.
2.6番茄红素对细胞DNA氧化损伤的保护作用
机体自由基过量时,会攻击DNA并最终造成氧化损伤.已发现的各种DNA氧化损伤产物中,鸟嘌呤最容易被氧化损伤,这是由于它具有较高能级的分子轨道,在发生氧化损伤时极易形成修饰核苷且化学性质较稳定的8-OH-dG[13].大量研究表明8-OH-dG可以作为反映内源及外源因素对DNA氧化损伤的较灵敏和稳定的生物标记物.图3是用CE检测番茄红素对H2O2引起U87细胞DNA损伤的作用,结果中峰面积与8-OH-dG含量成正比,即含量越高DNA氧化损伤越严重.与对照组相比,加入H2O2损伤细胞后,峰面积增大,8-OH-dG含量升高.1 μmol·L-1番茄红素对此损伤无作用,而浓度为5 μmol·L-1时峰面积减小,8-OH-dG浓度降低,表现出明显保护作用;相比之下,10 μmol·L-1也有一定的保护作用,但不如5 μmol·L-1组强.同样,槲皮素的抗DNA损伤活性不如番茄红素强.
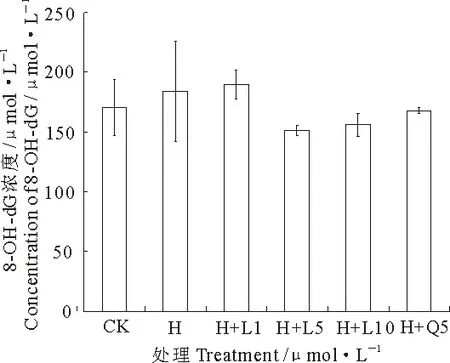
图3 番茄红素对8-OH-dG含量的影响
CK.对照组;H.H2O2处理组;H+L1.1 μmol·L-1番茄红素保护组;H+L5.5 μmol·L-1番茄红素保护组;H+L10.10 μmol·L-1番茄红素保护组;H+Q5.5 μmol·L-1槲皮素保护组.
CK.Control;H.Treated with H2O2;H+L1.Protection group of 1 μmol·L-1lycopene; H+L5.Protection group of 5 μmol·L-1Lycopene;H+L10.Protection group of 10 μmol·L-1lycopene;H+Q5.Protection group of 5 μmol·L-1lycopene quercetin.
3 讨论
所有需氧生物体内均产生ROS,它与多种病理过程相关.机体内ROS过量时,膜脂、蛋白质、DNA等大分子都会成为其攻击对象,引起细胞死亡、组织损伤,从而导致机体受损.番茄红素在多种果蔬中含量丰富,且具有多种生理活性,包括抗氧化作用、诱导细胞间隙通信、影响肿瘤细胞增殖、调节机体免疫力等功能[14].
有关番茄红素体外抗氧化的文献较多,但多集中于对提取方法的优化及抗油脂氧化能力的研究.本研究通过体外抗氧化测试,发现番茄红素具有较好的抗氧化活性和一定的还原能力,并且随着浓度的增大而增强.同时,番茄红素可猝灭单线态氧和自由基[15],有文献报道番茄红素是大约600多种天然类胡萝卜素中最有效的单线态氧捕获剂[16].另外番茄红素可有效清除超氧阴离子和羟自由基,同浓度下清除率甚至高于常用天然产物槲皮素.有实验表明,摄食番茄红素可有效抑制脂质等大分子氧化,明显减少脂质过氧化产物如丙二醛的产量[17],当浓度为20.8 μmol·L-1时,对脂质过氧化的抑制率可达到50%.Qu等[18]指出,番茄红素对大鼠皮层神经元细胞的氧化损伤有保护作用,此外,5 μmol·L-1番茄红素对H2O2引起的U87细胞氧化损伤有较好的保护能力.但当浓度达到25 μmol·L-1时,细胞活力反而低于H2O2损伤组,推测此浓度可能有促氧化的作用.丁怡等[19]用番茄红素保护H2O2对N2a细胞(小鼠来源神经瘤母细胞)的损伤时,同样检测到浓度为5 μmol·L-1表现出较强的保护作用,而20 μmol·L-1时,细胞活力与损伤组比无显著差异.进一步用CE检测胞内DNA损伤情况,发现番茄红素对H2O2诱导的DNA损伤有保护作用,并在浓度为5 μmol·L-1时最强.解瑞宁等[20]通过单细胞凝胶电泳检测番茄红素对H2O2引起的CHL细胞(中国仓鼠肺细胞)DNA损伤的保护作用时,发现在0.5~5 μmol·L-1范围内有明显保护作用,并随着剂量的增加,DNA拖尾百分率降低,DNA迁移长度变小,氧化损伤减轻,且在5 μmol·L-1时保护率最高.但高浓度(10 μmol·L-1)剂量组的平均尾长和拖尾率与H2O2损伤组比较无显著性差异,与本文结果相一致,在5 μmol·L-1时,番茄红素表现出较强的保护作用,但在高剂量组,保护作用不明显.这说明浓度5 μmol·L-1的番茄红素可能对DNA损伤有较强的保护能力.
综上,番茄红素除了在还原力实验中活性不如槲皮素,在其他的检测体系中抗氧化活性都接近或大于槲皮素,表明它是很好的抗氧化剂.但高浓度的番茄红素可能具有促氧化作用.
[1]STOHS S J.The role of free radicals in toxicity and disease[J].Journal of Basic & Clinical Physiology & Pharmacology,1995,6(3-4):205.
[2]WISEMAN H,HALLIWELL B.Damage to DNA by reactive oxygen and nitrogen species:role in inflammatory disease and progression to cancer[J].Biochem J,1996,313(1):17.
[3]刘国安,孙志鹏,杨庆明,等.大麦提取物抗氧化活性测定[J].西北师范大学学报(自然科学版),2013,49(2):80.
[4]WOODALL A A,LEE S W M,WEESIE R J,et al.Oxidation of carotenoids by free radicals:relationship between structure and reactivity[J].Biochim Biophys Acta,1997,1336(1):33.
[5]GIOVANNUCCI E.A review of epidemiologic studies of tomatoes,lycopene and prostate cancer[J].Experimental Biology and Medicine,2002,227(10):852.
[6]HEBER D,LU Q Y.Overview of mechanism of action of lycopene[J].Experimental Biology and Medicine,2002,227(10):920.
[7]KELKEL M,SCHUMACHER M,DICATO M,et al.Antioxidant and antiproliferative properties of lycopene[J].Free Radical Res,2011,45(8):925.
[8]PALOZZA P,BELLOVINO D,SIMONE R,et al.Effect of beta-carotene-rich tomato lycopene beta-cyclase(tlcy-b) on cell growth inhibition in HT-29 colon adenocarcinoma cells[J].British Journal of Nutrition,2009,102(2):207.
[9]OYAIZU M.Studies on products of browning reactions:antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44(6):307.
[10]刘国安,杨庆明,侯国鹏,等.黄连素抗氧化性的研究[J].西北师范大学学报(自然科学版),2009,45(6):87.
[11]BOOTS A W,HAENEN G R M M,BAST A.Health effects of quercetin:from antioxidant to nutraceutical[J].European Journal of Pharmacology,2008,585(2):325.
[12]PISOSCHI A M,POP A.The role of antioxidants in the chemistry of oxidative stress:a review[J].European Journal of Medicinal Chemistry,2015,97:55.
[13]KASAI H,NISHLLNURA S.Hydroxy lation of deoxygunosine at the C-8 position by aseorbic acidand other redueingagents[J].Nuel Aeie Res,1984,12(4):2137.
[14]KAUR H,CHAUHAN S,SANDHIR R.Protective effect of lycopene on oxidative stress and cognitive decline in rotenone induced model of Parkinson’s disease[J].Neurochem Res,2011,36(8):1435.
[15]BRITTON G.Carotenolds 1:structure and properties of carotenoids in relation to function[J].Faseb Journal,1995,9(15):1551.
[16]DI MASCIO P,KAISER S,SIES H.Lycopene as the most efficient biological carotenoid singlet oxygen quencher[J].Arch Biochem Biophys,1989,274(2):532.
[17]AGARWAL S,RAO A V.Tomato lycopene and low density lipoprotein oxidation:a human dietary intervention study[J].Lipids,1998,33(10):981.
[18]QU M Y,LI L,CHEN C H,et al.Protective effects of lycopene against amyloid β-induced neurotoxicity in cultured rat cortical neurons[J].Neuroscience Letters,2011,505(3):286.
[19]丁怡,钱珂,支枫,等.番茄红素对过氧化氢诱导的小鼠来源神经瘤母细胞损伤的保护作用及机制研究[J].中老年心血管病杂志,2013,15(6):640.
[20]解瑞宁,张凯,沈新南.番茄红素对CHL细胞DNA氧化损伤的影响[J].济宁医学院学报,2007,30(2):104.
(责任编辑俞诗源)
The antioxidant activity studies of lycopene
LIU Guo-an,XUE Ying,MA Wei,LI Gui-chen,WU Ya-nan
(College of Life Science,Northwest Normal University,Lanzhou 730070,Gansu,China)
Lycopene is one of the most abundant carotenoid which has multiple activities.In order to promote the application of lycopene in medicine,its antioxidant effect is discussed in this papper.The reducing activity,scavenging effects of both hydroxyl radical and superoxide anion,protections against the lipid peroxidation are measured by potassium ferricyanide method,deoxyribose degradation method,autoxidation of pyrogallol method and thiobarbituric acid colouration method,respectively.The detection of and oxidative damage of cells,protein,DNA are done by MTT method,SDS-PAGE,capillary electrophoresis,and all the test are compared with quercetin.The results indicate that lycopene shows some reducing activity and powerful ability of scavenging on free radicals.The EC50for the elimination of hydroxyl radical and superoxide anion are 0.02 and 69.31 μmol·L-1,respectively.Lycopene shows inhibiting effect of lipid peroxidation with IC50value of 20.8 μmol·L-1and obviously protective effect on cells and DNA from H2O2-induced oxidative damage at the concentration of 5 μmol·L-1.Also,lycopene is more active than quercetin in these systems.
lycopene;free radicals;antioxidant;protection
10.16783/j.cnki.nwnuz.2016.02.018
2015-11-23;修改稿收到日期:2015-01-08
教育部留学回国人员科研启动基金资助项目
刘国安(1964—),女,河北滦南人,教授,博士,硕士研究生导师.主要研究方向为生物化学与药理学.
E-mail:liuguoan@nwnu.edu.cn
TS 202.3
A
1001-988Ⅹ(2016)02-0089-06

