盐酸头孢噻呋乳房注入剂对干乳期奶牛的安全性分析
吴 彤,赵蕾蕾,张道康,徐 飞,张 宁,江善祥,刘义明*
(1.南京农业大学生命科学院,南京 210095;2.中国农业科学院饲料研究所,北京 100081;3.中国农业大学动物医学院,北京 100193;4.南京农业大学动物医学院,南京 210095)
盐酸头孢噻呋乳房注入剂对干乳期奶牛的安全性分析
吴彤1,赵蕾蕾2,张道康2,徐飞2,张宁3,江善祥4*,刘义明2*
(1.南京农业大学生命科学院,南京 210095;2.中国农业科学院饲料研究所,北京 100081;3.中国农业大学动物医学院,北京 100193;4.南京农业大学动物医学院,南京 210095)
为研究盐酸头孢噻呋乳房注入剂对干乳期奶牛临床使用的安全性,开展药物对健康奶牛的安全性研究,作者选择健康泌乳期奶牛12头(初产和经产各6头),四个乳区分别单次给予盐酸头孢噻呋乳房注入剂一支(规格10 mL:500 mg)。比较奶牛用药前后直肠温度、日产奶量、牛奶体细胞数和乳区病原菌的变化。整个试验期间对给药奶牛进行连续观察,记录是否出现红、肿、热、痛等临床症状。结果显示,与给药前相比,奶牛的直肠温度、日产奶量、牛奶体细胞数均无显著变化(P>0.05),乳区病原菌数量有所减少,同时,没有增加新的病原菌。结果表明,盐酸头孢噻呋乳房注入剂对干乳期奶牛正常体温、产奶量、奶中体细胞数和乳区菌群没有不良影响,该制剂用于奶牛是安全的。
盐酸头孢噻呋乳房注入剂;干乳期;安全性
奶牛乳房炎是奶牛养殖业中一种最常见的疾病,据报道,全世界的奶牛中有1/3左右患有不同程度的乳房炎,其中隐性乳房炎的发病率可达50%[1]。乳房炎所带来的奶牛产奶量下降,牛奶品质下降,药物治疗费用以及治疗期间的牛奶废弃给奶牛养殖业带来了严重的经济损失。由于干乳期奶牛乳房生理机能的变化,乳房炎的感染率较泌乳期更高,而且干乳期感染乳房炎会给妊娠带来严重的影响。干乳期防治是控制牛群乳房炎的一种重要手段[2],由于奶牛处于停乳的特殊时期,不仅方便用药,而且能提高治疗效果。病原菌感染是引起奶牛乳房炎的最重要原因,常见病原菌有大肠杆菌、链球菌和葡萄球菌[3]。奶牛干乳时向乳房内注入药物,可有效预防和治疗奶牛乳房炎,提高下一生产周期的产奶量。目前国内用于干奶期治疗乳房炎的药物相对较少,为提高干乳期奶牛乳房炎的防治效果,降低养殖成本,提高养殖效益,中国农业科学院饲料研究所(国家饲料药物基准实验室)等国内5家单位成功研制了盐酸头孢噻呋乳房注入剂,为干乳期奶牛乳房炎的预防和治疗提供一种新的选择。
头孢噻呋是第一个动物专用的第三代头孢类抗生素,最早在1984年由Bernard Labeeuw等首次合成,1988年被美国食品药品监督管理局(FDA)首次批准上市。2002年,EMEA批准盐酸头孢噻呋用于治疗奶牛的乳房炎。其抗菌谱广,抗菌活性强[4-6],药代动力学特性优良[7-8],现已被国内外广泛用于牛、羊、猪和禽类等动物疾病的治疗[9-12]。关于头孢噻呋的安全性,国内外也有一些报道。郭桂芳等[13]研究了肌肉注射盐酸头孢噻呋混悬注射液对猪的安全性,在5~25 mg·kg-1(按体重给药)的剂量范围内对猪的血常规和生理生化指标无显著影响。另据FDA报道,肉牛按最高推荐剂量(1 mg·kg-1)的25倍连续5 d肌肉注射头孢噻呋,没有全身性毒性症状。特殊毒性试验表明,头孢噻呋无“三致”作用及免疫毒性。罗永江等[14]用国产头孢噻呋钠进行了小鼠的急性毒性和鸡的亚慢性毒性试验,结果试验动物体征无显著变化,血常规和血生化指标也在正常范围内,LD50为1 673.02 mg·kg-1,说明该药毒性较低。郑欢庆等[15]的试验表明了国产盐酸头孢噻呋原料药和注射液对大鼠和小鼠的剂型毒性作用较小,属于实际无毒药物。
本研究考察了盐酸头孢噻呋乳房注入剂对干乳期奶牛的安全性,为该制剂的临床应用提供一定的依据。
1 材料与方法
1.1受试药物
盐酸头孢噻呋乳房注入剂,规格10 mL、500 mg,批号:110915,华秦源(北京)动物药业有限公司生产,推荐用药方法,干乳期奶牛每头牛每个乳区给药1支。
1.2试验动物
试验动物为经产和初产健康泌乳期奶牛各6头(1~6号牛为初产,7~12号牛为经产),产奶量在20~35 kg·d-1。
1.3给药
12头泌乳期奶牛的四个乳区分别注入盐酸头孢噻呋乳房注入剂各一支,给药1次。奶牛挤奶后,先用消毒毛巾清洁各乳区,再用消毒药液浸泡乳头约30 s,然后进行乳头内灌注给药。灌注时将含药推注管头插入乳头,轻轻推压活塞,将药物缓缓注入乳池内,随后轻轻按摩相应乳区,使药物均匀分布。
1.4直肠温度检查
给药前1天、给药当天和给药后第12小时、第3天、第5天、第7天和第10天,分别测量并记录试验奶牛的直肠温度,观察试验奶牛在给药前后体温是否有明显变化。
1.5日产奶量统计
给药前1天、给药当天和给药后第1、3、5、7、10天统计奶牛的日产奶量。每天早、中、晚分别对每头奶牛挤奶,每头奶牛每次挤奶汇入专用收集桶中,称重并记录,统计每头奶牛每天3次总产奶量(即日产奶量),计算10头奶牛的平均日产奶量。
1.6乳中体细胞数检测
给药前1天、给药当天和给药后第12小时、第3天、第5天、第7天和第10天,四个乳区分别采集奶样,每次挤奶前弃掉前3把奶,将奶样采集50 mL灭菌聚丙烯离心管中,直接使用体细胞计数仪进行牛奶中体细胞数(somatic cell count,SCC)检测。
1.7病原菌分离鉴定
分别在给药前0 天和给药后第10天各采集奶样1次(20 mL)进行细菌学检查。采样时先用清水冲洗乳房,用0.1%新洁尔灭或者75%乙醇对乳头及周围进行消毒,待酒精挥发后,手工挤奶,弃去前三把奶后,用灭菌试管采集奶样于灭菌试管中,贴好标签,低温(4 ℃)保存并于6 h内送实验室分离检测。
将奶样接种至选择性培养基进行病原菌分离。分离菌株经纯化培养后,依据菌落形态、染色特征、生化特点鉴定其种类。分离鉴定的细菌主要有金黄色葡萄球菌、停乳链球菌、乳房链球菌及大肠杆菌。
1.8临床症状观察
整个试验过程中,每天观察各试验奶牛的临床症状并进行记录。
2 结 果
2.1奶牛的直肠温度
奶牛的直肠温度统计表见表1。所有奶牛在给药前和给药后不同时间点的直肠温度均在奶牛的正常温度范围内,卡方检验P>0.05,说明按推荐剂量单次给药对奶牛的体温无显著影响。
表1奶牛用药前后直肠温度
Table 1Rectal temperature before and after treatment

℃
2.2日产奶量
12头奶牛各时间点的产奶量见表2。通过表2数据可知,12头奶牛在给予盐酸头孢噻呋乳房注入剂后,与给药前相比各时间点产奶量无显著变化(卡方检验P>0.05)。
表2奶牛用药前后日产奶量
Table 2Daily milk production before and after treatment
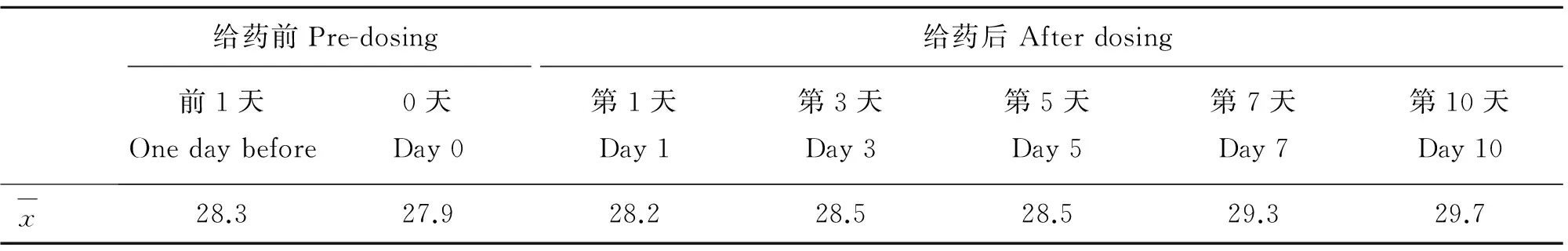
kg
2.3体细胞计数
体细胞计数结果见表3。由表3数据可知,12头奶牛给药前不同乳区体细胞检测结果与给药后各时间点奶样中体细胞数未见明显变化(卡方检验P>0.05)。
表312头奶牛不同乳区给药前后奶样中的体细胞数统计
Table 3SCC of different udder region of 12 cows before and after treatment (10 thousand·mL-1)

万·mL-1
2.4细菌分离鉴定
在给药前0天采集的奶样中,分离的链球菌、葡萄球菌和大肠杆菌分别为5株、7株和8株,给药后第10天,未检测到大肠杆菌,仅检测到1株葡萄球菌和1株链球菌(表4)。由此可见,盐酸头孢噻呋乳房注入剂对健康奶牛的乳房不会造成新增病原菌感染,而且对原有的病原菌有一定的清除能力,起到预防乳房炎的作用。
表4用药前后不同乳区所采奶样细菌分离情况
Table 4Pathogen of milk in different udder region before and after treatment

牛号Cownumber乳区Udderregion给药前第0天Day0pre-dosing给药后第10天Day10postdosing大肠杆菌Escherichiacoli链球菌Streptococcus葡萄球菌Staphylococcus大肠杆菌Escherichiacoli链球菌Streptococcus葡萄球菌Staphylococcus1左前√√左后√右前√√右后√2左前左后右前右后3左前左后右前右后4左前√左后√右前√右后√5左前左后右前右后6左前左后右前√√右后√7左前左后右前右后
(转下页 Carried forward)

(续表4 Continued)
2.5临床症状观察
12头奶牛四个乳区分别单剂量给药盐酸头孢噻呋乳房注入剂,在整个试验期间,给药乳区未出现乳房红、肿、热、痛等临床症状。
3 讨 论
靶动物安全性研究是药物临床研究的一部分,可以为药物的批准和临床应用提供科学依据。目前国内没有针对乳房用药的安全性指导原则,因此作者参考文献[16]进行了试验设计,选择奶牛直肠温度、产奶量、乳中体细胞数及乳中病原菌数四个指标来考察盐酸头孢噻呋乳房注入剂对干乳期奶牛的安全性,并在整个试验过程中观察奶牛的临床症状变化。
干乳期是奶牛乳房炎的高发期[17],早在1950年就有学者提出在奶牛停乳时向乳房内注入长效抗菌药物来预防和治疗奶牛乳房炎的发生。干奶期奶牛不挤奶,不存在牛奶中的药物残留问题,注入的药物也不会因挤奶而快速消除,药物能长时间的发挥作用。
近年来,由于抗生素的大面积使用和肆意滥用,细菌对抗生素的耐药性问题日益严重,抗生素的更新速度落后于病原菌变异的速度。头孢噻呋的合成和使用在一定程度上解决兽医临床上耐药菌的问题。国内外先后出现了多种头孢噻呋制剂,用于治疗临床各种动物细菌性疾病。2005年,FDA批准了辉瑞公司的盐酸头孢噻呋乳房注入剂上市。为填补这一空白,中国农业科学院饲料研究所(国家饲料药物基准实验室)联合国内5家单位成功研制了该制剂,经前期试验证明其稳定性良好。本试验通过给健康奶牛用药证明该制剂对奶牛安全,为后续临床试验提供依据。随着国内企业成功合成并大批量生产,头孢噻呋在兽药领域的应用前景将更加广阔。
[1]HERINGSTAD B,KLEMETSDAL G,RUANE J.Clinical mastitis in Norwegian cattle:frequency,variance components,and genetic correlation with protein yield[J].JDairySci,1999,82(6):1325-1330.
[2]EBERHART R J.Management of dry cows to reduce mastitis[J].JDairySci,1986,69(6):1721-1732.
[3]DINGWELL R T,LESLIE K E,DUFFIELD T F,et al.Efficacy of intramammary tilmicosin and risk factors for cure ofStaphylococcusaureusinfection in the dry period[J].JDairySci,2003,86(1):159-168.
[4]BEVERLY A D,GERARD S I.The activity of ceftiofur sodium forAeromonasspp. isolated from ornamental fish[J].JWildlDis,1992,28(3):453-456.
[5]SALMON S A,WATTS J L,AARESTRUP F M,et al.Minimum inhibitory concentrations for selected antimicrobial agents organisms isolated from the mammary glands of dairy heifers in New Zealand and Denmark[J].JDairySci,1998,81(2):570-578.
[6]WATTS J L,SALMON S A,YANCEY R J,et al.Antimicrobial susceptibility of microorganisms isolated from the mammary glands of dairy heifers in New Zealand and Denmark[J].JDairySci,1995,78:1637-1648.
[7]CHRISTENSEN J M,SMITH B B,MURDANE D B.The disposition of five therapeutically important antimicrobial agents in flamas[J].JVetPharmacolTher,1996,19(6):431-438.
[8]JACOBSON G A,MARTINODS S,CUNNINGHAM C P.Determination of ceftiofur in bovine plasma by HPLC-DAD[J].JPharmBiomedAnal,2006,40:1249-1252.
[9]MATTHIAS B,ERHARD Z,MICHAEL P.Quantitative determination of ceftiofur-related residues in bovine raw milk by LC-MS/MS with electrospray ionization[J].EurFoodResTechnol,2003,217:449-456.
[10]HOLYOAK G R,WANG S,LIU G,et al.The effects of ceftiofur sodium (Naxcel) on bovine oocyte and preimplantation embryonic development assessed byinvitroembryo production techniques[J].JVetPharmacolTherap,1998,(21):92-98.
[11]KESLER D J,BECHTOL D J.Efficacy of sustained release needle-less ceftiofur sodium implants in treating calves with bovine respiratory disease[J].ZentralblVeterinarmedB,1999,46:25-35.
[12]NAVARRE C B,ZHANG L,SUNKARA G.Cefliofur distribution in plasma and joint fluid following regional limb injection in cattle[J].JVetPharmacolTher,2001,22:13-19.
[13]郭桂芳,梁先明,杨大伟,等.肌肉注射盐酸头孢噻呋混悬注射液对猪安全性试验[J].中国兽医杂志,2010,46(11):66-68.
GUO G F,LIANG X M,YANG D W,et al.Satety experiment of pig muscle injection of Ceftiofur Hydrochloride[J].ChineseJournalofVeterinaryMedicine,2010,46(11):66-68.(in Chinese)
[14]罗永江,胡振英,罗超应,等.国产头孢噻呋钠的毒性试验[J].动物医学进展,2005,26(11):72-74.
LUO Y J,HU Z Y,LUO C Y,et al.Toxicity experiment of ceftiofur sodium[J].ProgressinVeterinaryMedicine,2005,26(11):72-74.(in Chinese)
[15]郑欢庆,黄玲利,周诗其,等.国产盐酸头孢噻呋急性毒性研究[J].毒理学杂质,2008, 22(1):77-78.
ZHENG H Q,HUANG L L,ZHOU S Q,et al.Study on acute toxicity of domestic ceftiofur hydrochloride[J].JournalofToxicology,2008,22(1):77-78.(in Chinese)
[16]FDA.US Food and drug administration CVM GFI #49.Target animal safety and drug effectiveness studies for anti-microbial bovine mastitis products (lactating and non-lactating cow products)[S].Revised April 4,1996.
[17]DINGWELL R T,LESLIE K E,SCHUKKEN Y H,et al.Association of cow and quarter-level factors at drying-off with new intramammary infections during the dry period[J].PrevVetMed,2004,(63):75-89.
(编辑白永平)
The Safety Evaluation of Ceftiofur Hydrochloride Intramammary Infusion (Dry Cow)
WU Tong1,ZHAO Lei-lei2,ZHANG Dao-kang2,XU Fei2,ZHANG Ning3,JIANG Shan-xiang4*,LIU Yi-ming2*
(1.CollegeofLifeSciences,NanjingAgriculturalUniversity,Nanjing210095,China;2.FeedResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China;3.CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing100193,China;4.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China)
The aim of the study was to evaluate the safety of Ceftiofur Hydrochloride intramammary infusion (Dry Cow) for dairy cows.Twelve healthy lactating cows (include 6 primiparous cows and 6 multiparous cows) were selected for the research.There were 6 primiparous cows and 6 multiparous cows among them.All the cows had not been treated with any antibiotics by systemic or intramammary administration 30 days before.They were fed with food and water without any antibiotics and under normal conditions.All the cow’s udder regions were injected by the drug of Ceftiofur Hydrochloride intramammary infusions (Dry Cow),and one piece of drug (specification:10 mL/500 mg) was only used for one udder region.The differences of rectal temperature,daily yielding,somatic cells number and the changes of pathogen in milk before and after administration were compared.The changes of clinical symptoms were observed all the time during the experiment.The results showed that there were no significant differences in rectal temperature,daily yielding,somatic cells number before and after administration(P>0.05).The number of pathogen in milk was reduced than before and there was not any new pathogen appeared at the same time.The results indicated that Ceftiofur Hydrochloride intramammary infusion (Dry Cow) have no adverse effects to dairy cows.It was safe to dairy cows when administrated according to the dosing regimen above.
cefquinome sulfate intramammary infusion;dry cow;safety
10.11843/j.issn.0366-6964.2016.08.027
2016-05-26
中国农业科学院创新工程(FRI-06);公益性行业(农业)科研专项"新型动物专用药物的研制与应用"(201303038)
吴彤(1995-),女,汉族,北京市人,主要从事生物工程技术和兽药工程研究,E-mail:2715135608@qq.com,Tel:82109803
江善祥,教授,E-mail:jiangshanxiang@163.com;刘义明,助理研究员,E-mail:liuyiming@caas.cn
S859.796
A
0366-6964(2016)08-1733-06

