鸭源鸡杆菌整合子及其与耐药性的相关性分析
彭志锋,高冬生,刘红英,杨 霞,赵 军,王新卫,李永涛,陈 陆,常洪涛,王川庆
(河南农业大学禽病研究所,郑州 450002)
鸭源鸡杆菌整合子及其与耐药性的相关性分析
彭志锋#,高冬生#,刘红英,杨霞,赵军,王新卫,李永涛,陈陆,常洪涛,王川庆*
(河南农业大学禽病研究所,郑州 450002)
为了解鸭源鸡杆菌的整合子及其与耐药性之间的关系,运用PCR方法检测鸭源鸡杆菌分离株携带1、2、3类整合子的情况,采用K-B法测定61株鸭源鸡杆菌对13种抗菌药的敏感性,并分析其整合子与耐药性的关联性。结果显示,所有参试菌株对克林霉素、诺氟沙星、链霉素有耐药性的菌株比例均不低于88.52 %(54/61)。19株鸭源鸡杆菌携带1类整合子,阳性率为31.15%,且此类菌株的耐药种数均≥3;在耐药种数≥5的菌株中,整合子阳性菌的比例(78.95%)显著高于整合子阴性菌的比例(28.57%,P<0.01)。本试验首次研究了鸭源鸡杆菌中整合子的分布情况。参试菌株仅携带1类整合子,且普遍存在多重耐药性;1类整合子可能在鸭源鸡杆菌多重耐药性的形成中发挥一定作用。
鸭源鸡杆菌;整合子;耐药性
鸡杆菌属是巴氏杆菌科中相对较新的属[1],该属包括数个种[2]。然而似乎只有溶血性鸭源鸡杆菌(Gallibacteriumanatis,G.anatis)在家禽中普遍流行,其感染往往造成蛋鸡的输卵管炎和腹膜炎[3-4]。随着细菌耐药性的不断增加,导致抗生素临床治疗效果不佳。研究显示巴氏杆菌科细菌存在普遍的耐药性[5-6],而鸭源鸡杆菌耐药性的报道尚不多见[7-8]。
细菌整合子是具有捕获和表达外源基因功能的遗传单位,在常见病原菌中普遍存在,且与多重耐药性关系密切[9-11]。包括鸭源鸡杆菌在内的巴氏杆菌科细菌整合子的研究鲜有报道[12]。为了解鸭源鸡杆菌的耐药性、整合子分布情况以及两者的关系,作者首次检测61株鸭源鸡杆菌分离株的整合子,以及对13种抗菌药的敏感性,并分析鸭源鸡杆菌整合子与耐药性之间的相关性,旨在了解鸭源鸡杆菌的耐药机制,并为临床筛选有效抗生素提供依据。
1 材料与方法
1.1菌株
61株鸭源鸡杆菌来源于河南、陕西、山西、山东四省患腹膜炎、输卵管炎的蛋鸡,由本实验室分离、保存[13];质控菌ATCC27090和ATCC25922购自广东微生物菌种保藏中心。
1.2试剂
药物纸片标准品购自杭州天和药物技术开发公司,包括青霉素(P)、氨苄西林(AM);诺氟沙星(NOR)、环丙沙星(CIP)、左氧氟沙星(LVF);克林霉素(CM);链霉素(S)、妥布霉素(TM)、卡那霉素(KAN)、庆大霉素(GM);四环素(TE);头孢噻呋(CEF)和利福平(RA)共13种(7类)抗菌药物;PCR扩增试剂购自宝生物工程(大连)有限公司。
1.3引物
检测1、2和3类整合酶基因的特异性引物参考以往的报道[14],预期扩增产物的大小分别为553、789和600 bp。引物由生工生物工程(上海)股份有限公司合成。
1.41、2和3类整合酶基因的PCR检测
煮沸法提取细菌DNA。按文献[14]所述分别进行三类整合酶基因的扩增,扩增产物用1.0%琼脂糖凝胶电泳,凝胶成像系统拍照分析。
1.5药物敏感性试验
采用K-B法测定61株鸭源鸡杆菌对13种抗菌药物的敏感性。由于还没有针对鸭源鸡杆菌的操作标准和判定标准,因此本研究参照NCCLS(2013)中巴氏杆菌的标准进行操作和结果判断。
1.6DNA序列分析
PCR扩增的整合酶基因片段测序后通过GenBank中Genome BLAST进行基因同源性分析。
1.7统计学分析
分析鸭源鸡杆菌整合子与耐药性的关系,并用SPSS 18.0软件进行统计学分析。
2 结 果
2.1整合子检出情况
仅部分菌株含有1类整合酶基因;所有菌株未发现2和3类整合子。
1类整合酶基因PCR产物片段大小与预期相符(图1)。经测序和同源性分析,与GenBank中1类整合酶基因相似性接近或等于100%。61株鸭源鸡杆菌中仅19株扩增出1类整合酶基因,阳性率为31.15%。所有参试菌株的2和3类整合酶基因检测均为阴性。
2.261株鸭源鸡杆菌的耐药表型
K-B法检测结果表明参试菌株均表现多重耐药,未见对所有菌株敏感的药物;61株鸭源鸡杆菌对下列药物有耐药性的菌株比例均在80%以上:克林霉素(CM,93.44%)、诺氟沙星(NOR,93.44%)、链霉素(S,88.52%)、环丙沙星(CIP,83.61%)、卡那霉素(KNA,80.33%);而对庆大霉素(GM,18.03%)、头孢噻呋(CEF,22.95%)和利福平(RA,11.47%)的耐药率均低于23%(图2)。
2.3鸭源鸡杆菌1类整合子与耐药性的关系
对每类受试药物逐一绘制参试鸭源鸡杆菌的耐药谱,所分别统计的1类整合子阳性和阴性菌株耐药谱分布情况见图3。结果显示61株鸭源鸡杆菌普遍存在耐药性;1类整合子阳性菌株的耐药种数为3~7,其中78.95%(14/19)的菌株耐药5~7种。1类整合子阴性菌株的耐药种数为1~6,其中仅28.57%(12/42)菌株耐药5~6种,远低于整合子阳性菌株的比例,两者差异极显著(P<0.01)。在耐药种数≥5的菌株中,整合子阳性菌株所占比例远高于整合子阴性菌株(图3)。耐药种数≥4的鸭源鸡杆菌共43株(70.5%),其中整合子阳性菌7株。耐药种数≤3的鸭源鸡杆菌共18株(29.5%),其中整合子阳性菌株2株。随着整合子阳性菌株比例的降低,参试菌株的耐药种数也相应减少,其差异极显著(P<0.01)。

M.DL2000 DNA相对分子质量标准;+.阳性对照;-.阴性对照;1~61.鸭源鸡杆菌1类整合酶基因PCR产物M.DL2000 DNA marker;+.Positive control;-.Negative control;1-61.PCR products of intI1 gene of G.anatis isolates图1 61株鸭源鸡杆菌1类整合酶基因PCR扩增产物电泳Fig.1 The results of PCR amplification of intI1gene of 61 G.anatis isolates

AM.氨苄西林;CIP.环丙沙星;CM.克林霉素;P.青霉素;NOR.诺氟沙星;KAN.卡那霉素;GM.庆大霉素;S.链霉素;TM.妥布霉素;TE.四环素;LVF.左氧氟沙星;CEF.头孢噻呋;RA.利福平AM.Ampicillin;CIP.Ciprofloxacin;CM.Clindamycin;P.Penicillin;NOR.Norfloxacin;KAN.Kanamycin;GM.Gentamicin;S.Streptomycin;TM.Tobramycin;TE.Tetracycline;LVF.Levofloxacin;CEF.Cephalothin;RA.Rifampicin图2 61株鸭源鸡杆菌耐药率分析Fig.2 Drug resistance rate of G.anatis strains(n=61)

虚线框显示耐药种数≥5时,1类整合子阳性菌(n=19)的耐药菌株比例均大于整合子阴性菌(n=42)The dotted box indicated when the number of antibiotic category≥5,Drug resistance rates of class 1 integron positive strains (n=19) are greater than that of class 1 integron negative strains (n=42),respectively图3 鸭源鸡杆菌多重耐药及其1类整合子分布Fig.3 Multidrug resistance and class 1 integron distribution of G.anatis isolates
除了头孢噻呋和利福平以外,61株鸭源鸡杆菌对其他11种抗菌药物的耐药性菌株比例均为1类整合子阳性菌株高于阴性菌株,但只有对环丙沙星和左氧氟沙星的耐药性,1类整合子阳性和阴性鸭源鸡杆菌的差异显著(P<0.01)(表1)。
表161株鸭源鸡杆菌耐药性与1类整合子的关系
Table 1Association between antibiotic resistance and class 1 integron in 61G.anatisstrains
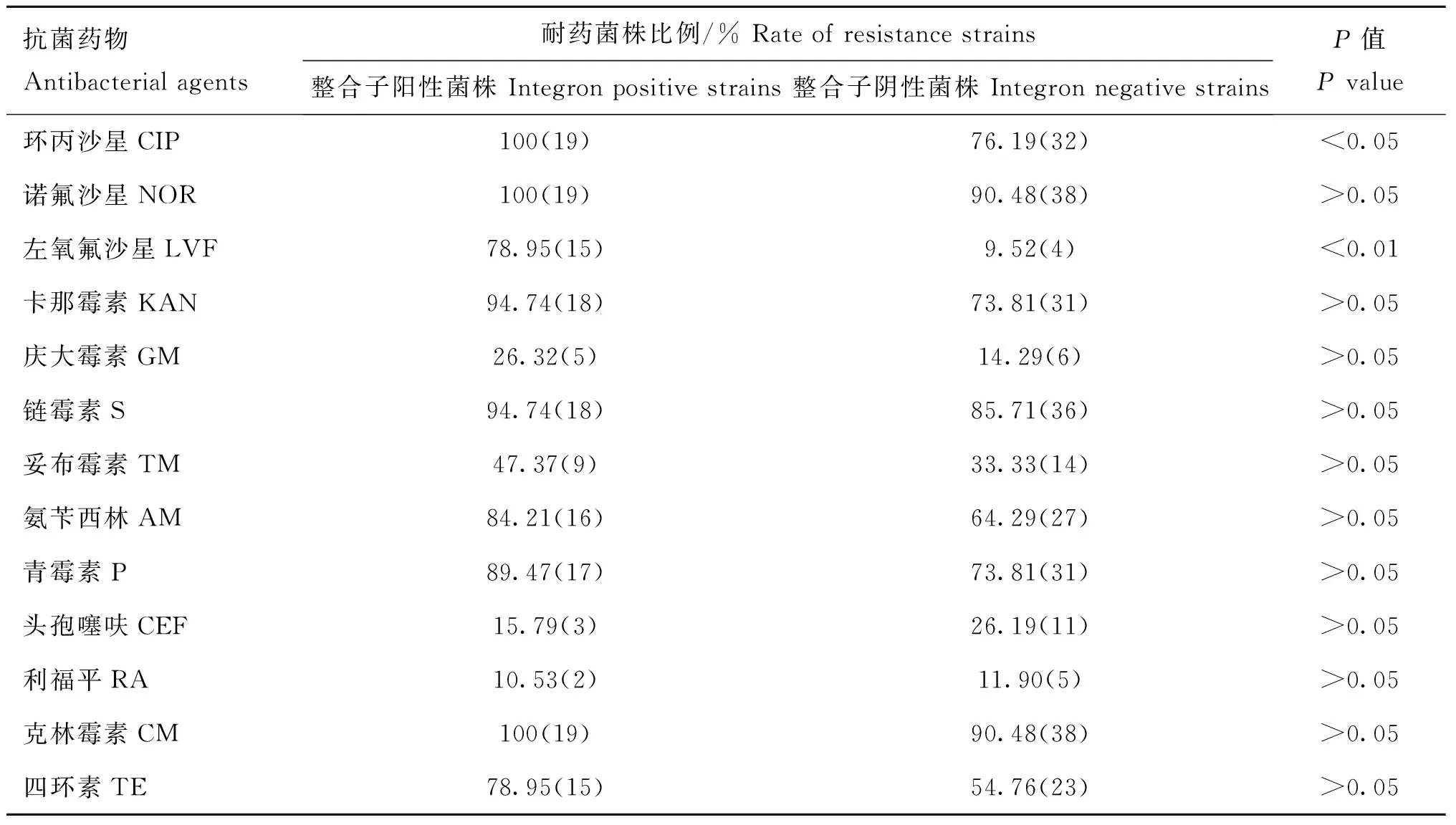
抗菌药物Antibacterialagents耐药菌株比例/%Rateofresistancestrains整合子阳性菌株Integronpositivestrains整合子阴性菌株IntegronnegativestrainsP值Pvalue环丙沙星CIP100(19)76.19(32)<0.05诺氟沙星NOR100(19)90.48(38)>0.05左氧氟沙星LVF78.95(15)9.52(4)<0.01卡那霉素KAN94.74(18)73.81(31)>0.05庆大霉素GM26.32(5)14.29(6)>0.05链霉素S94.74(18)85.71(36)>0.05妥布霉素TM47.37(9)33.33(14)>0.05氨苄西林AM84.21(16)64.29(27)>0.05青霉素P89.47(17)73.81(31)>0.05头孢噻呋CEF15.79(3)26.19(11)>0.05利福平RA10.53(2)11.90(5)>0.05克林霉素CM100(19)90.48(38)>0.05四环素TE78.95(15)54.76(23)>0.05
整合子阳性菌株总数为19,整合子阴性菌株总数为42
The amounts of integron positive strains and integron negative strains are 19 and 42,respectively
3 讨 论
3.1随着抗生素的大量使用,细菌耐药性造成细菌感染的治疗越来越复杂。本研究中,作者选取了禽类生产中经常用到的13种抗菌药物,并检测了61株鸭源鸡杆菌对其耐药情况,而且首次鉴定了整合子在鸭源鸡杆菌中的分布情况,并分析了其与多重耐药性的关系。本研究参试菌株普遍存在多重耐药性,以往的研究中也有类似结果[7-8]。鸭源鸡杆菌对克林霉素、诺氟沙星、环丙沙星和卡那霉素的多重耐药性提示,使用这些药物治疗该菌引起的鸡输卵管炎、腹膜炎可能不会收到预期效果。高耐药率可能与临床大量使用这些药物有直接关系[15];因此建议使用耐药率较低的庆大霉素和头孢噻呋等药物防治该病,同时勿过量使用抗生素,以减缓细菌耐药性的产生[16]。本文参试菌株耐药谱与巴氏杆菌科其他细菌的情况不尽相同[17-18],这可能与不同地区的用药习惯不同有关。本研究为防治该病的临床合理用药提供了科学依据。
3.2整合子是具有捕获和表达外源基因功能的遗传单位,存在于细菌质粒或染色体上,通过自身编码的整合酶来获取外源基因并使之表达[19]。整合子捕获、整合和表达耐药盒,引起耐药基因在同种或不同菌属间传播,从而使细菌耐药性得以广泛扩散[20-21]。革兰阴性菌中研究比较多的是1、2、3类整合子,其中以1类整合子最为常见[10,22-23]。目前,有关巴氏杆菌科细菌整合子的信息极少,本研究首次报道了整合子在鸭源鸡杆菌中的分布,并分析了其与多重耐药的关系。结果表明,所有参试菌株均不存在2、3类整合子,31.15%的菌株含有1类整合子。由于参试菌株数量限制,需要进一步检测更多菌株,才能确定2、3类整合子在鸭源鸡杆菌中的存在状态。
综合本研究的各项数据可以看出,整合子与鸭源鸡杆菌的多重耐药有一定的关系。整合子阳性菌的耐药种数为3~7,且耐药5~7种的菌株比例为78.95%(14/19);整合子阴性菌的耐药种数为1~6,且耐药5~6种的菌株仅28.57%(12/42),两者差异极显著(P<0.01);耐药种数为5、6和7时,整合子阳性菌株的耐药率均高于整合子阴性菌株(图3)。特别是在耐药种数为5的所有菌株中,其整合子阳性菌株比例明显高于阴性菌株比例且具有统计学意义,提示整合子可能与鸭源鸡杆菌多重耐药存在一定的关联性。这与某些学者对其他细菌的研究结果一致[10,24-25]。
3.361株鸭源鸡杆菌对11种抗菌药物的耐药率,均为整合子阳性菌株高于阴性菌株,但只有对环丙沙星和左氧氟沙星的耐药性差异具有统计学意义(P<0.01),这表明鸭源鸡杆菌对环丙沙星和左氧氟沙星的抗性可能与整合子的出现直接相关;对其他9种抗菌药的耐药率差异不显著(P>0.05),暗示参试细菌对此9种抗菌药的耐药表型差异与整合子无直接相关性。出现这一结果可能因为耐药表型差异不完全是由整合子主导的,而是由其他未检测的耐药因素共同作用的结果[7-8]。整合子与细菌多重耐药性的确切关系有待后续鉴定耐药基因后,统计分析其与耐药表型的相关性来确定。
4 结 论
河南、陕西、山西、山东鸭源鸡杆菌分离株携带1类整合子;鸭源鸡杆菌普遍存在多重耐药性,且1类整合子可能在其多重耐药性的形成中发挥一定作用。
[1]CHRISTENSEN H,BISGAARD M,BOJESEN A M,et al.Genetic relationships among avian isolates classified asPasteurellahaemolytica,‘Actinobacillussalpingitidis’ orPasteurellaanatiswith proposal ofGallibacteriumanatisgen.nov.,comb.nov.and description of additional genomospecies withinGallibacteriumgen.nov[J].IntJSystEvolMicrobiol,2003,53(Pt 1):275-287.
[2]BISGAARD M,KORCZAK B M,BUSSE H J,et al.Classification of the taxon 2 and taxon 3 complex of Bisgaard withinGallibacteriumand description ofGallibacteriummelopsittacisp.nov.,Gallibacteriumtrehalosifermentanssp.nov.andGallibacteriumsalpingitidissp.nov[J].IntJSystEvolMicrobiol,2009,59(Pt 4):735-744.
[3]PAUDEL S,LIEBHART D,HESS M,et al.Pathogenesis of Gallibacterium anatis in a natural infection model fulfils Koch’s postulates:1.Folliculitis and drop in egg production are the predominant effects in specific pathogen free layers[J].AvianPathol,2014,43(5):443-449.
[4]王川庆,陈陆,杨霞,等.蛋鸡群卡氏杆菌感染情况的初步研究[J].河南农业科学,2008(3):97-100,103.
WANG C Q,CHEN L,YANG X,et al.A premilinary study ofGallibacteriumanatisinfection in laying hens[J].JournalofHenanAgriculaturalSciences,2008(3):97-100,103.(in Chinese)
[5]GLASS-KAASTRA S K,PEARL D L,REID-SMITH R J,et al.Antimicrobial susceptibility ofEscherichiacoliF4,Pasteurellamultocida,andStreptococcussuisisolates from a diagnostic veterinary laboratory and recommendations for a surveillance system[J].CanVetJ,2014,55(4):341-348.
[6]YAKUBU D,MOSHOOD R,PAUL A,et al.Phenotypic characteristics ofPasteurellamultocidaisolated from commercial chickens affected by fowl cholera in Jos,Nigeria[J].JWorld’sPoultRes,2015,5(3):58-62.
[7]BOJESEN A M,VAZQUEZ M E,BAGER R J,et al.Antimicrobial susceptibility and tetracycline resistance determinant genotyping ofGallibacteriumanatis[J].VetMicrobiol,2011,148(1):105-110.
[8]郭伦涛,王川庆,杨霞,等.卡氏杆菌对磺胺甲噁唑及链霉素的耐药性与耐药基因关系的初步研究[J].中国家禽,2009,31(18):22-24.
GUO L T,WANG C Q,YANG X,et al.Study of relation between drug resistance against sulfamethoxazole and streptomycin inGallibacteriumand resistant genes[J].ChinaPoultry, 2009,31(18):22-24.(in Chinese)
[9]XU Y,LUO Q Q,ZHOU M G.Identification and characterization of integron-mediated antibiotic resistance in the phytopathogenXanthomonasoryzaepv.oryzae[J].PLoSOne,2013,8(2):e55962.

[11]OOSTERIK L H,PEETERS L,MUTUKU I,et al.Susceptibility of avian pathogenicEscherichiacolifrom laying hens in Belgium to antibiotics and disinfectants and integron prevalence[J].AvianDis,2014,58(2):271-278.
[12]KEHRENBERG C,SCHWARZ S.Trimethoprim resistance in a porcinePasteurellaaerogenesisolate is based on a dfrA1 gene cassette located in a partially truncated class 2 integron[J].JAntimicrobChemother,2010,66(2):450-452.
[13]郑鹿平.我国鸡群鸡杆菌的首次分离鉴定及生物学特性初步研究[D].郑州:河南农业大学,2010.
ZHENG L P.The first isolation and identification ofGallibacteriumanatisfrom fowls in China and preliminary research on its biological characterics[D].Zhengzhou:Henan Agriculral University,2010.(in Chinese)
[14]PLOY M C,DENIS F,COURVALIN P,et al.Molecular characterization of integrons inAcinetobacterbaumannii:description of a hybrid class 2 integron[J].AntimicrobAgentsChemother,2000,44(10):2684-2688.
[15]SINGER R S,WILLIAMS-NGUYEN J.Human health impacts of antibiotic use in agriculture:A push for improved causal inference[J].CurrOpinMicrobiol,2014,19:1-8.
[16]JOHNSON T J,SINGER R S,ISAACSON R E,et al.Invivotransmission of an IncA/C plasmid inEscherichiacolidepends on tetracycline concentration,and acquisition of the plasmid results in a variable cost of fitness[J].ApplEnvironMicrobiol,2015,81(10):3561-3570.
[17]林志敏,林彬彬,程龙飞.禽源多杀性巴氏杆菌耐药性及其质粒多样性的研究[J].福建农业学报,2015,30(7):648-651.
LIN Z M,LIN B B,CHENG L F.Plasmid diversity and antibiotic resistance of avianPasteruellamultocida[J].FujianJournalofAgriculturalSciences,2015,30(7):648-651.(in Chinaese)
[18]孙申菊.雪山鸡多杀性巴氏杆菌的分离鉴定与药敏试验[J].畜禽业,2015(4):12-13.
SUN S J.The indification ofPasteurellamultocidaisolated from xueshan chicken and its drug sensitive tes[J].LivestockandPoultryIndustry,2015(4):12-13.(in Chinaese)
[19]HALL R M,STOKES H W.Integrons:novel DNA elements which capture genes by site-specific recombination[J].Genetica,1993,90(2-3):115-132.
[20]GILLINGS M R.Integrons:past,present,and future[J].MicrobiolMolBiolRev,2014,78(2):257-277.
[21]GUERRA B,SOTO S,CAL S,et al.Antimicrobial resistance and spread of class 1 integrons amongSalmonellaserotypes[J].AntimicrobAgentsChemother,2000,44(8):2166-2169.
[22]KANG H Y,JEONG Y S,OH J Y,et al.Characterization of antimicrobial resistance and class 1 integrons found inEscherichiacoliisolates from humans and animals in Korea[J].JAntimicrobChemother,2005,55(5):639-644.
[23]KHAN A A,PONCE E,NAWAZ M S,et al.Identification and characterization of Class 1 integron resistance gene cassettes amongSalmonellastrains isolated from imported seafood[J].ApplEnvironMicrobiol,2009,75(4):1192-1196.
[24]赵红霞,李培锋,吴聪明,等.奶牛子宫内膜炎大肠杆菌耐药性及其与整合子关系的研究[J].畜牧兽医学报,2009,40(1):142-144.
ZHAO H X,LI P F,WU C M,et al.Research of drug-resistance ofEscherichiacoliisolated from bovine with endometritis and the relationship between antibiotic resistance and integron[J].ActaVeterinariaetZootechnicaSinica,2009,40(1):142-144.(in Chinaese)
[25]LIU H,WANG H,HUANG M,et al.Analysis of antimicrobial resistance and class 1 integrons among strains from upper respiratory tract of healthy adults[J].JThoracDis,2013,5(2):149-155.
(编辑白永平)
GallibacteriumanatisIntegron and Its Correlation with the Drug Resistance
PENG Zhi-feng#,GAO Dong-sheng#,LIU Hong-ying,YANG Xia,ZHAO Jun,WANG Xin-wei,LI Yong-tao,CHEN Lu,CHANG Hong-tao,WANG Chuan-qing*
(InstituteofPoultryDiseases,HenanAgriculturalUniversity,Zhengzhou450002,China)
The aim of the present study was to confirm existence of the integrons inGallibacteriumanatis(G.anatis)isolates and the role of integrons in multidrug resistance.The integrons class 1,2 and 3 inG.anatisisolates were detected by PCR amplification for the first time.The sensitivity of 61G.anatisstrains was tested against 13 kinds of antibiotics by Kirby-Bauer method.The correlation between multidrug resistance and integrons was analyzed.The results showed that drug resistance rates of allG.anatisisolates to clindamycin,norfloxacin and streptomycin were above 88.52%.No less than three kinds of drugs were resisted for 19G.anatisstrains which carrying class 1 integron.Among strains resisting more than five kinds of drugs,the proportion of the class 1 integron positive (78.95%) was significantly higher than that(28.57%)of class 1 integron negative strains(P<0.01).It was the first time,to our knowledge,that the distribution of intergons inG.anatishad been investigated. Only class 1 integron was found and multidrug resistance was very common inG.anatisisolates in this study.Class 1 integron might play an important role in the formation of multiple drug resistance phenotype ofG.anatisstrains.
Gallibacteriumanatis;antibiotic resistance;integrons
10.11843/j.issn.0366-6964.2016.08.019
2016-01-21
国家自然科学基金(31302090);河南省高校科技创新团队与支持计划资助项目(14IRTSHN015)
彭志锋(1982-),男,河南周口人,博士生,主要从事动物传染病发病机制及防制研究,E-mail:zfpeng2006@126.com;高冬生,男,(1985-),河南新密人,硕士,主要从事动物传染病发病机制及防制研究。#彭志锋和高冬生同为第一作者
王川庆,男,教授,博导, E-mail:wchuanq@163.com
S852.612
A
0366-6964(2016)08-1676-06

