新城疫病毒F蛋白纳米抗体的筛选及活性鉴定
高小龙,胡湘云,付向晶,王燕平,仝丽娜,王海新,王兴龙,张淑霞,萧 飒,杜恩岐,杨增岐
(西北农林科技大学 动物医学院,杨凌 712100)
新城疫病毒F蛋白纳米抗体的筛选及活性鉴定
高小龙△,胡湘云△,付向晶,王燕平,仝丽娜,王海新,王兴龙,张淑霞,萧飒,杜恩岐*,杨增岐*
(西北农林科技大学 动物医学院,杨凌 712100)
旨在筛选新城疫病毒(NDV)F蛋白的纳米抗体,并对筛选的抗体活性进行初步鉴定。以NDV F蛋白中和表位构建诱饵,利用酵母双杂交技术对双峰驼天然重链抗体可变区(VHH)酵母双杂交文库进行筛选,获得4株VHH抗体序列。挑选其中2株最符合VHH特征的进行原核表达与纯化,并对2株VHH活性进行鉴定。ELISA结果显示,VHH1与VHH2与NDV病毒的反应性显著高于阴性对照(P<0.05),表明VHH与NDV病毒反应活性良好;Western blot结果显示,2株VHH可特异性识别F蛋白;细胞中和试验结果表明,2株VHH抗体均具有一定的中和活性。以上结果提示本研究成功筛选出2株活性较好的抗NDV F蛋白的VHH抗体,为VHH在NDV防控中的应用奠定了基础。
新城疫病毒;F蛋白;VHH抗体;酵母双杂交
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种严重危害养禽业的重要疫病,被OIE列为必须报告的疫病。NDV属于副黏病毒科禽腮腺炎病毒属,其基因组为不分节段的单链负股RNA,大小约15 kb,依次编码6种结构蛋白。融合蛋白(fusion protein,F)是病毒囊膜上一个非常重要的糖蛋白,可介导病毒与宿主细胞的膜融合,同时还是诱导机体保护性免疫应答的主要抗原。研究表明,针对F蛋白的抗体可有效阻止病毒对宿主细胞和机体的侵染[1]。因此,F蛋白是NDV防控中的理想靶标。
NDV疫苗的广泛使用使ND大规模流行得到了有效控制。然而,近年来ND的流行出现了新的特点,如免疫鸡群仍可发生ND,且可从中分离到致病性NDV[2-4]。研究表明,现有商品化疫苗和基于常规抗体的治疗类制剂不能完全阻止ND发生[5-6]。同时,珍稀野生鸟类发生ND后往往缺乏特异性治疗药物[7],且在应用传统的多抗和单抗做治疗时存在免疫原性强、潜在的生物安全不明确等缺点。因此,开发新的治疗性药物尤为必要。
VHH(variable domains of camelid heavy-chain antibodies,VHH)抗体衍生于骆驼科动物体内存在的重链抗体[8-9]。由于其相对分子质量小(~15 ku)、结构稳定、可溶性好、组织穿透力强、免疫原性低且可识别隐蔽表位等特点,使其在病毒性疾病诊断和治疗上具有广阔的前景[10],但目前仍未见抗NDV的VHH报道。本研究为了获得F蛋白的VHH抗体,以F蛋白表位为诱饵对VHH抗体文库进行了筛选,成功获得2株VHH抗体,并对其活性进行了初步鉴定,为应用VHH防控ND奠定基础。
1 材料与方法
1.1病毒、菌株、质粒、试剂
NDV La Sota毒株和F48E9毒株均由本实验室保存。Y2H Gold菌株、pGBKT7、pGADT7、pGADT7-T、pGADT7-p53、pGADT7-Lam质粒及筛库所用试剂购自Clontech公司。双峰驼天然重链抗体可变区酵母双杂交文库由本实验构建与保存[11]。pHSIE原核表达质粒(带6×His标签和SUMO标签)由本实验室保存。2×Taq Master mix、HRP标记抗His单克隆抗体和cECL发光试剂盒购自康为世纪公司。IPTG购自Sigma公司,TMB购自天根生化科技(北京)有限公司,2K plus DNA marker购自全式金生物有限公司,限制性内切酶均购自Fermentas公司。其他无机试剂均为国产分析纯。
1.2引物及基因合成
根据GenBank上公布的VHH序列,设计1对克隆VHH的引物。参考文献中NDV F蛋白线性中和表位序列(LLPNLPKDKEACAKAPL)[12],合成一段由Linker(GGGS)串联重复3次的中和表位DNA片段,命名为F-neu,并在前段和末端分别引入EcoRⅠ、SalⅠ酶切位点(图1)。引物和基因片段均由苏州金唯智生物科技有限公司合成。

图1 F-neu编码序列结构Fig.1 The structure of synthesised F-neu
1.3诱饵质粒构建
将合成的F-neu和pGBKT7质粒用EcoRⅠ和SalⅠ双酶切,回收切出的F-neu片段和pGBKT7质粒,在T4 DNA连接酶的作用下16 ℃连接过夜;次日将连接产物转化DH5α感受态细胞,挑取单克隆摇菌后抽提质粒并做双酶切鉴定,酶切和测序正确后命名为pGBKT7-F-neu。
1.4文库筛选
将pGBKT7-F neu质粒按照Clontech公司酵母细胞转化手册转化Y2HGold酵母菌,进行诱饵的自激活和毒性验证。文库筛选时,取Y2H Gold(pGBKT7-F neu)与文库菌Y187(pGADT7-VHH)做杂交,方法参照Clontech公司MatchmakerTMGold Yeast Two-Hybrid protocol。杂交产物涂布70个150 mm的DDO/X/A平板,30 ℃倒置培养5 d后,将平板上发蓝的菌落挑到QDO/X/A平板上再次做筛选。QDO/X/A平板上仍生长且发蓝的菌落进行酵母质粒拯救,拯救的文库质粒与诱饵质粒共转Y2H Gold酵母菌做进一步回转验证。回转验证仍然发蓝的质粒进行测序比对分析,以确定筛选出的VHH抗体序列信息。
1.5VHH的表达与纯化
以拯救的pGADT7-VHH质粒为模板,用引物VHH-PF (5′-CGGGATCCCAGGTGCAGCTGGT-GGAGTCTGGRGGAGG-3′)和VHH-PR (5′-GC-GTCGACTTAGCTGGAGACGGTGACCWGGG-T-3′)在TaqDNA聚合酶的作用下进行PCR扩增,回收扩增出的VHH片段,通过BamHⅠ和SalⅠ酶切位点将VHH克隆至pHSIE载体6×His-SUMO标签下游以进行融合表达,酶切和测序鉴定正确后命名为pHSIE-VHH。
将pHSIE-VHH质粒转化Rosetta感受态细胞进行原核表达。表达时,从平板上挑取单菌落接种于氨苄LB培养基中,37 ℃振荡培养至OD600nm值为0.4~0.6时,加入终浓度为0.4 mmol·L-1的IPTG,于20 ℃诱导6 h后收集菌体,超声裂解破碎后取上清按Talon Metal Affinity Resin(Clontech)说明书进行蛋白质纯化,纯化产物进行12% SDS-PAGE电泳分析。
1.6间接ELISA
将NDV病毒用包被液稀释后包被酶标板,4 ℃过夜;次日弃包被液,PBST洗4次,用5%的脱脂奶粉进行封闭,37 ℃孵育1 h;弃封闭液,PBST洗板4次,每孔加100 μL稀释好的VHH,37 ℃孵育2 h;弃掉孔中的抗体,PBST洗4次,加入100 μL HRP标记的抗His单克隆抗体(1∶5 000),37 ℃孵育1 h;弃去孔中的抗体,PBST洗板4次,加入100 μL TMB显色液,室温避光显色20 min,加入50 μL 2 mol·L-1H2SO4终止反应,于OD450 nm波长处测定吸光度值。
1.7Western blot
将纯化的LaSota病毒200倍稀释进行SDS-PAGE电泳,电泳结束后转膜。转膜完成后,5%脱脂牛奶4 ℃封闭过夜;次日,TBST洗膜,加入稀释的VHH抗体室温孵育3 h;TBST洗膜,加入HRP标记抗His单克隆抗体(1∶6 000)室温孵育1.5 h;TBST洗膜后,用ECL发光试剂于暗室中压片。
1.8中和试验
将DF-1细胞铺96孔板,次日,待细胞长满80%~90%时,进行以下操作:用PBS将VHH做梯度稀释,取50 μL VHH与50 μL F48E9(100 TCID50)混匀后,置37 ℃孵育1 h;用PBS洗细胞一次,将孵育的VHH-病毒混合液加到细胞中,于CO2培养箱中37 ℃孵育1 h,每隔15 min振荡混匀一次;弃掉各孔中的VHH-病毒混合液,PBS洗细胞一次,加入100 μL维持液于CO2培养箱中37 ℃培养36~72 h,每个稀释度重复8个孔,24 h后观察并记录每孔细胞病变,按下列公式计算中和活性:中和活性(%)=(无病变孔数/总接种孔数)×100。
2 结 果
2.1诱饵质粒构建
将构建的pGBKT7-F-neu质粒用EcoRⅠ和SalⅠ做双酶切,切出了204 bp的目的条带,结果如图2所示。并且测序结果正确,表明诱饵质粒构建成功。

M.5 000的DNA相对分子质量标准标准;1.pGBKT7-F-neu双酶切M.5000 DNA marker;1.Digestion of pGBKT7-F-neu图2 诱饵质粒pGBKT7-F-neu双酶切鉴定Fig.2 Restriction enzyme digestion of bait plasmid pGBKT7-F-neu
2.2文库筛选
将筛选的阳性克隆进行质粒拯救,拯救的pGADT7-VHH质粒与pGBKT7-F-neu质粒共转Y2H Gold做回转验证,同时设立pGBKT7-Lam+pGADT7-T和pGBKT7-p53+pGADT7-T为阴阳性对照。结果如图3所示,筛选出的4个VHH与pGBKT7-F-neu共转后在DDO/X/A和QDO/X/A平板上菌落均为蓝色,VHH与pGBKT7空载体共转后在DDO/X/A和QDO/X/A上均不变蓝或不生长,且阴阳性对照均成立,表明筛选到的4株VHH为真阳性。
2.3序列分析
将4个阳性克隆进行测序和比对分析,结果如图4所示,可知筛选出的4株VHH与骆驼源重链抗体重链可变区高度同源,且第1框架区(framework region 1,FR1)区和FR3区有2个保守的半胱氨酸,同时FR2区37位、44位、45位和47位存在特征性氨基酸替换。
2.4VHH表达与纯化
从4株VHH中,挑选VHH1和VHH2进行原核表达。以拯救的pGADT7-VHH1和pGADT7-VHH2质粒分别为模板进行PCR,扩增出大小约400 bp的VHH片段,结果如图5A。将VHH片段胶回收后,通过BamHⅠ和SalⅠ酶切位点克隆至pHISE表达载体上,双酶切鉴定结果如图5B所示,成功切出400 bp的目的条带,且测序鉴定均正确。

A列.白色克隆表示诱饵蛋白无自激活和毒性;B列~E列.蓝色克隆表示F-neu与VHH在酵母细胞内可互作;F列.白色和蓝色克隆分别表示阴性和阳性对照Lane A.The white clones showed that the bait has no autoactivator activity in yeast;Lane B to E.When pBD-F and 4 positive pAD-VHH were cotransformed into Y2H Gold yeast strain,all cotransformants turned blue on DDO/X/A and QDO/X/A;Lane F.The white and blue clone indicated the negative and positive control,respectively图3 诱饵蛋白F-neu与VHH在酵母细胞内互作结果Fig.3 Interaction between F-neu and VHH in yeast
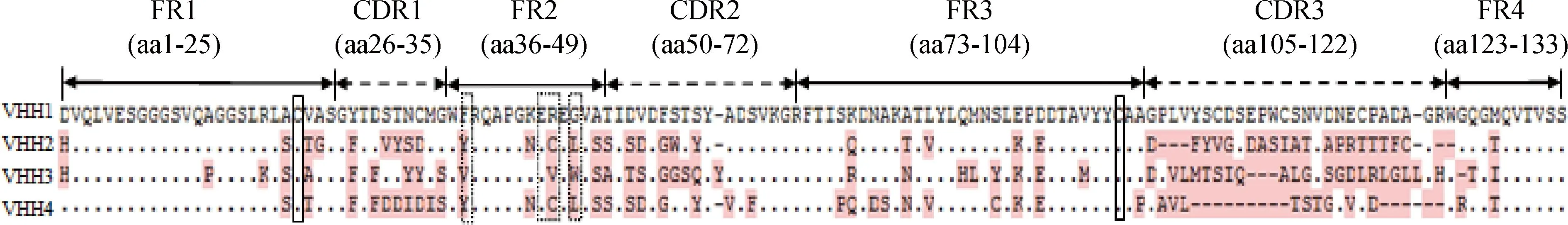
“.”表示与VHH1序列相同的氨基酸,不同的氨基酸用粉色字母表示;“-”表示此处氨基酸缺失;实线框内的为保守型半胱氨酸残基,虚线框内的为4个特征性氨基酸残基The dot indicate the same sequences compared with VHH1.Differences in the sequences are pinked,and the dash represent the missing sequences.Two hallmark Cys residues are labeled by the thick-line boxes.The four conservative hallmark residues of VHH in FR2 are labeled by the dotted line boxes图4 4株筛选出来的VHH氨基酸序列比对结果Fig.4 Deduced amino acid alignment of four selected VHH
将pHSIE-VHH1和pHSIE-VHH2质粒转化Rosetta感受态细胞进行诱导表达,表达产物用Talon树脂进行纯化,最后用含200 mmol·L-1咪唑的洗脱液洗脱目的蛋白质,结果如图6所示,成功纯化出约30 ku的VHH抗体。
2.5间接ELISA
用NDV LaSota病毒包被酶标板,封闭结束后,先加入纯化的VHH抗体进行孵育,洗板后,再加入HRP标记的抗His单克隆抗体进行孵育,最后用TMB显色液显色,结果如图7所示,VHH1和VHH2与NDV病毒的反应性显著高于阴性对照(P< 0.05),与其他病毒不反应(OD450 nm<0.1),且阴性对照的OD450nm<0.1。表明VHH1和VHH2与NDV反应性良好。

(A) VHH片段的PCR扩增:M.5000 DNA相对分子质量标准;1.VHH1的PCR扩增结果;2.VHH2的PCR扩增结果;3.阳性对照;C.阴性对照。(B) pHSIE-VHH双酶切鉴定:M.5000 DNA相对分子质量标准;1.pHSIE-VHH1酶切结果;2.pHSIE-VHH2酶切结果(A) The amplification of VHH,M.5000 DNA marker;1.PCR products of VHH1;2.PCR products of VHH2;3.Positive control;C.Negative control.(B)Double enzyme digestion of pHSIE-VHH,M.5000 DNA marker;1.Digestion of pHSIE-VHH1;2.Digestion of pHSIE-VHH2图5 VHH原核表达质粒构建Fig.5 Construction of VHH prokaryotic expression vector

M.蛋白质相对分子质量标准;1.VHH1;2.VHH2M.Protein marker;1.VHH1;2.VHH2图6 VHH抗体的纯化结果Fig.6 Purification of VHH

图7 间接ELISA检测VHH与NDV病毒的反应性Fig.7 Detection the interaction between the selected VHHs and NDV virion by indirect ELISA
2.6Western blot
用纯化的VHH抗体进行Western blot后,结果如图8所示,VHH1和VHH2均能识别大小约55 ku的F蛋白特异性条带,而空载体不反应,表明VHH1和VHH2可识别F蛋白。

M.蛋白质相对分子质量标准;1.VHH1;2.VHH2;3.空载体的表达菌裂解液M.Protein marker;1.VHH1;2.VHH2;3.The bacteria lysate of empty vector图8 Western blot 结果Fig.8 The result of Western blot
2.7中和试验
将纯化的2株VHH抗体稀释后进行中和试验。结果如图9所示,24 h以内VHH1和VHH2在低稀释度时(≤ 23)均能有效中和F48E9病毒在DF-1细胞上的增殖,细胞无合胞体出现;当抗体稀释度高于24时,VHH抗体的中和活性逐渐下降,出现合胞体的孔数逐渐增多。随着培养时间的延长,即36 h之后,各稀释度孔中合胞体也会逐渐出现并增多。表明VHH1和VHH2在病毒感染早期具有一定的中和活性。

图9 中和活性的测定Fig.9 Detection of neutralizing titer
3 讨 论
VHH抗体来源于骆驼胚系基因组上一套独特V基因片段的V-D-JH重排[13],并且发现目前VHH至少存在4个独特的亚群。尽管VHH抗体存在不同的亚群,但相对VH抗体而言各亚群均存在一些特征性氨基酸替换,即Val37-Phe/Tyr、Gly44-Glu/Gln、Leu45-Arg、Trp47-Gly/Leu,上述疏水性氨基酸向亲水性氨基酸的替换增加了VHH抗体的亲水性,同时弥补了缺失轻链而造成的不稳定和易聚集的缺点。本研究中,通过用F蛋白中和表位构建诱饵质粒对天然VHH抗体文库进行筛选,初步得到4株VHH抗体;对筛选到的4株VHH进行序列比对分析后发现,4株抗体37、44、45和47位存在VHH抗体的特征性氨基酸,与先前报道的一致[14]。同时发现所筛选的VHH抗体氨基酸差异主要集中在抗原互补决定区(complement determine region,CDR),FR区则相对保守,与之前报道一致[13,15]。
VHH抗体由于相对分子质量小,为单域结构,并且FR2区4个疏水性氨基酸位点发生了替换,增强了亲水性,使其可以在大肠杆菌和酵母菌中高效表达[16]。本研究中,前期在表达VHH抗体时选用了pColdTMI DNA载体,在进行诱导表达时发现VHH可溶性差,多为包涵体形式存在,与X.J.Fu等报道的不一致[17],可能与抗体自身序列有关。小泛素样相关修饰蛋白(small ubiquitin-related modifier,SUMO)是一类广泛存在于真核细胞的高度保守的蛋白质[18],研究表明,当给异源蛋白N段融合SUMO后,不仅可以促进异源蛋白质的正确折叠和增加表达水平,而且还能保护靶蛋白免受降解,起到分子伴侣的作用[19]。为了增加VHH抗体的可溶性可表达量,本研究中后来选取了带有SUMO助溶标签的pHSIE原核表达载体,诱导表达后发现重组VHH抗体表达量得到提高,并且多为可溶性表达。表明SUMO标签具有很好的助溶作用,与先前的报道一致[19-21]。
为了探究纯化的VHH抗体与NDV病毒和F蛋白的反应性,本研究进行了ELISA和Western blot。ELISA结果显示,筛选的VHH1抗体与LaSota病毒的反应性显著高于阴性和阳性对照(P<0.05),VHH2抗体与病毒反应性显著高于阴性对照(P<0.05),但与阳性对照差异不显著(P>0.05),表明表达的2株VHH与NDV病毒反应性良好。Western blot结果显示,表达的VHH1和VHH2可识别55 ku左右的特异性条带,而阴性对照不反应,表明筛选的VHH抗体能与F蛋白反应。中和试验结果显示,VHH在稀释度低时(≤ 23)可有效中和病毒,但36 h后会细胞会逐渐出现合胞体病变,且中和能力显著低于阳性对照血清(≥ 28,P<0.05);可能与以下因素有关:1)完全有效阻止病毒侵染机体和细胞依靠一种多抗体机制,即需要靠针对不同靶抗原不同表位的抗体共同协作[22];因此靶向单个中和表位的抗体中和能力有限;2)由于VHH抗体体积和相对分子质量小,只有常规抗体的1/10左右,因此组织穿透能力强于常规抗体,在某些方面具有无可比拟的优势;但是另一方面,小的体积和相对分子质量可能使VHH抗体结合到靶标后不足以形成足够的空间位阻效应来封闭靶位点活性,从而导致中和效价低。为了增加VHH的中和活性,后续可尝试将上述2株抗体多聚化,构建二价、三价等多价抗体以增强其活性。
[1]MERZ D C,SCHEID A,CHOPPIN P W.Importance of antibodies to fusion glycoprotein of paramyxoviruses in the prevention of spread of infection[J].JExpMed,1980,151(2):275-288.
[2]ZHANG R,PU J,SU JL,et al.Phylogenetic characterization of Newcastle disease virus isolated in the mainland of China during 2001-2009[J].VetMicrobiol,2010,141(3-4):246-257.
[3]LIEN Y Y,LEE J W,SU H Y,et al.Phylogenetic characterization of Newcastle disease viruses isolated in Taiwan during 2003-2006[J].VetMicrobiol,2007,123(1-3):194-202.
[4]DIEL D G,SUSTA L,CARDENAS GARCIA S,et al.Complete genome and clinicopathological characterization of a virulent Newcastle disease virus isolate from South America[J].JClinMicrobiol,2012,50(2):378-387.
[5]HU S L,MA H L,WU Y T,et al.A vaccine candidate of attenuated genotype VII Newcastle disease virus generated by reverse genetics[J].Vaccine,2009,27(6):904-910.
[6]XIAO S,NAYAK B,SAMUEL A,et al.Generation by reverse genetics of an effective,stable,live-attenuated Newcastle disease virus vaccine based on a currently circulation,highly virulent indonesian strain[J].PLoSOne,2012,7(12):e52751.
[7]CHEN S,HAO H,LIU Q,et al.Phylogenetic and pathogenic analyses of two virulent Newcastle disease viruses isolated from Crested Ibis (Nipponia nippon) in China[J].VirusGenes,2013,46(3):447-453.
[8]HAMERS-CASTERMAN C,ATARHOUCH T,MUYLDERMANS S,et al.Naturally occurring antibodies devoid of light chains[J].Nature,1993,363(6428):446-448.
[9]HOLLIGER P,HUDSON P J.Engineered antibody fragments and the rise of single domains[J].NatBiotechnol,2005,23(9):1126-1136.
[10]VANLANDSCHOOT P,STORTELERS C,BEIRNAERT E,et al.Nanobodies®:new ammunition to battle viruses[J].AntiviralRes,2011,92(3):389-407
[11]胡湘云,高小龙,付向晶,等.双峰驼天然重链抗体可变区酵母双杂交文库的构建与鉴定[J].畜牧兽医学报,2015,46(6):1071-1076.
HU X Y,GAO X L,FU X J,et al.Construction and characterization of a naiveCamelusBactrianusvariable domain of heavy chain of heavy-chain antibody(VHH)Yeast two-hybrid library[J].ActaVeterinariaetZootechnicaSinica,2015,46(6):1071-1076.(in Chinese)
[12]ZHAO Y,HAMMOND R W.Development of a candidate vaccine for Newcastle disease virus by epitope display in the Cucumber mosaic virus capsid protein[J].BiotechnolLett,2005,27(6):375-382.
[13]HARMSEN M M,RUULS R C,NIJMAN I J,et al.Llama heavy-chain V regions consist of at least four distinct subfamilies revealing novel sequence features[J].MolImmunol,2000,37(10):579-590.
[14]VAN DER LINDEN R,DE GEUS B,STOK W,et al.Induction of immune responses and molecular cloning of the heavy chain antibody repertoire of Lama glama[J].JImmunolMethods, 2000,240(1-2):185-195.
[15]VU K B,GHAHROUDI M A,WYNS L,et al.Comparison of llama VH sequences from conventional and heavy chain antibodies[J].MolImmunol,1997,34(16-17):1121-1131.
[16]RAHBARIZADEH F,RASAEE M J,FOROUZANDEH M,et al.Over expression of anti-MUC1 single-domain antibody fragments in the yeast Pichia pastoris[J].MolImmunol,2006,43(6):426-435.
[17]FU X J,GAO X L,HE S F,et al.Design and selection of a camelid single-chain antibody yeast two-hybrid library produced de novo for the cap protein of porcine circovirus type 2 (PCV2)[J].PLoSOne, 2013,8(3):556222.
[18]JONES D,CROWE E,STEVENS T A,et al.Functional and phylogenetic analysis of the ubiquitylation system in Caenorhabditis elegans:ubiquitin-conjugating enzymes,ubiquitin-activating enzymes,and ubiquitin-like proteins[J].GenomeBio,2002,3(1):RESEARCH0002.
[19]YANG S,SHANG Y,YIN S,et al.Selection and identification of single-domain antibody fragment against capsid protein of porcine circovirus type 2 (PCV2) from C.bactrianus[J].VetImmunolImmunopathol,2014,160(1-2):12-19.
[20]MALAKHOV M P,MATTERN M R,MALAKHOVA O A,et al.SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins[J].JStructFunctGenomics,2004,5(1-2):75-86.
[22]DELLA-PORTA A J,WESTAWAY E G.A multi-hit model for the neutralization of animal viruses[J].JGenVirol,1978,38(1):1-19.
(编辑白永平)
Screening and Characterization of VHH against Newcastle Disease Virus Fusion Protein
GAO Xiao-long△,HU Xiang-yun△,FU Xiang-jing,WANG Yan-ping,TONG Li-na,WANG Hai-xin,WANG Xing-long,ZHANG Shu-xia,XIAO Sa,DU En-qi*,YANG Zeng-qi*
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling712100,China)
This study aimed to obtain VHH (variable domains of camelid heavy-chain antibodies,VHH) against Newcastle disease virus (NDV) fusion protein (F protein).The synthesised DNA sequence encoding neutralizing epitope of F protein was used to construct bait plasmid.Then,the constructed bait was used to screen a naiveCamelusBactrianusVHH yeast two-hybrid library through yeast two-hybrid technology.After screening,four positive clones were primarily obtained and two of four VHHs with hallmark of VHH sequence were picked out for expression and purification.Subsequently,the biological activities of purified VHH were evaluated.Indirect ELISA results showed that the reactivity between VHH1 or VHH2 and NDV virion was significant higher than negative control.Western blot results suggested that VHH could specifically react with F protein.Neutralization assay further demonstrated that these two VHH could inhibit the replication of virulent NDV at some extent.These results indicate that we successfully obtained two VHH against NDV F protein,which laid the foundation for its application in ND control.
Newcastle disease virus;fusion protein;VHH;yeast two-hybrid
10.11843/j.issn.0366-6964.2016.08.015
2016-02-29
国家自然科学基金(31272578);西北农林科技大学引进人才科研启动基金(Z111021006)
高小龙(1988-),男,陕西宝鸡人,博士,主要从事动物传染病和基因工程抗体研究,E-mail:gaoxiaolong1017@163.com;△共同第一作者
杨增岐,教授,E-mail:yzq8162@163.com
S852.659.5;S852.43
A
0366-6964(2016)08-1645-07

