矢车菊素-3-葡萄糖苷对APPswe/PS1ΔE9阿尔茨海默病模型小鼠糖脂代谢的影响
宋 楠,张 玲,陈 巍,张 倩,韩云林,秦 川
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
矢车菊素-3-葡萄糖苷对APPswe/PS1ΔE9阿尔茨海默病模型小鼠糖脂代谢的影响
宋楠,张玲,陈巍,张倩,韩云林,秦川*
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京100021)
目的探讨矢车菊素-3-葡萄糖苷(Cy3G)对阿尔茨海默病(AD)模型小鼠糖脂代谢的影响。方法将7月龄APPswe/PS1ΔE9(PAP)的AD模型小鼠随机分为AD模型组(PAP)、Cy3G治疗组(PAPCy,5mg/kg/d)及同窝阴性对照组(nPAP);另外选择相同月龄的正常野生型C57BL/6J小鼠分别作为空白对照组(WT)和Cy3G干预组(WTCy,5mg/kg/d);每组12只,雌雄各半。Cy3G灌胃8周后,用MicroPET/CT检测脑葡萄糖代谢率;血生化方法检测小鼠肝肾功能及脂代谢相关指标;取全脑称重并计算脏器系数,HE染色进行组织病理学检查;透射电镜观察海马中老年斑沉积情况;Western-blot分析Jun氨基末端激酶(JNK)和蛋白激酶B(AKT)的表达情况。结果 MicroPET/CT结果显示,与WT组相比,PAP组小鼠脑18F-FDG的摄取率显著降低(P< 0.05),尤其在额叶和海马区降低尤为明显;与PAP组相比,PAPCy组小鼠额叶和海马区的18F-FDG的摄取率显著升高(P< 0.05)。血生化结果显示,与WT组相比,PAP组小鼠血清中天冬氨酸转氨酶(AST)和乳酸脱氢酶(LDH)水平显著升高(P< 0.05),脂代谢指标相对正常;与PAP组相比,PAPCy组血清LDH水平显著降低(P< 0.05)。脑组织HE染色未发现异常,但是在脑系数比较中,与WT组相比,PAP组小鼠脑系数显著降低(P< 0.05);与PAP组相比,PAPCy组小鼠大脑的脑系数显著升高(P< 0.05)。透射电镜下观察发现,WT组、WTCy组及nPAP组海马中未见有老年斑沉积,PAP组小鼠海马可观察到有老年斑沉积,而PAPCy组小鼠海马中老年斑沉积有所减少。Western blot结果显示,与WT组相比,PAP组JNK蛋白水平显著降低(P< 0.05)、AKT蛋白水平显著升高(P< 0.05);与PAP组相比,PAPCy组JNK蛋白水平显著升高(P<0.05),而AKT蛋白水平显著降低(P< 0.05)。结论Cy3G可以有效改善AD模型小鼠脑葡萄糖代谢障碍,但对脂代谢调节并不显著,同时还能抑制大脑海马中老年斑的沉积。提示,Cy3G可能是通过JNK/AKT通路调节胰岛素抵抗和炎症反应。
阿尔茨海默病;矢车菊素-3-葡萄糖苷;葡脂代谢
阿尔茨海默病(Alzheimer's disease,AD)作为常见的神经退行性疾病的一种,特征性的病理学表现有:β淀粉样肽(β amyloid peptides,Aβ)沉积形成的老年斑和tau蛋白过度磷酸化形成的神经原纤维缠结[1, 2]。临床上常伴有进行性认知功能障碍、人格和行为改变等[3, 4]。越来越的研究均证实,随着AD病程的发展,大脑葡萄糖代谢障碍是AD一个典型的病理生理特征,比认知功能障碍和其他病理改变早出现几十年[5-8],并对AD病程的发展起着重要作用[4]。因此,如何有效预防AD是关键。
矢车菊素-3-葡萄糖苷(cyaniding-3-glucoside,Cy3G)是酚类化合物中矢车菊色素(cyanidin,Cy)的一种糖苷形式,是植物中常见的且含量较为丰富的花色素糖苷单体。研究发现,Cy3G具有神经保护作用[9, 10],其发挥神经保护作用的机制也主要是涉及抗氧化作用和调节神经细胞间信号转导[2, 11]。此外,在非酒精性脂肪肝和2-型糖尿病的研究中发现,Cy3G可改善胰岛素抵抗、调节脂代谢及缓解氧化应激损伤[9, 12, 13]。但其是否通过调节糖脂代谢进而改善AD尚未有文献报道。本研究拟用APPswe/PS1ΔE9(PAP)转基因AD模型小鼠,观察Cy3G对AD模型小鼠糖脂代谢的影响及其相关生化、病理指标的改变,初步探讨可能的分子机制,以期能为Cy3G改善AD认知的机制研究及潜在临床应用提供新的思路。
1 材料和方法
1.1材料
1.1.1实验动物
实验所采用的APPswe/PS1ΔE9(PAP)双转基因阿尔茨海默病小鼠模型由本所遗传中心构建培育。该模型以C57BL/6J小鼠为背景,含有人APP瑞典突变位点(K595N/M596L)和人PS1第九外显子敲除(ΔE9)突变位点。用于繁殖的野生雌性C57BL/6J小鼠购自北京华阜康生物科技股份有限公司【SCXK-(京)2014-0004】,实验在中国医学科学院医学实验动物研究所开展【SYXK-(京)2011-0022】。并按实验动物使用的3R原则给予人道的关怀。
1.1.2实验药物和试剂
Cy3G购自(纯度≥99%)购自芬兰Polyphenols AS公司;RIPA裂解液(强)购于江苏碧云天公司;十二烷基硫酸钠(SDS)、过硫酸胺(APS)、Tris-HCl、甘氨酸、TEMED、Tween-20购自美国Sigma公司;N,N’-亚甲基双丙烯酰胺和丙烯酰胺购自美国Bio-Rad公司;磷酸酶抑制剂购自美国Thermo公司;苯甲基磺酰氟(PMSF)购自美国Amresco公司;丽春红、溴酚蓝购自北京鼎国生物技术公司;β-巯基乙醇购自美国Biotech公司;二硫苏糖醇(DTT)购自北方同正科技发展公司;BCATMProtein Assay Kit、蛋白Marker与ECL发光试剂盒购于美国Pierce公司;脱脂奶粉购自伊利公司;兔抗小鼠的JNK多克隆抗体和AKT单克隆抗体购自Cell Signaling公司;小鼠单克隆抗体GAPDH和HRP标记的羊抗兔IgG购自北京中杉金桥生物技术有限公司;Micro-PET示踪剂(18F标记的脱氧葡萄糖,18F-FDG)由中国医学科学院肿瘤医院提供。
1.1.3仪器和设备
MicroPET/CT及INVEON分析系统(Siemens,美国);全自动生化分析仪(日立7100,日本);透射电镜(JEOL JEM-1400,日本)及倒置显微镜(Olympus,日本);电泳电源、垂直电泳仪、湿式转印槽(北京凯元信瑞仪器有限公司)。
1.2方法
1.2.1动物分组与处理
将7月龄PAP模型小鼠分为AD模型组(PAP)、Cy3G治疗组(PAPCy,5 mg/kg/d)及同窝阴性对照组(nPAP);另外选择相同月龄的正常野生型C57BL/6J小鼠分别作为空白对照组(WT)和Cy3G干预组(WTCy,5 mg/kg/d);小鼠体重(23~25)g,每组12只,雌雄各半;Cy3G灌胃8周,灌胃体积为0.2 mL/只,溶剂对照为等体积无菌水。
1.2.2MicroPET/CT检测脑葡萄糖代谢水平
干预结束后,随机从各组中选择3只小鼠(雄性)并提前禁食不禁水12 h,实验前提前适应周围实验环境。
1)小鼠吸入含1.5%~2%异氟烷的纯氧进行吸入麻醉(1~2 L/min),待小鼠麻醉完全后,腹腔注射放射性示踪剂18F-FDG,注射量在14.5~21.9 MBq之间,活度≥0.5 mCi。
2)注射1 h后,将小鼠俯卧位固定在扫描床上,使其头部长轴与扫描器长轴保持平行且在扫描器视野内。
3)利用PET/CT进行图像釆集,整个扫描过程中小鼠头部固定,并使小鼠一直处于麻醉状态。
4)Micro-PET影像重建。釆用滤波后投影算法和CT光子衰减校正重建影像,得到10min的单帧图像。
5)感性兴趣区(region of interest,ROI)的选取。通过三维感兴趣区(3DROI)技术,在小鼠脑部横断面、矢状面和冠状面手动选取除小脑外的立体全脑3DROI,计算ROI内平均每克脑组织18F-FDG的摄取率(%ID/g)。
1.2.3血生化及脂代谢指标检测
于实验结束时,各组小鼠经眼眶静脉采血,按照试剂盒相关说明,并使用全自动生化分析仪进行血液生化检测。血液生化指标包括谷丙转氨酶(ALT)、天冬氨酸转氨酶(AST);脂代谢指标包括乳酸脱氢酶(LDH)、甘油三酯(TG)、高密度脂蛋白(HDL)及低密度脂蛋白(LDL)。
1.2.4脏器系数及病理学检查
将小鼠眼眶静脉取血后,颈椎脱臼处死,称全脑重量并根据当日体重计算脏器指数。脏器系数=(脏器重量/体重)×100%;沿脑横断面从中切开,入恒冷冰冻切片机行10 μm连续横断面切片,隔3取1,切片于4%多聚甲醛溶液中固定20 min,再在0.01mol/L PBS中放置30 min,最后经纯乙醇脱水2 min入蒸馏水,进行HE染色,封固镜检。
1.2.5透射电镜观察老年斑沉积
取小鼠海马CA1区,将组织修成1 mm×1 mm×1 mm大小的长条形,在含2.5%戊二醛的固定液中4°C固定2 h,0.1 mol/L PBS洗三次,每次10 min;1%锇酸4℃固定2 h,双蒸水冲洗三次,每次10 min;梯度酒精脱水(50%,70%,90%)各10 min,100%酒精2次,各15 min;环氧树脂Epon812包埋,超薄切片用醋酸双氧铀及枸橼酸铅双染色,透射电镜观察(JEOL JEM-1400)。
1.2.6Western-blot检测JNK和AKT蛋白表达的变化
提取脑组织蛋白并测定蛋白浓度。取含有60 μg蛋白的样品(用生理盐水调成等体积)加入5×上样缓冲液,100°C沸水浴变性5 min,置于冰上骤冷后进行10% SDS聚丙烯酰胺凝胶电泳、湿转法转膜并用5%脱脂奶粉封闭2 h,分别加入稀释好的抗体JNK(1∶500)、AKT(1∶500)和GADPH(1∶15 000);于摇床孵育,4°C过夜。次日弃去一抗,TBST摇床上洗膜3次,10 min/次,加入稀释好的二抗(1∶15 000),室温孵育1 h。加入化学发光试剂并置于天能化学发光成像系统(Tannon 5500)中成像,并用Image J进行条带灰度值分析,利用目的蛋白与内参蛋白条带的光密度比值衡量目的蛋白的相对表达量。1.2.7数据分析
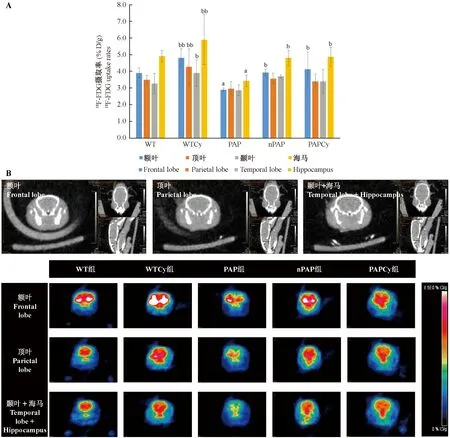
注:(A)Cy3G对PAP小鼠不同ROI内平均每克脑组织18F-FDG的摄取率(%ID/g)的影响,与WT组比较,aP < 0.05,aaP < 0.01;与PAP组比较,bP < 0.05,bbP < 0.01;(B)各组小鼠脑不同区域横断面MicroPET/CT影像。图1 Cy3G对PAP小鼠脑葡萄糖代谢的影响(n=3)Note. (A) Comparison of 18F-FDG uptake rates in the ROI of mice brains after Cy3G supplementation for 8 weeks (n=3; closely age-matched). Compared with WT group, aP < 0.05, aaP < 0.01; Compared with PAP group, bP < 0.05, bbP < 0.01. (B) MicroPET/CT imaging of mice after Cy3G supplementation for 8 weeks.Fig.1 Effects of Cy3G on cerebral glucose metabolism in PAP mice.
2 结果
2.1Cy3G对PAP小鼠脑葡萄糖代谢的影响
如图1A所示,MicroPET/CT检测小鼠额叶(frontal lobe)、顶叶(parietal lobe)、颞叶(temporal lobe)和海马(hippocampus)区对18F-FDG摄取率的变化。结果显示,各组间不同ROI内的平均每克脑组织18F-FDG的摄取率(%ID/g)存在显著差异。即与WT组相比,PAP组小鼠脑18F-FDG的摄取率显著降低(P< 0.05),尤其在额叶和海马区降低尤为明显;与PAP组相比,PAPCy组小鼠额叶和海马区的18F-FDG的摄取率显著升高,P值分别为0.019和0.036。
在横断面PET影像中%ID/g使用相同阈值,色标从上到下分别代表高、中、低18F-FDG摄取水平,相应为高、中、低脑葡萄糖代谢水平。结果显示(图1B),WT组和WTCy组小鼠大脑感兴趣区(额叶、顶叶、颞叶和海马区)18F-FDG的摄取率较高,PAP组小鼠18F-FDG摄取率较低,而PAPCy组小鼠则有所缓解。
2.2Cy3G对PAP小鼠血生化及脂代谢的影响
结果如表1所示,与WT组相比,PAP组小鼠血清中AST和LDH水平显著升高(P< 0.05),而LDL尽管有升高趋势,但差异不显著;与PAP组相比,PAPCy组血清LDH水平显著降低(P< 0.05)。此外,血清中ALT水平在各组小鼠中均无显著性差异。提示:PAP组小鼠存在肝肾功能异常,但脂代谢相对正常;Cy3G干预的各组小鼠无明显的肝肾损伤,并且脂代谢正常。
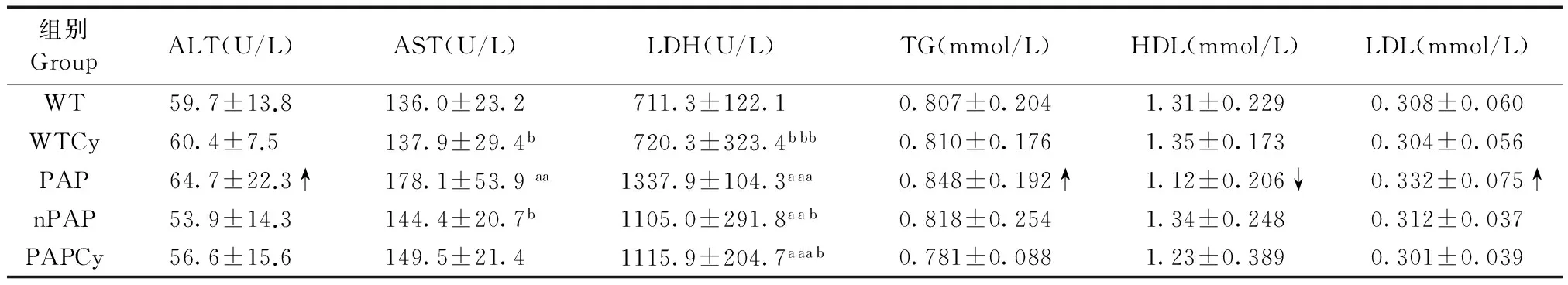
表1 各组间小鼠血生化检测
注:与WT组比较,aP< 0.05,aaP< 0.01,aaaP< 0.001;与PAP组比较,bP< 0.05,bbP< 0.01,bbbP< 0.001。
Note. Compared with WT group,aP< 0.05,aaP< 0.01,aaaP< 0.001; Compared with PAP group,bP< 0.05,bbP< 0.01,bbbP< 0.001.
2.3Cy3G对PAP小鼠脑系数的影响及病理学检查
脑系数结果显示(表2),与WT组相比,PAP组小鼠脑系数显著降低,差异具有统计学意义(P< 0.001);与PAP组相比,PAPCy组小鼠脑系数显著升高,差异具有统计学意义(P< 0.01)。HE染色结果表明,各组小鼠脑组织病理检查未见明显异常,细胞形态和结构规则、完整(图2)。
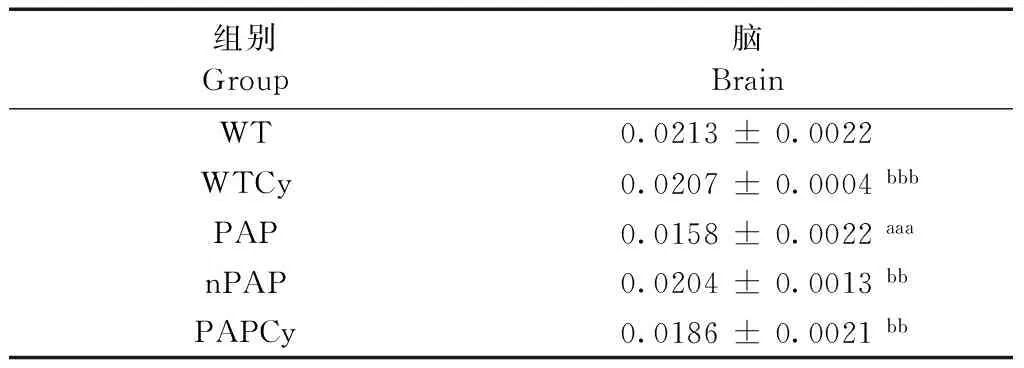
表2 各组间小鼠脑系数
注:与WT组比较,aP< 0.05,aP< 0.01,aaaP< 0.001;与PAP组比较,bP< 0.05,bbP< 0.01,bbbP< 0.001。
Note. Compared with PAP group,aP< 0.05,aaP< 0.01,aaaP< 0.001; Compared with PAP group,bP< 0.05,bbP< 0.01,bbbP< 0.001.
2.4Cy3G对PAP小鼠海马老年斑生成的影响
细胞外Aβ沉积形成的老年斑是AD的主要病理特征之一。通过透射电镜观察不同处理组小鼠海马中老年斑的生成情况,如图3所示,野生小鼠(包括WT组和WTCy组)及同窝阴性对照组(nPAP)海马内未见有老年斑形成,周围分布的线粒体结构正常;而AD模型小鼠(PAP组)小鼠海马中可观察到有老年斑沉积,其周围还有大量聚集在一起的自噬小体。而PAPCy组小鼠海马中老年斑沉积有所减少。
2.5Cy3G对PAP小鼠脑组织JNK和AKT蛋白表达的影响
结果如图4所示,JNK蛋白主要介导炎症反应,与WT组比,PAP组JNK蛋白水平显著降低,差异具有统计学意义(P< 0.01);与PAP组相比,PAPCy组JNK蛋白显著升高,差异具有统计学意义(P< 0.05)。AKT是调节胰岛素抵抗的蛋白,与WT和WTCy组相比,PAP组AKT蛋白水平显著升高,差异具有统计学意义(P< 0.05);与PAP组相比,PAPCy组AKT蛋白水平显著降低,差异具有统计学意义(P< 0.01)。
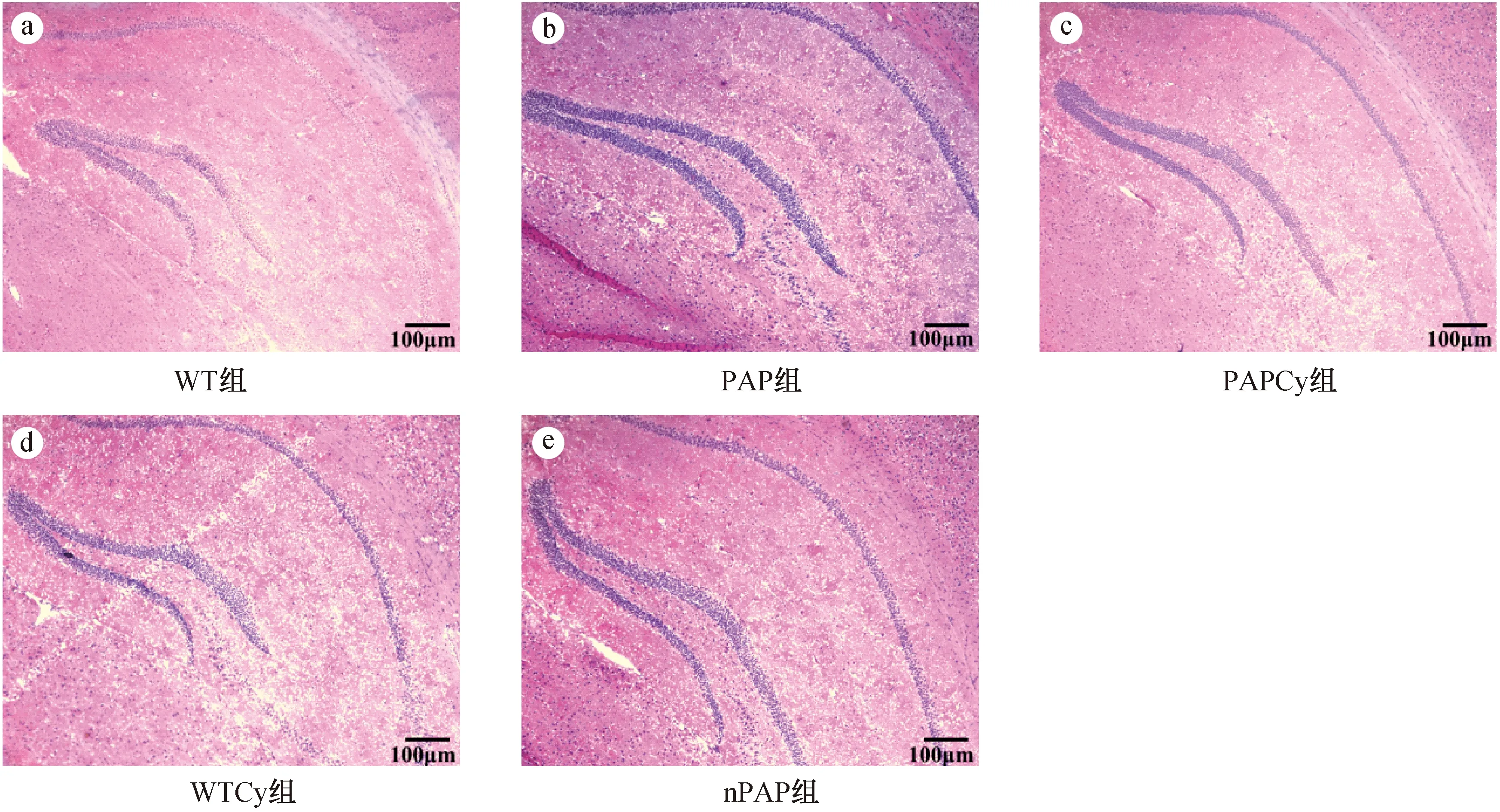
图2 脑组织病理学检查(×40,bar=100 μm,n=6)Fig.2 Pathological examination on tissue of mice.
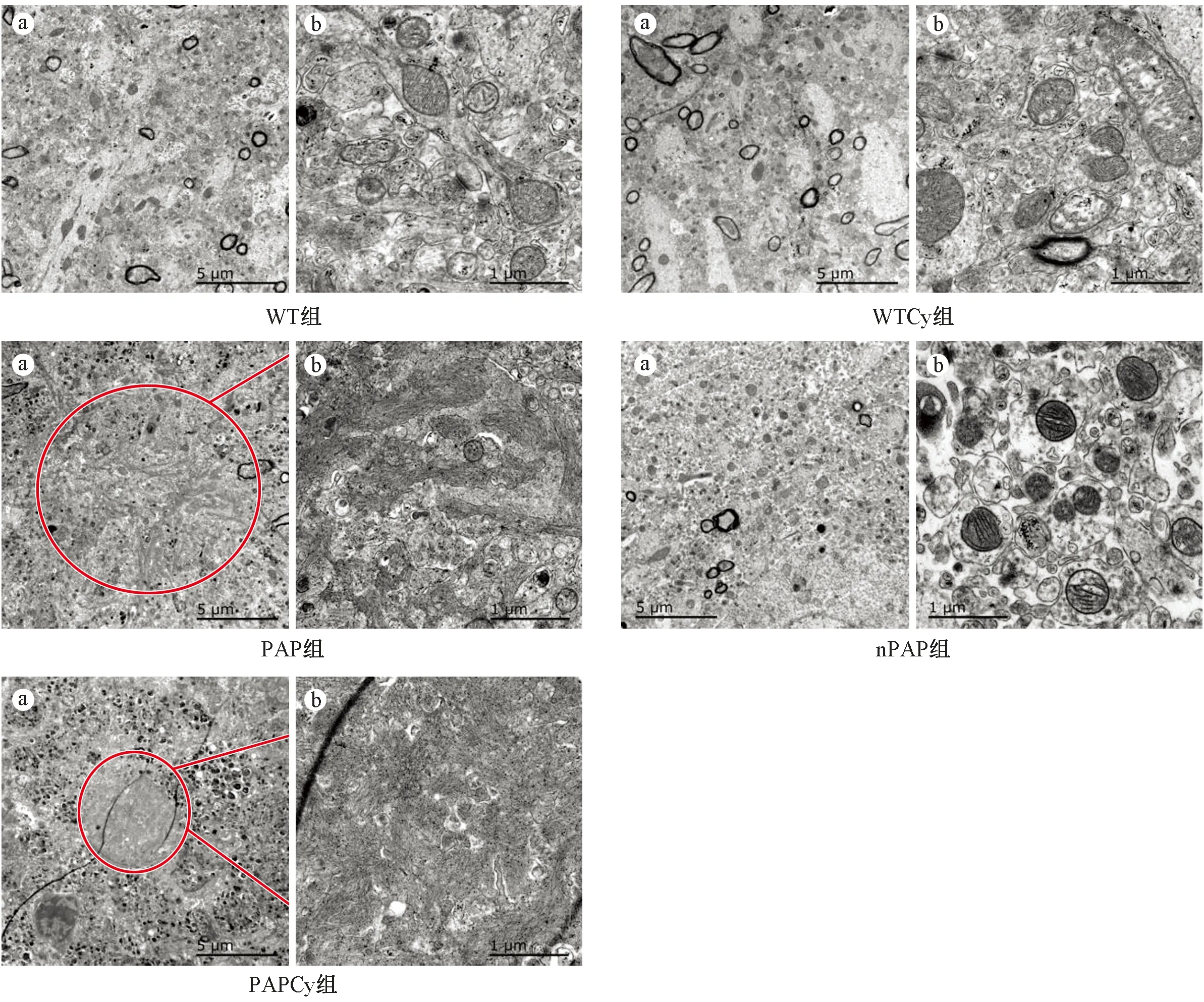
图3 透射电镜下海马区老年斑及其周围组织的超微结构(A:×600,bar=5 μm;B:×3000,bar=1 μm;n=3)Fig.3 Representative electron microscopy of senile plaques surrounded by dystrophic neuritis and autophagic vacuoles in hippocampus of each group
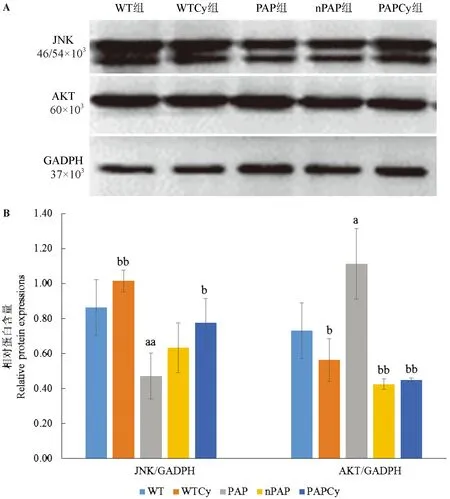
注:(A)为脑组织中JNK和AKT蛋白表达条带;(B)JNK和AKT蛋白表达灰度分析结果;与WT组比较,aP < 0.05,aaP < 0.01;与PAP组比较,bP < 0.05,bbP < 0.01。图4 Cy3G对PAP小鼠JNK和AKT蛋白表达的影响(n=3)Note. (A) The immunoreactive bands (JNK, 46/54 kDa; AKT, 60 kDa) were detected using chemiluminescence reagents. (B) The relative density of the detected bands was measured and calculated by an automatic chemiluminescence imaging analysis system; Compared with PAP group, aP < 0.05, aaP < 0.01; Compared with PAP group, bP < 0.05, bbP < 0.01.Fig.4 Effect of Cy3G on the expression of JNK and AKT in different groups.
3 讨论
阿尔茨海默病(Alzheimer’s disease, AD)作为是世界上最常见的一种老年痴呆症,在中国患者数也已超过600万,60岁人群中AD的患病率为3%~5%,并随着人口老龄化其患病率呈上升趋势,影响着我国经济和社会发展[14]。临床用于治疗AD的主要药物如胆碱酯酶抑制剂只能减轻部分症状,对患者脑内的主要病理变化并无明显改善作用,不能用于早期AD病理事件的干预或控制病情的发展,病人的生活质量无法有效改善,且药物毒副作用大[15]。此外,葡萄糖代谢功能障碍可增加老年人认知损伤的风险。而葡萄糖代谢动态平衡的失调,会引起大脑慢性代谢性疾病,其中也包括AD。即AD也是一种葡萄糖摄取和利用障碍的退行性代谢疾病。[16]
越来越多的研究证实,Cy3G除了具有清除自由基,抗氧化、抗炎,防止内皮功能紊乱,调节胆固醇代谢,改善胰岛素抵抗,预防癌症、糖尿病和心血患疾病等作用外,还具有神经保护作用[9-11, 17]。体外实验发现,用Cy3G活性单体预处理PC12(大鼠肾上腺嗜铬细胞瘤)细胞可有效改善H2O2造成的氧化损伤,也可显著抑制缺氧缺糖(oxygen glucose deprivation,OGD)所致的PC12细胞存活率降低[18]。Tarozzi等[19]研究还发现,该活性物质对Aβ致人神经母细胞瘤(SH-SY5Y)细胞损伤也具有保护作用,即细胞存活率升高、细胞调亡和坏死率降低、ROS生成量减少、细胞膜完整性得到保护。而Aβ可以通过扩散方式进入大脑实质,是AD发生的主要致病因素。体内研究发现,Cy3G可以降低大脑缺血损伤,对短暂中脑动脉阻塞(MCAO)造成的脑损伤模型小鼠具有神经保护作用[11];Shih等[2]研究发现,给快速老化(SAMP)小鼠饲喂富含Cy3G的提取物12周,可使大脑中过氧化氢酶及谷胱甘肽过氧化物酶活性升高,脂质过氧化水平降低,Aβ生成减少,学习记忆能力提高,即Cy3G能改善衰老小鼠的认知和行为能力[20]。体内外实验均证实:Cy3G可以透过血-脑屏障,在与学习和记忆相关的脑区发挥其神经保护功能[10, 21-23],因此,研究Cy3G对AD的预防或缓解作用具有现实意义。
本研究发现,Cy3G还能有效改善AD小鼠大脑中不同脑区的葡萄糖利用率,即补充Cy3G的AD小鼠其脑葡萄糖代谢率显著升高,尤其以海马区最为显著,其次是额叶、颞叶和顶叶。因此,推测Cy3G具有安全的胰岛素样活性,可调节大脑胰岛素敏感区的葡萄糖/能量代谢,Cy3G这种生物学效用与Shih和Scazzocchio等[9, 13]观点一致,即他们在非酒精性脂肪肝、2-型糖尿病的研究中发现,Cy3G可以通过活化过氧化物酶体增殖物激活受体γ(PPARγ)通路改善胰岛素抵抗、缓解氧化应激。Cy3G在脑中发挥其生物活性的机制可能与其在生理pH下化学性质不稳定、易分解有关,并且能迅速降解成酚酸(如原儿茶酸),这可能是其在体液中半衰期相对较短的原因;另一种可能是,在肠道中花青素首先通过肠道微生物将其糖苷键部分水解,生成花青素的糖苷配基(Cy)[24]。同时,Fleschhut[25]研究也已经证实,肠道菌群具有潜在的水解Cy3G的能力,即将Cy3G水解成Cy和PA,而后者可到达不同组织中,其中也包括脑组织[26]。此外,通过血生化检测并结合病理学检查,来评价Cy3G干预期间各组小鼠肝肾功能及脂代谢情况。结果显示:PAP小鼠存在肝肾功能紊乱,但是脂代谢相对正常;而Cy3G干预的各组小鼠均无明显的肝肾损伤,并且脂代谢正常。但是,Jia等[12]研究发现,在脂肪组织和肝脏中Cy3G可显著降低脂肪变性的肝细胞的脂质浓度,其激活肝细胞脂代谢的效果类似于降血脂药物。提示,在本研究中Cy3G可能对AD小鼠糖代谢方面发挥重要作用,而在脂代谢调节中的作用并不显著,这可能是因实验对象不同所致,Jia等是基于细胞水平上的研究,而本研究是从整体水平检测。为进一步研究Cy3G通过调节脑葡萄糖代谢改善AD的可能机制,在Cy3G干预期间,我们检测了脑系数并结合透射电镜观察海马区发现,尽管病理检查未发现异常,但是PAP小鼠脑系数明显减小。提示,AD模型小鼠可能出现了脑萎缩,同时海马区可观察到老年斑沉积;而补充Cy3G的PAP小鼠其脑萎缩趋势有明显改善,老年斑沉积也有所缓解。结合上述脑糖代谢紊乱的情况,应用免疫印迹法检测了AKT/JNK蛋白的变化。因为,根据文献报道,使用罗格列酮干预三转基因(APPswe/PS1ΔE9/TAU)AD模型小鼠4个月后,观察其对认知功能和AD相关脑病理变化的影响,发现这种长期治疗改善了空间学习能力与AKT信号通路改变有关,进而可缓解tau蛋白磷酸化和神经炎症[27]。而JNK的磷酸化水平升高可以导致胰岛素受体底物-1(IRS-1,第307位的丝氨酸)磷酸化,使AKT去磷酸化,进而出现胰岛素抵抗[28]。Shih等[13]研究进一步证实,Cy3G及曲格列酮分别或共同处理人类肝母细胞瘤HepG2细胞后,一方面Cy3G通过其代谢产物Cy(cyanidin)通过调控细胞外信号调节激酶(ERK)和JNK信号通路,发挥抗氧化作用;另一方面,两者可发挥协同效应,抑制由H2O2诱导的脂代谢相关基因的表达水平下调、ROS的生成和细胞的凋亡,缓解氧化应激介导的肝毒性。此外,Aβ能引起JNK信号转导通路的改变,导致海马神经元损伤[29, 30]。本研究发现PAP小鼠脑组织中AKT蛋白表达水平上调、JNK蛋白表达水平下调,而Cy3G干预后则逆转了上述蛋白水的变化。提示Cy3G可能通过对AKT/JNK通路的调节进而改善了AD小鼠脑胰岛素抵抗及炎症反应[28],可进一步解释Cy3G干预的AD小鼠脑葡萄糖代谢率升高的原因。
综上所述,Cy3G改善AD的神经保护作用机制可能与其改善脑葡萄糖代谢,调节胰岛素抵抗和缓解炎症反应有关,因此Cy3G可能具有潜在胰岛素增敏剂的活性。
[1]S.Y. Hong, W.S. Jeong, M. Jun. Protective effects of the key compounds isolated from Corni fructus against beta-amyloid-induced neurotoxicity in PC12 cells[J]. Molecules, 2012, 17 (9): 10831-10845.
[2]PH Shih, YC. Chan, J.W. Liao,etal. Antioxidant and cognitive promotion effects of anthocyanin-rich mulberry (Morus atropurpurea L.) on senescence-accelerated mice and prevention of Alzheimer’s disease[J]. J Nutr Biochem, 2010, 21 (7): 598-605.[3]Z Chen,C.Zhong.Decoding Alzheimer’s disease from perturbed cerebral glucose metabolism: implications for diagnostic and therapeutic strategies[J]. Prog Neurobiol, 2013, 108: 21-43.
[4]S.M. de la Monte. Brain insulin resistance and deficiency as therapeutic targets in Alzheimer’s disease[J]. Curr Alzheimer Res, 2012, 9 (1): 35-66.
[5]R.J. Caselli, K. Chen, W. Lee,etal. Correlating cerebral hypometabolism with future memory decline in subsequent converters to amnestic pre-mild cognitive impairment[J]. Arch Neurol, 2008, 65 (9): 1231-1236.
[6]L.Mosconi,A.Pupi,M.J.De Leon.Brain glucose hypometabolism and oxidative stress in preclinical Alzheimer’s disease[J]. Ann N Y Acad Sci, 2008, 1147: 180-195.[7]L. Mosconi, R. Mistur, R. Switalski,etal. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer’s disease[J]. Eur J Nucl Med Mol Imaging, 2009, 36 (5): 811-822.
[8]J.B.Langbaum,K.Chen,R.J.Caselli,etal. Hypometabolism in Alzheimer-affected brain regions in cognitively healthy Latino individuals carrying the apolipoprotein E epsilon4 allele[J]. Arch Neurol, 2010, 67 (4): 462-468.
[9]B. Scazzocchio, R. Vari, C. Filesi,etal. Cyanidin-3-O-beta-glucoside and protocatechuic acid exert insulin-like effects by upregulating PPARgamma activity in human omental adipocytes[J]. Diabetes, 2011, 60 (9): 2234-2244.
[10]A. Tarozzi, F. Morroni, A. Merlicco,etal. Neuroprotective effects of cyanidin 3-O-glucopyranoside on amyloid beta (25-35) oligomer-induced toxicity[J]. Neurosci Lett, 2010, 473 (2): 72-76.
[11]T.H. Kang, J.Y. Hur, H.B. Kim,etal. Neuroprotective effects of the cyanidin-3-O-beta-d-glucopyranoside isolated from mulberry fruit against cerebral ischemia[J]. Neurosci Lett, 2006, 391 (3): 122-126.
[12]Y. Jia, J.Y. Kim, H.J. Jun,etal. Cyanidin is an agonistic ligand for peroxisome proliferator-activated receptor-alpha reducing hepatic lipid[J]. Biochim Biophys Acta, 2013, 1831 (4): 698-708.
[13]P.H. Shih, S.L. Hwang, C.T. Yeh,etal. Synergistic effect of cyanidin and PPAR agonist against nonalcoholic steatohepatitis-mediated oxidative stress-induced cytotoxicity through MAPK and Nrf2 transduction pathways[J]. J Agric Food Chem, 2012, 60 (11): 2924-2933.
[14]Alzheimer’s Association.Alzheimer’s.2015 Alzheimer’s disease facts and figures[J].Alzheimers Dement,2015,11 (3): 332-384.
[15]T. Sobow. Combination treatments in Alzheimer’s disease: risks and benefits[J]. Expert Rev Neurother, 2010, 10 (5): 693-702.
[16]S.C.Correia,R.X.Santos,C.Carvalho,etal. Insulin signaling, glucose metabolism and mitochondria: major players in Alzheimer’s disease and diabetes interrelation[J]. Brain Res, 2012, 1441: 64-78.[17]A.Castaeda-Ovando,M.d.L.Pacheco-Hernández,M.E.Páez-Hernández,etal.Chemical studies of anthocyanins: A review[J]. Food Chemistry, 2009, 113 (4): 859-871.
[18]W.H.Shin,S.J.Park,E.J.Kim.Protective effect of anthocyanins in middle cerebral artery occlusion and reperfusion model of cerebral ischemia in rats[J]. Life Sci, 2006, 79 (2): 130-137.
[19]A.Tarozzi,A.Merlicco,F.Morroni,etal. Cyanidin 3-O-glucopyranoside protects and rescues SH-SY5Y cells against amyloid-beta peptide-induced toxicity[J]. Neuroreport, 2008, 19 (15): 1483-1486.
[20]P.C.Bickford,T.Gould,L.Briederick,etal. Antioxidant-rich diets improve cerebellar physiology and motor learning in aged rats[J]. Brain Res, 2000, 866 (1-2): 211-217.
[21]C. Andres-Lacueva, B. Shukitt-Hale, R.L. Galli,etal. Anthocyanins in aged blueberry-fed rats are found centrally and may enhance memory[J]. Nutr Neurosci, 2005, 8 (2): 111-120.
[22]L. Qin, J. Zhang, M. Qin. Protective effect of cyanidin 3-O-glucoside on beta-amyloid peptide-induced cognitive impairment in rats[J]. Neurosci Lett, 2013, 534: 285-288.
[23]J. Min, S.W. Yu, S.H. Baek,etal. Neuroprotective effect of cyanidin-3-O-glucoside anthocyanin in mice with focal cerebral ischemia[J]. Neurosci Lett, 2011, 500 (3): 157-161.
[24]A. Tarozzi, F. Morroni, S. Hrelia,etal. Neuroprotective effects of anthocyanins and their in vivo metabolites in SH-SY5Y cells[J]. Neurosci Lett, 2007, 424 (1): 36-40.
[25]J. Fleschhut, F. Kratzer, G. Rechkemmer,etal. Stability and biotransformation of various dietary anthocyanins in vitro[J]. European Journal of Nutrition, 2006, 45 (1): 7-18.
[26]M.A. El Mohsen, J. Marks, G. Kuhnle,etal. Absorption, tissue distribution and excretion of pelargonidin and its metabolites following oral administration to rats[J]. Br J Nutr, 2006, 95 (1): 51-58.
[27]Y. Yu, X. Li, J. Blanchard,etal. Insulin sensitizers improve learning and attenuate tau hyperphosphorylation and neuroinflammation in 3xTg-AD mice[J]. J Neural Transm (Vienna), 2015, 122 (4): 593-606.[28]C.J. Chang, C.S. Lin, C.C. Lu,etal. Ganoderma lucidum reduces obesity in mice by modulating the composition of the gut microbiota[J]. Nat Commun, 2015, 6: 7489.
[29]S.Mandrekar-Colucci,J.C.Karlo,G.E.Landreth. Mechanisms underlying the rapid peroxisome proliferator-activated receptor-gamma-mediated amyloid clearance and reversal of cognitive deficits in a murine model of Alzheimer’s disease[J]. J Neurosci, 2012, 32 (30): 10117-10128.
[30]M.Ahmadian,J.M.Suh,N.Hah,etal.PPARgamma signaling and metabolism: the good, the bad and the future[J]. Nat Med, 2013, 19 (5): 557-566.
Effect of cyaniding-3-glucoside on glucose and lipid metabolism in the APPswe/PS1ΔE9mouse model of Alzheimer's disease
SONG Nan, ZHANG Ling, CHEN Wei, ZHANG Qian, HAN Yun-lin, QIN Chuan*
(Comparative Medicine Center, Peking Union Medical College (PUMC); Institute of Laboratory Animal Science,Chinese Academy of Medical Science (CAMS); Key Laboratory of Human Disease Comparative Medicine,Ministry of Health, Beijing 100021, China)
ObjectiveTo investigate the effect of cyaniding-3-glucoside (Cy3G) on glucose and lipid metabolism in the APPswe/PS1ΔE9mouse model of Alzheimer’s disease (AD). MethodsSeven-month-old APPswe/PS1ΔE9(PAP) mice were randomly divided into model group (PAP), Cy3G treatment group (PAPCy, 5 mg/kg/d) and negative-control group (nPAP). In addition, age-matched and normal wild-type of C57BL/6J mice were selected and divided into vehicle group (WT), Cy3G intervention group (WTCy, 5 mg/kg/d). Each group containing 12 mice, with equal number of male and female mice. After 8-week Cy3G supplementation, microPET/CT was used to measure cerebral glucose metabolism rate of mice in each group. Biochemical methods were used to detect the liver / kidney function as well as indicators associated with lipid metabolism. After weighting brain tissue, the brain coefficient was tested and pathological examination was used to observe tissues changes. Transmission electron microscope was used to observe neuropathological amyloid plaques deposition. Western- blot was used to determine protein levels of AKT and JNK. ResultsCompared with the WT group, PAP mice had low levels of18F-FDG uptake rates, especially in the regions of the frontal lobe and hippocampus accompanied by the decreased brain coefficient and amyloid plaques deposition in hippocampus. And levels of aspartate transaminase (AST) and lactic dehydrogenase (LDH) were also increased in PAP mice, but lipid metabolism index was relatively normal. In addition, the expression of JNK was decreased and AKT was increased in mice of PAP. However, in the PAPCy group,18F-FDG uptake rates were obviously increased in the regions of the frontal lobe and hippocampus compared with those in the PAP mice. And the reduction of brain atrophy and amyloid plaques deposition, normal lipid metabolism and no obvious liver/kidney toxicity were also observed. Cy3G also could reverse the changes of JNK and AKT protein. ConclusionsCy3G can improve glucose metabolism disorders instead of lipid metabolism, inhibit the senile plaques deposition in hippocampus and regulate insulin resistance and inflammatory reaction associated with JNK/AKT pathway. Thus, Cy3G has a good safety profile and may be used as an ideal alternative to traditional disease-modifying treatments against AD.
Alzheimer's disease; Cyaniding-3-glucoside; Glucose and lipid metabolism
国家自然基金(81500938);协和青年基金(3332015151)。
宋楠,女,博士研究生,研究方向:病理学与病理生理学,神经退行性疾病的机制研究。E-mail:nannanxjwstu@163.com。
秦川,女,研究员,教授,博士生导师,研究方向:病理学与病理生理学。E-mail:qinchuan@pumc.edu.cn。
研究报告
R-332
A
1671-7856(2016)07-0015-09
10.3969.j.issn.1671-7856.2016.07.003
2016-04-13

