bcl-2 基因修饰神经干细胞移植修复大鼠脊髓损伤
张 梅,王跃新*,侯晓华,洪 军,殷胜春,李 岩,刘庆阳
(1.唐山市工人医院,河北 唐山 063000;2. 煤炭总医院,北京 100028)
bcl-2 基因修饰神经干细胞移植修复大鼠脊髓损伤
张梅1,王跃新1*,侯晓华1,洪军1,殷胜春1,李岩1,刘庆阳2
(1.唐山市工人医院,河北 唐山063000;2. 煤炭总医院,北京100028)
目的探讨bcl-2 基因修饰神经干细胞移植对脊髓损伤大鼠损伤神经功能恢复的影响。方法体外培养大鼠神经干细胞, 经Ad-EGFP为载体介导端B淋巴细胞瘤-2基因(bcl-2)基因转染神经干细胞,分为3组:对照组、阴性转染组、bcl-2转染组。Western-blot检测神经干细胞在转染前后bcl-2蛋白的表达。成年雌性SD大鼠85只,造模成功72只,随机分为对照组,NSCs组,bcl-2-NSCs组, 24只/组,按照改良的Allen打击法建立大鼠急性脊髓损伤模型。通过BBB评分、斜板试验进行运动功能评定。造模后7 d通过RT-PCR及Western-blot检测检测脊髓损伤区周围HSP27、c-fos基因的表达,TUNEL法检测细胞凋亡情况。造模后4周取材行病理切片HE染色及荧光显微镜观测EGFP标记的NSC存活及分布情况,通过SEP和MEP观察大鼠神经电生理恢复情况。结果bcl-2基因转染大鼠神经干细胞后,bcl-2转染组与对照组、阴性转染组相比bcl-2基因和蛋白水平均有表达(P< 0.05);大鼠下肢运动功能评价bcl-2-NSCs组优于NSCs组,NSCs组优于对照组。造模后72 h,bcl-2-NSCs组细胞凋亡数均明显低于对照组和NSCs组(P< 0.05)。造模后7 d,与对照组和NSCs组相比,bcl-2-NSCs组HSP27基因和蛋白的表达均较显著升高(P< 0.05),bcl-2-NSCs组c-fos基因和蛋白的表达较显著降低(P< 0.05)。造模后4周,HE染色对照组可见脊髓组织缺失及脊髓空洞形成,无神经轴索通过。NSCs组损伤区可见少量神经轴索样结构,脊髓空洞较小,bcl-2-NSCs组可见较多神经轴索样结构,未见脊髓空洞。EGFP标记的阳性细胞数:bcl-2-NSCs组最多,NSCs组次之,对照组未见,且各组之间差异有显著性(P< 0.05)。造模后4周,SEP和MEP的潜伏期:bcl-2-NSCs组
脊髓损伤;bcl-2 基因;修饰;神经干细胞;移植;修复;大鼠;神经功能
脊髓损伤(spinal cord injury,SCI)是一种常见的严重创伤,可导致创伤部位以下区域感觉和运动功能的不可逆损伤,且缺乏有效的治疗方法。在创伤区内抑制细胞凋亡对脊髓保护是非常重要的[1]。然而,由于SCI的病理生理机制的复杂性及多变性,还没有令人满意的药物或外科手术来治愈SCI[2],因此,对SCI潜在治疗方法的发掘仍迫在眉睫。
神经干细胞(NSC)是指具有分化为神经元,少突胶质细胞和星型胶质细胞能力,且能够自我更新并形成神经组织的细胞[3]。NSC具有的定向迁移、组织融合及免疫豁免性,使其在损伤移植后可以很好的存活。且研究已证实NSC移植安全有效,对小鼠的正常生长发育无明显影响。
B淋巴细胞瘤-2在神经系统及其他多种组织均有表达。SCI后,Bcl-2蛋白在幸存神经元中表达量明显增加,提示它是一种神经系统重要的保护性因子。有学者发现, Bcl-2的过表达能够使中枢神经继发性损伤减轻,改善预后,但是有关机制尚未阐明。本文将Bcl-2基因转染NSC细胞,检测NSC细胞的生物学特性,并进一步探讨Bcl-2-NSC对大鼠SCI功能恢复的影响。
1 材料和方法
1.1实验动物
清洁级SD大鼠85只,1月龄,体重(230~270)g。购自唐山恒安生物工程有限公司【SCXK(冀)2010-0-055】,唐山工人医院SPF 级实验动物室常规饲养【SYXK(冀)2011-0012】。
1.2主要试剂与仪器
胰蛋白酶(美国Santa Cruz 公司);PBS 缓冲液粉剂(福州迈新);Western-blot蛋白检测试剂盒(美国 Santa Cruz 公司);BCA 蛋白浓度测定试剂盒(Beyotime 公司);细胞培养箱(美国Thermo Forma 公司);化学发光检测试剂盒(美国Pierce);Bcl-2单克隆抗体(北京中山试剂公司);TUNEL染色试剂盒(Promega);Trizol试剂(美国Invitrogen公司);QuantiTect逆转录试剂盒(德国QIAGEN公司);HSP-27(美国Abcam公司);KEYPOINT 4诱发电位仪(北京市康泰医疗器械有限公司);扫描分析软件系统(Labworks Analysis Software,美国)。1.3实验方法
1.3.1神经干细胞培养、鉴定标记、NSC及bcl-2-NSC悬液的制备
取孕14 d的SD大鼠处死,75%的酒精浸泡消毒。切取胎鼠大脑,浸泡在DMEM/F12液中,去除脑膜和血管。将去除脑膜和血管的胎脑浸泡于DMEM/F12液中,用吸管反复吹打成悬液,过100目孔筛网,过滤的悬液接种于培养瓶中,加EGF, bFGF,N2添加剂,37℃,5%CO2培养箱中培养。72 h后换液。培养神经干细胞3 d后接种到涂布多聚赖氨酸的盖玻片上,以一抗Brdu 1:400的比例,进行免疫细胞化学染色,并用DAB 显色。对形成的神经球行nestin免疫组织化学染色,进行鉴定。 将移植前2 d呈对数生长期的NSC进行离心,添加培养液,反复吹打至单细胞悬液并进行计数,将种植密度调整为1×106/mL。在培养瓶中加入感染复数(MOI)为200PFU/细胞浆含bcl-2-Ad-EGFP颗粒的储存液,于培养箱中温育48 h后离心,并弃去上清液,再次吹打至单细胞悬液并进行计数,将种植密度调整为2×107个/μL。同时制备单纯NSC悬液(浓度为2×107个/μL)。1.3.2Western-blot检测Bcl-2蛋白表达
转染后48 h,按照3组细胞,提取总蛋白,5%浓缩胶40 V衡压1 h,10%分离胶60 V恒压3.5 h,湿转14 V恒压14 h,37℃摇床封闭2 h, 洗膜10 min,3次,兔抗鼠抗体Bax或BCL-2(1∶800)4℃ 过夜;抗鼠β-actin(1∶1 000)4℃过夜。TBST洗膜5 min×4次,山羊抗兔抗体1∶700,37℃摇床孵育1.5 h,TBST 洗膜5 min×4 次。再次运用TBS洗膜10 min后DAB显色,BCL-2与β-actin的灰度积分的比值进行分析,作为BCL-2 蛋白表达的量。
1.3.3大鼠SCI模型的制备及干预
将SD大鼠进行麻醉、固定并剃毛,暴露大鼠棘突和椎板,将T8-9的棘突及部分椎板切除,并将黄韧带切除,显露出硬脑膜。按照改良Allen法操作方法依次设计打击锤重量为10 g,打击高度为2.5 cm进行脊髓打击,鼠尾及双后肢可见痉挛性伸直片刻后又松弛表示造模成功,参考Zlokovic等[4]的方法将造模成功后3 d动物再次麻醉后进行细胞移植,随机分为3组,每组24只,单独放于3个笼子里。保持动物良好的卫生条件,允许其自由采食,并给与供水。其中,对照组:SCI后注入5 μL生理盐水溶液;NSCs组:注入等量NSC悬液;bcl-2-NSCs组:注入等量bcl-2-NSC悬液(细胞数均为2×107个/μL)。
1.3.4运动功能评价
3组大鼠均于SCI后的不同时期采用BBB评分、斜板试验评价运动功能。BBB评分[5]:共22级,0级:后肢完全瘫痪,21级:功能正常,主要观察指标包括关节活动次数,运动负荷、范围,前肢、后肢及前爪、后爪、尾巴的协调程度。斜板试验:大鼠放置在光滑的木板上,体轴垂直于板的垂直轴,每个试验斜板的角度增加5度,当最大角度时大鼠可停留5秒,则认为有功能价值。
1.3.5RT-PCR及Western-blot 检测HSP-27、c-fos基因的表达
取各组大鼠损伤区的脊髓组织50 mg,Trizol 法提取总RNA,用RT-PCR两步法试剂盒将mRNA逆转录成cDNA,将cDNA行PCR扩增。HSP27的引物序列:上游5’-GGCGCTCAACCGGCAACTCA-3’,下游5’-CTCAGGGACAGGGAAGAG-3’,GAPDH:上游5’-ACCTGACCTGCCGTCTAGAA-3’,下游:5’-TCCACCACCCTGTTGCTGTA-3’,c-fos:上游5’- GAC AGC CTT TCC TAC TAC CAT TTC C-3’,下游5’-CCA TCT TAT TCC TTT CCC TTC-3’反应条件:94℃ 5 min之后,94℃变性30 s,56℃退火30 s,72℃延伸45 s,23个循环后再72℃延伸10 min。PCR产物采用琼脂糖凝胶电泳。RT-PCR提取后的剩余物经1500 r/min 离心30 min后,取上清为粗体蛋白, Bradford法测定总的蛋白浓度。5%浓缩胶40 V衡压1 h,10%分离胶60 V恒压3.5 h,湿转14 V恒压14 h,37℃摇床封闭2 h, 洗膜10 min,3次,兔抗鼠抗体HSP-27或c-fos(1∶800)4℃ 过夜;抗鼠GAPDH(1∶1000)4℃过夜。TBST洗膜5 min×4 次,山羊抗兔抗体1∶700,37℃摇床孵育1.5 h,TBST 洗膜5 min×4 次。再次运用TBS洗膜10 min后DAB显色,HSP-27、c-fos与GAPDH的灰度积分的比值进行分析,为HSP-27、c-fos 蛋白表达的量。1.3.6TUNEL法检测细胞凋亡率
取脊髓组织进行石蜡切片处理。TUNEL法检测按德国Roche公司试剂盒购操作。待水化、37℃条件下蛋白酶K消化10 min,进行标记液标记后, 37℃下,经生物素化的地高辛反应30 min,加SABC,DAB显色。封片后对胞核含棕黄色颗粒的细胞计数。
1.3.7HE染色及荧光显微镜观察EGFP标记的NSC存活及分布
3组各随机取5只大鼠,取脊髓组织,固定用4%多聚甲醛,冲洗用生理盐水。从病变部位取长约1 cm的完整脊髓,经分级系列酒精脱水,纵向切片,厚约20 μm,进行HE染色。随机取10个视野,用高倍荧光显微镜(×20)观察EGFP标记的NSC的存活及分布情况。
1.3.8检测运动诱发电位和体感诱发电位
每组随机取5只大鼠,用KEYPOINT 4诱发电位仪检测后肢体感及运动诱发电位。将大鼠进行麻醉、固定,并准确安放参考及记录电极。直流波电脉冲刺激参数设计:3 Hz的频率,0.2 ms的波宽,5~15 mA的电流强度,50~60倍的叠加次数,后肢有轻微抽搐为参数设计良好。观察并记录数值变化。同样的方法检测运动诱发电位并记录。
1.4统计学方法
2 结果
2.1NSCs体外培养、鉴定及标记
脑组织单细胞悬液接种于培养瓶后1 h,大部分细胞沉积在瓶底,呈圆形、无突起,同时可以观察到小的细胞团,其中NSCs细胞数量较少。1 d后NSCs增多、较小、形状不规则,小部分细胞团贴壁;5 d后NSCs增多,为较大、形状规则的球形。免疫组化染色显示,NSCs球呈Nestin强阳性表达。
2.2Western-blot
基因在转染3 d及14 d后,bcl-2转染组的神经干细胞检测到 bcl-2 蛋白表达明显,而对照组和阴性转染组 bcl-2蛋白无表达,说明了bcl-2基因已稳定整合入bcl-2转染组神经干细胞中,且可以行目的蛋白的稳定表达,如图2A-B所示。
2.3运动功能评定结果
造模前所有大鼠的BBB评分、斜板试验评分差异均无显著性意义(P< 0.05)。移植后4周,NSCs组,bcl-2-NSCs组两项评分在损造模后2~4周较对照组都明显增加,差异有显著性意义(P< 0.05)。bcl-2-NSCs组两项评分在损造模后2~4周较NSCs组明显增加,差异有显著性意义(P< 0.05),见表1。
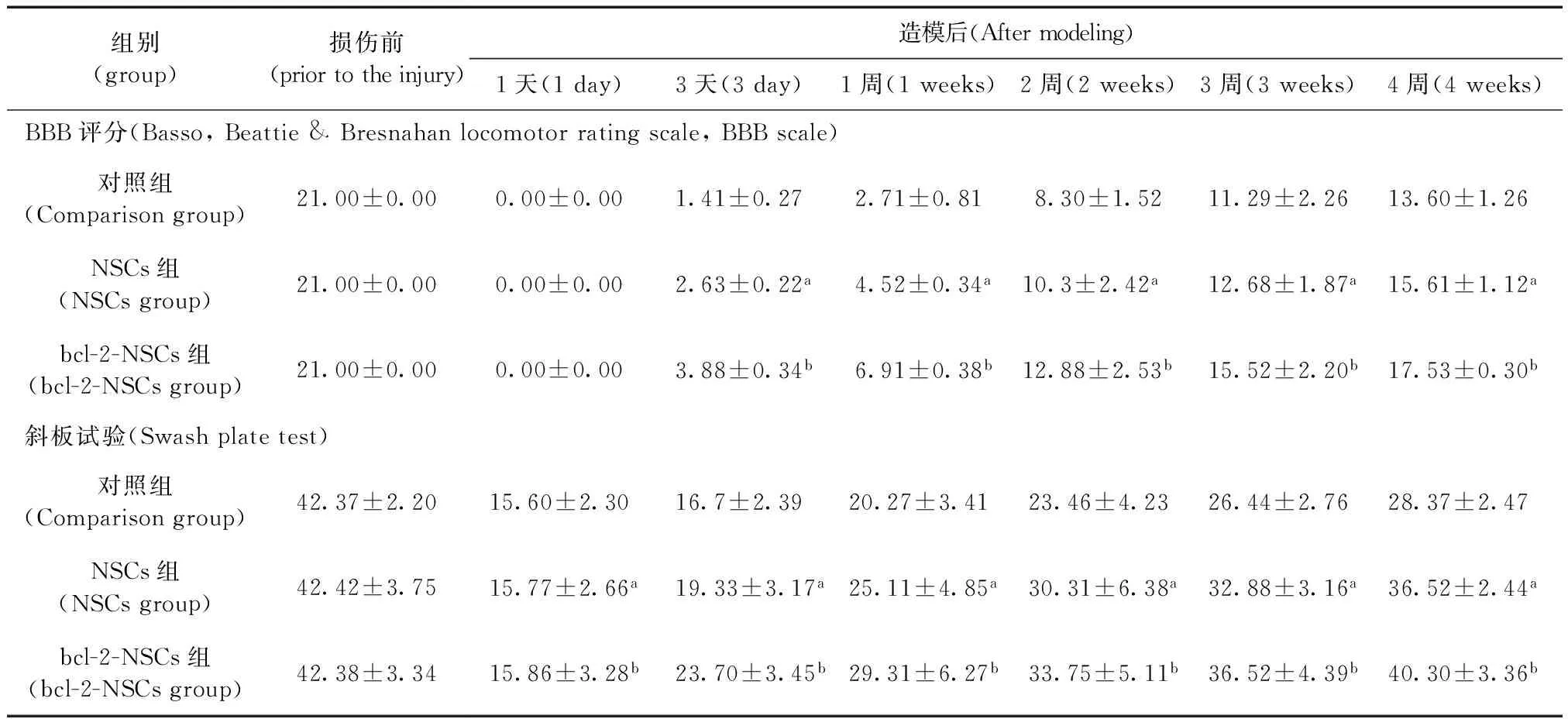
表1 各组大鼠运动功能评定结果(n=5)
注:与对照组相比,aP< 0.05;与NSCs组相比bP< 0.05。
Note.Compared with the control group,aP<0.05;Compared with NSCs groupbP<0.05.

注:(1A)倒置微镜下观察培养的原代神经干细胞形态(×40);(1B)神经干细胞Nestin免疫荧光化学染色阳性(×40);(1C)EGFP标记的NSCs(×100)。图1 神经干细胞的培养、鉴定及标记Note.(1A)primary neural stem cell morphology was observed under inverted microscope cultured(×40);(1B)neural stem cells Nestin immunofluorescence staining(×40);(1C)EGFP-labeled NSCs(×100).Fig.1 Culture, identification and labeling of neural stem cells

注:(A)转染3 d;(B)转染14 d。图2 bcl-2蛋白在神经干细胞中的稳定表达Note.(A)Transfection 3 days;(B)Transfection 14 days.Fig.2 Bcl-2 protein was stably expressed in neural stem cells
注:(3A)对照组;(3B)NSCs组;(3C)bcl-2-NSCs组。图3 HE染色观察各组神经细胞样形态学(×40)Note.(3A)The control group;(3B)NSCs group;(3C)bcl-2-NSCs group.Fig.3 HE staining in each group of neural cell-like morphology
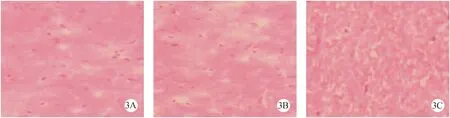
注:(4A)对照组;(4B)NSCs组;(4C)bcl-2-NSCs组。图4 荧光显微镜观察EGFP标记的绿色荧光细胞(×20)Note.(4A)The control group;(4B)NSCs group;(4C)bcl-2-NSCs group.Fig.4 Fluorescence microscopy of GFP-tagged green fluorescent cells
2.4HE染色和荧光显微镜观察
伤后4周,HE染色对照组可见损伤处脊髓组织断裂,为瘢痕连接,有明显空洞形成 (图3A)。NSCs组在移植部位组织空洞较对照组小,较bcl-2-NSCs组大(图3B)。bcl-2-NSCs组空洞消失(图3C)。NSCs组及bcl-2-NSCs组切片中均可见散在的EGFP标记的阳性的绿色荧光(图4A-C):对照组为(0±0.00)个/高倍视野,NSCs组为(12.15±3.24)个/高倍视野,bcl-2-NSCs组为(27.34±4.41)个/高倍视野,各组之间差异显著(P<0.01)。
2.5HSP-27、c-fos基因和蛋白的表达
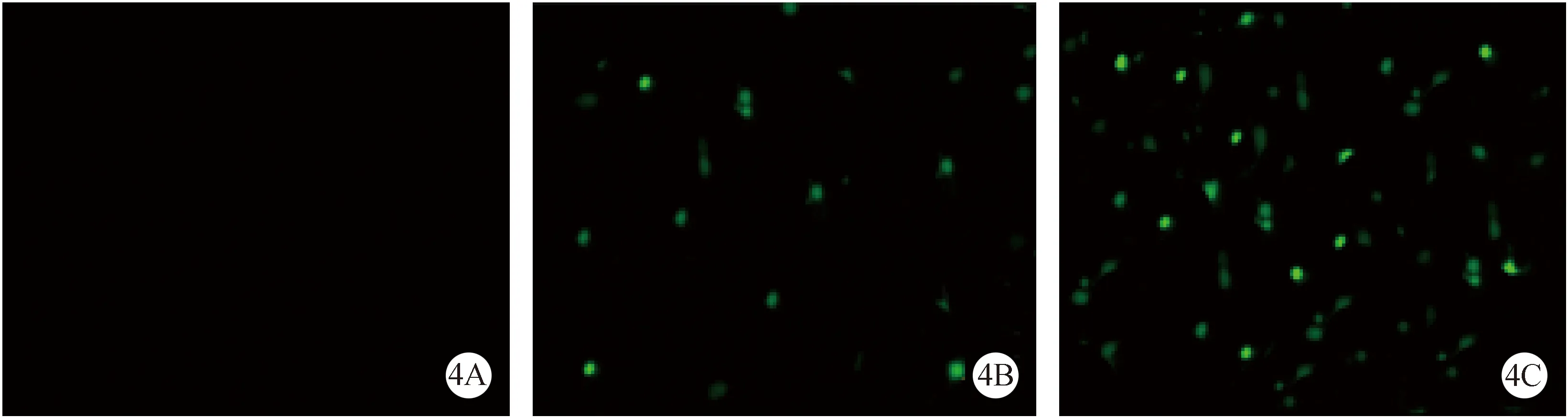
造模后7天,与对照组和NSCs组相比,bcl-2-NSCs组HSP27基因的表达显著升高,P< 0.05,c-fos基因的表达显著降低P< 0.05;与对照组比较,NSCs组GSP27蛋白的表达显著升高,P< 0.05,c-fos蛋白的表达显著降低P< 0.05,见图5。
2.6TUNEL检测细胞凋亡
凋亡神经细胞的细胞核内可见特异性棕黄色颗粒,TUNEL法测定,NSCs组中,免疫组化呈棕黄色颗粒的凋亡细胞数(20.41±4.38)明显少于对照组(30.12±3.44)(P< 0.05),bcl-2-NSCs组凋亡细胞最少(9.57±2.31)。见图6。
2.7体感诱发电位和运动诱发电位
移植后4周,对照组体感诱发电位和运动诱发电位少量恢复,bcl-2-NSCs组感诱发电位和运动诱发电位明显恢复,波幅增高。各组大鼠体感诱发电位潜伏期和波幅,见表2。NSCs组与对照组比较差异有显著性意义(P< 0.05)。bcl-2-NSCs组与对照组比较差异有非常显著性意义(P< 0.01)。NSCs组与bcl-2-NSCs组比较差异有显著性意义(P< 0.05),表明bcl-2-NSCs组电信号从后肢到头皮传导时间比其他组都短,传导通路已经畅通,恢复较好。
图5 脊髓损伤区HSP-27、c-fos基因与蛋白的表达Fig.5 Expression of HSP-27、c-fos gene and protein in spinal cord injury
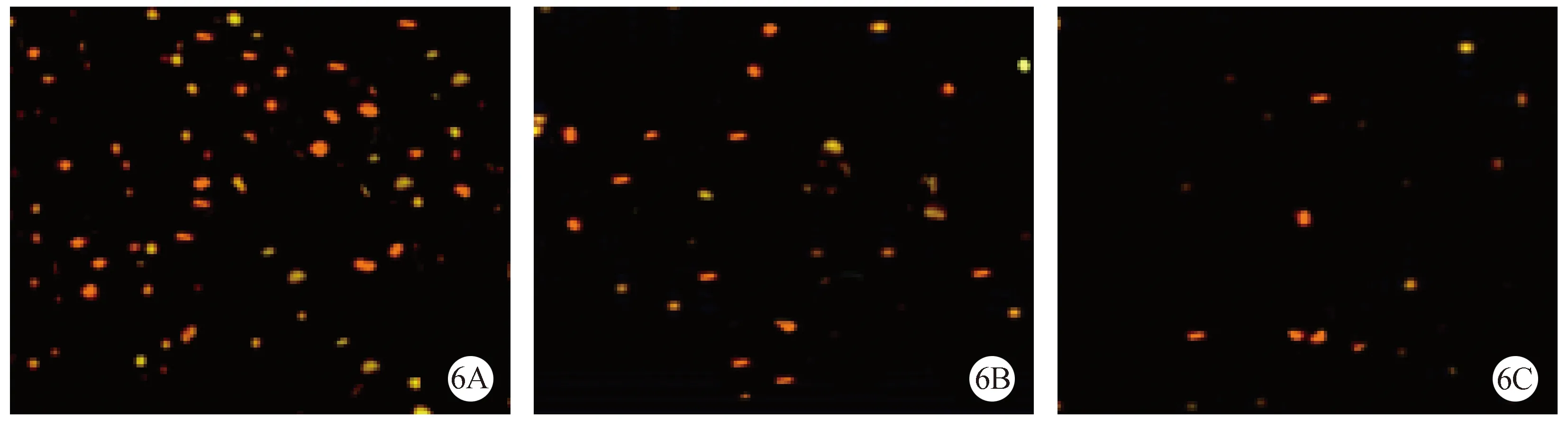
注:(6A)对照组;(6B)NSCs组;(6C)bcl-2-NSCs组。图6 TUNEL检测各组细胞凋亡(×20)Note.(6A)The control group;(6B)NSCs group;(6C)bcl-2-NSCs group.Fig.6 TUNEL staining of each group
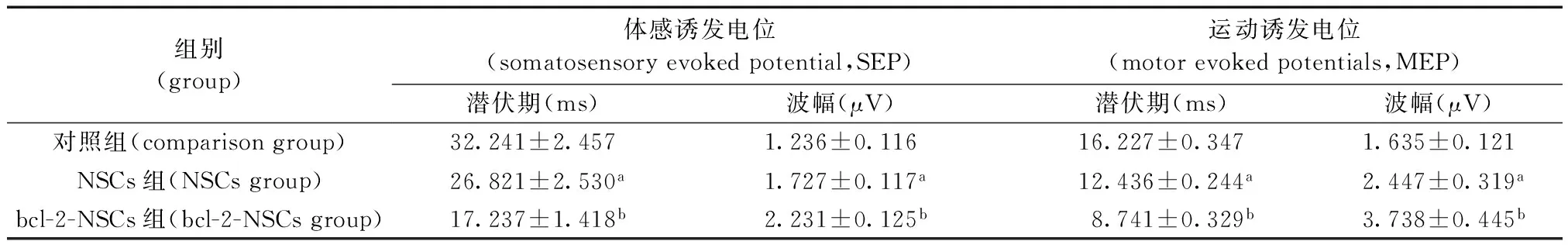
组别(group)体感诱发电位(somatosensoryevokedpotential,SEP)运动诱发电位(motorevokedpotentials,MEP)潜伏期(ms)波幅(μV)潜伏期(ms)波幅(μV)对照组(comparisongroup)32.241±2.4571.236±0.11616.227±0.3471.635±0.121NSCs组(NSCsgroup)26.821±2.530a1.727±0.117a12.436±0.244a2.447±0.319abcl-2-NSCs组(bcl-2-NSCsgroup)17.237±1.418b2.231±0.125b8.741±0.329b3.738±0.445b
注:与对照组相比,aP< 0.05;与NSCs组相比bP< 0.05。
Note.Compared with the control group,aP<0.05;Compared with NSCs group,bP<0.05.
3 讨论
SCI的病理损伤分为原发性SCI和继发性SCI[5]。发生前者时,损伤的脊髓组织会经历神经元凋亡、炎症反应、氧自由基损伤等破坏性及轴突再生等修复性过程,属于不可逆性损伤。后者则是由前者引发的一系列神经病理变化,给予积极的治疗手段可减慢其发生、发展,属于可控性损伤,所以目前将继发性SCI作为研究的焦点[6]。近来,Bcl-2减轻继发性SCI的作用越来越引起关注,除了抗凋亡功能外,一些研究提示,过表达的Bcl-2能够阻止由中毒、缺氧、缺乏生长因子等诱发的神经元死亡[7],提示Bcl-2对神经功能的保护作用是多方面的[8]。
Bcl-2基因家族包括促进(Bax)和抑制(Bcl-2)细胞凋亡的两大类成员,是SCI后细胞凋亡的重要调控基因。研究认为,Bcl-2与Bax以二聚体的形式在体内发挥作用,二者的比例是决定细胞存亡的关键[9]。燕景峰等[10]研究发现,Bcl-2组表达在各个时间点上较SCI、NSC组明显增多,凋亡率降低。本实验运用多项技术,研究了Bcl-2-NSC治疗小鼠SCI后机体的恢复情况。通过Ad-EGFP为载体介导Bcl-2基因转染使神经干细胞能够明显抑制细胞凋亡、促进神经干细胞增殖及修复,与前人的研究结果一致。
HSP是其中重要的一员,主要参与稳定细胞骨架。路艳等[11]发现,HSP(heat shock proteins,热休克蛋白,简称为HSP)可与APaf-1结合,阻止形成APaf-1/Cyt-c/casPase-9凋亡复合体,进而阻止细胞凋亡,起到保护神经系统损伤的作用。在实验中我们观察到,Bcl-2高表达小鼠的脊髓标本上HSP的表达明显升高,对提高脊髓的应激性、耐受缺血缺氧等损伤明显是有利的。
本实验仅对部分内容进行了探索,尚存在许多不足之处,还需要更进一步的探究。但本实验中涉及到转基因技术已引起了研究人员的极大兴趣,也许在不久的将来会有更广阔的前景。因此继续探索并完善基因修饰NSC移植治疗SCI的理论水平和分子机制,从而使基因治疗早日应用于临床,是我们进一步研究的课题和努力的方向。
[1]Wang Y,Wang H, Tao Y,etal.NecroPtosis inhibitor necrostatin-1 Promotes cell Protection and Physiological function in traumatic sPinal cordinjury[J]. Neuroscience,2014,266:91-101.
[2]David S,LoPez-Vales R,Wee Yong V.Harmful and beneficial effects of inflammation after sPinal cord injury: Potential thera Peutic imPlications[J]. Handb Clin Neurol,2012,109:485-502.[3]Karimi-Abdolrezaee S, EftekharPour E.Stem cells and sPinal cord injury rePair[J].Adv ExP Med Biol,2012,760:53-73.
[4]Zlokovic BV, APuzzo ML. Cellular and molecular neurosurgery: Pathways from concePt to reality-Part II:vector systems and delivery methodologies for gene theraPy of the central nervous system[J]. Neurosurgery, 1997,40(4):805-813.
[5]訾英,范广宇,朱悦.脊髓干细胞移植对脊髓损伤后神经功能的影响[J]. 中华实验外科杂志,2006,23(10):1257-1258.
[6]Rahman F, Bhargava A,TiPPu SR,etal. Analysis of the immunoexPression of Ki-67 and Bcl-2 in the Pericoronal tissues of analysis[J]. Dent Res J(Isfahan), 2013,10(1):31-37.[7]Schulman JJ, Wright FA, Kaufmann T,etal.The Bcl-2 family member Bok binds to the couPling domain of inositol 1,4,5-trisPhate recePtors and Protects them from Proteolytic cleavage[J]. J Biol Chem,2013,288(35):25340-25349.
[8]Kontos CK,Fendri A,Khabir A,etal.Quantitative exPression analysis and Prognostic significance of the Bcl-2-associated X gene in nasoPharyngeal carcinoma: a retrosPective cohort study[J]. BMC Cancer,2013,13:293.
[9]张强,熊婷,张其梅,等.缺血后适应对大鼠脑缺血再灌注损伤Bcl-2和Bax蛋白表达的影响[J]. 细胞与分子免疫学杂志,2011,27(3):329-330.
[10]燕景峰,岳长波. BDNF基因修饰神经干细胞移植治疗脊髓损伤的实验研究[J]. 中国临床神经外科杂志,2006,11(9):547-550.
[11]路艳,陈莹,李宗斌,等.老龄大鼠心脏缺血预处理后热休克蛋白27的变化研究[J]. 中国全科医学,2011,14(12):1308-1310.
Bcl-2 gene-modified neural stem cell transplantation for spinal cord injury in rats
ZHANG Mei1,WANG Yue-xin1*,HOU Xiao-hua1,HONG Jun1,YIN Sheng-chun1,LI Yan1,LIU Qing-yang2
(1. Tangshan Worker’s Hospital,Tangshan 063000,China;2.Coal General Hospital,Beijing 100028,China)
ObjectiveTo investigate the bcl-2 gene modification on neurological function recovery in rats with spinal cord injury in neural stem cell transplantation. Methods Cultured rat neural stem cells by Ad-EGFP as vector-mediated side B-cell lymphoma 2 gene (bcl-2) gene transfection of neural stem cells were divided into 3 groups: control group, negative transfection group, bcl-2 transfection group. Use western-blot to detect the expression of bcl-2 protein in neural stem cells before and after transfection. 85 adult female SD rats, successful model 72, were randomly divided into control group, NSCs group, bcl-2-NSCs groups, 24/group, rat acute spinal cord injury model in accordance with a modified Allen’s method. Assess the motor function by BBB rating and the swash plate test. 7 days after modeling by RT-PCR and Western blot detection of spinal cord injury around HSP27, c - fos gene expression, TUNEL assay apoptosis. Four weeks after model drawn line HE staining and fluorescence microscopy EGFP-labeled NSC survival and distribution of the rats neurophysiological recovery by SEP and MEP.Resultsbcl-2 gene transfection of rat neural stem cells, bcl-2 transfection group and control group, negative transfection group compared to bcl-2 mRNA and protein levels were expressed (P< 0.05); lower extremity motor function in rats evaluation of bcl-2-NSCs group than NSCs group, NSCs group than the control group. 72 hours after modeling, bcl-2-NSCs number of apoptotic cells were significantly lower than the control group and NSCs group (P< 0.05). 7 days after modeling, compared with the control group and NSCs group, bcl-2-NSCs group HSP27 gene and protein expression was significantly higher than that (P< 0.05), bcl-2-NSCs group c-fos mRNA and protein expression was significantly reduced compared (P< 0.05). 4 weeks after modeling, HE staining control group showed spinal cord tissue loss and the formation of syringomyelia, no axonal through. NSCs group damage zone few of neuraxis-like structures, syringomyelia smaller, bcl-2-NSCs group showed more nerve axon-like structure, no syringomyelia. EGFP-positive cells labeled: bcl-2-NSCs group the most, NSCs group followed, no control group, and the difference between the groups was statistically significant (P< 0.05). After the 4th week, SEP and MEP latency period: bcl-2-NSCs group
Spinal cord injury;Bcl-2 gene; Modification; Neural stem cells;Transplantation;Repair;Rat;Nerve function
唐山市科技计划项目(15130254a)。
张梅(1980-),女,本科,研究方向:脊柱脊髓损伤及其护理。E-mail:zhangmeiwang1@163.com。
王跃新(1979-),男,硕士,研究方向:脊髓脊柱损伤。E-mail:m13102643830@163.com。
研究报告
R-332
A
1671-7856(2016)07-0035-07
10.3969.j.issn.1671-7856.2016.07.006
2016-01-12

