MicroRNA-137与AngⅡ在自发性高血压大鼠心脏重构中的作用
侯永兰,李石林,刘玲玲
(河南省新乡市中心医院心内一科,河南 新乡 453000)
MicroRNA-137与AngⅡ在自发性高血压大鼠心脏重构中的作用
侯永兰*,李石林,刘玲玲
(河南省新乡市中心医院心内一科,河南 新乡453000)
目的探讨微小核糖核酸 195(MicroRNA-137,miRNA-137)、TGF-β1/Smads信号转导通路及血管紧张素Ⅱ(AngⅡ)在自发性高血压大鼠(SHR)心脏重构中的作用。方法取雄性SHR大鼠16只,随机分为SHR干预组(卡托普利10 mg/kg·d)和SHR 对照组(蒸馏水)各8只,另取Wistar大鼠8只为正常对照组, 分别给予SHR大鼠卡托普利10 mg/kg·d和蒸馏水灌服,共持续8周。造模前后测大鼠尾动脉血压,8 周后股动脉放血处死大鼠,HE 染色观察大鼠心脏形态学改变,实时荧光定量多聚酶链式反应(qRT-PCR)法检测大鼠心脏中 miRNA-137 的表达,Western-blot 检测转化生长因子β1(transforming growth factor beta1,TGF-β1)、血管紧张素Ⅱ(AngⅡ)、Smad蛋白3(small mother against decapen-taplegic protein three,Smad3)、I 型胶原(Col-Ⅰ)和Ⅲ型胶原(Col-Ⅲ)蛋白表达水平。结果SHR大鼠心脏miRNA-137、AngⅡ、TGF-β1、Smad3、Col-Ⅰ及 Col-Ⅲ的表达量均高于 Wistar 大鼠(P< 0.01 或P<0.05),SHR 干预组大鼠心肌细胞较 SHR 对照组明显变小,细胞排列较其紧密有序,miRNA-137、AngⅡ、TGF-β1、Smad3、Col-Ⅰ及Col-Ⅲ表达量均明显降低(P< 0.01 或P< 0.05)。结论miRNA-137可能通过上调 AngⅡ及TGF-β1/Smads信号转导通路促进SHR心脏重构;卡托普利干预可抑制 miRNA-137表达。
心脏重构; miRNA-137; 自发性高血压大鼠; TGF-β1/Smads信号通路
高血压等疾病是心内科最为常见的疾病,长期的高血压,心肌缺血会引起动脉硬化和心肌纤维化,对心肌功能影响甚大[1-2]。近年来发现,微小核糖核酸(microRNA)通过对基因转录后调控而介导了一系列的基因表达调控方式。已有研究证实miRNA 参与动脉硬化和心肌纤维化等一系列病理过程[3-4]。miRNA-137为microRNA重要成员之一,近年来,多种研究提示其与心肌重构关系密切,可能成为高血压、缺血性心脏病等疾病的一个新的治疗靶点[5]。目前对于miRNA-137在心血管重构中的作用及机制尚未完全清。MicroRNA-137在 SHR大鼠心脏重构中的作用及其机制,及卡托普利干预对自发性高血压大鼠(spontaneously hypertensive rats,SHR)大鼠心脏形态结构及表达心血管重构相关因子的影响。现报道如下。
1 材料和方法
1.1实验动物
8周龄雄性 SHR 16只和Wistar 大鼠8只,均购自上海交通大学医学院实验动物中心[SCXK(沪) 2013-0013],体重(215~245)g,所有大鼠均在新乡市中心医院动物实验室[SYXK(豫) 2011-0076]的清洁环境下饲养观察,室温20℃~24℃,普通饲料适应性喂养1周后使用。按实验动物使用的“3R”原则给以人道主义关怀。
1.2主要试剂及仪器
Trizol和Lipofectamine2000转染试剂(Invitrogen公司);10×Annealing Buffer、蛋白裂解液和SDS-PAGE凝胶配置试剂盒购(上海碧云天生物技术公司);ABI-7500型实时定量PCR仪(美国ABI 公司);PVDF膜和蛋白发光液(美国Millipore公司);miR-137 inhibitor和其对照剂(上海GenePharma有限公司);DMEM培养基和胎牛血清(美国Hyclone公司);TGF-β1 一抗、AngiotensinⅡ一抗、Smad3 一抗、CollagenⅠ一抗、CollagenⅢ 一抗、二抗(美国Assay Biotechnology公司);ALC-NIBP型无创大鼠血压心率测定仪(上海奥尔科特生物科技有限公司);卡托普利片(中美上海施贵宝制药有限公司,国药准字H20084569);ZH06-T16型大鼠灌胃针(中西集团);RM2155 型超薄石蜡切片机(德国LEICA公司);AllegraTM 64R台式低温高速离心机(德国Beckman公司);Image Pro plus病理图像分析软件(美国Media Cybernetics公司)。
1.3动物分组
雄性SHR大鼠16只,随机分为SHR干预组(卡托普利10 mg/kg·d)和SHR 对照组(蒸馏水)各8只,另取Wistar大鼠8只为正常对照组, 分别给予SHR大鼠卡托普利(中美上海施贵宝制药有限公司)10 mg/kg·d和蒸馏水灌服,共持续8周。
1.4实验方法
1.4.1血压测定及心脏样本获得
各组大鼠于干预前及干预 8 周后处死前测量鼠尾动脉血压,采用无创大鼠血压心率测定仪(ALC-NIBP,上海奥尔科特生物科技有限公司)按照仪器说明书的要求测定大鼠安静清醒状态下鼠尾动脉收缩压与舒张压(mmHg)。大鼠处死后立即取出心脏,分离室间隔和左心室游离壁,剪成小块,取部分左心室游离壁,常规脱水,石蜡包埋,HE 染色,待病理学检测。其余组织在-80℃冰箱冷冻保存。
1.4.2Western-Blot检测TGF-β1、AngⅡ、Smad3、Col-Ⅰ、Col-Ⅲ 蛋白表达水平
提取大鼠心脏组织的总蛋白,根据测定的蛋白浓度算出上样蛋白量,保证各组总蛋白量一致,在 100℃加热 10 min 以使蛋白质变性。电泳,将蛋白转移至 PVDF 膜,5%的脱脂奶粉封闭2 h,加入TGF-β1、AngⅡ、Smad3、Col-Ⅰ、Col-Ⅲ 等一抗,4℃孵育过夜,选择TGF-β1、AngⅡ、Smad3、Col-Ⅰ、Col-Ⅲ 等酶标二抗和稀释浓度,孵育1 h,洗膜后化学发光,得到胶片,拍照,阳性条带以Gel-pro4.0软件分析显影条带。
1.4.3Real-time PCR检测miRNA-137表达水平
根据其mRNA 序列,设计引物。miRNA-137引物:上游:5′ -AAT CAC ACT ACA ATC GGG CTC-3′;下游:5′ -CAT CTT CCT CCT TTC TCG ATT-3′;产物长度:256 bp。扩增产物2% , 琼脂糖凝胶电泳, 凝胶分析系统测定各条带积分光密度值。采用2-ΔΔCt 方法对实时定量 PCR 结果进行分析, 显示miRNA-137 RNA 的表达。
1.5统计学方法

2 结果
2.1干预前组间大鼠尾动脉血压比较
干预前,与SHR对照组比较,SHR干预组大鼠尾动脉收缩压及舒张压差别无统计学意义(P> 0.05)。干预8周后,与SHR对照组相比,SHR干预组大鼠尾动脉的收缩压与舒张压降低更明显(P< 0.05),两组与正常组相比,差异有统计学意义(P< 0.01,表1)。

表1 卡托普利干预前后组间大鼠尾动脉血压比较± s,mmHg)
注:a 为P<0.05,b 为P<0.01,与正常对照组比较;c 为P<0.01,与 SHR 对照组比较。
Note. a:P< 0.05, b:P< 0.01, compared with the normal control group; c:P< 0.01, compared with the SHR control group.

注:(A)正常对照组;(B)为SHR对照组;(C)为SHR干预组。图1 各组心脏组织形态学比较(×40)Note.(A)normal control group;(B)SHR control group;(C)SHR intervention group.Fig.1 Comparison of cardiac tissue morphology
2.2大鼠心脏形态结构比较
SHR对照组大鼠心肌细胞数量减少,排列疏松、紊乱,细胞肥大,胞核变圆畸形,SHR干预组大鼠心肌细胞体积变小,数量增加,细胞排列较紧密有序,而正常对照组大鼠心肌细胞形态正常,排列紧密有序,细胞核无畸形(图1)。
2.3心脏 miRNA-137 表达比较

注:(1)正常对照组;(2)SHR 对照组;(3)SHR 干预组。a:P <0.01,与正常对照组比较;b:P <0.01,与 SHR 对照组比较。图2 干预后组间大鼠心脏 miRNA-137 表达量Note.(1)normal control group;(2)SHR control group;(3)SHR intervention group. a:P < 0.01, compared with the normal control group; b:P < 0.01, comparedwith the SHR control group.Fig.2 miRNA-137 expression levels of cardiac in the rats after intervention
和SHR 对照组相比,SHR干预组大鼠心脏表达miRNA-137升高幅度较低(P< 0.01,见图2),两组miRNA-137表达都较正常对照组升高(P< 0.01)。2.4AngⅡ蛋白表达比较
和SHR 对照组相比,SHR干预组大鼠心脏表达AngⅡ蛋白表达升高幅度较低,两组AngⅡ蛋白表达都较正常对照组升高(P< 0.01,图3)。
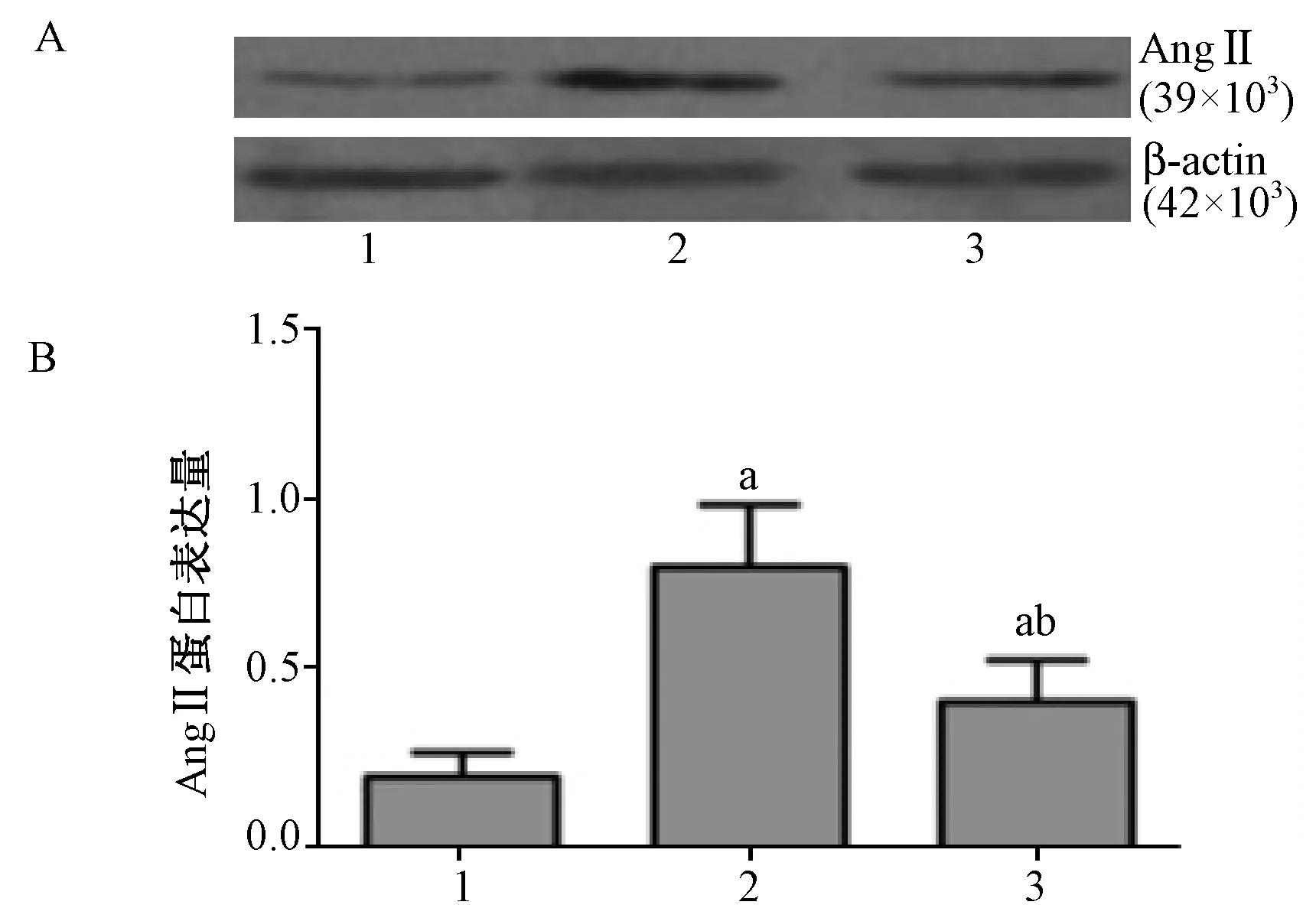
注:(A)Westen-bolt检测AngⅡ蛋白表达情况;(B) 干预后组间大鼠心脏 AngⅡ蛋白表达分析图。(1) 正常对照组,(2) SHR 对照组,(3) SHR 干预组。 a:P < 0.01,与正常对照组比较;b:P <0.01,与 SHR 对照组比较。图3 干预后组间大鼠心脏 AngⅡ蛋白表达量Note. (A)The expression of proteins AngⅡ determined by Western-blot analysis;(B) AngⅡprotein expression levels of Expression analysis.(1)normal control group; (2)SHR control group;(3)SHR intervention group.a:P < 0.01, compared with the normal control group; b:P < 0.01, compared with the SHR control group.Fig.3 AngⅡprotein expression profiles levels of cardiac in the rats after intervention
2.5TGF-β1/Smad3 蛋白表达比较
和SHR 对照组相比,SHR干预组大鼠心脏表达TGF-β1/Smad3蛋白和Col-Ⅰ/ Col-Ⅲ 蛋白表达升高幅度较低,两组TGF-β1/Smad3蛋白和Col-Ⅰ/ Col-Ⅲ 蛋白表达都较正常对照组升高(P< 0.01,图4)。

注:(A) Westen-bolt检测TGF-β1/Smad3蛋白表达情况;(B) 干预后组间大鼠心脏 TGF-β1/Smad3蛋白分析图。(1)正常对照组,(2)SHR 对照组,(3) SHR 干预组。a: P <0.01,与正常对照组比较;b:P<0.05,与 SHR 对照组比较。图4 干预后组间大鼠心脏 TGF-β1/Smad3 蛋白表达量.Note: (A) The expression of proteins TGF-β1/Smad3 determined by Western-blot analysis;(B) ATGF-β1/Smad3 protein expression levels of Expression analysis. (1)normal control group;(2)SHR control group;(3)SHR intervention group.a:P < 0.01, compared with the normal control group; b:P < 0.01, compared with the SHR control group.Fig.4 TGF-β1/Smad3 protein expression levels of cardiac in the rats after intervention
3 讨论
高血压是冠心病的主要危险因素之一 长期的高血压,心肌缺血会引起动脉硬化和心肌纤维化,严重的影响了患者的生活质量[6]。miRNA为非编码RNA,通过调节相关基因的表达,参与体内一系列生理病理过程[7]。已有研究证明,miRNA与心肌细胞的增殖分化密切相关[8]。近年来,miRNA在心肌缺血和心肌重构发生中的作用引起高度重视。
Liu等[9]科学家研究结果表明,miR-195与甲基化的CpG结合蛋白-1结合,负反馈调节心肌细胞的纤维化过程。此外,Zhao等[10]研究者报道miR-9亦能影响心肌细胞的增殖与分化,其作用靶点与TLX密切相关。研究新发现miR-97a通过TLX和周期蛋白D1调控心肌细胞增殖和分化[11]。然而,miRNA在心肌重构中的调节作用有待进一步研究。本实验的设计是为了探讨miRNA-137在心肌重构中的影响,使之成为高血压、缺血性心脏病等疾病的一个新的治疗靶点。
RAAS在高血压致心肌纤维化的发病机制中倍受关注。研究显示,TGF-β 是重要的致纤维化的细胞因子,其中TGF-β1是作用最强的一种[12]。研究显示,TGF-β1在体内可明显减轻全身及局部炎症反应。其表达上调可促进心肌重构。血管紧张素Ⅱ(AngⅡ)是生物活性最强的效应肽,AngⅡ发挥作用的一个重要途径就是通过调节 TGF-β1 的表达[13]。AngⅡ通过激活细胞内的MAPK家族而引起 TGF-β1 等细胞因子分泌和细胞外基质(如 Col-Ⅰ和 Col-Ⅲ)的表达增加[14]。本研究发现,卡托普利能有效减轻心室肥大,抑制成纤维细胞增殖及细胞外基质分泌增加,降低血压,逆转高血压所致的心血管重构。在本研究中,造模成功后的SHR干预组,其血压明显降低,HE 染色可见其心肌细胞数量增加,细胞体积变小,细胞排列较有序,证实卡托普利干预可以逆转高血压所致的心脏结构重构。
本研究结果显示, SHR 在未进行干预的情况下,其收缩压和舒张压显著升高,心肌细胞数量减少,排列紊乱,细胞肥大,胞核变圆畸形,证实 SHR心脏存在典型的高血压心脏重构的特征性改变。在本研究中,SHR对照组表达Col-Ⅰ/Col-Ⅲ 等蛋白表达均升高,与正常对照组大鼠相比,差异具有统计学意义。说明 AngⅡ、TGF-β1、Smad3 在 Col-Ⅰ和Col-Ⅲ表达中起着正性的调节作用。与Duisters 等[14]研究结果相类似。
此外,本研究中未用药物干预的SHR 大鼠心脏表达 miRNA-137 也显著升高,并且达到了血压正常的正常对照组大鼠心脏表达量的4 倍以上,并显示出与 AngⅡ、TGF-β1、Smad3、Col-Ⅰ和Col-Ⅲ 蛋白表达同向性的特征,且Kawano[15]的研究显示,特异高表达心脏 miRNA-137 可诱发心肌细胞肥大,结合SHR大鼠与人类同样的高血压发生机制,我们可以推测在高血压状态下,由于肾素-血管紧张素-醛固酮系统的激活,激活一系列细胞因子,通过 TGF-β1/Smad 通路转导,使细胞外基质 Col-Ⅰ和 Col-Ⅲ大量增生和过度积聚,最终造成心肌顺应性下降,发生病理性重构[6]。
综上所述,本研究提示,卡托普利通过抑制miRNA-137的表达而下调了TGF-β1/Smad 通路的转导,最终抑制了 Col-Ⅰ和 Col-Ⅲ 蛋白的表达,进而抑制了成纤维细胞增殖,抑制了SHR大鼠的心脏重构。本研究将对高血压引起的心脏重构的发生机制和治疗策略上提供新的研究方向,为miRNA-137作为心脏重构的治疗靶点提供实验基础和理论依据,具有重要的临床意义[17-18]。
[1]Latronico MV,Condorelli G. microRNAs in hypertrophy and heart failure[J]. Exp Biol Med (Maywood),2011,236(2):125-131.
[2]Bauersachs J. Regulation of myocardial fibrosis by microRNAs[J]. J Cardiovasc Pharmacol,2010,56 (5):454-459.
[3]Filipowicz W,Bhattacharyya SN,Sonenberg N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight? [J]. Nat Rev Genet,2008,9(2):102-114.
[4]Olena AF,Patton JG. Genomic organization of microRNAs[J]. J Cell Physiol,2010,222(3):540-545.
[5]Van RE,Olson EN. Searching for miR-acles in cardiac fibrosis[J]. Circ Res,2009,104(2):138-140.
[6]魏聪,胡兵,申锷. MicroRNAs 在心脏发育和疾病中的作用[J]. 中国病理生理杂志,2011,27(3):611-615.
[7]Dobaczewski M,Chen W,Frangogiannis NG. Transforming growth factor (TGF)-β signaling in cardiac remodeling[J]. J Mol Cell Cardiol,2011,51(4):600-606.
[8]Creemers EE,Pinto YM. Molecular mechanisms that control interstitial fibrosis in the pressure-overloaded heart[J]. Cardiovasc Res,2011,89(2):265-272.[9]Liu, Z.Q. Teng, A.L. McQuate,etal. An epigenetic feedback regulatory loop involving microRNA-195 and MBD1 governs neural stem cell differentiation[J].PLoS One,2013,22(8): e51436.
[10]C. Zhao, G. Sun, S. Li,etal. A feedback regulatory loop involving microRNA-9 and nuclear receptor TLX in neural stem cell fate determination[J]. Nat Struct Mol Biol, 2009,16(5)365-371. [11]C. Zhao, G. Sun, S. Li,etal. MicroRNA let-7b regulates neural stem cell proliferation and differentiation by targeting nuclear receptor TLX signaling[J]. Proc Natl Acad Sci U S A,2010, 107 (5) 1876-1881.[12]Shan H,Zhang Y,Lu Y,etal. Downregulation of miR-133 and miR-590 contributes to nicotine-induced atrial remodelling in canines[J]. Cardiovasc Res,2009,83(3):465-472.
[13]Small EM,Thatcher JE,Sutherland LB,etal. Myocar-din-related transcription factor-a controls myofibroblast activation and fibrosis in response to myocardial infarction[J]. Circ Res,2010,107(2):294-304.
[14]Duisters RF,Tijsen AJ,Schroen B,etal. miR-133 and miR-30 regulate connective tissue growth factor: implications for a role of microRNAs in myocardial matrix remod-eling[J]. Circ Res,2009,104(2):170-178.
[15]Kawano H,Do YS,Kawano Y,etal. AngiotesinⅡhas multiplepior brothic effects in human cardiac fibroblasts[J]. Ciroulation,2000,10(1): 1130-137.[16]Castro-Chaves P,Cerqueira R,Pintalhao M,etal. New pathways of the renin-angiotensin system :the role of ACE2 in cardiovascular pathophysiology and therapy[J]. Expert Opin Ther Targets,2010,14(5): 485-496.[17]张振辉,黎佼,刘本荣,等. 过表达 miR-29a 对大鼠心肌细胞凋亡的影响[J]. 中国动脉硬化杂志,2012,20 (12) :1079-082.[18]陆细红,邓敏,贺洪辉,等. miR-125b 通过靶向抑制 Smad4调控骨髓间充质干细胞成骨分化[J]. 中南大学学报(医学版),2013,38(4) : 341-346.
Effects of MicroRNA-137 and AngⅡ on cardiac remodeling in spontaneously hypertensive rats
HOU Yong-lan*,LI Shi-lin, LIU Ling-ling
(Department of Cardiology, Xinxiang Central Hospital,Xinxiang 453000,China)
ObjectiveTo investigate the role of small RNA 195 (MicroRNA-137), TGF-β1/Smads signal transduction pathway and angiotensin II (Ang II) in cardiac remodeling in spontaneously hypertensive rats (SHR). Methods16 SHR male rats were randomly divided into intervention group SHR (captopril 10 mg/kg·d) and SHR control group (distilled water) , the other 8 Wistar rats were normal control group, rats were given captopril 10 mg/kg·d or distilled water for 8 weeks. Caudal arterial pressure was measured before and after the intervention, intervention after 8 weeks rats were killed by exsanguination, HE staining was used to observe the morphological changes of rat heart, qRT-PCR method was used to detect the expression of miRNA-137 in rat heart, Western-blot detection of TGF-β1 and Ang II, Smad 3, Col-Ⅰand Col-Ⅲ protein. ResultsCompared to the normal control groups,the miRNA-137,AngⅡ,TGF-β1,Smad3,Col-Ⅰand Col-Ⅲ were higher expressed in SHR treatment group and SHR control groups(P<0.01 orP<0.05); Compared to the SHR control group,the cardiomyocyte of SB group becomes smaller and arranged more closely and orderly,the miRNA-137,AngⅡ,TGF-β1,Smad3,Col-Ⅰand Col-Ⅲ were significantly lower expressed(P<0.01 orP<0.05). ConclusionsMiRNA-137 may promote SHR cardiac remodeling by up regulation of Ang II and TGF-β1/Smads signaling pathway; the captopril intervention can inhibit miRNA-137 expression.
Heart Remodeling; miRNA-137; SHR; TGF-β1/Smads signaling pathway
侯永兰(1980-)女,硕士研究生,主治医师,研究方向:高血压,冠心病,心力衰竭的药物治疗,心律失常的介入治疗等。E-mail:houyonglan62@163.com。
研究报告
R-332
A
1671-7856(2016)07-0052-05
10.3969.j.issn.1671-7856.2016.07.009
2016-01-11

