丙泊酚干预对大鼠视神经损伤的影响及机制研究
李学东,陈家康,覃 军,麦用军,肖振勇
(柳州市工人医院,广西 柳州 545000)
丙泊酚干预对大鼠视神经损伤的影响及机制研究
李学东,陈家康*,覃军,麦用军,肖振勇
(柳州市工人医院,广西 柳州545000)
目的探讨大鼠视神经损伤后丙泊酚干预对损伤视神经及视网膜神经节的影响及机制。方法SD大鼠 67只,随机取20只为正常组,不予任何处理。余行视神经钳夹法造模,造模成功42只纳入实验。随机分为:模型对照组和丙泊酚组,各21只/组。造模后4 d, 以TUNEL法检测大鼠视网膜和视神经细胞凋亡,造模后7 d, RT-PCR、Western-blot检测视网膜和视神经节细胞组织 Caspase-3、BCL-2基因和蛋白表达。造模后14 d,行闪光视觉诱发电位检测,处死大鼠取眼球,观察各组大鼠视网膜和视神经的病理形态,行视网膜神经节细胞计数。结果 造模后4 d,丙泊酚组视网膜神经节细胞凋亡数量明显低于模型对照组(P< 0.05),造模后7 d与模型对照组相比,丙泊酚组 Caspase-3的表达显著降低(P< 0.05);BCL-2的表达显著升高(P< 0.05)。造模后14 d,荧光金阳性RGC数:模型对照组最少,丙泊酚组较多,正常组最多,且各组之间差异有统计学意义(P< 0.05)。丙泊酚组大鼠闪光视觉诱发电位伏期较模型对照组大鼠短(P< 0.05)、波幅明显高于模型对照组(P< 0.05)。结论丙泊酚干预通过减少大鼠视神经钳夹后RGCs的凋亡,降低视网膜Caspase-3的表达,升高BCL-2的表达,对视神经损伤起到保护作用。
大鼠;视神经损伤;丙泊酚; 视网膜神经节细胞;Caspase-3;BCL-2
视神经损伤发病率逐年增高,可能是交通事故发生率上升所致。视神经损伤导致的患者不可逆的视力丧失明显增多,给患者的生活带来极大的痛苦和不便[1-2]。属于中枢神经系统的视神经及神经节细胞损伤后具有修复和再生困难的特点。视神经损伤早期采取有效手段进行干预,以挽救损伤的视神经和神经节细胞意义重大。近年来,丙泊酚在中枢神经系统损伤的康复治疗过程中的应用也越来越受到临床及科研工作者的重视[3-4]。研究表明丙泊酚对脑缺血再灌注损伤有较强的保护作用,对多种细胞的凋亡均有一定的的抑制作用。它能突显大鼠脑缺血再灌注时TNF的抑制作用。同时丙泊酚具还具有作用时间短、苏醒完全而迅速、起效快、持续输注后无蓄积等优点。目前已有研究表明丙泊酚对损伤的视神经及视网膜亦有一定的保护作用[5-6],然而丙泊酚治疗是怎样改善视神经损伤区及视网膜的微环境,进而起到保护视神经的作用的,具体保护效果如何,仍需进一步探讨。
1 材料和方法
1.1实验动物
清洁级SD 雌性大鼠67 只, 1月龄,体重(250~270)g购于广西医科大学实验动物中心[SCXK(桂)20090006];动物饲养于柳州市工人医院标准动物饲养室[SYXK(桂)20100014]。所有大鼠均在 12 h明光 ( 7 : 00~19 : 00) /12 h暗光、 温度为22℃~25℃ 的环境下饲养。按实验动物使用的“3R”原则给以人道主义关怀。
1.2主要试剂与仪器
GAPDH、 Caspase-3、BCL-2兔抗大鼠多克隆抗体(美国Sigma公司);耐热性TaqDNA 聚合酶、RT-PCR试剂盒(TaKaRa公司);M-MLV逆转录酶(美同Promega 公司产品);100 bPDNA ladder (华美生物工程公司);荧光金(美国 Biotium 公司);TUNEL凋亡试剂盒(德国Roche公司);丙泊酚(20 mL:200 mg乐山裕恒药业有限公司);BCL-2和 Caspase-3物根据Genebank资料,利用Primer 5.0引物设计软件确定最优引物,然后经Blast匹对,由上海生工生物有限公司合成;眼科手术显微镜(上海轶德医疗设备有限公司);立体定位仪 (日本成茂);眼科视觉电生理仪 (德国 Roland 公司);血管夹(创生医疗器械有限公司);光学显微镜(奥林巴斯公司)。
1.3实验方法
1.3.1视神经损伤大鼠造模及丙泊酚干预
依据参考文献采用目前国内外最常用的视神经夹挫伤模型造模[7],67只大鼠眼部经裂隙灯和检眼镜检查屈光间质清晰,眼底无病变。随机取20只大鼠为正常组,不予任何处理。余47只进行视神经钳夹法造模(右眼),过程如下:10%的水合氯醛腹腔注射麻醉后(0.3 mL/kg),乙醇消毒右眼上睑后,垂直于睑缘方向剪开。于上方巩膜缘处将大鼠球结膜剪开,钝性分离。眼球向下方牵拉后,钝性分离肌锥,避免血管损伤,逐渐暴露出视神经。于球后2.5 mm 处动脉瘤夹持视神经6 s。观察术眼瞳孔散大且无视网膜出血,逐层缝合后于结膜囊内及上眼睑涂红霉素眼膏。大鼠清醒后,观察术眼出现瞳孔散大,眼底无视网膜出血,且大鼠无眼球突出及眼睑闭合不全,表明造模成功,纳入实验。5只大鼠造模失败,予以剔除,余42只纳入实验。将其随机分为:模型对照组21 只,丙泊酚组21 只。模型对照组大鼠无治疗,常规饲养,丙泊酚组大鼠造模后4 h予以丙泊酚治疗,通过尾静脉留置针泵注丙泊酚注射液(2 mL/kg/h) 持续4 h,连续治疗2 d。
1.3.2凋亡细胞检测
造模后第4天各组大鼠分别随机取5只, 按前述方法麻醉满意后剖胸,行左心室主动脉插管, 以4%的多聚甲醛灌流进行固定。摘取眼球作石蜡切片,TUNEL法检测计数,按德国Roche公司试剂盒购操作。待水化、37℃条件下蛋白酶K消化10 min,行标记液标记后, 37℃下,经生物素化的地高辛反应30 min,加SABC,DAB显色。封片,损伤区周围随机选取不重复的6个高倍视野,对胞核含棕黄色颗粒的细胞计数。
1.3.3RT-PCR检测
造模后第7天各组大鼠分别随机取5只, 迅速取出右眼眼球,分离出视网膜,以Trizol说明书法提取视网膜的总RNA,总RNA含量测定采用紫外分光光度计法,用RT~PCR两步法试剂盒(TaKaRa公司)将mRNA逆转录成cDNA,接着再将cDNA行PCR扩增。用以下引物见表1,取扩增产物行电泳,电泳结果通过凝胶图像分析系统进行光密度分析,计算BCL-2, Caspase-3与GAPDH的光密度积分的比值,作为BCL-2,Caspase-3 mRNA表达的指标。
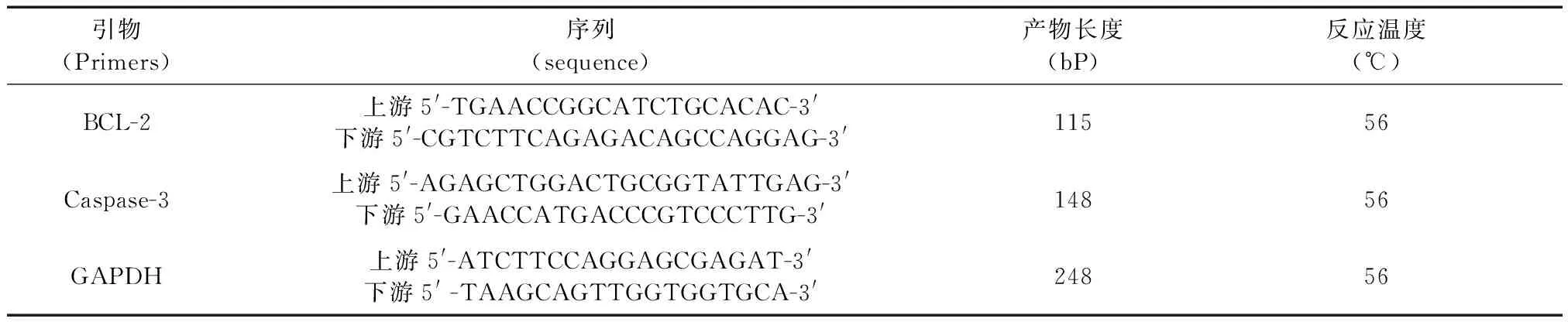
表1 引物序列
1.3.4Western-blot检测
RT-PCR提取后的剩余物经1500 r/min,离心30 min后,取上清为粗体蛋白, Bradford法测定总的蛋白浓度。5%浓缩胶40 V衡压1 h,10%分离胶60 V恒压3.5 h,湿转14 V恒压14 h,37℃摇床封闭2 h,洗膜10 min,3次,兔抗鼠抗体Caspase-3或BCL-2(1∶800)4℃ 过夜;抗鼠GAPDH(1∶1000)4℃过夜。TBST洗膜5 min×4次,山羊抗兔抗体1∶700,37℃摇床孵育1.5 h,TBST洗膜5 min×4次。再次运用TBS洗膜10 min后DAB显色,按Quantity one图像进行分析研究,Caspase-3、BCL-2与GAPDH的灰度积分的比值进行分析,作为Caspase-3、BCL-2蛋白表达的量。
1.3.5逆行荧光金标记
造模后第9天各组大鼠分别随机取5只, 按前述方法麻醉满意后,立体定位仪固定(日本成茂)大鼠的头部,正中纵行切开头皮,分离皮下组织,暴露颅骨, 以前颅为标志用手持式电动骨钻在颅骨表面相应位置(前颅后方6.0 mm,旁开1.4 mm,深度4.0 mm)钻开颅骨并暴露硬脑膜,于每点各注射3%的荧光金3 μL。造模后14天,以颈椎脱臼法处死每组经荧光金标记的大鼠,迅速取出右眼眼球,将眼球于4%多聚甲醛磷酸中固定2 h,生理盐水冲洗,将其眼前节和玻璃体去除,将眼杯剪开放射状切口4个,使其视网膜剥离,将分离后的视网膜于载玻片上平铺,玻璃体面朝上。在空气中自然干燥后,待视网膜加盖玻片并滴荧光增强剂进行封片。使用荧光显微镜与距离视乳头中心2 mm 处,分别上下左右各拍摄一张照片,并代表4个象限的RGC情况。本研究经盲态人工RGC进行计数测量。
1.3.6闪光视觉诱发电位检查
参照ISCEV标准[8],并且使用Roland视觉电生理检查仪(德国),各组随机取5只大鼠于夹伤后第14天进行F-VEP 检查。10%的水合氯醛腹腔注射麻醉后(0.3 mL/kg),大鼠皮肤备皮后,安尔碘消毒,将电极银针刺入皮下,两耳尖连线中点处为记录电极,右眼同侧颊部处为参考电极,置右侧耳郭为地电极, 阻抗标准5 Ω以下,经适应15 min后,左眼完全被不透光黑眼罩遮盖,通过电生理仪,LED 眼罩闪烁刺激,光强:3.93 cd/m2,频率:1.9 Hz,通频带宽:1~100 Hz,分析时间:250 ms,叠加:100次,连续测量5次。取均值为闪光视觉诱发电位 P1的波幅及潜伏期。
1.3.7视网膜病理组织学观察
以上检测均完成后,剩余大鼠以颈椎脱臼法处死,摘出整个眼球及5 mm长的视神经,向眼球中注射少量固定液后于FAA固定液中固定48 h,经梯度乙醇脱水后,剪开眼球前段去掉晶状体后,二甲苯透明处理,石蜡行定向包埋,行视网膜冠状面连续4 μm切片,常规HE染色,光镜观察。
1.4统计方法
2 结果
2.1TUNEL检测细胞凋亡
凋亡神经细胞的细胞核内可见特异性棕黄色颗粒,光镜下可见正常组视网膜均未见棕黄色颗粒着染的RGCs(图1A);模型对照组可见较多棕黄色颗粒着染的RGCs(白箭所指)((图1B );丙泊酚组可见少量的棕黄色颗粒着染的RGCs,其数量较模型对照组少(图1C)。具体见表2,经两两比较后,差异显著(P< 0.01)。
2.2Caspase-3、BCL-2 基因表达
结果 (图2,表3 )显示视神经造模损伤后第7天,丙泊酚组大鼠视网膜的Caspase-3基因表达较正常组高,BCL-2 基因表达较正常组低,差异有显著性意义(P< 0.05);视网膜Caspase-3基因的表达丙泊酚组与模型对照组相比明显降低,BCL-2基因的表达明显升高,差异有显著性意义(P< 0.05)。2.3Caspase-3、BCL-2 Protein 表达
结果 (图3、表3) 显示视神经造模损伤后第7天,丙泊酚组大鼠视网膜的Caspase-3 蛋白因表达较正常组高,BCL-2 蛋白表达较正常组低,差异有显著性意义(P< 0.05);视网膜Caspase-3蛋白的表达丙泊酚组与模型对照组相比明显降低,BCL-2蛋白的表达明显升高,差异有显著性意义(P< 0.05)。
2.4大鼠FG阳性RGCs计数
三组大鼠的平均FG阳性RGCs数有显著差异(P<0.05)。正常对照组FG阳性RGCs数均较丙泊酚组和模型对照组多(P<0.05),丙泊酚组FG阳性的RGCs数较模型对照组多(P<0.05)。模型对照组视网膜组织FG阳性RGCs计数(图4A,红箭所指);丙泊酚组视网膜组织FG阳性RGCs计数(图4B,红箭所指);正常组视网膜组织FG阳性RGCs计数(图4C,红箭所指),具体见表2,各组间比较均有统计学意义(P< 0.05)。
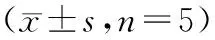
表2 各组大鼠TUNEL细胞凋亡及FG阳性RGCs计数
注:与模型对照组相比,*P< 0.05;与正常组相比#P< 0.05。
Note.Compared with the model control group,*P< 0.05 compared with the normal group#P< 0.05.
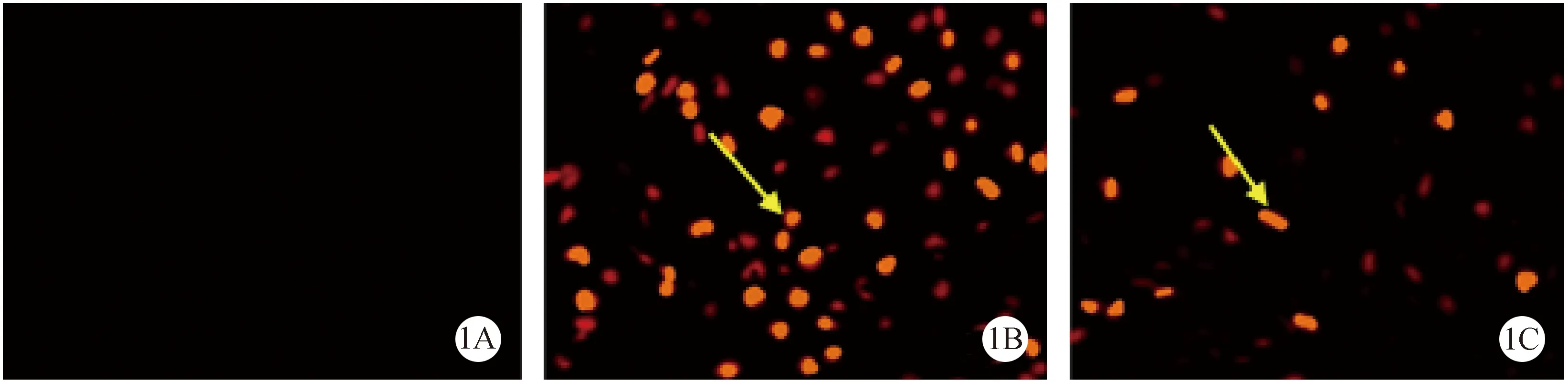
注:(1A)正常组;(1 B)模型对照组;(1 C)丙泊酚组。图1 TUNEL检测各组细胞凋亡(×20)Note.(1A)Normal group;(1B)Model control group;(1C)Propofol group.Fig.1 TUNEL staining of each group
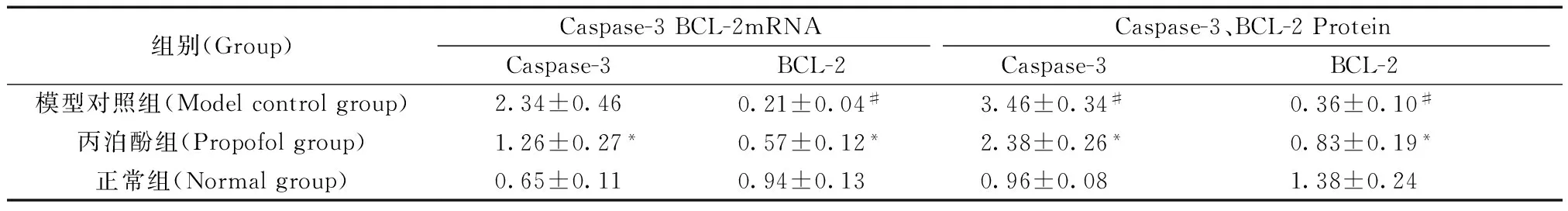
组别(Group)Caspase-3BCL-2mRNACaspase-3、BCL-2ProteinCaspase-3BCL-2Caspase-3BCL-2模型对照组(Modelcontrolgroup)2.34±0.460.21±0.04#3.46±0.34#0.36±0.10#丙泊酚组(Propofolgroup)1.26±0.27*0.57±0.12*2.38±0.26*0.83±0.19*正常组(Normalgroup)0.65±0.110.94±0.130.96±0.081.38±0.24
注:与模型对照组相比,*P< 0.05;与正常组相比#P< 0.05。
Note.Compared with the model control group,*P<0.05 compared with the normal group#P< 0.05.
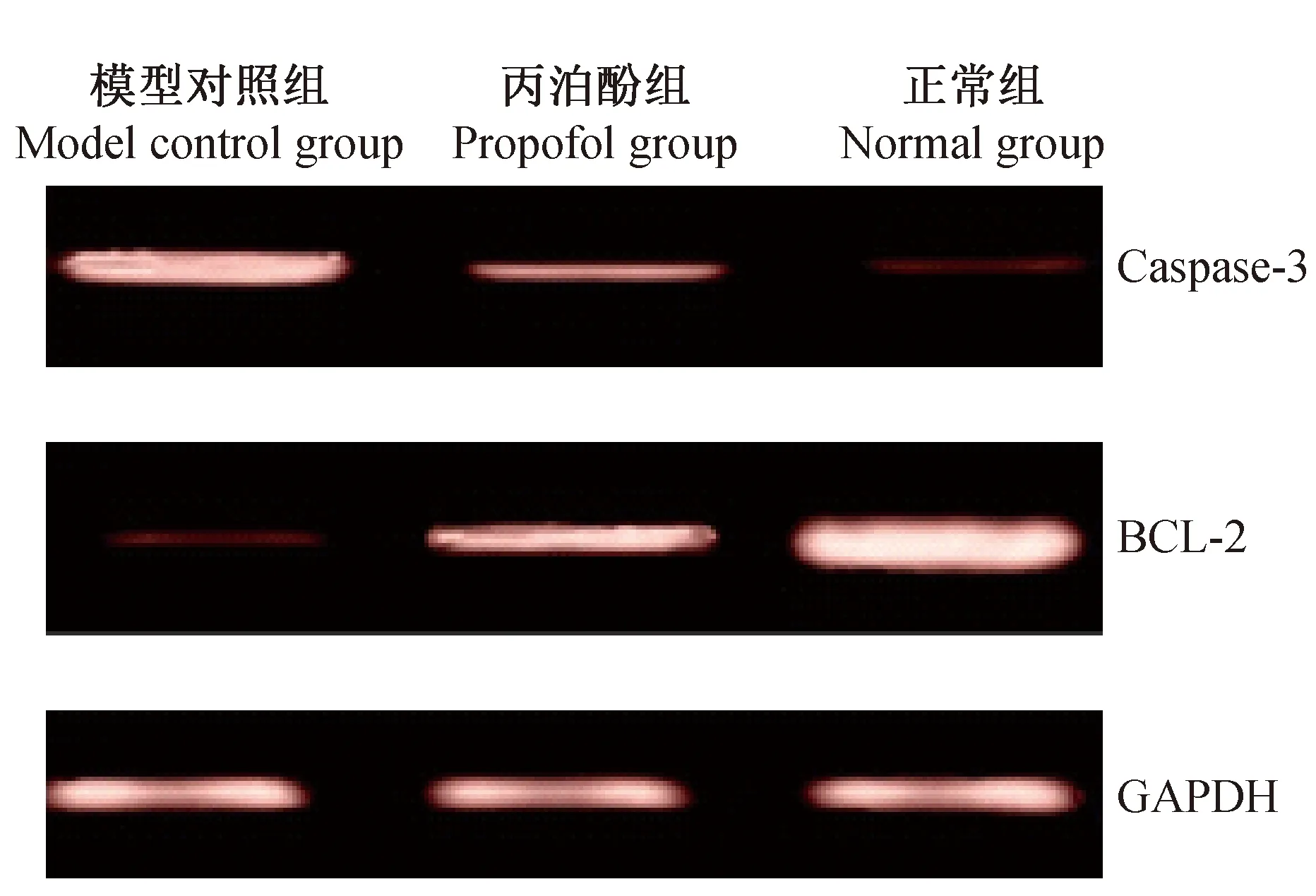
图2 各组大鼠 Caspase-3、BCL-2 m RNA的表达Fig.2 The rats Caspase-3, BCL-2 m RNA of expression

图3 各组大鼠 Caspase-3、BCL-2 蛋白的表达Fig.3 The rats Caspase-3, BCL-2 Protein of expression
2.5各组大鼠F-VEP 检查结果
在造模后14 d,3组各随机取大鼠5只,进行F-VEP检查,结果表明丙泊酚组大鼠P1波的波幅与模型对照组相比增大,其潜伏期较模型对照组明显缩短。丙泊酚组与模型对照组相比差异显著(P< 0.05)。即模型对照组大鼠的视觉诱发电位由视网膜传导枕部脑组织的时间较丙泊酚组长,表明了丙泊酚组的传导通路较模型对照组畅通,视神经损伤恢复较好(见表4)。
2.6视网膜HE染色观察
正常组(5A)大鼠视网膜HE 染色可见3层结构,由图片下方向上依次是感光细胞层、双极细胞层及RGC 层,多层排列的是感光细胞层和双极细胞层,RGC层的细胞则呈单层排列。造模后14 d,模型对照组(5C)的视网膜结构破坏严重,视网膜的厚度明显变薄,感光细胞的数量显著下降,细胞的内外节几乎消失,胞核大而浅染,而RGC层细胞的胞核亦明显稀疏。丙泊酚组(5B)RGC 胞体与正常组大小无明显区别,但数目略少,感光细胞的内外节存在,外核层细胞有轻度的水肿与空泡变性,其排列稍紊乱(图5)。
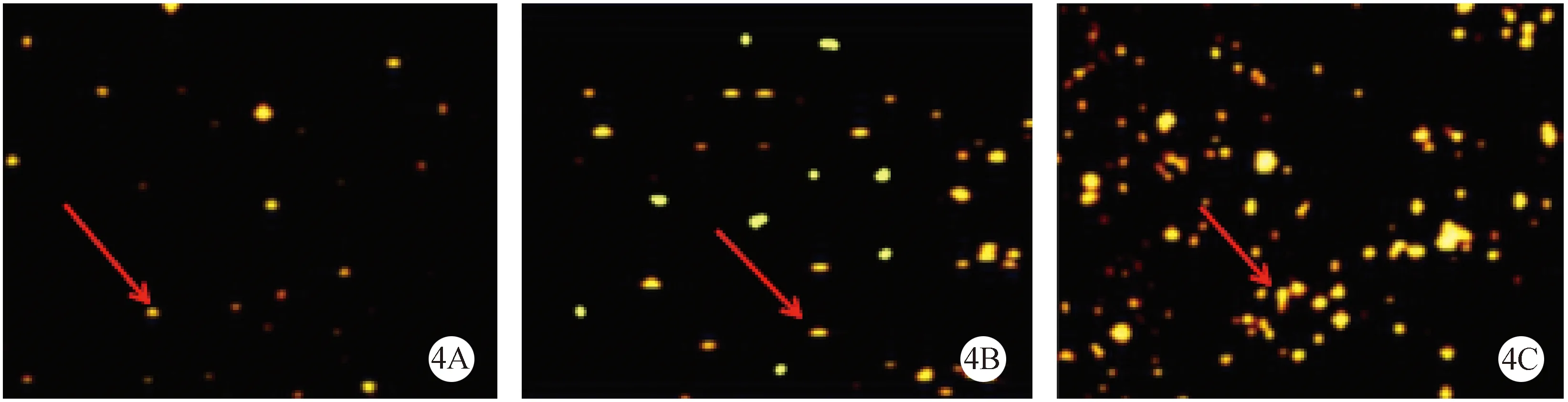
注:(4A)模型对照组;(4B)丙泊酚组;(4C)正常组。图4 各组大鼠FG阳性RGCs计数比较(×20)Note.(4A)Model control group;(4 B)Propofol group;(4C)Normal group.Fig.4 The rats FG-positive RGCs count comparator
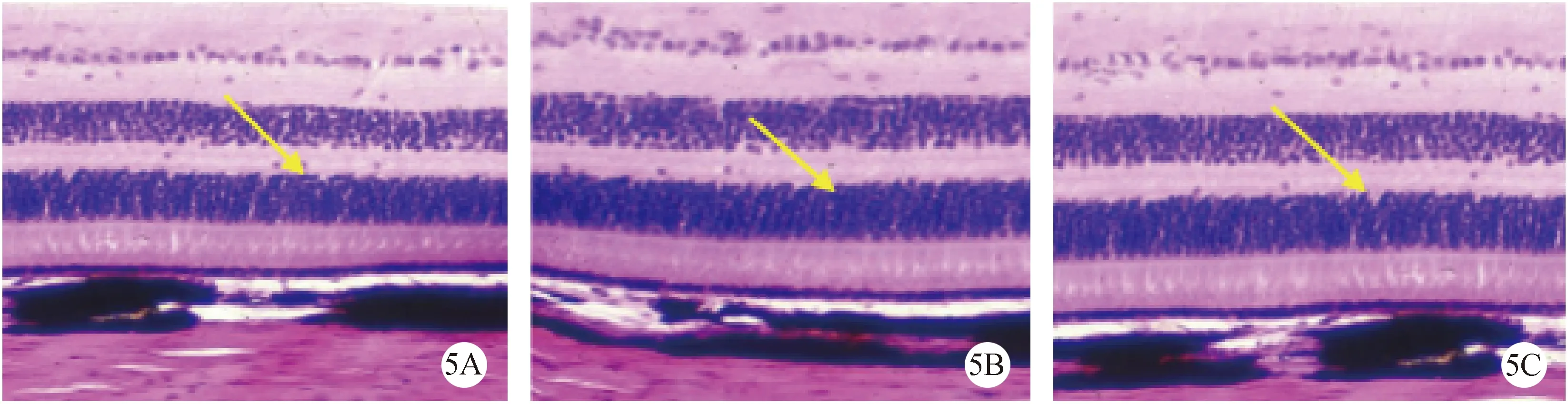
注:(5A)正常组;(5B)丙泊酚组;(5C)模型对照组。图5 各组大鼠造模后14 d视网膜组织(×20)Note.(5A)Normal group;(5 B)Propofol group;(5C)Model control group.Fig.5 Rats 14 d after modeling Retinal tissue

组别(Group)潜伏期(ms)波幅(μV)模型对照组(Modelcontrolgroup)115.34±6.82#3.04±0.48#丙泊酚组(Propofolgroup)76.48±5.46*8.75±1.12*正常组(Normalgroup)64.26±2.5314.30±2.36
注:与模型对照组相比,*P< 0.05;与正常组相比#P< 0.05。
Note.Compared with the model control group,*P< 0.05 compared with the normal group,#P< 0.05.
3 讨论
为了研究丙泊酚对大鼠视神经损伤的影响及相关机制,本文采用了国内外最常用的视神经夹挫伤模型,据目前研究表明该视神经夹挫伤模型较为精确,其具有可直视视神经的损伤部位,可控性较强.损伤的性质具体化且定量等优点,为相关丙泊酚干预大鼠视神经损伤的相关研究提供了可靠的动物实验模型,能充分的模拟并体现出临床丙泊酚干预对于视神经损伤作用的病理生理过程[8-10]。因为在临床上各种原因所致的视神经损伤中,以外力及周围组织水肿压迫引起者较为常见,以间接损伤为主,多为视神经被急性挤压伤所致,根据以上情况,沽通常采用挤压、钳夹视神经等方法建立视神经损伤的动物模型[10-11]。
视神经损伤后导致继发性的视网膜细胞的缺血、缺氧, 通过是视网膜细胞的 Caspase-3表达升高,BCL-2的表达降低导致了视神经及视网膜节细胞的继发性凋亡。相关实验研究表明,神经系统损伤后予以丙泊酚干预能够使是损伤后的 Caspase-3表达受到抑制,促进损伤后BCL-2的表达,从而起到了抑制神经细胞凋亡的作用[12-14],本研究同样表明了丙泊酚通过降低视网膜 Caspase-3基因和蛋白的表达,促进BCL-2基因基因和蛋白的表达,对视神经损伤起到保护作用,减少了视网膜节细胞的凋亡。造模后4 d丙泊酚组细胞凋亡数均明显较模型对照组少(P< 0.05),丙泊酚组大鼠闪光视觉诱发电位伏期较模型对照组大鼠短(P< 0.05)、波幅明显高于模型对照组(P< 0.05)。表明了视神经细胞凋亡减少的同时视觉功能得到了一定程度的恢复。同时丙泊酚已被证明具有抗氧化活性,它可能还可以通过以下途径起到视神经保护作用:降低代谢率、减少神经组织耗氧;抑制线粒体通透性转换孔,抗脂质过氧化反应;激活细胞外调节蛋白激酶转导的通路;抑制细胞钙超载及炎性细胞因子表达等。以上机制的研究有待将来相关实验进一步验证。
总之本研究对丙泊酚干预治疗大鼠视神经损伤就细胞凋亡及 Caspase-3、BCL-2等指标的的表达变化进行了研究,初步进行了有益的探讨,取得了一定的实验成果,具体更深入及详尽的研究有待进一步探讨。
[1]郭建,付研,丁宁,等.机动车事故致间接性视神经损伤的临床研究[J].中华急诊医学杂志,2014,23(1):84-88.
[2]尹丹萍,柳林.视神经损伤后修复与再生的研究进展[J].国际眼科杂志,2013,13(6):1152-1156.
[3]陈君,王国林.丙泊酚预处理或后处理对缺氧鼠脑神经元保护效应的研究[J].中国麻醉与镇痛,2004,6(2):109-112.
[4]李庆凯.急性重型颅脑损伤术中丙泊酚静脉麻醉的脑保护作用分析[J].中国实用神经疾病杂志,2014,2(14):62-63.
[5]孙海燕,路红,赵平,等.丙泊酚对急性高眼压大鼠视神经保护作用研究[J].中国实用眼科杂志,2014,32(03):379-382.
[6]杨明,朱彧.丙泊酚对体外培养小鼠视网膜细胞抗氧化应激的作用[J].临床麻醉学杂志,2013,29(12):1222-1225.
[7]刘晓坤,罗钢,赵平.重组人促红细胞生成素对大鼠视神经挫伤后GAP-43mRNA影响[J].中国实用眼科杂志, 2014, 32(06):789-792.
[8]Yoles E,Muller S,Schwartz M.NMDA-recePtor antagonist Protects neurons from secondary degeneration after Partial oPtic nerve crush[J]. J Neurotrauma,1997,14(9):665-675.
[9]刘德林,吴小影,罗瑜琳,等.不同剂量左旋多巴对形觉剥夺性弱视鼠闪光视觉诱发电位的影响[J]. 眼视光学杂志,2009,11(04):246-253.
[10]刘晓坤,杨伊帆,卞晓芸,等.大鼠视神经损伤后一氧化氮合酶的变化及牛磺酸的影响[J].中华眼外伤职业眼病杂志,2013(11):801-804.
[11]朱夏茹,陈晓明.大鼠外伤性视神经损伤模型建立的研究进展[J].国际眼科杂志,2014,14(12):2182-2184.
[12]Vucetic M,lensen PK,Jansen EC,etal.Diameter variatiOIlS ofretinal blood vessels during and after treatment with ProPofol[J]. Br J OPhthalmol,2004,88(6):771-775.
[13]张蔚,于金国,王兴,等.周围神经损伤神经脊细胞 Caspase-3的表达与病理变化[J].中华眼科杂志,2010,46(12):1084-1089.
[14]章静,吴香丽,刘丽霞,等.银杏叶提取物对大鼠视神经损伤后Bcl-2和Bax表达的影响[J].河北医科大学学报,2014,35(03):336-338.
NeuroProtective mechanisms of ProPofol to retinal ganglion cells in a Partial oPtic nerve crush rat model
LI Xue-Dong,CHEN Jia-Kang*, QIN Jun,MAI Yong-Jun,XIAO Zhen-Yong
(Liuzhou Worker’s Hospital, Liuzhou 545000, China)
ObjectiveTo investigate the Protective effect of propofol on the retinal ganglion cells of the rat optic nerve crush model. Methods 67 SD rats. Randomly selected 20 rats, don’t do any processing for the normal group. With more than 47 rats optic clamps for optic nerve contusion model, legal system building 5 failure, success of 42 rats were randomly divided into the optic nerve damage and propofol group, 21 / group. Will not be any treatment after optic nerve injury group building, 4 hours after propofol group for propofol therapy. After 4 days of successful modeling, the apoptosis of retinal ganglion cells were detected by TUNEL staining. After 7 days of successful modeling, the expression of Caspase-3, BCL-2 in retina and optic nerve cells of rats were detected by RT-PCR and Western-blot.After 14 days of successful modeling, The amplitude and latent period of P1 wave of flash visual evoked potential were detected.The animals were sacrificed and the optic nerve was taken to observe the pathological morphology of retina and optic nerve in rats, and the retinal ganglion cells (RGC) were counted. ResultsAfter 4 days of successful modeling,the apoptosis of the propofol group was significantly lower than that of the optic nerve injury group (P< 0.05).After 7 days of successful modeling,the expression of Caspase-3 in the propofol group was significantly lower than that in the propofol group (P< 0.05), the expression of BCL-2 in the propofol group was significantly higher than that in the propofol group (P< 0.05).After 14 days of successful modeling, FG Positive RGC numbers: normal group>propofol group> optic nerve injury group and between groups difference was statistically significant (P< 0.05). The flash visual evoked potential of the rats in propofol group was significantly shorter than that in the optic nerve injury group (P< 0.05) and the amplitude of the visual evoked Potential was significantly higher than that of the optic nerve injury group (P< 0.05).ConclusionsPropofol treatment can through an early reduction in rats after optic nerve crush RGCs apoptosis, decreased Caspase-3 expression, increased BCL-2 expression and improve number of optic nerve crush of RGCs survival.
Rats;Optic nerve damage;Propofol;Retinal ganglion cells;Caspase-3;BCL-2
李学东(1970-),男,学士学位,研究方向:神经外科。E-mail:lixuedonggx@163.com。
陈家康,E-mail:LXDDOCTORLG@163.com。
研究报告
R-332
A
1671-7856(2016)07-0042-06
10.3969.j.issn.1671-7856.2016.07.007
2015-09-01

