硫辛酸生产工艺及废水处理工艺的研究进展
张腾霄 王斌 刘爽 刘栋栋 徐占玲
(绥化学院食品与制药工程学院 黑龙江绥化 152061)
硫辛酸生产工艺及废水处理工艺的研究进展
张腾霄王斌刘爽刘栋栋徐占玲
(绥化学院食品与制药工程学院黑龙江绥化152061)
硫辛酸是一种辅酶和新型高效抗氧化剂,成为当今用于研发抗衰老、延长人类寿命药品和保健品的重要原料药。文章详细研究论述了目前世界范围内现有的硫辛酸合成方法及工艺、废水处理方法及工艺,并对各种工艺的优缺点进行了讨论,为工业化生产硫辛酸提供工艺选择和指导。
硫辛酸;合成方法;生产工艺;纯化工艺;废水处理
硫辛酸有双硫五元环结构,电子密度很高,具有显著的亲电子性和与自由基反应的能力,催化酰基的产生和转移,参与三羧酸循环及光合成反应[1,2]。1951年生化学家Lester Reed第一次成功的从猪肝中分离出硫辛酸并鉴定了其分子结构[3]。随后,大量药理实验证实硫辛酸具有抗氧化、消除自由基、保护巯基酶免受重金属离子毒害等作用,在水相和油相均表现出优良的抗氧化性能,临床用于治疗糖尿病及其并发症、肝损伤及代谢异常、缺血再灌注、退行性神经病变、辐射损伤、白内障、心脏病等病症[4-11]。因其安全可靠,疗效确切,故硫辛酸在医药、保健、美容等领域用量逐步大增。
目前,世界范围内对硫辛酸的需求量剧增,但供给量却很少,因此硫辛酸的高效合成方法和工艺成为研发热点。硫辛酸有R型和S型两种对应异构体,R型有活性,S型无活性但无毒性,等量R型和S型组成外消旋体α-硫辛酸。1952年,HornbergerJr等以4-(四氢呋喃基)-丁酸和3-(α-四氢吡喃基)-丙酸为原料合成了硫辛酸[12]。1955至 1957年,Reed、Bullock等以6-氯羰基己酸乙酯(己二酸单乙酯酰氯)、乙烯和硫脲等为原料合成了硫辛酸并多次对工艺进行改进和优化[13-15],1957年,Sergre等以2-乙酰氧乙基环己酮为起始原料合成了硫辛酸[16]。1961年,Reed等以己二酸单乙酯酰氯为原料合成了硫辛酸[17]。1983年,Golding等由S-苹果酸合成了S-硫辛酸后,进而确定了R-硫辛酸的绝对构型[18]。2001年,Nikalje等以己辛酸二酯为原料合成了有立体构型的硫辛酸[19]。根据目前关于硫辛酸合成方法及工艺的文献资料,对其合成方法、路线、工艺优缺点等方面归纳比较如下。
一、硫辛酸的合成路线与工艺
(一)以6,8-二氯辛酸乙酯为起始原料的合成路线。该合成方法采用以硫化钠、硫磺、6,8-二氯辛酸乙酯等为原料,经过硫化、环合、水解、酸化、精制等工序制得[20,21]。合成步骤如下:
1.硫化钠、硫磺在60℃下反应制备二硫化钠,反应式如下:
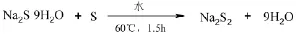
2.硫化和环合反应。二硫化钠与6,8-二氯辛酸乙酯在水、乙醇溶剂中,以四丁基溴化铵为催化剂,75℃下反应得到α-硫辛酸乙酯和副产物A1的混合物,该步反应收率为58%,反应式如下:

3.水解和酸化反应。α-硫辛酸乙酯先用氢氧化钠溶液在60℃下反应,酯键水解生成α-硫辛酸钠和乙醇,再加入盐酸,使硫辛酸钠酸化生成目标产物α-硫辛酸,该步反应收率为90%,反应式如下:

上述合成工艺的硫化和环合反应步骤中有大量副产物A1生成,造成了原料浪费和收率偏低,需要加以改进减少副产物A1生成。在上述混合物中加入复合还原剂Na2SO3· NaHSO3·Na2S2O3,复合还原剂的用量为6,8-二氯辛酸乙酯重量的20%~100%,最佳反应温度范围50~70℃,反应时间2~5h,反应式如下:

然后加少量活性炭除杂,过滤,得到几乎不含副产品A1的硫辛酸钠盐水溶液;加稀盐酸酸化析出浅黄色晶状硫辛酸晶体,为硫辛酸粗品,粗品摩尔收率80%~90%。
此工艺采用水为溶剂,除少量乙醇做助溶剂外,未用其它有机溶剂,环境污染小,且显著降低了成本。改进后的工艺步骤中采用复合还原剂使副产物A1转变为硫辛酸,显著提高了产品收率,产品的摩尔收率≥70%,产品含量99%,溶剂残留(甲苯、环己酮、乙酸乙酯等)含量几乎等于0ppm,实现了绿色合成。
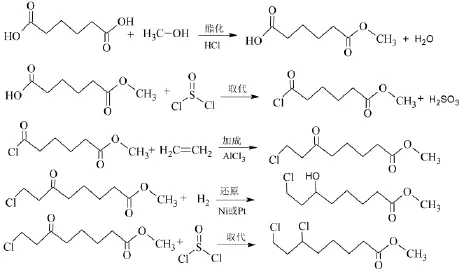
(二)以己二酸为起始原料的合成路线。该合成方法首先把己二酸用甲醇或乙醇单酯化反应,然后进行单酰氯化(取代)、傅氏加成、还原加氢等共5步反应制得中间体6,8-二氯辛酸乙酯[22,23],反应式如下:
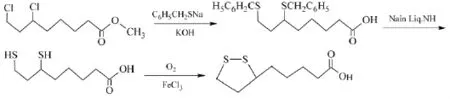
然后再用苯甲基巯醇取代、脱苯甲基、氧化环合3个步骤制得终产物α-硫辛酸[23],己二酸到终产物8个步骤的反应总收率不超过30%,反应式如下:
此合成路线的中间产物6,8-二氯辛酸乙酯,用上述“以6,8-二氯辛酸乙酯为起始原料的合成路线”进行硫化与环合、水解、酸化3个步骤也可以制得终产物α-硫辛酸。
从上述反应路线来看,以己二酸为起始原料合成硫辛酸路线长,使用了甲苯、环己烷、醋酸乙酯等多种溶剂,造成甲苯、环己烷、醋酸乙酯在产品中的残留量达到500~5000ppm,成本高、污染环境大。因此,此合成路线的经济性差,产品需要进一步纯化,解决对策是利用专利技术“制备无溶剂的α-硫辛酸的方法”对该路线的产品进一步纯化[24],得到化学纯度高的α-硫辛酸产品,但这样一来势必大大降低总收率且提高成本。
(三)以环己酮和乙烯基乙醚为起始原料的合成路线。该合成方法采用以环己酮、乙烯基乙醚等为原料,经自由基加成、Baeyer-Villiger氧化、酯键水解、亲核取代、氧化二硫化、精制等工序制得[25,26],Baeyer-Villiger氧化是关键步骤,催化剂可选用双氧水乙酸混合液、过氧乙酸、三氯过氧乙酸、间氯过苯甲酸等。合成步骤如下:
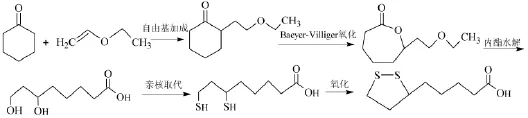
该合成路线仅通过4步反应即可得到目标产物,合成步骤简短,不仅原料成本低,产物总收率也较高,收率约为45%。整个过程没有高温、高压的反应条件,也不需要昂贵的催化剂,易于工业化生产,因此,该合成路线极具工业化潜力。
(四)以环己酮、四氢吡咯和2-卤代-乙酸乙酯为起始原料的合成路线。该合成方法采用以环己酮、四氢吡咯和2-卤代-乙酸乙酯为起始原料,经烯胺化、加成、Baeyer-Villiger氧化、开环取代、磺化环合共5个步骤制得终产物α-硫辛酸[27],合成步骤如下:
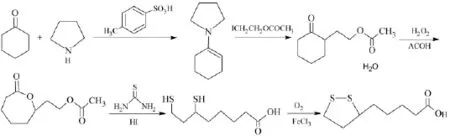
该合成路线通过5步反应即可得到目标产物,总收率为25%,合成工艺路线较短,不需要贵金属作为催化剂,也不涉及高温高压的环境,对反应设备要求低,有很好的工业化应用前景。
(五)以2-乙醇乙酯-环己酮为原料的生物合成路线。从微生物中寻找单加氧酶(Monnooxygenase,MO),利用生物酶选择性催化底物化合物生成内酯,从而替代传统化学合成所用的过氧酸类催化剂,这类生物酶称为BVMO。目前,从醋酸不动杆菌(Acinetobacter calcoaceticus NCIMB9871)与恶臭假单胞菌(Pseudomonas Putida NCIMB10007)等微生物中提取并纯化得到BVMO,成功应用于α-硫辛酸的合成过程[28],其酶催化机理如下:
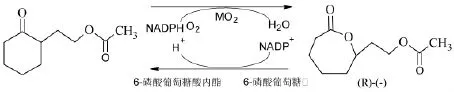
此种酶转化法显著降低了副反应,提高了此步骤的收率,但是该酶的催化活性需要辅因子,所以在反应过程中需要添加NADPH或NADH,目前,采用辅因子再生法可实现辅因子的循环利用。
在上述酶转化法基础上,有学者采用全细胞转化法实现了硫辛酸的生物合成[29],该法直接把前体物质1-羟基-2-乙醇乙酯-环己烷为原料加入微生物培养基中通过恶臭假单胞菌的生物发酵获得硫辛酸,生物代谢转化过程如下:
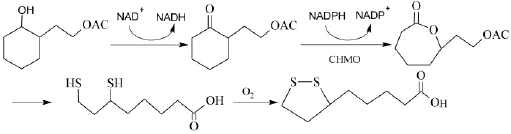
全细胞转化法优点是不需要额外加入辅因子,不需要构建辅因子循环反应体系,不需要加入纯化的BVMO,其缺点是微生物细胞内存在的内酯水解酶往往使中间产物代谢破坏造成副反应增多,从而导致终产物产率低。
二、硫辛酸生产中废物、废水处理方法及工艺
在硫辛酸的化学合成及产物提取纯化过程中产生多种有机废液,特别是以己二酸为原料的合成路线经历了8个步骤,排放大量的废水,废水呈黄色,pH值4.5~5,CODcr58000mg/L左右,属于难处理的医药化工有机废水。随着国家对环保要求的日益严格,严禁废水直接超标排放,制药行业排放标准将CODcr从原来的小于100mg/L降至小于80mg/L。我国生产硫辛酸的企业通常采用将各道生产工艺中的废水引入集水池,对进入到集水池的混合废水稀释4~5倍,再经雾化等设施处理后排放。这种处理方式属于被动处理,不仅处理量大、处理成本高,而且严重浪费水资源。
为应对日益严苛的法律要求,如何将硫辛酸生产工艺中所产生的废水处理好,变废为宝也越发的受到学者的重视。以下列举现阶段工艺性能好、效果突出的4种废水处理方法。
(一)汽提回收乙醇/树脂吸附/醇洗脱附法。该法先用汽提回收环合水解废水中的乙醇,然后用大孔树脂吸附废水中的硫辛酸,最后再用洗脱液洗脱下大孔树脂吸附的硫辛酸并使树脂再生[30],具体工艺为:1.将硫辛酸生产过程中环合水解废水经过汽提回收乙醇(汽提溜出液精馏回收乙醇),于0~50℃的温度和0.5~3.0BV/h的流量条件下,通过装填有苯乙烯-二乙烯基苯共聚大孔吸附树脂吸附柱,废水中的硫辛酸吸附在树脂上,出水经中和、好氧生化处理后,达标排放。所述的预处理是先将硫辛酸生产过程中环合水解废水汽提,去除废水中的乙醇,然后再将含乙醇的汽提馏出液精馏,回收得到的乙醇回用于硫辛酸的生产;2.用甲醇或乙醇作脱附剂,将吸附了硫辛酸的大孔吸附树脂脱附再生,然后再将大孔吸附树脂水洗;3.水洗后,水洗脱附液经蒸馏或精馏回收甲醇或乙醇再用作脱附剂。该法的处理效果为树脂吸附、好氧生化后废水的CODcr从58000mg/L左右降至100mg/L以下,硫辛酸含量从1300mg/L左右降至0.5mg/L以下脱附液返回生产工段中回收硫辛酸,如此可从每吨废水回收1.3kg硫辛酸,总硫的质量浓度从400~450mg·L-1降为0.05mg·L-1,既实现了高效率治理废水又提高了目的产物的产率。
(二)反应成矾结晶/纳滤/反渗透耦合法。该法先向加成废水中加入硫酸铵和硫酸钠反应生成铵明矾,并精制得铵明矾成品,再过滤、萃取,分别回收8-氯-6-羰基辛酸乙酯和己二酸单乙酯,萃取后浓缩液与透过液经反渗透脱盐,再经生化处理达标排放[31],具体工艺如下:1.向硫辛酸加成废水中加入硫酸铵和硫酸钠,搅拌反应,冷却后结晶,过滤得铵明矾粗品;2.将铵明矾粗品加水,加热使其溶解,配成饱和溶液,冷却至室温,结晶、过滤、干燥后,得铵明矾精品;3.将步骤1)过滤所得的滤液经纳滤后,浓缩液用二氯乙烷萃取,分层,二氯乙烷层加碳酸钠水溶液调节至pH7~8,分层,有机相含8-氯-6-羰基辛酸乙酯进入还原步骤,水相加入甲苯并用盐酸酸化至pH3~4,甲苯层回收己二酸单乙酯,进入酰化步骤;4.萃取后的浓缩液与透过液送至反渗透装置脱盐处理,再经生化处理达标排放;5.将步骤2过滤所得的滤液与加成废水汇合,重复步骤1和2。该法针对加成步骤废水设计的技术方案从废水中回收了铝盐(纯度≥99.0%的铵明矾)和有机中间体,废水处理工艺与合成工艺循环成一体,在减低成本和提高处理效率方面优势巨大。
(三)反应成盐/纳滤/萃取/反渗透法。该法的废水处理工艺为:向环合废水中加入稀酸,反应生成H2S气体,用NaOH溶液吸收制得Na2S溶液返回环合工艺循环使用;废液经纳滤分成浓缩液和透过液,浓缩液用甲苯萃取回收硫辛酸;透过液经反渗透脱盐,再经生化处理即可达标排放[32]。该法针对环合步骤废水设计的技术方案从废水中回收了硫和硫辛酸,转变为硫化钠回收利用,提高了成品硫辛酸的收率,处理后的废水COD低、含盐量小,生化处理效果好、易达标。
(四)清浊分流/分储/循环回用零排放法。该法适用于以己二酸为起始原料的生产工艺,该法的先进之处在于对整个工艺产生的废水分成三大类,建立三套分流-储存-循环使用的系统,三类废水处理各个击破,实现了零排放放[33],具体工艺如下:将水冲泵循环水和循环冷却水及有机工艺废水进行清浊分流,即分别引入各自独立的储池中分别集中处理,处理后引回继续使用;水冲泵循环水引到水冲泵循环水处理池经单独处理后循环回用于水冲泵;将冷却水引入冷却水池中经冷却后回用于夹套冷却;将同一工艺环节中的含有有机物料的水引入工艺水集水池中作为加料用水而回用于同一工艺。该处理方法从生产工艺上减少了污染物的外排量,零排放且节约水资源,节约生产原料成本。
三、结论
硫辛酸独特的保健和药用价值被证实和认可。以6,8-二氯辛酸乙酯为起始原料和以环己酮为起始原料的合成工艺因合成路线短、污染小的优势逐渐取代其它合成工艺,成为工业化的主导方向。制药行业国家环保标准的提高,促进了硫辛酸合成方法、废水处理方法的革新,大量专利技术涌现,这些新技术促进了硫辛酸制药工业的更好更快的发展,为解决国际上硫辛酸的巨大供应缺口提供了技术保障。
[1]张璨文,丁美会,杨喻晓,等.硫辛酸抗氧化性及其生理保健功能研究进展[J].科技通报,2009,29(4):432-436.
[2]张金彦,吉绍长.药物硫辛酸的研究进展[J].现代化工,2012,32(5):32-36.
[3]Reed L,Debusk B,Gunsalus I.Crystalline alpha-lipoic acid:a catalytic agent associated with pyruvate dehydrogenase[J]. Science,1951,114(2952):93-94.
[4]Packer L,kraemer K,Rimbacb G.Molecular aspects of lipoic acid in the prevention of diabetes complication[J].Nutrition,2001,17(10):888-895.
[5]Rochette L,Ghibu S,Muresan A,et al.Alpha-lipoic acid: molecular mechanisms and therapeutic potential in diabetes[J]. Canadian journal of physiology and pharmacology,2015,93(12): 1021-1027.
[6]KhabbaziT,MahdaviR,SafaJ,etal.Effects of alpha-lipoic acidsupplementation on inflammation,oxidativestress,andserum lipid profile levels in patients with end-stage renal disease on hemodialysis[J].Journal of renalnutrition,2012,22(2):244-250.
[7]Xu Y, Zhou X, Shi C, et al.α-Lipoic acid protects against the oxidative stress and cytotoxicity induced by cadmiumin HepG2 cells through regenerating glutathione regulated by glutamatecysteine ligase [J].Toxicology Mechanisms and Methods. 2015,25(8):596-603.
[8]ElshazlySM,El-MoselhyMA,Barakat W.Insights in themechanismunderlying the protective effect of α-lipoic acid against acetaminophen-hepatotoxicity[J].European Journal of Pharmacology,2014,726,(5):116-123.
[9]Xing Z G,Yu G D,Qin L,et al.Effects and mechanism of lipoic acid on beta-amyloid-intoxicated C6 glioma cells[J]. Geneticsand Molecular Research,2015,14(4):13880-13888.
[10]Porcaro G,Brillo E,Giardina I,et al.Alpha Lipoic Acid (ALA)effects on subchorionic hematoma:preliminary clinical results[J].European review for medical and pharmacological sciences,2015,19(18):3426-3432.
[11]Ramos L F, Kane J, McMonagle E, et al. Effects of combination tocopherols and alpha lipoic acid therapy on oxidative stress and inflammatory biomarkers in chronic kidney disease[J].Journal of renal nutrition,2011,21(3):211-218.
[12]Hornberger Jr C S,Heitmiller R F,Gunsalus I C,et al. Synthetic preparation of lipoic acid[J].Journal of the American chemicalsociety,1952,74(9):2382-2382.
[13]Reed L G,Niu C.Syntheses of DL-α-Lipoic Acid[J]. Journal of the American chemical society,1955,77(2):416-419.
[14]Thomas R C,Reed L J.Synthesis and properties of high specific activity DL-α-Lipoic Acid-S235[J].Journal of the American chemical society,1955,77(20):5446-5448.
[15]Thomas R C,Reed L J.Synthesis of DL-1,2-Dithiolane-3-caproic Acid and DL-1,2-Dithiolane-3-butyric Acid,Homologs of α-Lipoic Acid[J].Journal of the American chemical society,1956,78(23),6151-6153.
[16]Segre A,Viterbo R,Parisi G,et al.A new synthesis of 6-thioctic acid(DL-α-lipoic acid)[J].Journal of the American chemical society,1957,79(13):3503-3505.
[17]LesterJ,Reed,AustinTex,etal.Method for preparing—6,8-dihalooctanoic esters[P].US:2980716,1961-04-18.
[18]Golding B T,Brookes M H,Howes D A.Method for producing lipoic acid and dihydrolipoic acid[J].Journal of the American chemical society,1983,(19):1051-1053.
[19]Nikalje M D,Sudalai A.Asummetric dihyroxylation and hydrogenation approaches to the enantioselective synthesis of R-(+)-α-lipoicacid[J].Tetrahedron Letter,2001,(42):4891-4893.
[20]冷一欣,牛锦森,黄春香.R-(+)-α-硫辛酸的合成工艺[J].化工进展,2012,31(6):1325-1329.
[21]李洁,朱建益,董旭,等.一种α-硫辛酸的制备方法[P]. CN:ZL201310034941.2,2014-11-19.
[22]DonaldSAcker,Brookside Park,etal.Process of preparing α-lipoic acid using dichlorooctanoate and metal disulfide[P]. US:2792406,1957-05-01.
[23]GuenesG,Hutthmacher KlausDR,Kleemann Axel D R,etal.Process for the production of 1,2-dithiolan-3-pentanoicacid (thioctic acid)and intermediate compounds therefore[P].DE: 3512911,1986-10-16.
[24]H·舒哈鲍尔,S·温克勒,A·格鲁伯.制备无溶剂的α-硫辛酸的方法[P].CN:ZL00808557.9,2003-12-17.
[25]JacchimP,PeterE,WolfgangS,etal.Preparation of R/S-gamma-lipoic acid or R/S-alpha-lipoic acid[P].US:6229042,2001-05-08.
[26]孙耀冉.α-硫辛酸合成工艺研究[D].石家庄:河北师范大学,2004.
[27]王钝,宫平,丁亚平.6-α-硫辛酸的多种合成方法[J].中国药物化学杂志,1999,9(4):304-305.
[28]AdgerB,BesMT,GroganG,etal.The synthesis of R-(+)-α-lipoic acid using a monooxygenase[J].Bioorganic Chemistry,1998,(2):195-199.
[29]Bross C,Carlos R S,Carme B,et al.Baeyer-villiger oxidation by Pseudomonas.putida NCIMB1007 in organic solvents:the influence on the regioselectivity[J].Tetrahedron,1998,(54):5781-5788.
[30]陈金龙,魏瑞霞,成志强,等.硫辛酸生产过程中环合水解废水的治理与资源的回收利用方法[P].CN:ZL02112931.2,2004-08-11.
[31]王车礼,邹振荣,黄燕华,等.一种硫辛酸生产过程中加成废水的处理方法[P].CN:ZL201210056712.6,2013-05-01.
[32]王车礼,邹振荣,黄燕华,等.硫辛酸生产过程中环合废水的处理方法[P].CN:ZL201410533517.7,2014-12-17.
[33]陈惠国,王建刚.硫辛酸制备中的废水处理与循环回用零排放的方法[P].CN:ZL200810024111.0,2009-12-16.
[责任编辑郑丽娟]
TQ463.5
A
2095-0438(2016)08-0148-05
2016-03-01
张腾霄(1982-),男,山东兖州人,绥化学院食品与制药工程学院讲师,硕士,研究方向:制药工程、生物工程及食用菌研究。
绥化学院2015年大学生科技创新项目(shxy201516)。

