肾移植术后细菌感染患者致病菌种分布及耐药性分析
董艳,陈晨,李利娜
(山东大学第二医院,济南250033)
肾移植术后细菌感染患者致病菌种分布及耐药性分析
董艳,陈晨,李利娜
(山东大学第二医院,济南250033)
目的观察肾移植术后细菌感染患者致病菌种分布及耐药性。方法 收集肾移植术后感染患者尿液、痰等标本进行细菌培养,对检出的206株致病菌进行菌种鉴定和药敏试验。结果 206株致病菌中革兰阴性菌173株(83.98%)、革兰阳性菌33株(16.02%)。大肠埃希菌(77株)、肺炎克雷伯菌(36株)、阴沟肠杆菌(13株)、粪肠球菌(10株)是主要致病菌。大肠埃希菌对氨苄西林、哌拉西林的耐药率高,分别为89.61%和93.91%;对喹诺酮类抗菌药物环丙沙星、左氧氟沙星的耐药率也较高,分别为70.13%和68.83%;对青霉素+酶抑制剂类的耐药率较低;检出1株耐美罗培南的大肠埃希菌,未检出对亚胺培南耐药的大肠埃希菌。肺炎克雷伯菌对氨苄西林、哌拉西林的耐药率较高,分别为86.11%和52.78%,未发现对亚胺培南和美罗培南耐药的菌株。表皮葡萄球菌对青霉素、氨苄西林、阿莫西林/克拉维酸钾、头孢曲松的耐药率为100%,对庆大霉素、左氧氟沙星、莫西沙星的耐药率低。金黄葡萄球菌对青霉素及左氧氟沙星的耐药率均为100%,对青霉素+酶抑制剂类抗菌药物耐药率低。未检出对万古霉素和利奈唑胺耐药的表皮葡萄球菌及金黄葡萄球菌。检出1株对万古霉素及利奈唑胺均耐药的粪肠球菌。结论 肾移植术后感染患者致病菌种主要以革兰阴性菌为主,大肠埃希菌为主要致病菌,耐药性较高。
肾移植;感染;细菌;耐药性
肾移植是目前终末期肾病患者最有效治疗手段之一。移植后应用免疫抑制剂增加了肾移植术后细菌感染的发病率[1]。感染成为肾移植术后重要的死亡原因之一[2,3]。近年来,国内外多项研究分析不同地区、医院及病区感染患者的细菌分布及耐药性,结果显示差异很大,且关于肾移植患者的相关报道很少。2013年1月~2014年12月,我院肾移植科送检的肾移植术后感染患者尿液、痰等标本中检出致病菌206株,现分析细菌培养结果和药敏试验结果。
1 材料与方法
1.1标本来源标本来源于我院肾移植科送检的肾移植术后感染患者尿液118株、痰液36株、血液27株、移植肾周引流液及分泌物25株。
1.2菌种鉴定方法 送检标本按《全国临床检验操作规程》进行分离培养,分离培养后的细菌均用美国Beckman Coulter公司(原德国SIEMENS公司)生产的MicroScan WalkAway 96全自动细菌鉴定及药敏分析仪或法国生物梅里埃公司生产的API手工板条,鉴定到种。
1.3药敏试验采用MIC法或K-B法。MIC法所用药敏板条为美国Beckman Coulter公司(原德国SIEMENS公司)产品,K-B法所用药敏纸片为英国Oxoid公司产品,M-H琼脂为济南百博生物技术公司产品。药敏结果判断依据美国临床实验室标准化研究所(CLSI)2013年判断标准,质量控制菌株均购自美国典型菌种保藏中心(ATCC),包括金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922、粪肠球菌ATCC29212和铜绿假单胞菌ATCC27853。药物包括氨苄西林、哌拉西林、哌拉西林/他唑巴坦、替卡西林/克拉维酸、阿莫西林/克拉维酸钾、头孢唑林、头孢呋辛、头孢他啶、头孢曲松、头孢吡肟、头孢西丁、氨曲南、庆大霉素、妥布霉素、阿米卡星、环丙沙星、左氧氟氟沙星、亚胺培南、美罗培南、复方新诺明。
2 结果
2.1菌种分布检出病原菌菌种分布及标本来源见表1。检出的206株细菌中革兰阳性菌33株(16.02%)、革兰阴性菌173株(83.98%)。检出最多的感染菌株为大肠埃希菌(77株),其次为肺炎克雷伯菌(36株)、阴沟肠杆菌(13株)、粪肠球菌(10株)。标本来源及细菌分布构成比见表1。

表1 检出病原菌菌种分布及标本来源
2.2主要革兰阴性菌耐药情况大肠埃希菌对氨苄西林、哌拉西林的耐药率高,分别为89.61%和93.91%;对喹诺酮类抗菌药物环丙沙星、左氧氟沙星的耐药率也较高,分别为70.13%和68.83%;对青霉素+酶抑制剂类的耐药率较低;检出1株耐美罗培南的大肠埃希菌,未检出对亚胺培南耐药的大肠埃希菌。肺炎克雷伯菌对氨苄西林、哌拉西林的耐药率较高,分别为86.11%和52.78%,未发现对亚胺培南和美罗培南耐药的菌株。检出1株耐亚胺培南的铜绿假单胞菌。详见表2。

表2 5种主要革兰阴性杆菌耐药情况
2.3主要革兰阳性菌耐药情况 表皮葡萄球菌对青霉素、氨苄西林、阿莫西林/克拉维酸钾、头孢曲松的耐药率为100%,对庆大霉素、左氧氟沙星、莫西沙星的耐药率低。金黄葡萄球菌对青霉素及左氧氟沙星的耐药率均为100%,对青霉素+酶抑制剂类抗菌药物耐药率低。未检出对万古霉素和利奈唑胺耐药的表皮葡萄球菌及金黄葡萄球菌。检出1株对万古霉素及利奈唑胺均耐药的粪肠球菌。详见表3。
3 讨论
本研究检出最多的致病菌种为大肠埃希菌,其次为肺炎克雷伯菌、阴沟肠杆菌、粪肠球菌等。与国内文献不同。谭庆等[4]报道的器官移植病区病原菌主要为金黄色葡萄球菌。朱有华等[5,6]发现肾移植后感染的最主要菌种为铜绿假单胞菌。这可能与标本来源、地区差异、患者特点的不同有关。本研究菌株来源于尿液较多,这可能与手术部位涉及泌尿系统、留置双J导尿管、移植肾摘取过程中的污染或供肾捐献者可能为感染患者等有关。不同途径导致的感染的病原菌也有所不同。20世纪80年代肾移植术后发生院内尿路感染的病原菌以肠杆菌科菌(大肠杆菌为主)、铜绿假单胞菌多见[7]。20世纪90年代以真菌多见,其次是肠杆菌科菌[8]。2007年瞿立辉等[9]报道葡萄球菌为肾移植受者术后早期尿路感染的主要病原菌,大肠杆菌和肠球菌所占比例减少。而本研究结果显示我院肾移植术后发生尿路感染的病原菌以大肠埃希菌最多见,其次为肺炎克雷伯菌。我院肾移植术后发生呼吸道感染的病原菌以肺炎克雷伯菌、阴沟肠杆菌、铜绿假单胞菌多见。检出的病原菌中条件致病菌占多数。考虑主要与免疫抑制药物的应用、患者原发病的长期慢性消耗等因素有关[10,11]。
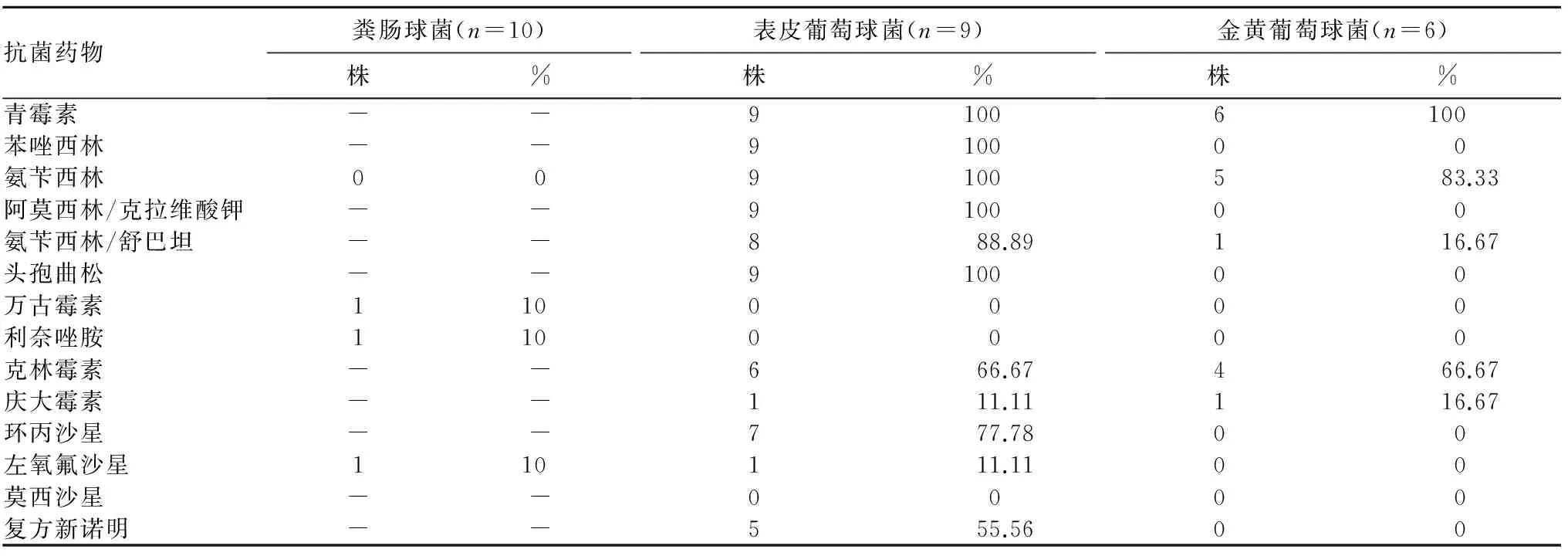
表3 3种主要革兰阳性菌耐药情况
本研究检出的大肠埃希菌对青霉素+酶抑制剂类、头霉素类、碳青霉烯类药物敏感,对青霉素类、头孢菌素及喹诺酮类抗菌药物耐药率高。肺炎克雷伯菌对大多抗菌药物敏感,仅对青霉素类药物耐药率高。革兰阳性菌中粪肠球菌对氨苄西林、左氧氟沙星、万古霉素及利奈唑胺敏感,表皮葡萄球菌对莫西沙星、左氧氟沙星、万古霉素及利奈唑胺敏感。检出1株耐美罗培南的大肠埃希菌和1株耐亚胺培南的铜绿假单胞菌。碳青霉烯类抗菌药物是治疗肠杆菌科细菌的最有效药物,但近年来耐药菌株的检出率呈逐年上升趋势[12],有研究显示产碳青霉烯酶是导致肠杆菌对碳青霉烯类抗菌药物耐药的主要机制[13,14]。检出1例对利奈唑胺和万古霉素均耐药的粪肠球菌,近年来国内外对临床分离和体外诱导耐药菌株的研究结果认为,粪肠球菌对利奈唑胺的耐药机制与23SrRNAV区位点突变有关[15,16]。
本研究结果显示,肾移植术后出现尿路感染的患者致菌种以大肠埃希菌及肺炎克雷伯菌多见,可选择青霉素+酶抑制剂类、头霉素类、碳青霉烯类药物治疗;呼吸道感染的病原菌以肺炎克雷伯菌、阴沟肠杆菌、铜绿假单胞菌多见,可选择青霉素+酶抑制剂类、喹诺酮类、碳青霉烯类药物治疗。总之,及时开展肾移植感染患者的病原学监测,了解细菌分布及其耐药趋势,对合理选择抗菌药物、预防和控制耐药菌株产生、保障肾移植患者生命健康具有重要意义。
[1] Roberto M. Immunosuppressive drugs in kidney transplantation: impact on patient survival, and incidence of cardiovascular disease, malignancy and infection[J]. Drugs, 2009,69(16):2227-2243.
[2] Linares L, Cofan F, Cervera C, et al. Infection-related mortality in a large cohort of renal transplant recipients[J]. Transplant Proc, 2007,39(7):2225-2227.
[3] Vega J, Videla C, Borja H, et al. Causes of death with a functioning graft among kidney allograft recipients[J]. Rev Med Chil, 2012,140(3):295-304.
[4] 谭庆,孙煦勇,曲海燕,等.器官移植患者病原菌分布及耐药性分析[J].中华医院感染学杂志,2014,24(11):2613-2615.
[5] 朱有华,张明,盛茂,等.肾移植患者细菌谱的调查及耐药性的研究[J].中华器官移植杂志,2002,23(2):40-42.
[6] 王书会,王一瑶,王静娜,等.肾移植术后患者医院感染目标性监测及危险因素分析[J].中华医院感染学杂志,2013, 23(4):823-825.
[7] 谢桐,徐琴君,张光有.尸体肾移植患者的尿路感染[J].中华泌尿外科杂志,1984,5(3):88-89.
[8] Mueller T, Resinger C, Ruffingshofer D, et al. Urinary tract infections beyond the early post-transplant period in pediatric renal graft recipients [J]. Wien Klin Wochenschr, 2003,115(11):385-388.
[9] 瞿立辉,蔡秋琴,王逸民,等.肾移植受者术后早期尿路感染病原菌及耐药性分析[J].中华肾脏病杂志,2007,6(6):387.
[10] Kumar V, Sun P, Vamathevan J, et al. Comparative genomics of Klebsiella pneumonia Strains with Different Antibiotic Resistance Profiles[J]. Antimicrob Agents Chemother,2011,55(9):4267-4276.
[11] Hawkey PM. Prevalence and clonality of extended-spectrum beta-lactamases in asia [J]. Clin Microbiol Infect, 2008,14(1):159-165.
[12] Hu F, Chen S, Xu X, et al. Emergence of carbapenem-resistant clinical enterobacteriaceae isolates from a teaching hospital in shanghai, china.[J]. J Med Microbiol, 2012,61(1):132-136.
[13] Gupta N, Limbago BM, Patel JB,et al.Carbapenem-resistant enterobacteriaceae: epidemiology and prevention [J]. Clin Infect Dis, 2011,53(1):60-67.
[14] Falagas ME, Karageorgopoulos DE, Nordmann P, et al. Herapeutic options for infections with Enter-obacteriaceae producing carbapenem-hydrolyzing enzymes[J]. Future Microbiol, 2011,6(6):653-666.
[15] 李多云,余治健,徐俊,等.利奈唑胺体外诱导粪肠球菌耐药株23SrRNA V区基因突变位点分析[J].中国病原生物学杂志, 2014,9(4):316-317.
[16]Diaz L, Kiratisin P, Rodrigo E, et al. Transferable plasmid-mediated resistance to linezolid due to cfr in a human clinical isolate of enterococcus faecalis[J]. Antimicrob Agents Chemother, 2012,56(7):3917-3922.
10.3969/j.issn.1002-266X.2016.26.029
R699.2;R631
B
1002-266X(2016)26-0080-03
2016-02-20)

