短柄樱桃干腐病病原菌的鉴定及其生物学特性*1
凌丹燕, 李永强, 路 梅, 郭卫东
(浙江师范大学化学与生命科学学院,浙江金华 321004)
短柄樱桃干腐病病原菌的鉴定及其生物学特性*1
凌丹燕,李永强,路梅,郭卫东
(浙江师范大学化学与生命科学学院,浙江金华321004)
为了明确短柄樱桃干腐病的病源,采用组织分离法和单孢分离法分离纯化了病原菌,依据柯赫法则、形态特征及核糖体基因内转录间隔区(rDNA-ITS)序列对其进行了鉴定,同时检测了其部分生物学特性.实验结果表明:引起短柄樱桃干腐病的病原菌为金黄壳囊孢菌(Cytospora chrysosperma;KR260904);该病菌菌落生长和孢子萌发的最适pH为9,最佳光照条件为12 h黑暗/12 h光照,最适温度为25℃;在供试的10种碳、氮源中,乳糖和蛋白胨利于该菌落的生长,葡萄糖和酵母有利于其孢子的萌发.
短柄樱桃;干腐病;金黄壳囊孢;鉴定;生物学特性
短柄樱桃(Prunus pseudocerasus cv.Duanbing)为蔷薇科(Rosaceae)李属(Prunus)落叶果树,主产浙江,有自花结实性好、丰产性佳、适应性强、果实大、成熟期早而集中等特点,是中国樱桃的优良栽培品种之一,现已成为中国南方樱桃产业发展的重点品种,并于1992年通过省级品种认定,为中国樱桃中通过省级认定的少数品种之一[1].但是,随着种植面积的扩增,各种真菌病害也随之普遍产生,主要有褐腐病、黑色轮纹病和枝枯病等.
干腐病是一种高发植物病害,在多种植物的栽培过程中皆有发生,危害严重.到目前为止,国内外对大樱桃、石榴、马铃薯、棕榈和花椒等植物的干腐病进行了许多研究报道[2].然而,对短柄樱桃干腐病的相关研究尚未见报道.2013年春,笔者在金华市雅畈镇的樱桃种植基地发现疑似干腐病的短柄樱桃病株:在植株的主干部有不规则形暗褐色病斑,病皮坚硬;切开表皮,木质部呈黄褐色(见图1),多株柔嫩植株整株死亡.本文对采集的疑似短柄樱桃干腐病的病株材料进行了病原菌的分类鉴定及其生物学特性研究.本研究结果将对短柄樱桃干腐病的发病机理与侵染机制研究,及对其病害的有效防治提供科学依据.

图1 短柄樱桃干腐病的症状
1 材料与方法
1.1供试材料
短柄樱桃干腐病枝条采自金华市雅畈镇浙江省特色经济植物生物技术研究重点实验室种植基地.
1.2短柄樱桃干腐病病原菌的分离和培养
采集具有显著病状的病样,采用常规植物组织分离法进行病原菌的分离.纯化后的菌株在PDA培养基上进行培养和形态学观察,同时进行斜面培养,置于4℃冰箱中保存备用[3].
1.3短柄樱桃干腐病病原菌的致病性检测
采用柯赫氏法则对病原菌进行致病性检测:将PDA培养5 d的病原菌用直径5 mm打孔器打孔形成菌饼,接种到经70%乙醇溶液表面消毒的健康短柄樱桃枝条上,枝条用“十字法”造成伤口.设接种菌饼和接种PDA培养基2个处理,每个处理重复6次,在25℃保湿培养,每天观察并记录发病状况,并对接种发病后的枝条进行病菌的再分离.
1.4病原菌的形态和生物特性研究
将菌种接种于PDA培养基中,置于28℃生化培养箱中培养6 d,用灭菌打孔器从菌落边缘打孔取直径为5 mm的菌饼,用于以下实验.
1.4.1培养性状的观察
配制4种培养基:PDA,Czapek,MYA(酵母浸膏1.5 g,麦芽浸膏1.5 g,琼脂2.0 g,水100 mL)和SZ(樱桃树皮10 g,琼脂2.0 g,水100 mL)[4],接种菌饼至不同的培养基平板,7 d后观察并记录各菌落的生长状态.每个实验均重复3次,且每次实验均重复4次(下同).
1.4.2碳氮源对菌落生长和孢子萌发的影响
配制3%不同碳源(葡萄糖、乳糖、麦芽糖、蔗糖和淀粉)及0.2%不同氮源(硫酸铵、草酸铵、酵母提取物、蛋白胨和硝酸铵)的查氏培养基平板,接种菌饼于28℃生化培养箱中培养,每间隔24 h用十字交叉法测量菌落直径,连续测量9 d,求其平均菌落直径.
分别用0.5%的葡萄糖、乳糖、麦芽糖、蔗糖、淀粉、硫酸铵、草酸铵、酵母提取物、蛋白胨和硝酸铵溶液配制孢子悬浮液(1×105~1×106/mL),各取适量孢子悬液涂布于载玻片上,在9,12和24 h后观察分生孢子的萌发情况,计算孢子萌发率.
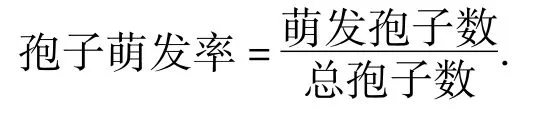
1.4.3pH对菌落生长和孢子萌发的影响
配制pH值分别为2,3,4,5,6,7,8,9,10,11 和12共11种PDA培养基.接种菌饼至不同pH值的培养基平板中央,置于28℃恒温培养.连续6 d测量菌落直径,求其平均菌落直径.
配制pH值为3,4,5,6,7,8,9,10,11和12的孢子悬浮液.取适量孢子悬浮液涂布于载玻片上,28℃恒温培养,在9,12和24 h后观察分生孢子的萌发情况,并计算孢子萌发率.
1.4.4光照对菌落生长和孢子萌发的影响
设置完全光照、完全黑暗、12 h光照/12 h黑暗和12 h黑暗/12 h光照4种光照条件,菌饼接种于PDA培养基上,培养5 d后测量菌落直径.
取适量孢子悬浮液涂布于载玻片上,在完全光照、完全黑暗、12 h光照/12 h黑暗和12 h黑暗/12 h光照4种条件下培养,9,12和24 h后观察分生孢子的萌发情况,统计孢子萌发率.
1.4.5温度对菌落生长和孢子萌发的影响
接种菌饼至PDA培养基中央,分别在5,10,15,20,25,30和35℃的恒温条件下培养6 d,观察菌落生长情况,连续6 d测量菌落直径.
取适量孢子悬液涂布于载玻片上,在5,10,15,20,25,30和35℃的恒温条件下培养,9,12和24 h后取出观察分生孢子的萌发情况,并统计孢子萌发率.
1.5rDNA-ITS的PCR扩增与序列分析
1.5.1基因组DNA的提取
采用改良CTAB法[5]提取樱桃干腐病病原菌DNA.
1.5.2PCR扩增
采用真菌通用引物ITS1和ITS4进行PCR扩增.25μL反应体系包括10×PCR buffer 2.5μL,dNTP溶液(10 mmol/L)2.0μL,ITS1和ITS4引物溶液各1μL,模板DNA溶液2μL,5 U/μL Taq酶溶液0.5μL,超纯水16μL.反应程序为:94℃预变性10 min;94℃变性30 s,54℃退火30 s,72℃延伸30 s,36个循环;72℃延伸10 min.PCR产物送上海英潍捷基有限公司测序.
1.5.3rDNA-ITS序列同源性比较
对测得的供试菌株rDNA-ITS区段的序列在GenBank核酸数据库的BLAST进行序列比对分析,采用MAGA 4软件构建病原菌进化树.
2 实验结果与分析
2.1短柄樱桃干腐病分离物的致病性
利用组织分离法从病健交界处的植物组织中分离得到8株疑似病原物(命名为DY1~8),分别进行了柯赫氏法则验证.接种结果显示,分离物DY3能够引起与分离植株相同症状的病害.通过病原物的再分离,得到与DY3培养性状相同的纯菌株.实验结果说明,分离物DY3是引起短柄樱桃干腐病的病原菌之一.
2.2短柄樱桃干腐病病原菌的形态学鉴定
将斜面保存的DY3菌株移至平板培养基培养5 d后,取5 mm菌饼置于新的PDA培养基上培养.菌落圆形,菌丝灰白色,呈绒毛状.1~5 d时,气生菌丝旺盛,菌落周围有一圈白色菌丝,中间出现深灰色基质菌丝,呈放射状,菌落直径达70~80 mm;6~10 d时,菌丝迅速生长,深灰色的基质菌丝明显增加,甚至有些已经出现少许孢子团,菌落周围仍是灰白色菌丝;10~15 d时,灰白色气生菌丝中形成黑色的孢子器,培养基中间和培养基边缘同玻璃接触处也有黑色的孢子器,孢子器逐渐增大且呈规则排列;15~20 d时,小颗粒状物上可以吐出淡黄色的孢子粘液.分生孢子单胞、无色、腊肠形,其大小为(0.68~1.36)μm× (3.74~6.80)μm(见图2).

图2 短柄樱桃干腐病病原菌的形态
2.3短柄樱桃干腐病病原菌rDNA-ITS序列分析
以分离物DY3的DNA为模板,用通用引物ITS1和ITS4对其核糖体rDNA-ITS进行PCR扩增,得到一个长度为 556 bp的扩增片段.用 BLAST软件在GenBank中搜索同源序列,分离物DY3与Cytospora chrysosperma的同源性为97%.短柄樱桃干腐病病原菌进化树见图3.结合上述菌落和孢子形态观察结果,鉴定该病原菌为金黄壳囊孢菌(Cytospora chrysosperma).
2.44种培养基中短柄樱桃干腐病病原菌的生长状态
从表1和图4可以看出,短柄樱桃干腐病病原菌DY3在不同培养基上的菌落颜色、生长速度与菌落形态都略有不同.就生长速度而言:在PDA培养基上,菌丝生长快速;在Czapek培养基上,菌丝生长缓慢;MYA和SZ培养基上介于两者之间.
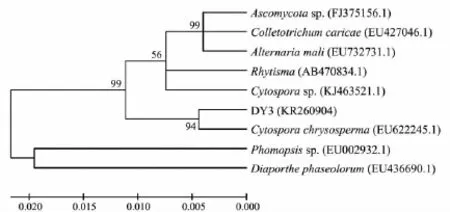
图3 短柄樱桃干腐病病原菌进化树

图4 短柄樱桃干腐病病原菌DY3在不同培养基上的菌落形态
2.5碳源对短柄樱桃干腐病病原菌菌落生长和孢子萌发的影响
图5显示了不同碳源对短柄樱桃干腐病病原菌DY3菌丝生长的影响.实验结果显示,碳源不是菌丝生长的决定性物质,即使在无碳源的情况下,DY3菌丝仍能够生长,只是生长受到抑制,并且菌丝呈透明状.在5种供试碳源中,最适菌丝生长的碳源为乳糖;最适合孢子萌发的碳源为葡萄糖,24 h萌发率接近70%,远远高于其他碳源中的孢子萌发率(见图6).

图5 碳源对短柄樱桃干腐病病原菌菌落生长的影响
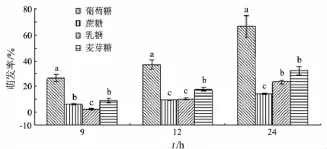
图6 碳源对短柄樱桃干腐病病原菌孢子萌发的影响
2.6氮源对短柄樱桃干腐病病原菌菌落生长和孢子萌发的影响
根据图7显示,不同氮源对短柄樱桃干腐病病原菌DY3菌丝生长的影响不同.就菌落生长速率而言,酵母提取物、蛋白胨>无氮源>草酸铵>硫酸铵>硝酸钠.从菌落生长状况看,无氮源培养基上虽然菌落生长速率不受影响,但菌丝颜色近透明,说明并不能满足菌丝的正常生长.从产孢情况看,以蛋白胨、硝酸铵和硫酸铵为氮源的查氏培养基更有利于病原菌产孢,相比之下蛋白胨查氏培养基中孢子团长得更密集.在孢子萌发过程中,蛋白胨最能刺激孢子的萌发(见图8),24 h孢子萌发率达到80%,其次是硝酸铵和硫酸铵,草酸铵最差.
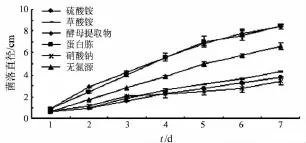
图7 氮源对短柄樱桃干腐病病原菌菌落生长的影响

图8 氮源对短柄樱桃干腐病病原菌孢子萌发的影响
2.7pH对短柄樱桃干腐病病原菌菌落生长和孢子萌发的影响
不同酸碱度培养基对短柄樱桃干腐病病原菌DY3菌丝生长和孢子萌发率的影响见图9和图10.在极端酸碱度条件下(pH=2,12),病原菌菌丝基本不生长;在pH 4~11条件下,病原菌的菌落长势较快,其中pH值为8和9时长势更好.从图10可以看出:当pH值为5和9时,病原菌的孢子萌发率最高;以pH 7为中点向两端变化,萌发率呈先递增后递减的趋势.因此,适合短柄樱桃干腐病病原菌孢子萌发的培养基酸碱度为pH 5 和pH 9.结合病原菌菌落生长状况和孢子萌发率,最适合病原菌DY3生长的pH值为9.

图9 pH对短柄樱桃干腐病病原菌菌落生长的影响

图10 pH对短柄樱桃干腐病病原菌孢子萌发的影响
2.8光照对短柄樱桃干腐病病原菌菌落生长和孢子萌发的影响
从图11不同光照处理对短柄樱桃干腐病病原菌DY3菌丝生长的影响可以看出:全黑暗不利于该菌菌丝的生长;12 h光照/12 h黑暗处理下菌丝生长速率提高;12 h黑暗/12 h光照处理下菌丝的生长速率显著提高,菌落直径达8 cm,与全光照处理无显著差异.12 h黑暗/12 h光照处理下菌丝的生长速率明显高于12 h光照/12 h黑暗处理,说明菌丝的生长不仅受光照时间长短的影响,光暗交替的次序也是决定菌丝生长速率的因素之一.图12显示了随着培养时间的延长,各光照处理孢子的萌发率均升高.培养24 h后,12 h黑暗/12 h光照处理的孢子萌发率显著高于其他处理.由此可见,短柄樱桃干腐病病原菌DY3孢子萌发的最佳光照条件为先12 h黑暗培养、再12 h光照处理.

图11 光照对短柄樱桃干腐病病原菌菌落生长的影响

图12 光照对短柄樱桃干腐病病原菌孢子萌发的影响
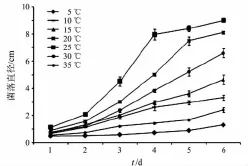
图13 温度对短柄樱桃干腐病病原菌菌落生长的影响

图14 温度对短柄樱桃干腐病病原菌孢子萌发的影响
2.9温度对短柄樱桃干腐病病原菌菌落生长和孢子萌发的影响
温度对短柄樱桃干腐病病原菌DY3菌落生长的影响较大.从图13可以看出,不同温度下菌落直径大小为25℃>20℃ >30℃ >15℃ >10℃>35℃>5℃,菌落直径大小随着温度的升高先增大后减小,而25℃为菌落生长最适温度.从图14可知不同温度对金黄壳囊孢菌孢子萌发的影响.25℃孢子萌发率最高,35℃和5℃孢子萌发率较低.结合菌落生长情况和孢子萌发率,25℃是培养短柄樱桃干腐病病原菌的适宜温度.
3 讨论和结论
关于短柄樱桃干腐病的分子鉴定和生物学特性研究尚未见有相关文献报道.但是,由真菌侵染引起的植株干腐病却是世界性的植物病害,对许多作物和观赏植物构成严重的威胁[6-7].本研究首次对短柄樱桃干腐病进行了研究,根据分离菌株的柯赫氏法则验证和rDNA-ITS分子鉴定结果,确认引起短柄樱桃干腐病的病原菌DY3为金黄壳囊孢菌(C.chrysosperma),其形态学特征与陈海燕[8]、杨明秀[9]的研究报道相似:菌落圆形,菌丝灰白色,呈绒毛状;分生孢子单孢、腊肠形、无色.
金黄壳囊孢菌是引起树木腐烂病的一类重要病害,分布广泛,受害树种种类多,给农业生产造成严重的经济损失,其危害对象主要包括杨树、柳树、核桃、樱桃等.目前,国内外对此病原菌的研究主要集中在杨树干腐病.杨明秀等[10]通过对各地区杨树干腐病病原菌遗传多样性的研究发现,中国金黄壳囊孢菌(C.chrysosperma)能引起杨树腐烂病,并且其致病性与地理来源不存在明显的关系.由于缺少较为系统性的资料,金黄壳囊孢菌的鉴定较为困难.在形态学研究上主要根据Fotouhifar等[11]和Adams等[12]等对壳囊孢属的形态学描述,鉴定的主要依据为子实体结构和分生孢子形态及大小.本研究将分子生物学手段和传统形态学方法相结合,提高了鉴定结果的准确性[13].
本研究首次对引起短柄樱桃干腐病的金黄壳囊孢菌的生物学特性进行了系统研究.研究发现:金黄壳囊孢菌在PDA,Czapek,MYA和SZ这4种不同的培养基上菌落颜色、形态、生长速度等都有一定的区别;在SZ培养基上产生同心圆轮纹,但是菌落气生菌丝旺盛,这与张星耀等[4]的研究结果有所不同,推测可能是病原菌种来源不同所致.在不同的碳、氮源对菌丝生长和孢子萌发影响的研究中,发现:乳糖能促进菌丝最快生长,葡萄糖则最适于其分生孢子的萌发;酵母提取物和蛋白胨均利于其菌落生长,蛋白胨则最适于其孢子萌发.这与冀瑞卿等[14]对金黄壳囊孢菌生物学特性的研究相一致.同时,冀瑞卿等[14]发现金黄壳囊孢菌培养的最适pH值为5~6,但本研究发现其最适pH值为9.
关于植物干腐病害病原菌鉴定已有很多报道.李晓琴等[15]发现尖孢镰刀菌(Fusarium oxysporum f.sp)能够引起维管束病害,导致唐菖蒲干腐病的发生;而王璇等[16]对山核桃干腐病的研究发现,引起山核桃干腐病发生的病原菌主要为葡萄座腔菌(Botryosphaeria dothidea).本文关于金黄壳囊孢菌引起短柄樱桃干腐病的报道,是国内外首次报道.通过病原菌分离鉴定及其生物学特性研究,为阐明短柄樱桃干腐病的发生机理提供了实验依据.在今后的研究中,将开展有关药剂毒理等实验,为短柄樱桃干腐病害的有效防治提供切实可行的技术指导.
[1]陈镇,李永强,陈文荣,等.温度对短柄樱桃花芽萌发及若干生理指标的影响[J].浙江师范大学学报:自然科学版,2010,33(2):210-215.
[2]Kozlakidis Z,Covelli L,Di Serio F,etal.Molecular characterization of the largestmycoviral-like double-stranded RNAs associated with Amasya cherry disease,a disease of presumed fungal aetiology[J].Journal of General Virology,2006,87(2):3113-3117.
[3]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998:119-153.
[4]张星耀,陈海燕,梁军,等.金黄壳囊孢菌(Cytospora chrysosperma)的培养性状和营养体亲和性[J].西北农林科技大学学报:自然科学版,2007,35(3):99-105.
[5]李永强,杨佳妮,陈文荣,等.佛手采后致病青霉的分离鉴定[J].植物病理学报,2011,41(5):534-537.
[6]Ren Jiahong,Li Hao,Wang Yanfang,et al.Biocontrol potential of an endophytic Bacillus pumilus JK-SX001 against poplar canker[J].Biological Control,2013,67(3):421-430.
[7]Purkayastha S,Kaur B,Dilbaghi N,et al.Characterization of Macrophomina phaseolina,the charcoal rot pathogen of cluster bean,using conventional techniques and PCR-based molecularmarkers[J].Plant Pathology,2006,55(1):106-116.
[8]陈海燕.杨树溃疡病病原菌营养体亲和性研究[D].杨凌:西北农林科技大学,2006.
[9]杨明秀.中国金黄壳囊孢菌遗传多样性及杨树防御机制研究[D].哈尔滨:东北林业大学,2014.
[10]杨明秀,宋瑞清.中国金黄壳囊孢菌的致病性分化及遗传多样性[J].林业科学,2013,49(6):115-121.
[11]Fotouhifar K B,Hedjaroude G A,Leuchtmann A.ITS-rDNA phylogeny of Iranian strains of Cytospora and associated teleomorphs[J].Mycologia,2010,102(6):1369-1382.
[12]Adams G C,Roux J,Wingfield M J.Cytospora species(Ascomycota,Diaporthales,Valsaceae):introduced and native pathogens of trees in South Africa[J].Australasian Plant Pathology,2006,35(5):521-548.
[13]Fan Xinlei,Hyde K D,Liu Min,et al.Cytospora species associated with walnut canker disease in China,with description of a new species C. gigalocus[J].Fungal Biology,2015,119(5):310-319.
[14]冀瑞卿,李玉,宋瑞清,等.金黄壳囊孢菌rDNA ITS序列测定及生理学特性[J].吉林农业大学学报,2010,32(5):483-487.
[15]李晓琴,黄云,陈捷,等.唐菖蒲干腐病病原生物学特性[J].上海交通大学学报:农业科学版,2008(4):308-312.
[16]王璇,马良进,吕全,等.山核桃干腐病病原菌的鉴定[J].浙江农林大学学报,2014,31(2):238-245.
(责任编辑薛荣)
Identification and biological characteristic researches of rot pathogen isolated from Chinese cherry(Prunus pseudocerasus)
LING Danyan, LIYongqiang, LU Mei, GUOWeidong
(College of Chemistry and Life Sciences,Zhejiang Normal University,Jinhua 321004,China)
To identify the pathogen causing Chinese cherry(Prunus pseudocerasus)rot,tissue separation and monospore isolation were used to isolate and purify the pathogen.The pathogen identification was carried out based on Koch's postulates,morphology and ribosomal internal transcribed spacer genes(rDNA-ITS).And partial biological characteristics of the pathogen were tested in vitro at the same time.The results showed that the rot pathogen diseasewas caused by Cytospora chrysosperma(KR260904),and the optimum pH for itsmycelia growth and conidia germination was9,and the optimum illumination was12 h of illumination followed by 12 h of darkness,the optimum temperaturewas25℃.In 10 kinds of carbon and nitrogen source,lactose and peptone were better formycelia growth,while glucose and yeast promoted obviously conidia germination.The resultswould be helpful for the illumination of the pathogenesis and infection mechanism of the disease.
Chinese cherry;rot pathogen;Cytospora chrysosperma;identification;biological characteristics
Q945.8
A
1001-5051(2016)02-0200-07
10.16218/j.issn.1001-5051.2016.02.013
*收文日期:2015-04-20;2015-06-05
浙江省重中之重学科“现代农业生物技术与作物病害防控”开放基金资助项目(2012KFJJ014);浙江省自然科学基金资助项目(Y3110194)
凌丹燕(1990-),女,浙江海宁人,硕士研究生.研究方向:生物化学与分子生物学.
路梅.E-mail:lumei@zjnu.cn

