原癌基因MET启动子的G-四链体结构
阎 敬,关一夫
(中国医科大学基础医学院生物化学与分子生物学教研室,沈阳110122)
原癌基因MET启动子的G-四链体结构
阎敬,关一夫
(中国医科大学基础医学院生物化学与分子生物学教研室,沈阳110122)
目的解析原癌基因MET启动子中的G-四链体结构,并初步探索其功能。方法采用圆二色光谱、紫外吸收光谱、非变性凝胶电泳和PCR Stop实验分析MET启动子富含G的Pu23WT序列的G-四链体拓扑结构特征,并分析该结构的功能。结果MET启动子的Pu23WT序列形成了分子内平行型G-四链体结构,该结构能够阻滞聚合酶链反应。结论原癌基因MET启动子形成的分子内G-四链体结构在细胞内K+条件下可能负性调控基因表达。
G-四链体;原癌基因MET;基因表达调控
网络出版地址
人类基因组DNA的主要二级结构是经典的B型双螺旋结构,此外还存在G-四链体、三链体、i-模体等二级结构类型,DNA结构多样性与其功能多样性是密不可分的。上世纪60年代首次报道了某些富含鸟嘌呤(G)的DNA序列能够形成G-四链体结构[1],它是由4个G通过Hoogsteen氢键形成G-四分体平面,多个G-四分体平面之间由不同的环连接成G-四链体结构,并且平面中心能够容纳一个阳离子。近年的研究陆续发现,在富含G的原癌基因启动子、mRNA的5′非翻译区、核糖体DNA和端粒末端序列等都能够形成G-四链体结构,该结构在基因表达调控过程中发挥着重要的作用。
原癌基因MET位于人类7号染色体长臂(7q31),编码的MET蛋白(也称为肝细胞生长因子受体)具有酪氨酸激酶活性[2]。它的激酶活性可被配体肝细胞生长因子、配体非依赖途径及其他肝细胞生长因子非依赖的受体激活,活化的MET通路通过不同的机制引发一系列磷酸化反应,激活PI-3K、ERK1/2、PLC-γ、STATs、Src和Ras等重要信号通路,从而参与肿瘤的发生、增殖、分化、血管形成、侵袭和转移过程[3]。
生物信息学分析揭示:MET启动子转录起始位点近端区域富含G(启动子-48~-26核酸序列GC GGGCGGGCGGGGCGCTGGGCT,命名为Pu23WT),可能形成G-四链体结构。本研究利用多种生物物理和分子生物学实验方法,详细解析MET启动子的G-四链体结构特点及其在MET基因表达调控中的作用。
1 材料与方法
1.1主要试剂与仪器
MET启动子富含G区域的寡核苷酸序列、突变体及引物等由上海生工生物技术有限公司合成;Stains-all购自美国Sigma-Aldrich公司;Klenow Fragment购自大连TaKaRa生物技术公司;UV-Visible分光光度计Cary100购自美国Varian公司;圆二色光谱仪J-810购自日本分光株式会社。
1.2圆二色光谱分析
将MET基因近端启动子-48~-26的Pu23WT序列及其突变体(表1)制备成pH7.4的寡核酸溶液(5 μmol/L寡核酸,140 mmol/L K+,20 mmol/L二甲胂酸钠),然后将该溶液在95℃水浴中变性5 min,缓慢冷却至室温(约25℃),放置过夜;用空白溶液调零后,在0.1 cm样品池中加入500 μL样品,在室温扫描200~350 nm的圆二色光谱,每个样品重复扫描3次。

表1 Pu23WT及其突变体Tab.1 Pu23WT and its mutants
1.3紫外吸收光谱分析
Pu23WT及其突变体样品的准备与采集圆二色光谱的准备方法相同;空白溶液调零后,在比色杯中加入150 μL样品,采集295 nm波长的20~95℃3个循环的吸光度,分别计算变性与复性测量结果的平均值,制作样品的变性、复性和fraction folded曲线,并计算解链温度。
1.4非变性凝胶电泳
将用于圆二色光谱测定的寡核酸样品95℃变性5 min,缓慢冷却至室温(约25℃),然后4℃静置10 min;配制20%非变性聚丙烯酰胺凝胶,4℃缓慢聚合;上样,待样品自然沉降后,在4℃50 V电泳15 min,然后4℃120 V电泳约90 min;室温避光Stains-all溶液中染色过夜,次日曝光约30 min,扫描仪成像。
1.5PCR stop分析
在Pu23WT的3′末端加上9 nt的随机寡核酸(即Pmet序列:GCGGGCGGGCGGGGCGCTGGGC TATGTTCACG),引物(序列:ATCCAGAAGTACGT GAACAT)与Pmet的3′末端互补,在Klenow Fragment的作用下向两端延伸,形成DNA双链结构。如果Pmet序列形成了G-四链体结构,可能抑制Klenow Fragment的聚合作用。分别配制含0 mmol/L、50 mmol/L和140 mmol/L K+的20 μL反应体系,室温反应30 min,加入上样缓冲液终止反应;在室温条件下,15%聚丙烯酰胺凝胶用120 V电压进行电泳70 min;EB染色5 min,凝胶成像仪成像。
2 结果
2.1圆二色光谱和紫外吸收光谱
目前圆二色光谱是最简单、最直接的分析DNA二级结构的常用实验技术,并且圆二色光谱能够区分G-四链体的拓扑学特征,广泛用于研究G-四链体的构型变化。生物信息学分析提示,在MET启动子转录起始位点近端富含G岛的DNA序列中可能形成G-四链体结构,为了解析G-四链体结构的形成、拓扑结构特点及其稳定性,本研究将MET启动子的Pu23WT序列的不同G岛的G逐一突变(表1),然后模拟生理条件检测Pu23WT及其突变体的圆二色光谱(图1)。Pu23G7T与Pu23G10T两个突变体依然保持了与Pu23WT相似的光谱特征:在265 nm附近有正吸收峰,240 nm有负吸收峰,这是平行型G-四链体结构的特征性圆二色光谱;突变体Pu23G1T和Pu23G3T在265 nm附近有一个小的正吸收峰、240 nm的负吸收峰以及290 nm附近的肩峰,提示它们形成了混合型G-四链体结构;Pu23G12/13T则可能形成了平行型G-四链体结构。圆二色光谱的信号强度提示Pu23G7T和Pu23G10T能够形成稳定的G-四链体结构,由此推测Pu23WT序列形成了由3层G-四分体堆积而成的G-四链体结构,即第1个、第2个和第4个G岛以及第3个G岛的5′端或者3′端的3个连续G参与形成了稳定的G-四链体结构。
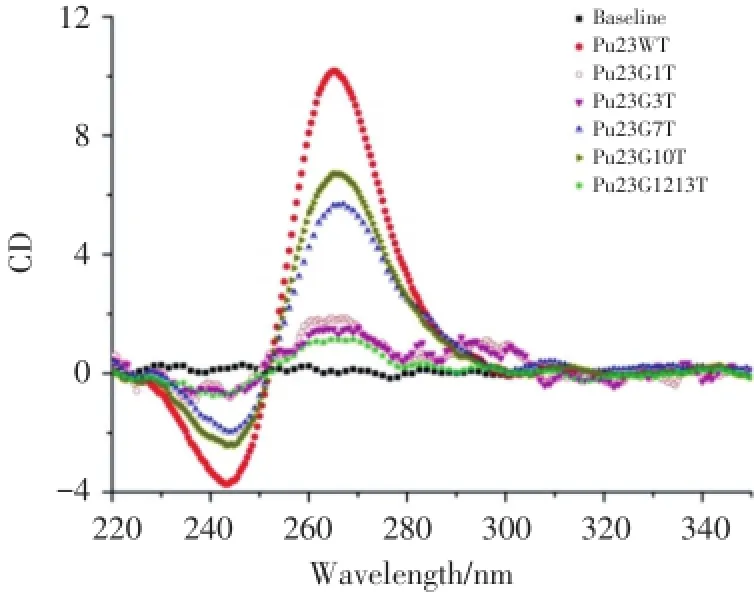
图1 Pu23WT及其突变体的圆二色光谱Fig.1 CD spectra of Pu23WT and the mutants
利用紫外分光光度计采集295 nm处的Pu23WT及其突变体升温、降温过程的吸收光谱,并比较2个光谱是否拟合。如果完全重合,表明形成的G-四链体是单分子的G-四链体,反之表明这个G-四链体是由多分子形成的。Pu23WT、Pu23G7T与Pu23G10T的升温与降温吸收曲线基本可逆(图2A、2C和2E),说明它们是单分子G-四链体结构。根据升温、降温过程的吸收光谱制作fraction folded曲线,计算得到Pu23WT、Pu23G7T与Pu23G10T的解链温度分别为80.32℃、76.02℃和79.57℃(图2B、2D和2F)。
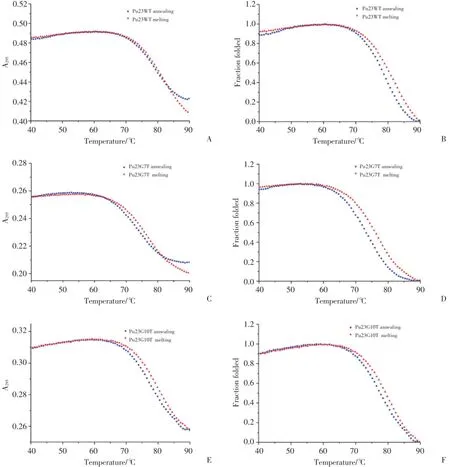
图2 紫外吸收光谱和fraction folded曲线Fig.2 UV spectra and fraction folded curves
2.2非变性凝胶电泳结果
由于Pu23WT及其突变体形成的G-四链体空间构象不同,分子的紧密程度不同,导致其在非变性聚丙烯酰胺凝胶电泳中迁移率也不同:分子内的G-四链体结构的迁移率大于单链分子,单链分子的迁移率大于分子间G-四链体结构。根据聚丙烯酰胺凝胶电泳结果,通过分析样品与分子量标记物的位置关系,推测Pu23WT及其突变体是否形成G-四链体结构以及形成的G-四链体结构是分子内还是分子间构型。在140 mmol/L K+溶液中Pu23WT的迁移率大于25 nt单链分子,说明Pu23WT形成了分子内G-四链体结构;其突变体Pu23G7T和Pu23G10T迁移率更大些,也形成了分子内的G-四链体结构(图3)。
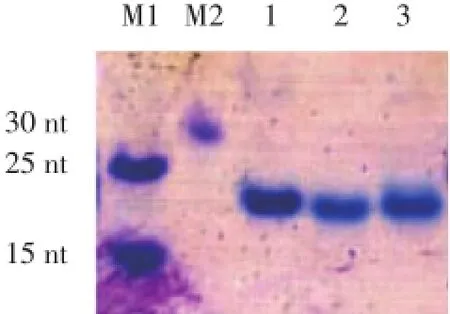
图3 140 mmol/L K+溶液中非变性凝胶电泳结果Fig.3 Non-denatured electrophoresis assay in the buffer of 140 mmol/L K+
2.3PCR stop电泳结果
G-四链体的每个G-四分体平面中心有一个由4个带负电荷的氧原子围成的袋状结构,具有很强的负电性,带正电荷的金属离子或者小分子配体可以与之配位。不同金属离子能够诱导同一DNA序列形成特异拓扑结构的G-四链体,并且金属离子能够提高G-四链体的稳定性。在多种金属离子中,已经证明K+能够稳定G-四链体拓扑结构。在不同浓度的K+溶液中,序列Pmet的Klenow Fragment聚合实验结果显示:无K+的Klenow Fragment体系的扩增效率远高于有K+的扩增体系(图4),说明K+促进Pu23WT形成的G-四链体结构通过空间位阻效应阻滞了Klenow Fragment聚合反应的进行。上述结果显示,MET启动子的Pu23WT序列形成在K+的环境中能够形成分子内平行型G-四链体结构,并且该结构能够阻滞聚合酶链反应。
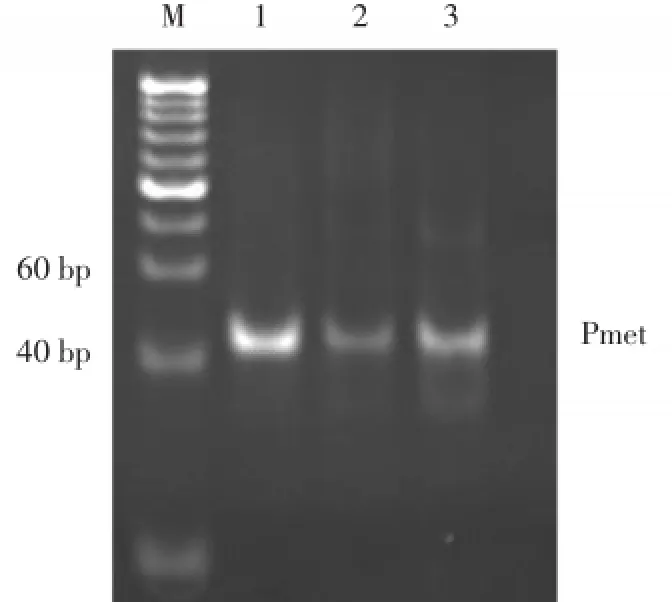
图4 Pmet的K+浓度依赖的PCR stop实验Fig.4 PCR stop assay results of Pmet in the presence of K+
3 讨论
不同的DNA序列、超螺旋的拓扑结构、离子浓度、DNA结合蛋白和其他修饰[4]可使DNA瞬时形成非B型双螺旋结构,例如Z-DNA、三链体、十字交叉型、发夹、G-四链体和i-模体结构。有研究证明c-MYC[5]、VEGF[6]、HIF-1α[7]、RET[8]、KRAS[9]、BCL-2[10]和c-MYB[11]等多个原癌基因的启动子能够形成G-四链体结构,并且抑制基因表达,从而抑制肿瘤细胞增殖,促进细胞凋亡,减缓肿瘤细胞侵袭和转移。由此可见,通过诱导原癌基因启动子区域形成G-四链体结构可以抑制基因的表达,进而影响肿瘤细胞的生物学行为。
[1]Gellert M,Lipsett MN,Davies DR.Helix formation by guanylic acid[J].Proc Natl Acad Sci USA,1962,48(12):2013-2018.
[2]Bottaro D,Rubin J,Faletto D,et al.Identification of the hepatocyte growth factor receptor as the c-met proto-oncogene product[J].Science,1991,251(4995):802-804.
[3]Eder JP,Vande Woude GF,Boerner SA,et al.Novel therapeutic inhibitors of the c-Met signaling pathway in cancer[J].Clin Cancer Res,2009,15(7):2207-2214.
[4]Wells RD,Blakesley RW,Hardies SC,et al.The role of DNA structure in genetic regulation[J].CRC Crt Rev Biochem,1977,4(3):305-340.
[5]Seenisamy J,Rezler EM,Powell TJ,et al.The dynamic character of the G-quadruplex element in the c-MYC promoter and modification by TMPyP4[J].J Am Chem Soc,2004,126(28):8702-8709.
[6]Guo K,Gokhale V,Hurley LH,et al.Intramolecularly folded G-quadruplex and i-motif structures in the proximal promoter of the vascular endothelial growth factor gene[J].Nucleic Acids Res,2008,36(14):4598-4608.
[7]Guan Y,Reddy KR,Zhu Q,et al.G-rich oligonucleotides inhibit HIF-1α and HIF-2α and block tumor growth[J].Mol Ther,2010,18(1):188-197.
[8]Guo K,Pourpak A,Beetz-Rogers K,et al.Formation of pseudosymmetrical G-quadruplex and i-motif structures in the proximal promoter region of the RET oncogene[J].J Am Chem Soc,2007,129(33):10220-10228.
[9]Cogoi S,Paramasivam M,Spolaore B,et al.Structural polymorphism within a regulatory element of the human KRAS promoter:formation of G4-DNA recognized by nuclear proteins[J].Nucleic Acids Res,2008,36(11):3765-3780.
[10]Ishimaru D,Zuraw L,Ramalingam S,et al.Mechanism of regulation of bcl-2 mRNA by nucleolin and A+U-rich element-binding factor 1(AUF1)[J].J Biol Chem,2010,285(35):27182-27191.
[11]Broxson C,Beckett J,Tornaletti S.Transcription arrest by a G quadruplex forming-trinucleotide repeat sequence from the human cmyb gene[J].Biochemistry,2011,50(19):4162-4172.
(编辑陈姜)
G-quadruplex Structures in promoters of MET proto-oncogene
YAN Jing,GUAN Yifu
(Department of Biochemistry and Molecular Biology,College of Basic Medical Science,China Medical University,Shenyang 110122,China)
Objective To identify G-quadruplex structures in the promoter region of MET.Methods CD spectroscopy,UV spectroscopy,nondenatured electrophoresis and PCR stop assay were applied to indicate the G-quadruplex structure and its function.Results The Pu23WT sequence in the promoter of MET adopted an intramolecular parallel G-quadruplex structure under physiological conditions in vitro,which can stop the extension of Pmet.Conclusion G-quadruplex structure in the promoter might inhibit MET gene expression in vivo.
G-quadruplex;MET proto-oncogene;regulation of gene expression
R730.53
A
0258-4646(2016)05-0402-04
10.12007/j.issn.0258-4646.2016.05.005
国家自然科学基金(31070705)
阎敬(1980-),女,讲师,博士.
关一夫,E-mail:yfguan@mail.cmu.edu.cn
2015-11-27
网络出版时间:

