BRCA1在不同化疗敏感性浆液性卵巢癌中的表达及表观遗传学调节机制
李 达,毕芳芳,杨 清
(中国医科大学附属盛京医院妇产科,沈阳110004)
BRCA1在不同化疗敏感性浆液性卵巢癌中的表达及表观遗传学调节机制
李达,毕芳芳,杨清
(中国医科大学附属盛京医院妇产科,沈阳110004)
目的探讨不同化疗敏感性浆液性卵巢癌组织中BRCA1的表达水平及介导BRCA1表达的表观遗传学分子机制。方法选取化疗敏感与化疗耐药的卵巢癌组织标本各10例,利用实时荧光定量PCR方法验证差异化疗敏感性的卵巢癌组织中BRCA1的表达特点;采用焦磷酸测序技术分析这些差异化疗敏感性的卵巢癌标本中BRCA1基因启动子区域1~4位点的甲基化水平;采用回归分析研究BRCA1基因差异的甲基化位点与BRCA1表达的相关性。结果化疗耐药的卵巢癌组织BRCA1表达水平显著升高,同时耐药组BRCA1基因核心启动子区域1~4位点甲基化水平降低;值得注意的是,位点4甲基化水平降低最明显,同时与BRCA1表达呈显著负相关。结论研究结果提示,BRCA1基因启动子核心区域位点4的甲基化水平降低,可能显著影响BRCA1的转录调节及其相关的卵巢癌化疗敏感性。
卵巢癌;BRCA1;化疗敏感性;表观遗传学;DNA甲基化
网络出版地址
卵巢癌是严重威胁女性健康的妇科恶性肿瘤之一[1]。当前研究资料表明,Ⅰ~Ⅱ期卵巢癌患者5年生存率为80%~95%,而卵巢癌晚期(Ⅲ~Ⅳ期)虽经过规范化的治疗,包括理想的肿瘤细胞减灭术和以铂类和(或)紫杉醇为基础的联合化疗,其5年生存率仍在15%~20%左右,化疗耐药是造成卵巢癌患者5年生存率得不到改善的重要原因[1-2]。因此,明确卵巢癌耐药机制是当今妇科领域迫切需要解决的问题之一。
由铂类耐药机制可知,DNA损伤修复能力强弱是决定卵巢癌组织顺铂敏感性的重要原因之一[3]。众所周知,BRCA1是DNA损伤修复的重要因子[3]。同时研究[4]显示,约50%的家族遗传性卵巢癌患者携带BRCA1胚系突变,约50%~80%的散发型卵巢癌BRCA1表达水平显著降低。当前普遍认为BRCA1功能增强介导的DNA损伤修复能力上调,是卵巢癌化疗耐药的重要原因。然而,针对BRCA1功能增强机制方面的理解仍非常有限,本研究拟从DNA甲基化的角度探讨差异化疗敏感性的卵巢癌组织BRCA1表达调控的表观遗传学机制。
1 材料与方法
1.1材料
收集中国医科大学附属盛京医院妇产科2012至2015年手术切除的原发性卵巢癌患者标本20例,患者年龄35~60(50.4±7.4)岁。标本分为2组:敏感组(n=10),患者经理想的肿瘤细胞减灭术联合以紫杉醇和铂类为基础的化疗6~8个疗程,达到临床完全缓解;耐药组(n=10),肿瘤细胞减灭术后化疗过程中肿瘤仍进展,肿瘤标志物(如CA125)等持续不降,二次探测手术有残余病灶或停药半年内出现肿瘤复发。
1.2焦磷酸测序技术
利用美国Qiagen公司生产的亚硫酸盐修饰试剂盒对基因组DNA进行亚硫酸盐转化;随后利用美国Bioline公司生产的DNA扩增试剂盒对修饰好的DNA进行扩增,扩增引物见表1,扩增条件为95℃2 min,40个循环(95℃15 s,56℃15 s,72℃30 s)。扩增后,纯化生物素标记的PCR产物,并将该产物用表1中的引物孵育;用美国Qiagen生产的测序试剂进行焦磷酸测序,并用PyroMark Q24 1.010软件计算甲基化比例。
1.3荧光定量PCR
总RNA利用美国Invitrogen公司的Trizol试剂进行提取;随后用DNaseⅠ去除污染的基因组DNA;2 μg总RNA利用日本TaKaRa公司生产的反转录试剂盒进行反转录,随后在美国罗氏Roche LightCycler 2.0仪器中进行荧光定量反应,样本分析采用2-△△Ct方法进行。扩增引物见表1。
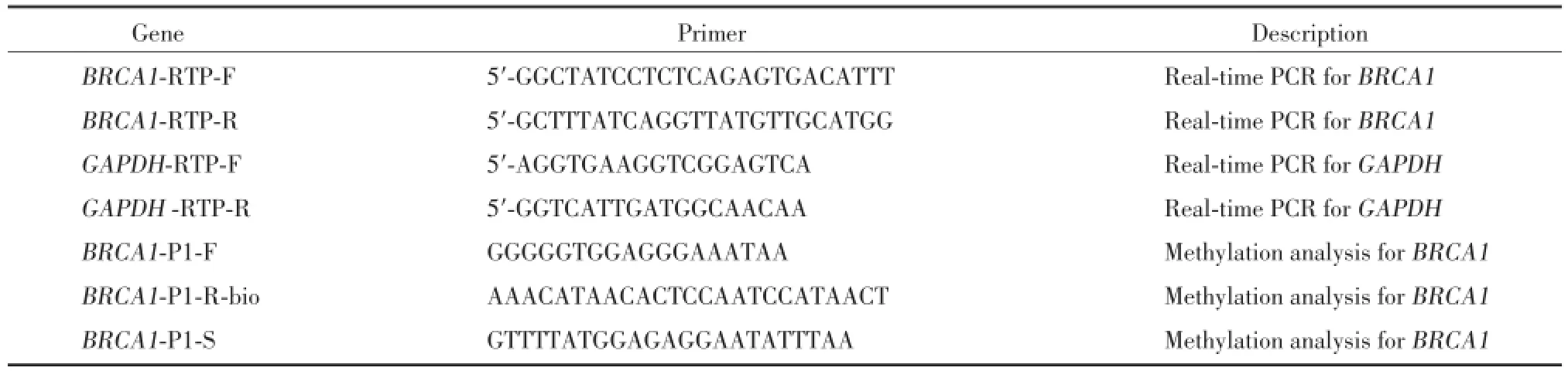
表1 引物序列表Tab.1 Primers used in this study
1.4统计学分析
2 结果
2.1实时荧光定量PCR分析BRCA1基因的表达水平
与化疗敏感的卵巢癌组织相比,化疗耐药的卵巢癌组织BRCA1表达水平显著升高(P<0.05)。见图1。
2.2焦磷酸测序技术分析BRCA1启动子核心区域1~4位点甲基化水平
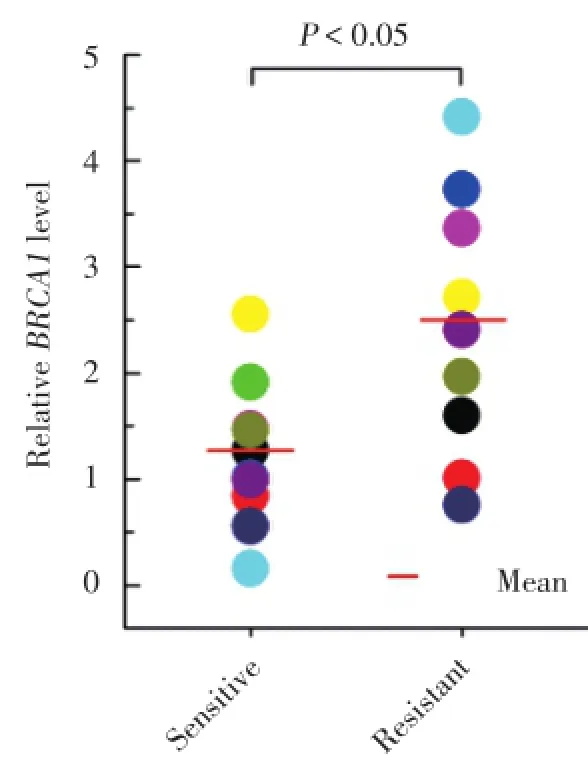
图1 BRCA1mRNA表达水平Fig.1 Expression level of BRCA1 mRNA
前期研究[5]证实BRCA1基因1~4位点甲基化程度显著代表BRCA1启动子核心区域甲基化水平,此次利用焦磷酸测序技术分析化疗敏感与化疗耐药的卵巢癌组织BRCA1基因1~4位点的甲基化水平。结果显示,与化疗敏感的卵巢癌组织相比,化疗耐药的卵巢癌组织BRCA1核心启动子区域1~4位点甲基化水平显著降低。见图2。
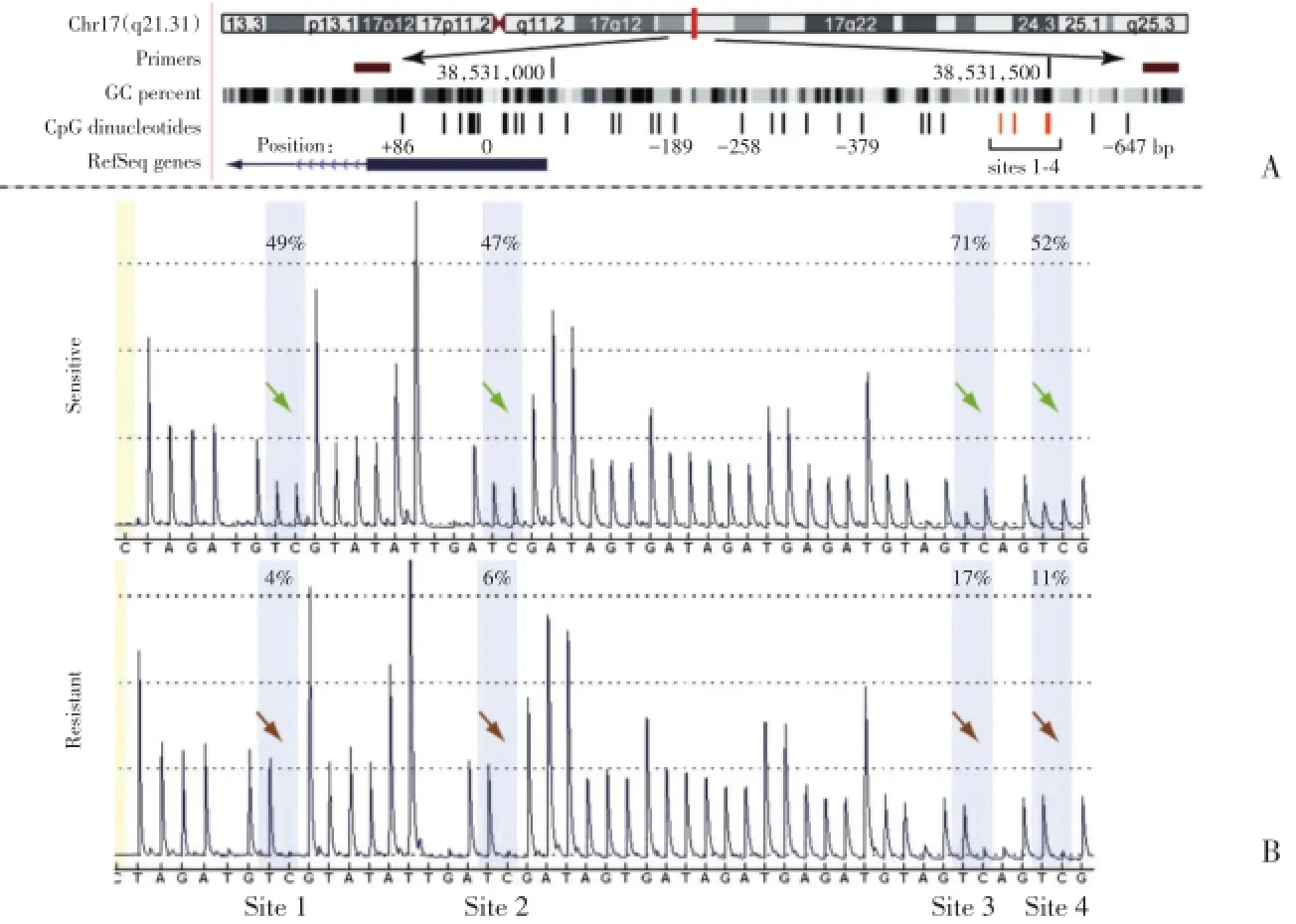
图2 BRCA1核心启动子区域1~4位点甲基化样式Fig.2 Methylation pattern of sites 1-4 in the core promoter region of BRCA1
2.3化疗敏感与化疗耐药的卵巢癌组织中BRCA1基因1~4位点甲基化程度
经统计学分析发现,与化疗敏感的卵巢癌组织相比,化疗耐药的卵巢癌组织1~4位点的甲基化水平均降低,其中位点4甲基化比例降低差异有统计学意义(P<0.05)。见图3。
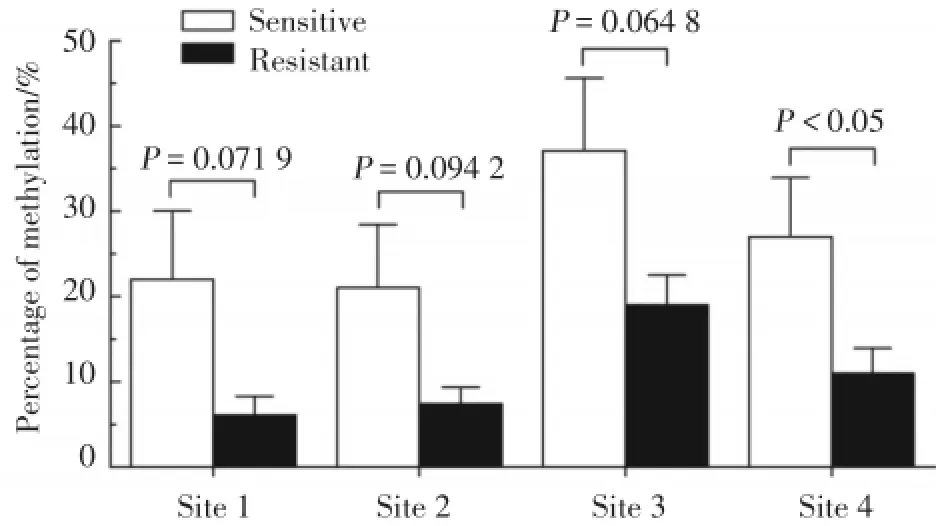
图3 BRCA1核心启动子区域1~4位点甲基化水平Fig.3 Methylation levels of sites 1-4 in the core promoter region of BRCA1
2.4卵巢癌组织中1~4位点甲基化水平与BRCA1表达水平的相关性
回归分析发现,位点3和位点4与BRCA1的表达水平呈现一定程度的负相关,并且回归模型有统计学意义(P<0.05)。见图4。
3 讨论
本研究提示:化疗耐药的卵巢癌组织BRCA1表达水平显著升高,同时耐药组BRCA1基因核心启动子区域1~4位点甲基化水平均有降低趋势,但位点4甲基化比例降低最为明显,位点3和位点4与BRCA1表达呈显著负相关。该数据提示,BRCA1核心启动子区域位点4的甲基化程度,可能显著参与BRCA1的转录调节及其相关的卵巢癌化疗敏感性。
众所周知,BRCA1是乳腺癌和卵巢癌易感基因,广泛参与细胞的转录调节[6]、表观遗传学调控[7]和细胞代谢[8]。值得注意的是,我们先前的研究[5]证实,BRCA1能够显著参与依赖于NAD+的组蛋白去乙酰化酶1相关的能量代谢和应激反应,同时在卵巢进展过程中,BRCA1是表皮生长因子的重要调控因子[9]。有趣的是,近期大量的研究[10-13]直接或间接的提示BRCA1、组蛋白去乙酰化酶1和表皮生长因子均显著参与化疗抵抗。这些数据提示我们,BRCA1自身及BRCA1级联的一系列信号和代谢反应与化疗耐药显著相关。截至当前,一系列的研究数据也指向BRCA1与化疗抵抗,如:(1)转录因子Pit-1同源蛋白能够显著抑制BRCA1的表达,提升了乳腺癌顺铂治疗的敏感性[14];(2)差异表达的BRCA1能够通过线粒体途径调节顺铂治疗的敏感性[10];(3)miR-9[15]和miR-638[16]通过下调BRCA1,进而干扰DNA修复,增加顺铂的细胞毒性;(4)BRCA1-IRIS失活,显著提升了卵巢癌细胞顺铂的治疗效果[11];(5)CDK12失活,抑制了BRCA1转录,干扰了DNA同源重组修复,能够显著提升卵巢癌对顺铂的治疗效果[17]。由此可见,BRCA1是调节卵巢癌化疗敏感性重要靶点。
另外,我们近期的研究[18]也补充了BRCA1转录调节的新机制,证实了聚ADP核糖聚合酶1可能是BRCA1的下游靶分子。该研究建立了BRCA1相关的转录调节、DNA损伤修复、细胞周期调控、细胞凋亡等重要事件与聚ADP核糖聚合酶1介导的细胞衰老、寿命延长、抗氧化应激、能量代谢调节、尤其DNA损伤修复间的分子联系。更为重要的是,该数据提示我们,BRCA1可能协同聚ADP核糖聚合酶1共同调节DNA损伤修复与顺铂耐药性间的分子联系。该研究提示了差异顺铂敏感性卵巢癌组织存在一种特异的介导BRCA1转录的表观遗传学机制,此结果将为卵巢癌病因学研究及化学治疗策略提供新的见解和思路。
[1]Lech A,Daneva T,Pashova S,et al.Ovarian cancer as a genetic disease[J].Front Biosci(Landmark Ed),2013,18:543-563.
[2]Muggia F.Platinum compounds 30 years after the introduction of cisplatin:implications for the treatment of ovarian cancer[J].Gynecol Oncol,2009,112(1):275-281.
[3]Caestecker KW,Van de Walle GR.The role of BRCA1 in DNA double-strand repair:past and present[J].Exp Cell Res,2013,319(5):575-587.
[4]Ramus SJ,Gayther SA.The contribution of BRCA1 and BRCA2 to ovarian cancer[J].Mol Oncol,2009,3(2):138-150.
[5]Li D,Bi FF,Chen NN,et al.A novel crosstalk between BRCA1 and sirtuin 1 in ovarian cancer[J].Sci Rep,2014,4:6666.
[6]Dacheux E,Vincent A,Nazaret N,et al.BRCA1-dependent translational regulation in breast cancer cells[J].PLoS One,2013,8(6):e67313.
[7]Li D,Bi FF,Cao JM,et al.Regulation of DNA methyltransferase 1 transcription in BRCA1-mutated breast cancer:a novel crosstalk between E2F1 motif hypermethylation and loss of histone H3 lysine 9 acetylation[J].Mol Cancer,2014,13:26.
[8]Li D,Chen NN,Cao JM,et al.BRCA1 as a nicotinamide adenine dinucleotide(NAD)-dependent metabolic switch in ovarian cancer[J].Cell Cycle,2014,13(16):2564-2571.
[9]Li D,Bi FF,Cao JM,et al.Effect of BRCA1 on epidermal growth factor receptor in ovarian cancer[J].J Exp Clin Cancer Res,2013,32:
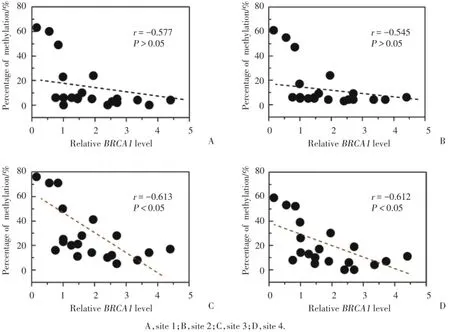
图4 BRCA1表达与1~4位点甲基化水平相关性Fig.4 Correlation between the levels of BRCA1 and methylation sites 1-4
102.
[10]Fan S,Liu B,Sun L,et al.Mitochondrial fission determines cisplatin sensitivity in tongue squamous cell carcinoma through the BRCA1-miR-593-5p-MFF axis[J].Oncotarget,2015,6(17):14885-14904.
[11]Paul BT,Blanchard Z,Ridgway M,et al.BRCA1-IRIS inactivation sensitizes ovarian tumors to cisplatin[J].Oncogene,2015,34(23):3036-3052.
[12]Shin DH,Choi YJ,Park JW.SIRT1 and AMPK mediate hypoxiainduced resistance of non-small cell lung cancers to cisplatin and doxorubicin[J].Cancer Res,2014,74(1):298-308.
[13]Aichler M,Motschmann M,Jutting U,et al.Epidermal growth factor receptor(EGFR)is an independent adverse prognostic factor in esophageal adenocarcinoma patients treated with cisplatin-based neoadjuvant chemotherapy[J].Oncotarget,2014,5(16):6620-6632.
[14]Seoane S,Arias E,Sigueiro R,et al.Pit-1 inhibits BRCA1 and sensitizes human breast tumors to cisplatin and vitamin D treatment[J].Oncotarget,2015,6(16):14456-14471.
[15]Sun C,Li N,Yang Z,et al.miR-9 regulation of BRCA1 and ovarian cancer sensitivity to cisplatin and PARP inhibition[J].J Natl Cancer Inst,2013,105(22):1750-1758.
[16]Tan X,Peng J,Fu Y,et al.miR-638 mediated regulation of BRCA1 affects DNA repair and sensitivity to UV and cisplatin in triple-negative breast cancer[J].Breast Cancer Res,2014,16(5):435.
[17]Joshi PM,Sutor SL,Huntoon CJ,et al.Ovarian cancer-associated mutations disable catalytic activity of CDK12,a kinase that promotes homologous recombination repair and resistance to cisplatin and poly(ADP-ribose)polymerase inhibitors[J].J Biol Chem,2014,289(13):9247-9253.
[18]Li D,Bi FF,Chen NN,et al.A novel crosstalk between BRCA1 and poly(ADP-ribose)polymerase 1 in breast cancer[J].Cell Cycle,2014,13(21):3442-3449.
(编辑陈姜)
Expression and Epigenetic Regulation of BRCA1in Chemosensitive and Chemoresistant Ovarian Cancer
LI Da,BI Fangfang,YANG Qing
(Department of Obstetrics and Gynecology,Shengjing Hospital,China Medical University,Shenyang 110004,China)
Objective To investigate the expression of BRCA1in chemosensitive and chemoresistant ovarian cancer specimens,so as to provide a novel insight into the epigenetic mechanism involved in BRCA1transcription.Methods Serous ovarian cancer patients(10 chemosensitive and 10 chemoresistant cancer)were enrolled for the study.BRCA1 levels was analyzed by real-time quantitative PCR.The methylation levels of BRCA1 core promoter(sites 1-4)was determined by pyrosequencing.Regression analysis was used to examine the possible relationship between BRCA1 levels and the methylation levels of sites 1-4 in ovarian cancer specimens.Results Compared to chemosensitive ovarian cancer tissues,BRCA1 levels were increased,but the methylation levels of BRCA1 core promoter(sites 1-4)were decreased in chemoresistant ovarian cancer tissues.However,it is interesting to note that only a significant inverse correlation was observed between BRCA1 levels and the methylated levels of site 4(r=-0.612,P<0.05).Conclusion Our findings imply that the methylation levels ofsite 4 in the core promoter of BRCA1 may be widely involved in the regulation of BRCA1 expression and chemosensitivity in ovarian cancer.
ovarian cancer;BRCA1;chemosensitivity;epigenetic;DNA methylation
R737.31
A
0258-4646(2016)05-0385-05
10.12007/j.issn.0258-4646.2016.05.001
国家自然科学基金(81402130);辽宁省临床能力建设项目(LNCCC-A01-2015)
李达(1984-),男,讲师,博士.
杨清,E-mail:yangq_cmu@163.com
2016-01-18
网络出版时间:

