铜绿假单胞菌产β-内酰胺酶与耐药相关性分析
徐荣,谢,张聪玲,谭为(宜春市人民医院检验科,江西 宜春336000)
铜绿假单胞菌产β-内酰胺酶与耐药相关性分析
目的 调查本院铜绿假单胞菌(PA)耐药性与产β-内酰胺酶现状,并探讨产酶与耐药之间的相关性。方法 收集院内感染PA菌株112株,进行药敏、超广谱β-内酰胺酶(ESBLs)、金属β-内酰胺酶(MBL)和头孢菌素酶(AmpC)的检测。构建PA产β-内酰胺酶与耐药之间的Logistic回归方程,ROC曲线评价产酶预期概率(PRE)与多重耐药(MDR)在筛查PA产酶菌株中的价值。结果 我院PA菌株对阿米卡星、美洛培南、亚胺培南、环丙沙星、哌拉西林/他唑巴坦和头孢他啶的敏感率都>70%,ESBLs、MBL和持续高产AmpC酶的阳性率分别为3.6%、8%和16.1%。PRE筛查产β-内酰胺酶菌株的灵敏度和特异度可达100%和93%,分别高于MDR的96.2%和74.4%。结论 临床应加强对PA产β-内酰胺酶的监测,以Logistic回归PRE值为指标筛查产β-内酰胺酶菌株,要优于以MDR为指标。
铜绿假单胞菌;β-内酰胺酶;耐药表型;Logistic回归分析
铜绿假单胞菌 (Pseudomonas aeruginosa,PA)是非发酵革兰阴性杆菌的代表菌种,广泛存在于医院、社区环境,人体皮肤、肠道、呼吸道中,具有适应性强,毒力因子多的特点,是临床最重要的病原菌之一[1]。在环境选择压力下,PA对各种抗菌药物的耐药率正逐渐升高,出现了大量对β-内酰胺类抗生素(β-lactam antibiotic,BLA)广谱耐药的菌株,而BLA由于具有杀菌活性强、毒性低及适应症广的优点,一直是临床抗感染治疗最重要的抗菌药物[2,3]。PA对BLA的耐药机制包括β-内酰胺酶的产生、外膜通透性降低、主动外排泵系统表达,药物作用靶位改变和保护性生物被膜形成等[4]。其中,产β-内酰胺酶机制尤为重要,因为相关基因可通过转座子、整合子、质粒等可移动基因元件在不同菌株之间快速传递,并且这些可移动元件往往又携带有介导其它抗菌药物耐药的因子,容易造成耐药性的广泛播散[5-7]。对临床分离的PA进行主要β-内酰胺酶包括超广谱β-内酰胺酶(Extended spectrum β-lactamases,ESBLs)、金属β-内酰胺酶(Metallo β-lactamase,MBL)和持续高产头孢菌素酶(AmpC)的检测,不仅有利于流行病学重点菌株的监控,还可以为临床合理用药提供指导[8]。现将本院临床分离获得的112株PA产β-内酰胺酶与耐药检测结果及相关性研究报告如下。
1 材料与方法
1.1菌株来源收集本院2014年12月至2105年10月间的临床分离获得的非重复PA菌株112株,标本来源为痰液(90株),伤口分泌物(10株),尿液(6株),穿刺液(3株)和血液(3株)。标准菌株铜绿假单胞菌ATCC 27853和大肠埃希菌ATCC 25922购自江西省临床检验中心。
1.2仪器和试剂 DRP-9802电热恒温培养箱购自上海森信实验仪器有限公司,DW-HL290超低温冰箱购自中科美菱;药敏纸片哌拉西林(PIP,100μg)、哌拉西林/他唑巴坦(TZP,100/10μg)、头孢噻肟(CTX,30μg)、头孢他啶(CAZ,30μg)、头孢吡肟(FEP,30μg)、头孢西丁(FOX,30μg)、氨曲南(ATM,30μg)、亚胺培南 (IPM,10μg)、美罗培南(MEM,10μg)、阿米卡星(AMK,30μg)、左氧氟沙星(LVX,5μg)、环丙沙星(CIP,5μg)、阿莫西林/克拉维酸(AMC)和M-H培养基均购自杭州滨和微生物试剂有限公司。
1.3药敏试验根据CLSI 2013版标准,采用纸片扩散法检测PA对PIP、TZP、CAZ、FEP、ATM、IPM、MEM、AMK、LVX和CIP的敏感性,质控菌株为铜绿假单胞菌ATCC27853。
1.4ESBLs检测[9,10]采用双纸片协同法进行ESBLs检测,在AMC纸片周围20~24mm贴上CTX、CAZ和ATM纸片,如周围任意纸片的抑菌圈在靠近AMC侧出现扩大,则判定为阳性。
1.5MBL检测[7]采用 EDTA纸片增效法进行MBL检测,将0.5mmol/L EDTA溶液10μl分别加到CAZ和IPM纸片上,如CAZ与CAZ-EDTA或IPM与IPM-EDTA之间,任意一对的抑菌环直径相差5mm以上,则判定为阳性。
1.6持续高产AmpC酶检测首先进行粗酶液提取,将待测菌株转接M-H平板过夜培养,刮取1/4平板上的菌苔于1ml无菌生理盐水中,-65℃反复冻融5次(每次冻2h以上,再取出融化)后,4℃、10000r/min离心15min取上清[11]。采用三维试验进行持续高产AmpC酶检测,将0.5麦氏比浊度的大肠埃希菌ATCC 25922涂布于M-H平板上,在平板中央贴一张FOX纸片,从距离纸片5mm处用11号手术刀片向外缘方向切一10×1mm的裂隙,在裂隙中加入40μl酶粗提液。孵育过夜后观察裂隙内侧端有无细菌生长,若在裂隙与FOX纸片交界处出现矢状生长则判断为阳性[10]。
1.7PA产β-内酰胺酶与耐药相关性采用二分类Logistic回归分析,以PA产β-内酰胺酶(ESBLs、AmpC或MBL)为因变量,表型检测中10种抗菌药物的敏感性及MDR判断为自变量。产β-内酰胺酶变量分为阳性和阴性2类,药物敏感性分为敏感(S)和非敏感(R或I)2类,MDR判断分为“YES”和“NO”2类;变量选入方法为基于Wald统计量的前进法,构建回归方程,计算产酶预期概率(Predicted probability,PRE)[12]。以PRE和MDR为检验变量,产β-内酰胺酶为状态变量,绘制ROC曲线。统计软件为SPSS 13.0。
2 结果
2.1药敏试验结果112株PA对10种代表性抗菌药物的敏感性结果见表1,敏感率较高的有AMK (90.2%)、MEM (83%)、IPM (76.8%)、CIP (75.9%)、TZP(72.3%)和CAZ(72.3%)。按多重耐药菌(MDR)国际标准化定义专家建议,PA对抗菌药物中3类或3类以上(每类中1种或1种以上)不敏感则判断为MDR[13]。我院PA的MDR比例为42%(47/112)。MBL和持续高产AmpC的阳性率分别为3.6%(4/ 112)、8%(9/112)和16.1%(18/112),β-内酰胺酶总阳性率为23.2%(26/112),阳性结果见表2。4株菌产MBL同时持续高产AmpC,1株菌产ESBLs同时持续高产AmpC。

表1 112株PA抗菌药物敏感性试验结果
2.3PA产β-内酰胺酶与耐药相关性采用Logistic回归分析构建的方程为PRE=1/[1+e-(3.192MDR+4.176PIP+3.983CAZ+3.132ATM-10.677)],MDR、PIP、CAZ、ATM 非敏感的相
2.2β-内酰胺酶检测结果112株PA中,ESBLs、对危险度Exp(B)分别为24.3、65.1、53.7、22.9。分别以PRE和MDR为指标诊断PA菌株是否β-内酰胺酶的ROC曲线见图1,PRE曲线的曲线下面积为0.986,要高于MDR曲线的0.853;当PRE取值0.241时,诊断灵敏度和特异度分别为 100%和93%,分别高于MDR的96.2%和74.4%。
3 讨论
本院临床分离获得的112株PA的药敏检测结果显示,AMK、MEM、IPM、CIP、TZP和CAZ的敏感率均大于70%,可作为经验性抗感染治疗的选择;菌株MDR比例为42%,远高于对IPM 23.2%的不敏感率(耐药或中介),因此医院感染控制当中,不能简单以IPM不敏感作为MDR-PA的判断标准。
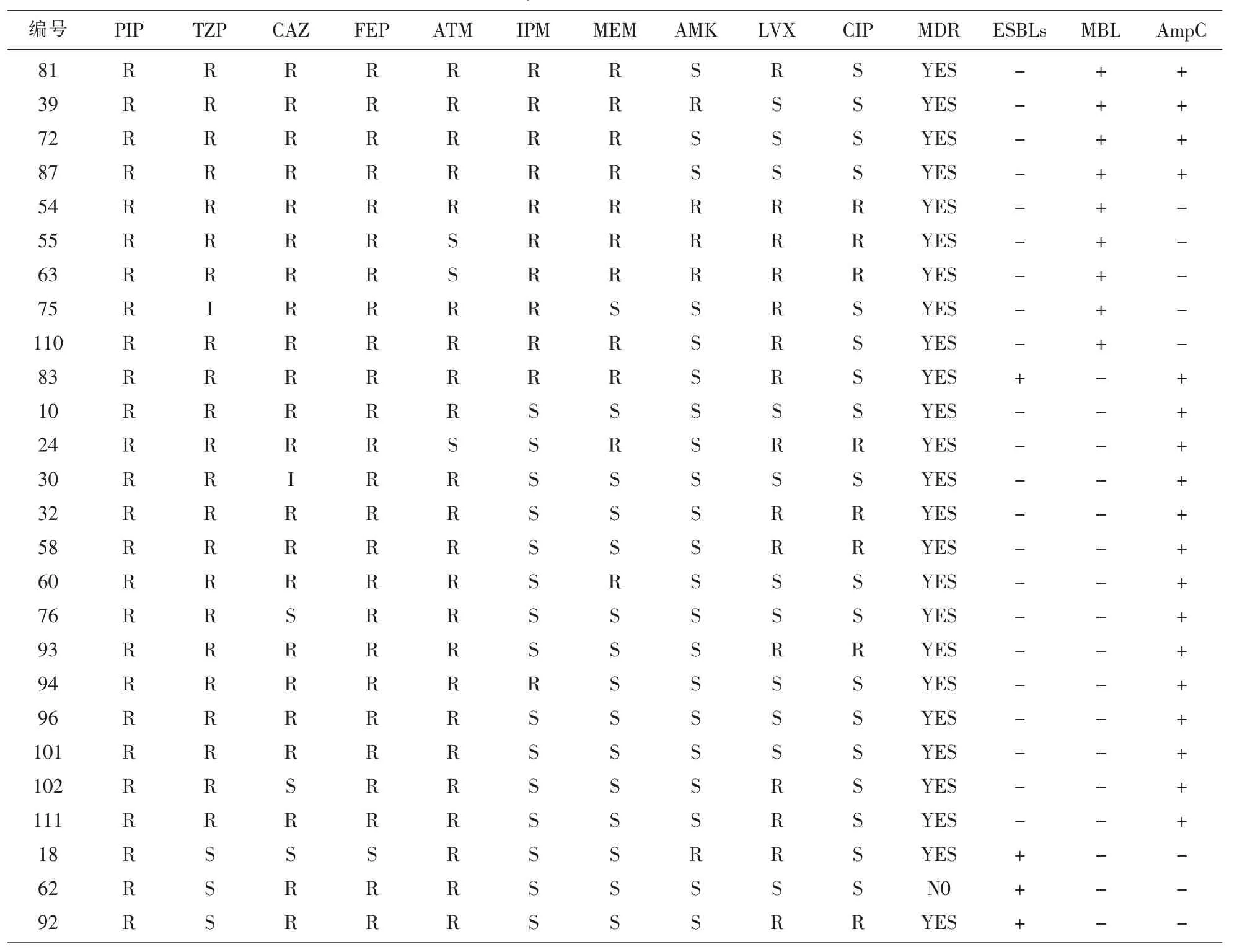
表2 26株β-内酰胺酶阳性PA检测结果
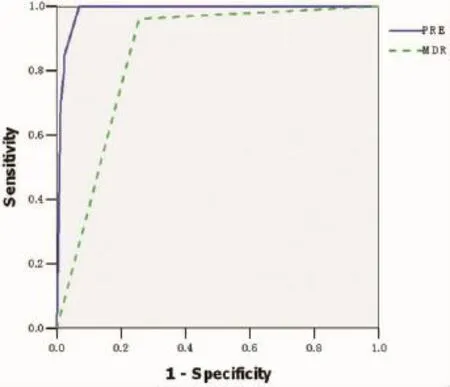
图1 以PRE和MDR为指标判断PA菌株是否β-内酰胺酶的ROC曲线
β-内酰胺酶按Ambler分类可分为A~D类[14]。ESBLs属于A类或D类,能灭活广谱头孢菌素和单环β-内酰胺类,可被克拉维酸抑制,主要存在于肠杆菌科细菌。本院PA产ESBLs比例较低,为3.6%,3株单产ESBLs菌株都表现为对复合制剂TZP敏感。MBL属于B类,能灭活包括碳青霉烯类在内的多数BLA,可被EDTA抑制。本院PA产MBL的比例为8%,9株MBL阳性菌株中有2株对ATM敏感,可能与MBL对单环β-内酰胺类水解能力低有关[1,11]。AmpC酶属于C类,为PA染色体固有,当染色体基因变异或质粒介导时可持续高产,本院PA持续高产AmpC酶比例为16.1%,在三类主要β-内酰胺酶中阳性率最高。
本实验中选择的ESBLs、持续高产AmpC酶和MBL检测方法,所用材料在一般临床微生物室都常备或较易获取,但与改良三维试验一样较耗费精力,日常工作中很难对临床分离的所有PA菌株都进行检测,因此有必要先对可能产β-内酰胺酶的菌株进行筛查[11]。针对本院112株PA菌株的检测结果显示,单纯以MDR阳性为产酶筛选标准,灵敏度和特异度分别为96.2%和74.4%,如果采用二分类Logistic回归分析综合耐药表型为PRE值后,再进行判断,灵敏度和特异度可达100%和93%。
Logistic回归分析显示,在10种代表性抗菌药物中,只有BLA中的PIP、CAZ和ATM耐药可作为PA菌株产β-内酰胺酶的高危因素,相对危险度Exp(B)分别为65.1、53.7和22.9。没有被纳入方程的自变量(P>0.05)包括IPM和MEM,可能的原因是,很多不产β-内酰胺酶PA菌株存在着对碳青霉烯类抗生素耐药的其它机制,如Opr D2蛋白缺失等[15,16]。
[1]Hong DJ,Bae IK,Jang IH,et al.Epidemiology and Characteristics of Metallo-β-Lactamase Producing Pseudomonas aeruginosa[J].J Infect Chemother,2015,47(2):81-97.
[2]Potron A,Poirel L,Nordmann P,et al.Emerging broad-spectrum resistance in Pseudomonas aeruginosa and Acinetobacter baumannii:Mechanisms and epidemiology[J].Int J Antimicrob Agents,2015,45(6):568-585.
[3]陆婷婷,王良平,丁琳.443株铜绿假单胞菌分布及耐药分析[J].实验与检验医学,2015(2):232-234.
[4]王丽娟,徐修礼,史皆然,等.多药耐药铜绿假单胞菌研究进展[J].国际检验医学杂志,2013,34(13):1713-1715.
[5]Wolska K,Kot B,Piechota M,et al.Resistance of Pseudomonas aeruginosa to antibiotics[J].Postepy Hig Med Dosw,2013,16(67):1300-1311.
[6]邹义春,汪宏良,罗卓跃,等.多药耐药铜绿假单胞菌β-内酰胺酶基因与转座子、整合子遗传标记研究[J].中华医院感染学杂志,2008,18(12):1659-1662.
[7]吴俊,叶惠芬,陈惠玲,等.多重耐药铜绿假单胞菌金属β-内酰胺酶基因型及传播机制[J].中华传染病杂志,2009,27(5):273-276.
[8]周华,周建英,俞云松.多重耐药革兰阴性杆菌感染诊治专家共识解读[J].中华内科杂志,2014,53(12):984-987.
[9]孟峻,郭素芳,张军力.铜绿假单胞菌超广谱β-内酰胺酶、AmpC酶的检测及耐药性分析[J].中华医院感染学杂志,2009,19(18):2480-2482.
[10]陈东科,孙长贵.实用临床微生物学检验与图谱[M].北京:人民卫生出版社,2011:787-791.
[11]陈东科,张志敏,张秀珍.三维法检测β内酰胺酶的影响因素探讨及方法的改进[J].中华检验医学杂志,2003,26(10):600-604.
[12]徐荣,易婷,王宏碧,等.AFU、ALP、GGT和β2-MG联合诊断原发性肝癌[J].实验与检验医学,2012,30(4):391-393.
[13]李春辉,吴安华.医疗机构耐药菌MDR、XDR、PDR的国际标准化定义专家建议 (草案)[J].中国感染控制杂志,2011,10(3):238-240.
[14]Bush K.The ABCD's of β-lactamase nomenclature[J].J Infect Chemother,2013,19(4):549-559.
[15]吴琴,邹义春,罗卓跃,等.铜绿假单胞菌耐药基因的检测与分析[J].实验与检验医学,2009,27(5):478-480.
[16]邸秀珍,王睿.耐碳青霉烯类铜绿假单胞菌耐药机制的研究现状[J].中国临床药理学杂志,2015(8):669-672.
Correlation analysis between β-lactamases of Pseudomonas aeruginosa and drug resistance
XU Rong,XIE Jing,ZHANG Congling,et al.People's Hospital of Yichun City,Yichun Jiangxi 330006,China.
Objective To investigate the status of drug resistance and β-lactamases of Pseudomonas aeruginosa(PA)in our hospital,and explore the correlation between them.Methods 112 strains of hospital-acquired PA were collected.Their drug-resistant phenotypes were tested by K-B method and β-lactamases,including ESBLs,MBL and AmpC,were also detected.Then the Logistic regression equation between drug resistance and β-lactamase was build to calculate predicted probability(PRE).ROC curve was used to evaluate the value of PRE and MDR index.Results The sensitive rates of AMK,MEM,IPM,CIP,TZP and CAZ were higher then 70%,and the positive rates of ESBLs,MBL and AMPC were 3.6%、8%and 16.1%respectively in our hospital. For screening of β-lactamase positive PA,the sensitivity and specificity of PRE index was 100%and 93%,which were higher than those of MDR index.Conclusion The clinical monitoring of PA β-lactamases should be strengthened.PRE from Logistic regression may be a better index than MDR for the screening of high-risk strains.
Pseudomonas aeruginosa;β-lactamase;Drug-resistant phenotype;Logistic regression
R446.5,Q939.92,R378.99+1
A
1674-1129(2016)04-0451-04
10.3969/j.issn.1674-1129.2016.04.013
徐荣,男,1985年1月生,硕士,主管技师,主要从事临床微生物学检验及研究工作。
(2016-03-09;
2016-07-10)

