终末糖基化终产物在心衰合并睡眠呼吸暂停综合征中的影响
方跃华,王安平,陈如花
(福建医科大学附属福州市第一医院检验科,福建 福州350009)
终末糖基化终产物在心衰合并睡眠呼吸暂停综合征中的影响
方跃华,王安平,陈如花
(福建医科大学附属福州市第一医院检验科,福建 福州350009)
目的高迁移率族蛋白1(High-mobility group box-1,HMGB1)是终末糖基化终产物受体(Receptor for advanced glycation endproducts,RAGE)的配体。HMGB1通过与RAGE相互作用对心功能不全的影响已被证实。睡眠呼吸暂停综合征(Sleep apnea syndrome,SAS)以慢性间歇性缺氧引起炎症反应,加剧心血管疾病的发生发展。研究旨在评估心力衰竭(Heart failure,HF)合并SAS患者血清HMGB1水平以及SAS对心力衰竭的影响。方法 我们共检测了165(男性141例,年龄62.88± 10.77)例患者的血清HMGB1、高敏C反应蛋白(High-sensitivity C-reactive protein,hsCRP)和前脑钠素氨基末端肽(N-terminal pro-brain natriuretic peptide,NT-proBNP),同时采用经胸超声心动图评估患者的左室结构和功能。其中,68例诊断为心力衰竭合并SAS,另外70例诊断为单纯性心力衰竭,其余27例作为对照。结果 心衰患者血清HMGB1、hsCRP和NT-proBNP水平及纽约心脏学会(New York Heart Association,NYHA)功能分级明显较对照组高(P<0.001),心衰患者的左室收缩末和舒张末内径较对照组增加(P<0.001),而射血分数比对照组明显减少(P<0.001);此外,心力衰竭合并SAS患者的血清HMGB1、hs-CRP水平较单纯性心力衰竭患者升高(P=0.011;P=0.017);心衰患者血清HMGB1水平与NT-proBNP和hsCRP水平呈正相关 (分别为γ=0.622;γ=0.682)。多因素回归分析显示HMGB1是心力衰竭发病的独立危险因素。结论 血清HMGB1、hs-CRP、NT-proBNP水平在心力衰竭时升高,心力衰竭合并SAS时HMGB1升高尤为显著,且HMGB1是心力衰竭发病的独立危险因素。因此,HMGB1是SAS影响心力衰竭发病及进展的关键因素。
高迁移率族蛋白1;心力衰竭;睡眠呼吸暂停综合征
高迁移率族蛋白1(HMGB1)是一种细胞核DNA结合蛋白,坏死细胞被动释放和激活后的免疫细胞主动分泌[1]。近期HMGB1被证实是终末糖基化终产物受体 (RAGE)的配体[2,3],HMGB1和RAGE结合促进受体的脱落[4]。其信号经RAGE可激活炎症通路和强化细胞氧化应激,导致了大量的炎性因子产生和粘附分子的表达增加[3]。HMGB1水平不仅与大鼠的缺血再灌注损伤相关,而且与糖尿病患者冠状动脉疾病的发病也有关[2,5],同时HMGB1还参与心肌梗死后的炎症应答和左室重构[6]。另一方面,低水平的HMGB1有利于心肌的生物学特性,能吸引干细胞局部定殖使得心肌细胞再生和分化[7,8],促进血管生成,改善心肌的运动功能和心肌梗死后的远期生存[9]。已证实向心肌内注射HMGB1可引起低度炎症,可改善心肌梗死后的心室重塑,起到延缓心力衰竭进展的作用[10]。
睡眠呼吸暂停综合征(SAS)是临床上常见的重要慢性睡眠呼吸疾病。SAS以睡眠中反复的呼吸停止和低通气为主要表现,可造成夜间反复的胸内负压增高、CO2潴留、酸中毒和低氧血症,从而引起夜间的反复觉醒、神经内分泌功能的紊乱,如儿茶酚胺、肾素、醛固酮、血管加压素、心房利钠肽均有不同程度的增加,并对心血管系统产生相应的负性影响[11]。慢性间歇性缺氧可激活促炎转录因子的表达,如核因子NF-KB和激活蛋白-1等,激活炎症细胞,同时促进其下游的炎症介质的表达,引起慢性炎症、氧化应激、内皮功能紊乱、内皮损伤及一氧化氮释放减少[12-14],而这些病理生理变化显著增加高血压、动脉粥样硬化、心力衰竭和卒中的发病率和病死率[15-18]。
近十年的研究已证实心肌功能障碍与心肌局部炎症有密切联系,细胞因子的过度产生,导致心脏纤维组织增多,局部炎症激活和炎性产物的增加,在心力衰竭的进展中具有明显作用[19]。近期研究证实HMGB1不仅在SAS慢性间歇性缺氧所致的炎症反应中起作用[20],而且还参与了心力衰竭发病和心力衰竭合并糖尿病发病的过程[21]。基于以上发现,我们假设血清HMGB1水平不仅作为生物标志物,同时亦影响SAS患者心力衰竭的进展。我们推测心力衰竭程度与血清HMGB1水平存在等级关系,而单纯心力衰竭与心力衰竭合并SAS两种状态的血清HMGB1亦有所不同。因此我们检测对照组、单纯心力衰竭、心力衰竭合并SAS患者的血清,评估三组人群血清HMGB1、高敏C反应蛋白(hsCRP)、前脑钠素氨基末端肽(NT-proBNP)水平及与心衰程度相关性。
1 材料与方法
1.1研究人群本研究入选了68例心力衰竭合并SAS的患者(年龄63.6±11.5岁,男性58例),70例单纯心力衰竭的患者(年龄61.9±10.0岁,男性60例),以及27例对照组。入选时间从2015年1月至2016年2月,患者均来自于我院门诊及病房。收缩性心衰的诊断是按欧洲心脏病学会指南为依据,患者有明显的心衰症状或体征,同时经超声评估左室射血分数 (Left ventricular ejection fraction,LVEF)≤45%。睡眠呼吸暂停综合征的诊断是经多导睡眠图监测每晚7h睡眠过程中呼吸暂停反复发作30次以上或者睡眠呼吸暂停低通气指数 (AHI)≥5 次/小时并伴有嗜睡等临床症状。呼吸暂停是指睡眠过程中口鼻呼吸气流完全停止10s以上;低通气是指睡眠过程中呼吸气流强度(幅度)较基础水平降低50%以上,并伴有血氧饱和度较基础水平下降≥4%。睡眠呼吸暂停低通气指数是指每小时睡眠时间内呼吸暂停加低通气的次数。对照组的入选需经超声心动图、多导睡眠监测、冠状动脉造影证实,排除左室收缩功能异常、SAS及患有显著冠状动脉疾病。高血压的诊断依据是收缩压≥140mmHg和/或舒张压≥90mmHg。糖尿病的诊断依据是美国糖尿病学会标准:2次空腹血糖浓度≥7.0mmol/L,或者具有糖尿病症状同时餐后血糖浓度≥11.1mmol/L,或者在75g葡萄糖负荷摄入后2h血糖浓度≥11.1mmol/L,或者已在服用口服降血糖药物或肠外胰岛素。为避免混入其他可能影响研究的因素,研究开始就排除有病毒性心肌炎病史、肥厚性心肌病、原发性心脏瓣膜病、肺心病、慢性病毒或细菌感染、肿瘤以及患有免疫疾病的患者。
详细记录患者的人口统计学资料,临床表现以及合并用药史,评估患者的纽约心脏病学会(NYHA)心功能分级,采用经胸超声心动图评估患者心力衰竭的严重度。
1.2实验室检测患者空腹时进行外周静脉采血。空腹血糖,尿素氮,肌酐,尿酸,总胆固醇,甘油三酯、低密度脂蛋白胆固醇,高密度脂蛋白胆固醇,hs-CRP检测采用美国贝克曼AU5821分析仪,试剂采用日本积水医疗株式会社。糖化血红蛋白检测采用美国伯乐VARIANTⅡ分析仪及配套试剂盒。NT-proBNP检测采用罗氏电化学发光E602分析仪及配套免疫试剂盒 (Roche Diagnostics)。血清HMGB1浓度的检测应用酶联免疫化验试剂盒(HMGB1 human ELISA kit;Shino-Test Corporation,Tokyo,Japan)按说明书进行。HMGB1的检测精度为0.2ng/ml,批次间变异系数<10%。实验过程均严格按照标准实验室技术操作规程操作。
1.3超声心动图检测经胸二维超声心动图检测分别使用Hewlett-Packard Sonos 2500(Hewlett-Packard,San Diego,CA,USA)或GE Vivid-7 system (General Electric Vingmed Sound AS,Horton,Norway)配备2.5或1.7~3.4MHz换能器。图像获得是静息下病人左侧卧位时呼气末图像。左室舒张末和收缩末容量的检测是根据美国超声心动图学会建议的双平行Simpson方法,同时计算左室射血分数。以三个连续心动周期的平均值作为记录。
1.4多导睡眠监测多导睡眠监测使用Somté PSG (Somte PSG system,Compumedics,AUS)监测受试者夜晚7h睡眠过程中呼吸暂停反复发作的次数并记录睡眠呼吸暂停低通气指数。
本研究经过医院伦理委员会的审核并同意,所有参与研究的受试者均签署知情同意书。
2 结果
心力衰竭患者与对照组比较,人口统计学资料的性别、年龄、高血压、糖尿病、高脂血症、吸烟未见差异;实验室检测中空腹血糖、糖化血红蛋白、肾功能、血脂未见差异;合并用药中血管紧张素转化酶抑制剂、血管紧张素受体拮抗剂、他汀类药物未见差异,心力衰竭患者应用β受体阻滞剂、利尿剂、洋地黄类、阿司匹林较对照组多(见表1)。
相对于对照组,心力衰竭患者的血清HMGB1 (20.12±15.38 vs 0.92±0.77ng/ml;P<0.001)、NT-proBNP(1892.5±2332.1 vs 80.6±25.1pg/ml;P<0.001)、hsCRP(1.80±1.12 vs 0.55±0.36mg/L;P<0.001)水平明显升高;左室收缩末内径(46.8±9.2 vs 25.2±6.0mm;P<0.001)、左室舒张末内径(65.6±4.9 vs 50.6±3.2mm;P<0.001)明显增大,而左室射血分数(32.2±5.8 vs 62.4±8.2%;P<0.001)明显降低;同时心力衰竭患者的NYHA心功能分级明显较对照组差(P<0.001)。其中,心力衰竭合并SAS患者的血清HMGB1(24.91±17.98 vs 12.92±10.99ng/ml;P= 0.011)和hsCRP(2.02±1.25 vs 1.28±0.72mg/L;P= 0.017)水平较单纯心力衰竭患者明显升高;左室舒张末内径(66.5±7.8 vs 61.2±3.6mm;P=0.021)明显增大(见表1、图1)。心力衰竭患者的血清HMGB1水平与NT-proBNP(γ=0.622;P<0.001)和hs-CRP (γ=0.682;P<0.001)水平呈正相关(见图2)。

图1 单纯心衰、心衰合并SAS与对照组血清高迁移率族蛋白1(HMGB1)、高敏C反应蛋白(hs-CRP)、前脑钠素氨基末端肽(NT-proBNP)水平的比较。Control=对照组,non SAS=单纯心力衰竭组,SAS=心力衰竭合并睡眠呼吸暂停综合征组。
采用单因素条件logistic回归分析,对传统的心血管危险因素进行校正,结果显示血尿酸、甘油三酯、血尿素氮可能是影响心力衰竭发病的危险因素。采用backward多因素条件logistic回归分析,将血尿酸、甘油三酯、血尿素氮、hsCRP、NT-proBNP和HMGB1等带入多因素logistic回归模型,选择Backward conditional方法进行分析,结果显示HMGB1[(OR=1.120,95%CI(1.082~1.156);P= 0.001)]是心力衰竭发病的独立危险因素(见表2)。

表1 心力衰竭患者与对照组的临床基线资料
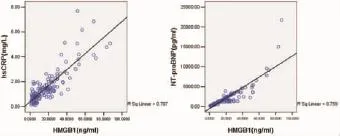
图2 心衰患者血清高迁移率族蛋白1(HMGB1)水平与高敏C反应蛋白(hs-CRP)和前脑钠素氨基末端肽(NT-proBNP)水平的相关性及其分布。
3 讨论
虽然近期研究发现血清HMGB1水平升高,不仅见于中重度SAS患者[20],而且与心力衰竭的发病和进展亦有关[21]。但是尚未有研究评估单纯心力衰竭与心力衰竭合并SAS两者的血清HMGB1水平,及HMGB1在心力衰竭合并SAS中的作用是否影响心力衰竭的发病和进展。
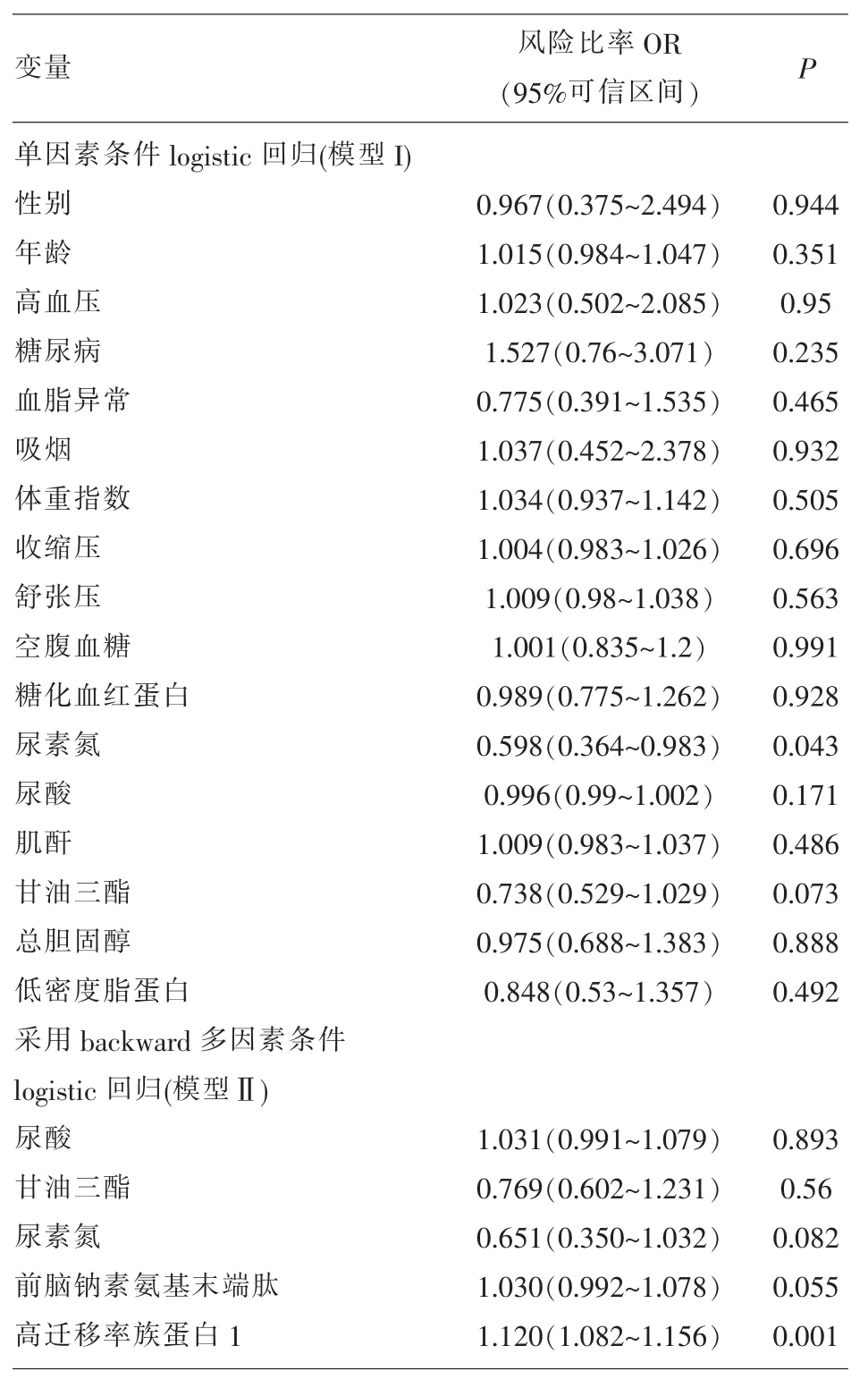
表2 SAS患者合并心力衰竭发病的回归分析
HMGB1,是基因表达的细胞内调节器,同时也是RAGE的配体,目前已证实参与炎症反应,败血症,动脉粥样硬化以及再灌注损伤[1]。然而,HMGB1在体内的病理作用仍然是有争论的。Andrassy等发现在鼠的缺血再灌注模型中HMGB1的干预可导致促炎作用和心功能的恶化,而HMGB1拮抗剂明显减少损伤[2]。相反的,Takahashi等的实验证实在心梗模型的鼠心肌内注射HMGB1可明显减弱局部炎症和纤维化,进而改善心功能[10]。HMGB1的这种有益作用也得到了Limana等人和Kitahara等人实验的支持[8,9];前者显示通过测定心肌c-kit+细胞增殖和分化能力证实外源性HMGB1的干预能促进心肌的再生[8];后者显示心梗后血管增生、心功能和生存率方面得到改善[9]。
我们的研究提示心力衰竭和HMGB1存在正相关,与HMGB1的有害作用相一致。在研究中HMGB1与临床严重度和心衰恶化事件的发生呈平行关系。对于上述心衰中HMGB1作用机制的差异目前仍然不清楚,但是不同研究中所应用的不同实验条件可能是造成结果具有差异的原因。在本研究中,入组的心力衰竭患者者具有不同病因,其病程大多超过6个月,与实验条件严格控制下的动物模型或细胞实验相比存在差异。在缺血再灌注条件下,大量的氧自由基产物引起弥漫性的心肌损伤是主要的病理生理机制,同时在小鼠的心梗模型中持续性的心肌缺血是最主要的刺激10。不同研究的最终结果可能会不同,这有赖于HMGB1和众多其他发挥不同作用的因素联合发病的机制。然而在活体HMGB1的浓度和分布与先前报道的研究是大相径庭的,可能是造成结果悬殊的原因之一。
我们在研究中发现心力衰竭合并SAS患者的血清HMGB1较单纯心力衰竭患者升高,提示以慢性间歇性缺氧为主要表现的SAS所致神经内分泌紊乱、血管舒缩调节障碍、氧化应激、炎症介质释放激活可能影响HMGB1在循环和局部组织的表达水平,出现血清HMGB1水平的升高,随后HMGB1与RAGE的相互作用通过多种途径加剧了心肌细胞的损伤和心脏结构的重塑,导致心脏舒缩功能异常的发生和心力衰竭的进展。近期研究证实不伴有其它心血管疾病的单纯SAS患者血清HMGB1水平较健康受试者明显升高,而且这些患者还同时伴有内皮功能障碍[20]。慢性间歇性缺氧造成内皮细胞损伤,引起局部组织炎症介质的表达增加和激活。受损的内皮细胞被动释放HMGB1,局部炎症可以募集单核巨噬细胞,免疫细胞在炎症介质的作用下主动分泌HMGB1,两者均增加了细胞外HMGB1水平,而细胞外的HMGB1又可以刺激细胞表达炎性细胞因子,该循环将导致广泛而持续的炎症反应,作为主要靶器官的心血管系统受损最明显,加剧高血压、动脉粥样、心力衰竭的发病和进展[1]。值得关注的是,除外HMGB1炎症通路的激活对心力衰竭的影响,HMGB1对心力衰竭的作用机制可能与影响RAGE相关蛋白产物的调节也有关。研究显示心力衰竭患者血清中RAGE裂解片段(cRAGE)表达升高,而内源性分泌RAGE(esRAGE)表达减少。HMGB1和其他炎症因子可诱导金属蛋白酶降解RAGE,cRAGE可能参与严重炎症反应相关的病理生理变化,cRAGE增加提示炎症反应过度激活和细胞外基质重塑。esRAGE被认为能清除终末糖基化终产物和一些炎症因子,起到改善内皮功能的作用,HMGB1水平的升高能抑制esRAGE的表达,降低其保护血管的作用[21]。
综合分析,目前的发现说明SAS通过慢性间歇性缺氧的病理生理变化能影响机体HMGB1的表达,而HMGB1影响心力衰竭发病和进展的作用机制可能是:⑴参与激活炎症通路,导致炎症因子大量释放,炎症反应失去控制;⑵影响RAGE相关蛋白产物的调节,破坏局部组织损伤和保护因素的平衡。两者共同影响心力衰竭的进展和严重程度。血清HMGB1水平在心力衰竭合并SAS患者中升高尤为显著,而这些患者更易在随访过程中因心衰再入院。这些发现均提示SAS与心力衰竭的进展或严重程度密切相关,而HMGB1在SAS影响心力衰竭发病及进展中的作用十分关键。由于研究只涉及患者循环中HMGB1水平的变化,并未进行细胞分子水平的研究,所以HMGB1影响合并SAS患者的心力衰竭的作用机制仍不十分清楚。在伴或不伴SAS的心力衰竭患者中血清HMGB1的表达水平存在明显差异,这提示SAS对心力衰竭进展的影响与HMGB1有关。
研究局限
首先,本研究主要是横断面的研究,而且由于事件累积太少所致后续数据意义不大,因此只能发现相关性。由于研究设计,无法进行预测和因果推论。其次,虽然受试者的数据体现了差异且符合原来的假设,但是样本量相对来说较少,而且需要大规模的前瞻性研究来证实HMGB1和相关蛋白与心力衰竭的相关性及其预测价值,以及SAS对HMGB1的影响是否加剧心力衰竭。第三点,即便有确实的意义,这种相关的重要性有待探索,而且可能存在的变量间相互作用并未检测;很重要的是未检测舒张功能。第四点,所有心衰患者均是中国人,所以不能确定研究结果是否能适用于其他种族人群。然而,新的标志物被发现,与其他可能的病理机制相关,是该领域的新突破。
[1]Bangert A,Andrassy M,Müller AM,et al.Critical role of RAGE and HMGB1 in inflammatory heart disease[J].Proc Natl Acad Sci USA,2016,113(2):E155-164.
[2]Zhou Y,Li Y,Mu T.HMGB1 Neutralizing Antibody Attenuates Cardiac Injury and Apoptosis Induced by Hemorrhagic Shock/Resuscitation in Rats[J].Biol Pharm Bull,2015,38(8):1150-60.
[3]Boteanu RM,Uyy E,Suica VI,et al.High-mobility group box 1 enhances the inflammatory process in diabetic lung[J].Arch Biochem Biophys,2015,583:55-64.
[4]Good DW,George T,Watts BA.High-mobility group box 1 inhibits HCO(3)(-)absorption in medullary thick ascending limb through a basolateral receptor for advanced glycation end products pathway [J].Am J Physiol Renal Physiol,2015,309(8):F720-730.
[5]Yan XX,Lu L,Peng WH,et al.Increased serum HMGB1 level is associated with coronary artery disease in nondiabetic and type 2 diabetic patients[J].Atherosclerosis,2009,205(2):544-548.
[6]Kohno T,Anzai T,Naito K,et al.Role of high-mobility group box 1 protein in post-infarction healing process and left ventricular remodeling[J].Cardiovasc Res,2009,81(3):565-573.
[7]Xie HL,Zhang Y,Huang YZ,et al.Regulation of high mobility group box 1 and hypoxia in the migration of mesenchymal stem cells[J].Cell Biol Int,2014,38(7):892-897.
[8]Limana F,Germani A,Zacheo A,et al.Exogenous high-mobility group box 1 protein induces myocardial regeneration after infarction via enhanced cardiac C-kit+cell proliferation and differentiation[J].Circ Res,2005,97(8):e73-e83.
[9]Kitahara T,Takeishi Y,Harada M,et al.High-mobility group box 1 restores cardiac function after myocardial infarction in transgenic mice[J].Cardiovasc Res,2008,80:40-46.
[10]Takahashi K,Fukushima S,Yamahara K,et al.Modulated inflammation by injection of high-mobility group box 1 recovers post-infarction chronically failing heart[J].Circulation,2008,118(14 Suppl.):S106-S114.
[11]Miller JD,Aronis KN,Chrispin J,et al.Obesity,Exercise,Obstructive Sleep Apnea,and Modifiable Atherosclerotic Cardiovascular Disease Risk Factors in Atrial Fibrillation[J].J Am Coll Cardiol,2015,66(25):2899-2906.
[12]Wu J,Stefaniak J,Hafner C,et al.Intermittent Hypoxia Causes Inflammation and Injury to Human Adult Cardiac Myocytes[J]. Anesth Analg,2016,122(2):373-380.
[13]Querejeta Roca G,Shah AM.Sleep Disordered Breathing:Hypertension and Cardiac Structure and Function[J].Curr Hypertens Rep,2015,17(12):91.
[14]Dharia SM,Unruh ML,Brown LK.Central Sleep Apnea in Kidney Disease[J].Semin Nephrol,2015,35(4):335-346.
[15]Cowie MR,Woehrle H,Wegscheider K,et al.Adaptive Servo-Ventilation for Central Sleep Apnea in Systolic Heart Failure[J].N Engl J Med,2015,373(12):1095-1105.
[16]Roca GQ,Redline S,Claggett B,et al.Sex-Specific Association of Sleep Apnea Severity With Subclinical Myocardial Injury,Ventricular Hypertrophy,and Heart Failure Risk in a Community-Dwelling Cohort:The Atherosclerosis Risk in Communities-Sleep Heart Health Study[J].Circulation,2015,132(14):1329-1337.
[17]Parisot J,Damy T,Gellen B,et al.Sleep-disordered breathing in chronic heart failure:development and validation of a clinical screening score[J].Sleep Med,2015,16(9):1094-1101.
[18]Lipford MC,Flemming KD,Calvin AD,et al.Associations between Cardioembolic Stroke and Obstructive Sleep Apnea[J].Sleep,2015,38(11):1699-1705.
[19]Heymans S,Hirsch E,Anker SD,et al.Inflammation as a therapeutic target in heart failure?A scientific statement from the Translational Research Committee of the Heart Failure Association of the European Society of Cardiology[J].Eur J Heart Fail,2009,11:119-129.
[20]Wu KM,Lin CC,Chiu CH,et al.Effect of treatment by nasal continuous positive airway pressure on serum high mobility group box-1 protein in obstructive sleep apnea[J].Chest,2010,137(2):303-309.
[21]Wang LJ,Lu L,Zhang FR,et al.Increased serum high-mobility group box-1 and cleaved receptor for advanced glycation endproducts levels and decreased endogenous secretory receptor for advanced glycation endproducts levels in diabetic and non-diabetic patients with heart failure[J].Eur J Heart Fail,2011,13(4):440-449.
The influence of advanced glycation endproducts on heart failure with sleep apnea syndrome
FANG Yuehua,WANG Anping,CHEN Ruhua.Department of Laboratory Medicine,First Affiliated Fuzhou Hospital,Fujian Medical University,Fuzhou 350009,China.
Objective High-mobility group box-1(HMGB1)is a ligand for the receptor of advanced glycation endproducts (RAGE).It has been confirmed that the interaction of HMGB1 with RAGE influence cardiac dysfunction.Sleep apnea syndrome (SAS)induces inflammation by the pathophysiology of chronic intermittent hypoxia,it exacerbates the incidence and development of cardiovascular disease.The study aimed to assess the serum levels of HMGB1 in patients with heart failure(HF)and SAS,while to explore the association between SAS and heart failure.Methods We assayed serum levels of HMGB1,high-sensitivity C-reactive protein(hsCRP)and N-terminal pro-brain natriuretic peptide(NT-proBNP),and assessed left ventricular structure and function in 68 SAS and 70 non-SAS patients compined with chronic HF.Of the total 27 normal subjects served as normal controls. Results the levels of Serum HMGB1,hsCRP and NT-proBNP,left ventricular end-diastolic and end-systolic diameters,and New York Heart Association functional(NYHA)class were higher and,in contrast,left ventricular ejection fraction lower in HF patients than those in subjects without HF(for all;P<0.001),while higher levels of HMGB1 and hsCRP in SAS HF vs.non-SAS HF patients (P=0.011 and P=0.017,respectively).For HF patients-with or without SAS-HMGB1 levels correlated positively with NT-proBNP and hsCRP values(γ=0.622,γ=0.682,all P<0.001).Multivariable regression analysis revealed that HMGB1 was the independent risk factor in HF patients with or without SAS.Conclusion The levels of serum HMGB1,hs-CRP and NT-proBNP were increased in heart failure,and HMGB1 was significantly elevated in heart failure patients with SAS,and HMGB1 was an independent risk factor for heart failure.Therefore,HMGB1 is the key factor that affects the incidence and progression of heart failure in SAS.
High-mobility group box-1;Heart failure;Sleep apnea syndrome
R541.6
A
1674-1129(2016)04-0416-06
10.3969/j.issn.1674-1129.2016.04.003
方跃华,女,1975年11月出生,本科,学士学位,主管检验师,在职研究生在读。
(2016-05-19;
2016-07-06)

