抗胸腺细胞免疫球蛋白治疗儿童再生障碍性贫血的不良反应相关因素及疗效相关性研究
李福兴,石苇,乔晓红,周晓迅,何薇,谢晓恬(同济大学附属同济医院 儿科,上海 200065)
抗胸腺细胞免疫球蛋白治疗儿童再生障碍性贫血的不良反应相关因素及疗效相关性研究
李福兴,石苇,乔晓红,周晓迅,何薇,谢晓恬
(同济大学附属同济医院 儿科,上海 200065)
目的归纳抗胸腺细胞免疫球蛋白(ATG)免疫抑制治疗儿童再生障碍性贫血(AA)不良反应防治对策,评价不良反应与疗效的关系,分析不良反应发生的相关因素。方法采用ATG联合环孢菌素A(CsA)联合免疫抑制疗法(CIS)治疗儿童再生障碍性贫血共61例,其中使用美国(Genzyme公司)R-ATG 31例,使用德国(Fresenius公司)R-ATG 30例。采取不良反应综合防治措施,比较两种ATG不良反应发生率,分析不良反应与疗效关系,分析不良反应的相关因素。结果Fresenius-ATG相关类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为40.00%(12例)、43.30%(13例)、16.70%(5例)和23.33%(7例);Genzyme-ATG相关类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为35.48%(11例)、35.48%(11例)、9.70%(3例)和29.03%(9例),两种制剂ATG不良反应发生率差异无统计学意义(P>0.05)。不良反应的发生与否疗效比较差异无统计学意义,不良反应发生率在不同年龄,性别和疾病分型中差异无统计学意义。经综合防治,所有不良反应均得以及时控制,无治疗相关死亡。结论ATG联合CsA治疗儿童再生障碍性贫血安全有效,综合防治措施可有效防治不良反应。Fresenius-ATG和Genzyme-ATG治疗儿童再生障碍性贫血不良反应发生率相当;不良反应的发生并不影响ATG治疗效果;不同年龄、性别及疾病严重程度与不良反应发生无直接相关性。
再生障碍性贫血;免疫抑制治疗;抗胸腺细胞球蛋白;不良反应
再生障碍性贫血(aplastic anemia,AA)(以下简称再障)是由多种病因所导致的骨髓造血功能衰竭和全血细胞减少性疾病。是严重危害儿童健康的血液病之一,尤其是重型再障(severe aplastica anemia,SAA),起病急,进展快,需要依赖输血维持生命,严重的感染和出血倾向,病死率高,临床治疗较为困难[1-3]。再障治疗手段主要包括异基因造血干细胞移植(allo-HSCT)及以抗胸腺细胞免疫球蛋白(antithymocyte globulin,ATG)为主的联合免疫抑制疗法,但移植治疗供体获取困难,且移植风险较大,故联合免疫抑制疗法是无合适供体病人首选,目前已取得与移植相当的疗效,由于是异种蛋白,其不良反应较多[4]。如不采取及时有效的防治措施,可能影响治疗地顺利实施,甚至发生治疗相关死亡。
本研究拟总结同济大学附属同济医院儿科1995年1月-2014年12月,应用ATG、环孢素A (cyclosporine,CsA)联合治疗儿童再障后的不良反应和防治措施,探讨不良反应与疗效关系及不良反应相关因素。
1 资料与方法
1.1病例
选取无合适供体及不适宜移植治疗、自愿接受以ATG为主的联合免疫抑制疗法(combined immuno-suppressive,CIS)治疗患儿共61例。其中,男性31例,女性30例,年龄3~12岁(平均7岁)。所有病例均经过外周血象、骨髓涂片、骨髓活检,符合国际再障诊断标准[5]。通过病史、临床体征、胎儿血红蛋白检测,染色体断裂实验等排除先天性骨髓衰竭综合征。参照Camitta再障分型标准,使用美国(Genzyme公司)R-ATG31例,包括极重型再障(VSAA)5例,重型再障(SAA)18例,依赖输血型非重型再障(NSAA)8例,使用德国(Fresenius公司)-ATG30例,包括极重型再障(VSAA)2例,重型再障(SAA)19例,依赖输血型非重型再障(NSAA)9例。依赖成份输血的标准为患儿外周血象下降程度达到《2009版英国再障诊疗指南》红细胞或血小板输注指征。
1.2治疗方案
1.2.1免疫抑制治疗ATG:采用兔抗胸腺细胞免疫球蛋白(rabbitanti-human thymocyte immunoglobulin,R-ATG),其中美国(Genzyme公司)R-ATG治疗31例,剂量为3.5 mg/(kg·d),德国(Fresenius公司)R-ATG治疗30例,剂量为4~5 mg/(kg·d);均为连续5 d疗程。CsA:均于ATG前2周开始服用CsA:5~8 mg/(kg·d),服药后4 h血清峰浓度维持于200~400ng/L。ATG结束后2周开始大剂量免疫球蛋白(HDIG)。雄性激素和中药制剂作为辅助治疗。至疗效达平台期1年之后,在密切观察外周血象变化之下,行CsA和辅助药物缓慢减量。
1.2.2不良反应防治方法①ATG治疗准备:清除和预防感染,彻底治愈存在的感染疾病,选择单独隔离血液病房;ATG治疗前2周,输注常规剂量免疫球蛋白200 mg/(kg·d);治疗前3 d口服庆大霉素和制霉菌素;保证饮食清洁卫生,加强口腔护理。改善患儿全身状况:评估各系统功能,纠正可能存在的电解质、酸碱平衡及脏器功能异常;输血支持:酌情成分输血和注射粒系集落刺激因子(granulocyte colony stimulating factor,G-CSF),以纠正重度贫血,争取使粒细胞绝对计数(ANC)>0.5×109/L、外周血小板(BPC)维持于>20×109/L和血红蛋白>60 g/L。②过敏反应:治疗前须进行过敏试验,具体方法:静脉输注地塞米松(Dex)0.3 mg/kg,口服H1受体阻滞剂异丙嗪0.5~1.0 mg/kg后,以1/10支ATG加入生理盐水100ml缓慢静脉滴注1h,输注结束后再观察1h,如无不良反应,开始使用ATG。第1天:ATG皮试阴性后,甲泼尼龙(MP)2 mg/kg溶于5%葡萄糖500 ml中缓慢静脉滴注5~6 h,MP开始1 h后,无不良反应,则开另一路静脉,当日余量ATG溶于0.9%氯化钠注射液500ml中,匀速静脉滴注8~12 h,监测血压6 h,口服异丙嗪0.5~1.0 mg/kg次,共3次。疗程第2~5 d:开两路静脉,监测血压,异丙嗪:0.5~1.0 mg/kg次,一日3次口服。首先输注地塞米松(Dex)0.1 mg/kg,然后MP 2 mg/kg溶于5%葡萄糖500 ml中缓慢静脉滴注5~6 h,MP开始1 h后,开另一路静脉ATG加入氯化钠注射液500 ml中,匀速静脉滴注8 h。使用过程中监测血压和血糖。过敏和类过敏反应发生时间为ATG使用期间1~5 d,绝大多数为用药第1天,常见中轻度发热,口服退热剂(布洛芬或对乙酰氨基酚),体温降至正常后继续输注。如出现皮疹,暂停ATG输注,加用甲强龙1mg/kg静脉滴注,并临时口服异丙嗪抗过敏对症治疗,皮疹基本消退后继续输注。③血清病:多见于疗程结束后1~4周,常表现为高热,皮疹和关节酸痛,少数有血尿和血小板破坏。故ATG治疗结束后,住院观察3~4周,甲泼尼龙逐步以等量泼尼松龙口服替换,至治疗第15天起逐渐减量,一旦出现血清病则立即输注足量甲泼尼龙2~3 mg/(kg·d)治疗,同时,酌情应用广谱抗生素和辅助治疗,直至血清病得以控制。一般情况下数天内可以控制,如ATG治疗30d后无血清病,则泼尼松渐减量至停。④血小板下降:ATG可因为含有血小板抗体,或血小板与淋巴细胞存在相同抗原,而导致血小板进一步下降。治疗期间需每天监测血小板计数,酌情输注单采血小板或浓缩血小板,使外周血小板计数维持于20×109/L以上。⑤感染:一旦发生感染,根据不同感染部位,分析可能的病原体,联合应用强效广谱抗生素,同时进行病原学检测以助治疗。⑥其他:每天监测血压和血糖,及时发现和控制少数患儿由皮质激素所致的高血压和高血糖;选用联苯双酯等保肝药物。常规服用铝碳酸镁片(达喜)和钙剂,以防皮质激素所致消化道损伤和钙磷代谢异常。
1.2.3疗效评价参照国际camitta再障疗效标准,获得完全反应(complete response,CR)和部分反应(partial response,PR)者为有效,未见疗效反应者(no response,NR)为无效。判定疗效前需3个月未接受成分输血或应用G-CSF。
1.2.4不良反应分析比较Fresenius公司和Genzyme公司不良反应发生率差异,按是否发生类过敏反应、血清病分组比较疗效差异,比较不同性别,不同年龄,不同疾病类型之间不良反应发生率差异。分析容易发生不良反应的高危因素。
1.3统计学方法
采用SPSS 14.0统计软件进行数据分析,组间有效率比较应用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1疗效
Fresenius-ATG和Genzyme-ATG两组总有效率分别为80.00%(24/30)和83.33%(25/31),差异无统计学意义(χ2=0.004,P=0.018)。
2.2Fresenius-ATG和Genzyme-ATG不良反应比较
Fresenius ATG组(n=30)相关类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为40.00%(12例)、43.30%(13例),16.70%(5例)和23.33%(7例);Genzyme ATG(n=31)组相关类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为35.48%(11例)、35.48%(11例),9.70%(3例)和29.03%(9例),两种制剂ATG不良反应发生率比较差异无统计学意义(P>0.05),见表1。
2.3主要不良反应发生与否疗效比较
将患儿分成有类过敏组和无类过敏组,比较两组疗效差异。其中,类过敏组23例中,CR率43.48% (10例),PR率34.78%(8例),NR率21.74%(5例),CR+PR率78.26%(18例);无类过敏组38例中,CR 率68.42%(26例),PR率 15.79%(6例),NR率15.79%(6例),CR+PR率(84.21%),CR率无类过敏反应组较高(68.42%/43.47%),但两组比较差异无统计学意义(P>0.05),见表2。
按是否发生血清病分组,比较两组疗效。其中,血清病组25例中,CR率64.00%(16例),PR率24.00%(6例),NR率 12.00%(3例),CR+PR率88.00%(22例);无血清病组36例中,CR率55.50% (20例),PR率22.22%(8例),NR率22.22%(8例),CR+PR率77.78%(28例),两组有效性比较差异无统计学意义(P>0.05),见表3。
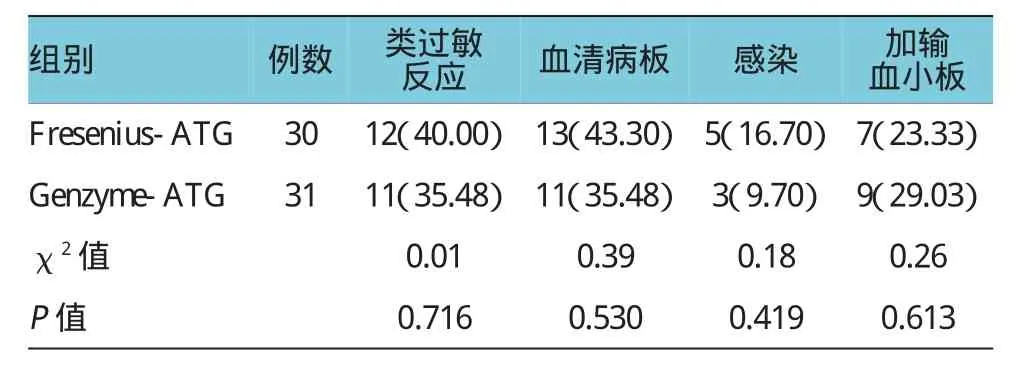
表1 不同ATG不良反应比较 例(%)
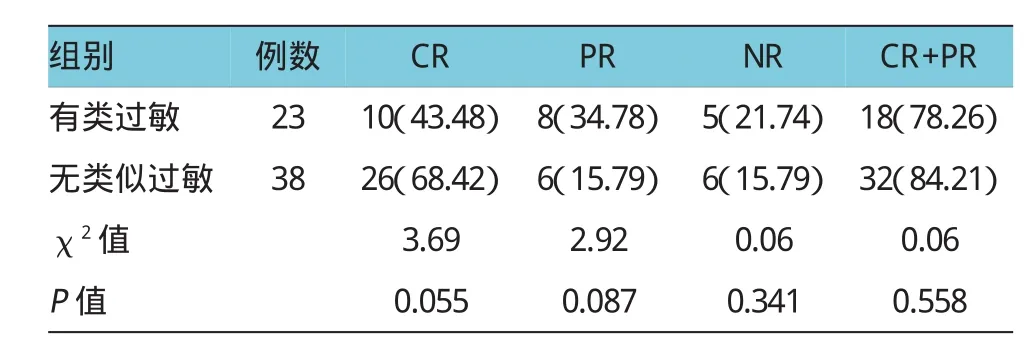
表2 发生类过敏反应的疗效比较 例(%)
2.4不良反应相关因素分析
2.4.1性别与不良反应以性别分组,比较不良反应发生率。男性患儿组(n=31)类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为48.39%(15例)、35.48%(11例)、9.70%(3例)和22.58%(7例);女性患儿组(n=30)相关类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为26.67%(8例)、43.33%(13例)、6.67%(2例)和26.67%(8例),两组不良反应发生率比较差异无统计学意义(P>0.05),见表4。
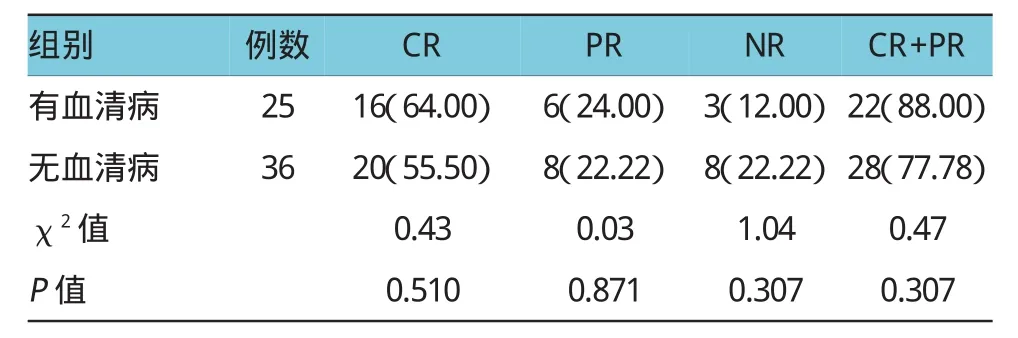
表3 类过敏反应的疗效比较 例(%)

表4 不同性别不良反应发生率比较 例(%)
2.4.2年龄与不良反应将患儿分为7岁以下组和7岁及以上两组,比较不良反应发生率。其中,<7岁组(n=32),类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为40.62%(13例)、40.62% (13例)、12.50%(4例)和34.38%(11例);7岁及以上组(n=29),类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为34.48%(10例)、41.38%(12例)、3.40%(1例)和17.24%(5例);两组不良反应发生率比较,差异无统计学意义(P> 0.05),见表5。
2.4.3疾病分型与不良反应将患儿分SAA组(包括VSAA)和NSAA组,比较不良反应发生率。重型组(n=44),类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为 43.18%(19例),43.18%(19例)、9.09%(4例)和29.55%(13例);非重型组(n=17),类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别为23.53%(4例)、29.41%(5例)、5.88%(1例)和11.76%(2例);两组不良反应发生率无统计学意义(P>0.05),见表6。
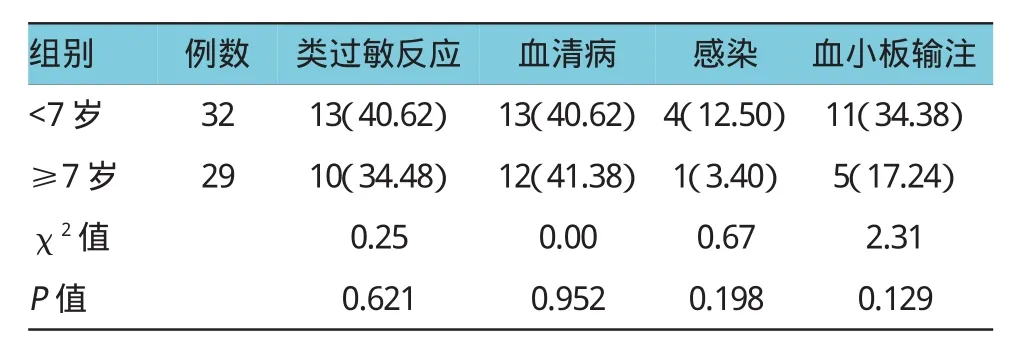
表5 不同年龄不良反应发生率比较 例(%)
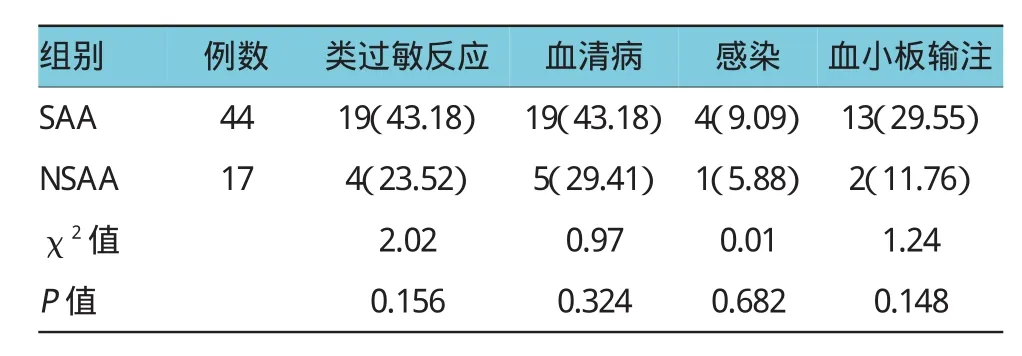
表6 不同分型间不良反应发生率比较 例(%)
3 讨论
再生障碍性贫血是儿童期较为常见且严重的血液病之一。我国属于再障高发地区,儿童处于高发年龄段,且SAA比例较高,严重危害儿童生命健康[6]。骨髓或造血干细胞移植作为可以治愈再生障碍性贫血的唯一手段,但因为缺乏合适供体,以及高额费用等诸多因素限制难以广泛开展,以ATG为主的联合免疫抑制治疗成为大多数再障患者的首选治疗手段。ATG用于再障治疗已有近40年,是目前历史最长,疗效最为确切的免疫抑制剂[7-9]。目前,以ATG联合SA的CIS疗法已被推荐为无法接受allo-HSCT治疗的SAA或依赖输血的NSAA的首选药物疗法,如何进一步提高疗效和降低ATG相关不良反应是目前研究重点。
ATG为选择性免疫抑制剂,是通过提取人类胸腺细胞或T淋巴细胞免疫兔、马、猪等动物,使其体内产生针对人T淋巴细胞的特异性抗体,经纯化后所制备的生物制品。由于ATG为异种动物蛋白,治疗时不良反应发生率很高,国内文献报道,过敏及类过敏不良反应发生率34.4%~50.68%之间,血清病反应为52.0%~68.0%[10-11],感染发生率为50%左右[12],甚至发生治疗相关死亡[13]。ATG治疗期间的不良反应主要包括变态反应、血清病、血小板破坏和继发感染。本科近年来在开展以ATG为主的联合免疫抑制疗时,根据ATG主要不良反应的发生时间和发生机制,采取具有针对性的积极防治措施,以达到使用前早预防,使用中早发现,发现后有效治疗,确保治疗安全顺利进行,进而提高再障患儿的远期疗效。笔者统计发现,Fresenius-ATG组不良反应发生率类过敏反应、血清病、感染和需加输血小板分别为40.00%、43.30%、16.70%和23.33%;Genzyme-ATG组不良反应发生率类过敏反应、血清病、感染和需加输血小板等不良反应发生率分别35.48%、35.48%、9.70%和29.03%,两种制剂ATG不良反应发生率比较差异无统计学意义,与文献报道一致。但由于采取积极的防治措施,从未发生过因ATG不良反应导致死亡事件。
本研究分析主要不良反应的发生是否会影响ATG治疗效果,结果提示,有类过敏反应组CR率为43.48%,无类过敏组CR率68.42%,虽然无类过敏反应组CR率比有类过敏反应组的要高,但两组比较差异无统计学意义。血清病组NR率12.00%,而无血清病组NR率22.22%,似乎提示血清病组NR率较低,但两组比较差异无统计学意义。该结果提示类过敏反应及血清病的发生并不直接影响ATG治疗效果。
本研究还进行不良反应高危因素分析,分析比较不同性别、不同年龄和疾病严重程度之间ATG不良反应发生率,结果发现,男性患儿类过敏反应发生率较女性患儿高(48.39%/26.67%),但差异无统计学意义;7岁以下患儿类过敏反应、血清病发生率与7岁及以上患儿相当,而感染和需加输血小板等不良反应发生率<7岁患儿发生率要高,但差异无统计学意义,7岁以下儿童感染发生率高可能与其自身免疫功能尚不完善有关;SAA组各种不良反应发生率均较NSAA组高,两组类过敏反应、血清病、感染和需加输血小板等不良反应发生率比较差异无统计学意义。
综上所述,ATG治疗儿童再障疗效确切,不良反应发生率高,但只要采取积极有效的综合防治措施,可以保证治疗的顺利进行。不良反应的发生并不影响ATG治疗效果。不同性别、年龄及疾病严重程度并不影响不良反应的发生。进一步评估ATG治疗再障的不良防御和疗效,需要进一步大样本,长期随访研究。
[1]Davies1 JK,Guinan EC.An update on the management of severe idiopathic aplastic anaemia in children[J].Br J Haematol,2007, 136(4):549-564.
[2]Young NS,Scheinberg P,Calado RT.Aplastic anemia[J].Curr Opin Hematol,2008,15(3):162-168.
[3]Young NS,Calado RT,Scheinberg P,et al.Current concepts in the Patho-physiology and treatment of aplastic anemia[J].Blood, 2006,108(8):2509-2519.
[4]Kobayashi R,Kaneda M,Watanabe N,et al.Adverse effects of antithymocyte globulin/anti lymphocyte globu lin therapy[J].Rinsho Ketsuek,1999,40(7):531-535.
[5]Marsh JCW,Ball SE,Cavenagh J,et al.Guidelines for the diagnosis and management of aplastic anaemia[J].Br J Haematol, 2009,147(1):43-70.
[6]谢晓恬.儿童再生障碍性贫血的临床诊断治疗 [J].中华实用儿科临床杂志,2012,27(15):197-199.
[7]Marsh JC,Ball SE,Cavenagh J,et a1.Guidelines for the diagnosis and management of aplastie anaelllia[J].Br JHaematol, 2009,147(1):43-70.
[8]Young NS,Bacigalupo A,Marsh JC,et a1.Aplastie anemia: pathophysio-logy and treatmen[J].Biol Blood Marrow Transplant, 2010,16(Suppl 1):119-125.
[9]Maleovati L,De Latour RP,Risitano A.Aplastic anemia& MDS International Foundation(AA& MDSIF):Bone Marrow Failure Disease Scientific Symposium 2010[J].Leuk Res,2011,35(3): 291-294.
[10]王颖超,殷楚云,冯磊.免疫抑制疗法治疗儿童再生障碍性贫血疗效分析[J].中国当代儿科杂志,2012,14(1):33-37.
[11]展世宏,卢俊,李建琴,等.抗淋巴细胞球蛋白为主的免疫抑制剂治疗再生障碍性贫血的疗效及其不良反应[J].实用儿科临床杂志[J],2011,26(3):193-195.
[12]吴蔚,沈和萍,赵芬英.再生障碍性贫血抗胸腺细胞免疫球蛋白治疗的不良反应及其对策[J].中华儿科杂志,2006,44(5):383-384.
[13]马秀慧,赵文理,卢俊,等.抗淋巴细胞球蛋白和抗胸腺细胞球蛋白治疗儿童重型再生障碍性贫血的不良反应比较[J].中华临床医师杂志(电子版),2015,9(7):1238-1241.
(张蕾编辑)
Adverse reactions management of Antithymocyte Globulin in treatment of childhood with aplastic anemia
Fu-xing Li,Wei Shi,Xiao-hong Qiao,Xiao-xun Zhou,Wei He,Xiao-tian Xie
(Department of Pediatrics,Tongji Hospital,Tongji University,Shanghai 200065,China)
Objective To summarize the adverse reactions of rabbit antithymocyte globulin in treatment of children with aplastic anemia.Methods 61 children with AA treated with ATG and CsA in our department were analyzed,31 of them received(Genzyme)R-ATG and CsA,the other 30 received Fresenius-ATG and CsA therapy,comprehensive measures were used to prevent and control ATG related adverse reactions.The incidence of adverse effects between the two groups were compared,the relationship between adverse reactions and efficacy rate,adverse related factors were also analyzed.Results There were no significant differences in ATG-induced adverse reactions between the(Genzyme)R-ATG and Fresenius-ATG groups.The incidence of anaphylactoid reactions,serum sickness,platelet transfusion and infection were 35.48%versus 40.00%,35.48%versus 43.3%,9.70%versus 16.70%,29.03%versus 23.33%respectively.There were no significant differences for Efficacy rates of group with adverse reactions and group without adverse reactions.The incidence of adverse reactions were not significantly different for gender,age and severity.Conclusion The immunosuppressive treatment with antithymocyte globulin and cy-closporin is safe and effective for children with AA.Adverse reactions could be avoided and treated with comprehensive measures.Adverse reactions did not affect the therapy efficacy.Gender,age and severity may not related with adverse reactions.
aplastic anemia;immunosuppressive treatment;antithymocyte globulin;adverse reaction
R 556.5
B
10.3969/j.issn.1005-8982.2016.04.017
1005-8982(2016)04-0080-05
2015-10-08
谢晓恬,E-mail:xtxie@163.com;Tel:13044172413

