不同剂量肝素对高糖诱导后的人腹膜间皮细胞水通道蛋白1表达的影响
李鸽,赵久阳,任泽银,肖伟,桂永丰(.湖南省常德市第一人民医院 肾病内科,湖南 常德,45000;.大连医科大学附属第二医院 肾内科,辽宁 大连 6000)
论著
不同剂量肝素对高糖诱导后的人腹膜间皮细胞水通道蛋白1表达的影响
李鸽1,赵久阳2,任泽银1,肖伟1,桂永丰1
(1.湖南省常德市第一人民医院 肾病内科,湖南 常德,415000;2.大连医科大学附属第二医院 肾内科,辽宁 大连 116000)
目的研究不同剂量肝素对高糖诱导后的人腹膜间皮细胞水通道蛋白1(AQP1)mR NA和蛋白表达水平的影响。方法分离并培养人腹膜间皮细胞,并用高糖(2.5%葡萄糖溶液)诱导4、8、12和24h;采用逆转录-聚合酶链反应(R T-PCR)检测AQP1 mR NA的表达水平,从而确定表达量达峰值的诱导时间。将不同剂量的肝素添加至人腹膜间皮细胞培养液中,并经2.5%高糖溶液诱导后,用R T-PCR及免疫组织化学法检测实验组与对照组AQP1 mR NA和蛋白表达水平。结果与对照组比较,实验组AQP1 mR NA和蛋白表达明显增加,且mR NA表达呈时间依赖性,且在高糖诱导24h时表达量达峰值,差异有统计学意义(P<0.05);R T-PCR与免疫组织化学结果具有一致性,均提示AQP1mR NA和蛋白表达水平在2.5%葡萄糖+1.5×10-2mg/ml肝素组呈现明显上调,差异有统计学意义(P<0.05);免疫组织化学染色提示2.5%葡萄糖+1.5×10-2mg/ml肝素组细胞可见胞核及胞浆有空泡样改变。结论肝素在高糖环境中诱导24h后可显著增加人腹膜间皮细胞水通道蛋白AQP1 mR NA和蛋白的表达,且大剂量的肝素能使胞浆及胞核出现明显的空泡样改变。
肝素;人腹膜间皮细胞;水通道蛋白1
腹膜透析是终末期肾衰竭患者可供选择的治疗方法之一,但临床上腹膜透析患者常发生腹膜透析管堵塞,为解决该问题,体内外抗凝剂肝素常添加于腹膜透析液中。有研究显示,大剂量肝素添加于含葡萄糖的腹膜透析液中可使腹膜透析的超滤量增加[1],但肝素是否通过影响腹膜间皮细胞中水通道蛋白1 (aquaporin 1,AQP1)的表达来实现的,国内外未见相关报道,故本实验探讨不同剂量肝素对高糖诱导后人腹膜间皮细胞水通道蛋白AQP1表达的影响。
1 材料与方法
1.1试剂与仪器
1.1.1主要试剂TRIzol试剂盒为美国Invitrogen公司产品,逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒及焦碳酸二乙酯(diethy pyrocarbonate,DEPC)水为宝生物工程(大连)有限公司产品,鼠抗人细胞角蛋白单抗、二氨基联苯胺(Diaminobenzidine,DAB)显色液、免疫组织化学法SP试剂盒,均为北京中杉金桥生物技术有限公司产品,鼠抗人波形蛋白抗体、抗白细胞CD45抗体、抗第Ⅷ因子相关抗原抗体均为武汉博士德生物技术有限公司产品,AQP1一抗为美国Santa Cruz公司产品,细胞消化液[0.125%胰蛋白酶-0.02%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)-2Na]为美国Sigma公司产品,1640培养液为美国Invitrogen公司产品,胎牛血清(fetal bovine serum,FBS)为天津TBD公司产品,D-葡萄糖、氯仿、异丙醇等分析纯购自天津市科密欧化学试剂有限公司,肝素钠注射液(12 500 u/2 ml,12500u相当于100 mg)购自江苏万邦生化医药股份有限公司,PBS液、D-Hank平衡盐溶液为本实验室自行配置,过滤灭菌分装,室温保存。
1.1.2主要仪器二氧化碳CO2培养箱及高速台式冷冻离心机为德国贺力式公司生产,垂直层流洁净工作台为上海上净净化设备有限公司生产,紫外可见分光光度计(型号UV-9100)为北京瑞利分析仪器公司生产,紫外分析仪(型号WFH-201)购自温州市孚华分析仪器厂,倒置相差显微镜购自日本奥林巴斯公司,凝胶成像分析系统购自美国Pharmacia Biotech公司,水平电泳槽购自北京市六一仪器厂,PCR仪购自美国Biometra公司。
1.2人腹膜间皮细胞的分离、培养与鉴定
本实验从连续性腹膜透析患者透出液中分离并提取人腹膜间皮细胞,无菌条件下收集患者流出液标本,4℃、1200r/min离心5min。D-Hank平衡盐溶液洗涤沉淀3次,将细胞接种于含10%(V/V)胎牛血清的1640培养液中,置于二氧化碳CO2培养箱37℃培养。每3天换液1次。原代培养的人腹膜间皮细胞最初呈多形性,星状及梭状占多数。待细胞生长融合后形成典型的铺路石样外观(见图1),这与周循等人描述的人腹膜间皮细胞形态一致[2]。用0.125%胰蛋白酶-0.01%EDTA 2 ml混合液消化细胞,吸管吹打均匀,使细胞密度保持在1×105~1× 106个/ml。第2代细胞用于形态学及免疫组织化学鉴定,第3代细胞进行实验研究。免疫组织化学法显示,抗细胞角蛋白抗体阳性、抗波形蛋白抗体染色阳性(见图2、3),抗第Ⅷ因子抗体和抗白细胞CD45抗体染色阴性(见图4、5),由此可排除血管内皮细胞、成纤维细胞等[3-4],证明其是腹膜间皮细胞。
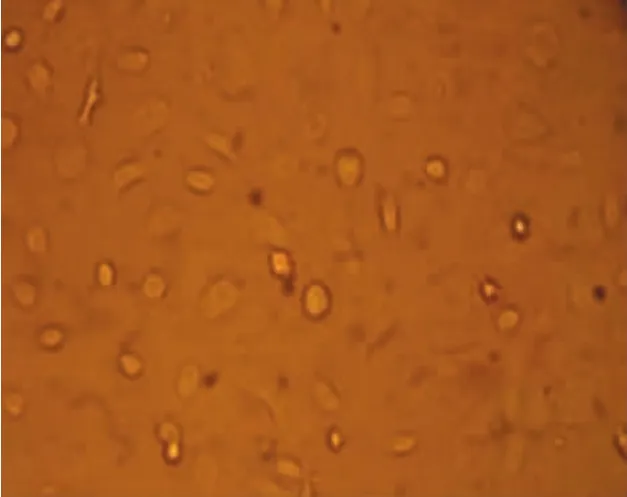
图1 人腹膜间皮细胞 (×400)
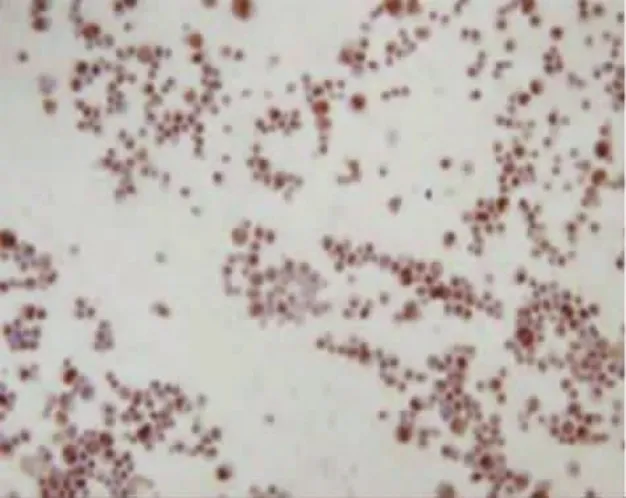
图2 细胞角蛋白阳性 (×100)
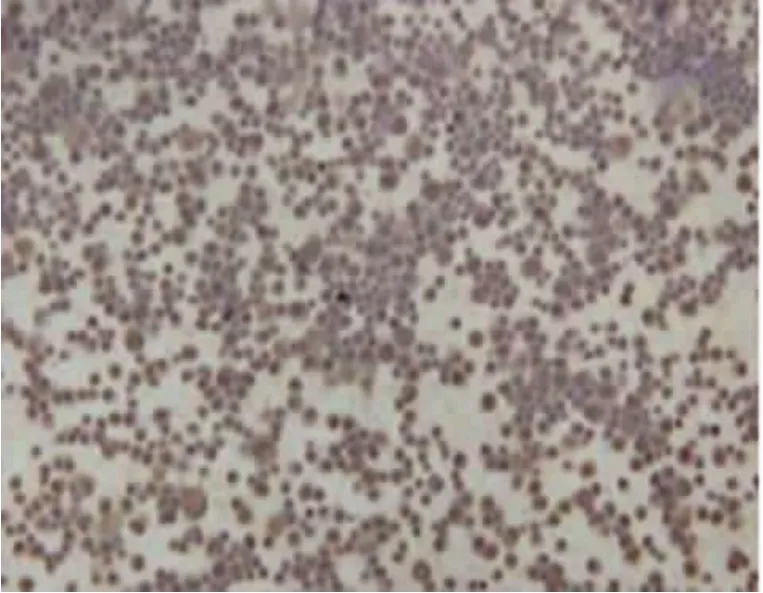
图3 细胞波形蛋白阳性 (×100)
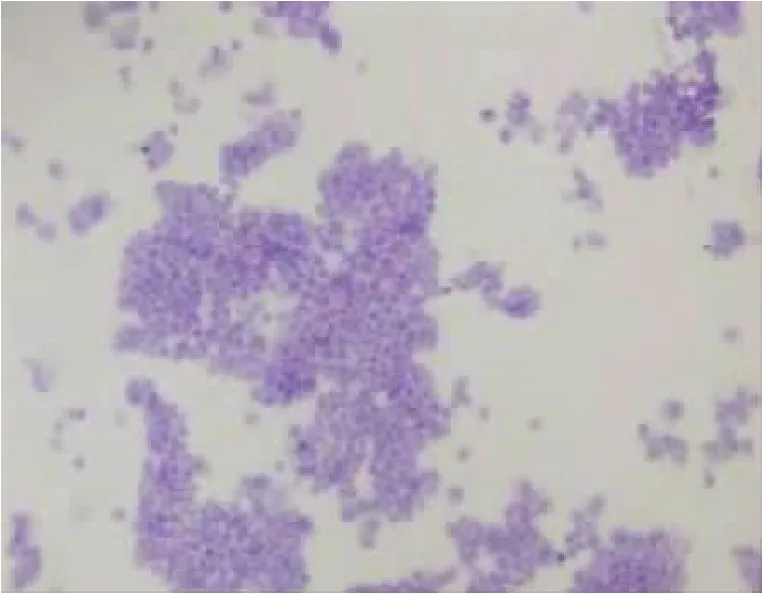
图4 第Ⅷ因子相关抗原阴性 (×100)
图5 白细胞CD45抗原阴性 (×100)
1.3经2.5%高糖诱导后AQP1 mRNA表达水平呈时间依赖性
将3次传代后的人腹膜间皮细胞均匀接种于6孔培养板上,用无血清的1640培养液同步消化24 h。无菌称取葡萄糖2.5 g,溶于100 ml无菌三蒸水中,配置成2.5%高糖溶液。将2.5%高糖添加于细胞培养液中,分别诱导4、8、12和24 h,比较诱导不同时间后AQP1 mRNA的表达水平。提取细胞总RNA,在6孔细胞板内加入1 ml TRIzol,轻轻吹打数次,收集细胞于2 ml离心管内(德国Eppendorf公司),室温静置5min。加入氯仿200μl,振荡充分摇匀,室温静置5min,4℃、1000r/min离心10min。加入与上清液等体积的异丙醇,上下混匀,室温静置5min,4℃、1200r/min离心10min。用75%乙醇1 ml清洗沉淀,4℃、1 200 r/min离心5 min,弃上清留沉淀,室温干燥。用8μl DEPC处理水溶解沉淀。取2μl RNA样本,在紫外分光光度计下测量260和280nm下光密度(optical density,OD)值,A260/A280值在1.8~2.0。凝胶成像仪下可见28、18和5S 3条清晰的RNA带,说明RNA无降解。cDNA的合成参照逆转录试剂盒操作程序进行。反应体系为10μl,反应条件为:37℃预变性10 min,42℃变性60 min,99℃延伸5min。引物序列从Genebank中查阅,采用Primer Premier 5软件设计引物。β-actin(531bp):正向引物5'-CCCTGGACTTCGAGCAAGAGAT-3',反向引物5'-GTTTTCTGCGCAAGTTAGG-3';AQP1 (336 bp):正向引物5'-AGATCAGCATCTTCCGTG-3',反向引物5'-AGTTGTGTGTGATCACCG-3';PCR反应条件:94℃预变性3 min;55℃变性1 min;72℃延伸1min。反应后取5μl PCR产物在1.2%琼脂糖凝胶上电泳,凝胶成像分析系统中观察并拍照。对图像中的内参(β-actin)和目的基因(AQP1)的DNA条带进行光密度分析,用AQP1光密度值/β-actin光密度值表示目的基因相对表达量。每组测3个数值,求平均数,然后进行统计学分析。
1.4RT-PCR检测不同实验组细胞AQP1基因表达水平
用一定剂量的无菌注射用水稀释肝素钠注射液(50 mg/ml),配置不同浓度的肝素溶液,并加入到细胞培养液中,用2.5%葡萄糖诱导细胞24 h;按照不同实验要求随机分为以下5组:①无葡萄糖无肝素对照组(对照组);②2.5%葡萄糖组;③2.5%葡萄糖+ 2.5×10-3mg/ml肝素组;④2.5%葡萄糖+5.0×10-3mg/ml肝素组;⑤2.5%葡萄糖+1.5×10-2mg/ml肝素组。细胞RNA的提取、逆转录成cDNA,以及PCR扩增方法同1.3所述。
1.5免疫细胞化学法检测AQP1蛋白表达
收集细胞,PBS冲洗3次,多聚甲醛冰上固定30min。PBS再次冲洗3次。自然风干后,用3%过氧化氢H2O2室温避光孵育30 min,PBS冲洗3次。血清封闭非特异性抗原后,加Ⅰ抗AQP1多克隆抗体,4℃孵育过夜。加入生物素化Ⅱ抗,37℃孵育30min,PBS洗3次,加入链酶亲合素-生物素-碱性磷酸酶复合物,37℃孵育30min,PBS洗3次。滴加DAB显色液,镜下观察至出现棕黄色阳性信号后蒸馏水冲洗终止反应。苏木素复染,碳酸锂水溶液返蓝,梯度乙醇逐级脱水,透明,过二甲苯溶液,中性树胶封片,自然风干。每张切片随机取5个视野光镜拍照,用Image ProPlus6.0图像分析软件测出OD值,并计算平均光密度。着色越深,则OD值越大,表明该蛋白表达水平越高,比较对照组与实验组不同剂量肝素对高糖诱导24 h后AQP1的蛋白表达水平差异是否具有统计学意义。
1.6统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1RT-PCR反应
经2.5%葡萄糖诱导4、8、12和24 h后,人腹膜间皮细胞水通道蛋白AQP1的mRNA表达水平呈现出时间依赖性,诱导4、8、12和24 h后AQP1 mRNA表达比诱导前有上调(F=11.392,P=0.004),提示高糖可上调AQP1的表达。诱导24h时mRNA表达量比诱导4、8和12h增加(F=7.513,P=0.035),而诱导4、8和12 h组间比较,差异无统计学意义(F=0.121,P=0.623)(见图6)。
2.5%葡萄糖组、2.5%葡萄糖+2.5×10-3mg/ml肝素组、2.5%葡萄糖+5.0×10-3mg/ml肝素组以及2.5%葡萄糖+1.5×10-2mg/ml肝素组与对照组比较,AQP1的mRNA表达比较,差异有统计学意义(F= 15.638,P=0.002)。而2.5%葡萄糖+2.5×10-3mg/ml肝素组与2.5%葡萄糖+5.0×10-3mg/ml肝素组中AQP1 mRNA的表达比较,差异无统计学意义(F= 1.085,P=0.533),而2.5%葡萄糖+1.5×10-2mg/ml肝素组较前3组可明显增加腹膜间皮细胞上AQP1 mRNA的表达(F=10.473,P=0.027)(见图7)。
2.2免疫组织化学法
实验组与对照组中均有AQP1蛋白表达(见图8、9)。与对照组比较,2.5%葡萄糖组、2.5%葡萄糖组+不同剂量肝素组的AQP1蛋白阳性表达明显增高,差异有统计学意义(F=9.367,P=0.003),胞核上亦可见棕黄色深染颗粒;2.5%葡萄糖+1.5×10-2mg/ml肝素组与3组的AQP1表达比较,差异有统计学意义(F=7.421,P=0.016);而2.5%葡萄糖组、2.5%葡萄糖+2.5×10-3mg/ml肝素组、2.5%葡萄糖+5.0×10-3mg/ml肝素组比较,差异无统计学意义(F=2.540,P=0.297)(见图10~13)。2.5%葡萄糖+1.5×10-2mg/ml肝素组免疫组织化学染色可见胞核及胞浆有空泡样变,而2.5%葡萄糖+常规剂量肝素组胞浆及胞核未见明显空泡样变。
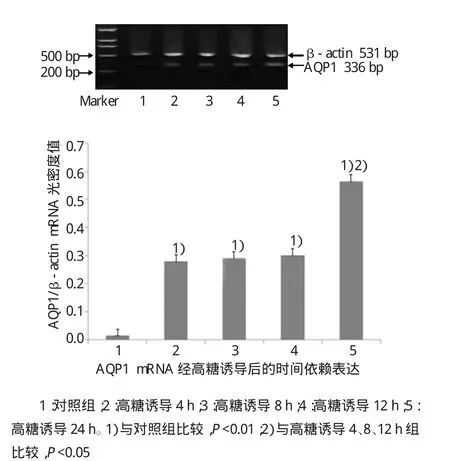
图6 AQP1 mRNA经高糖诱导后的时间依赖表达
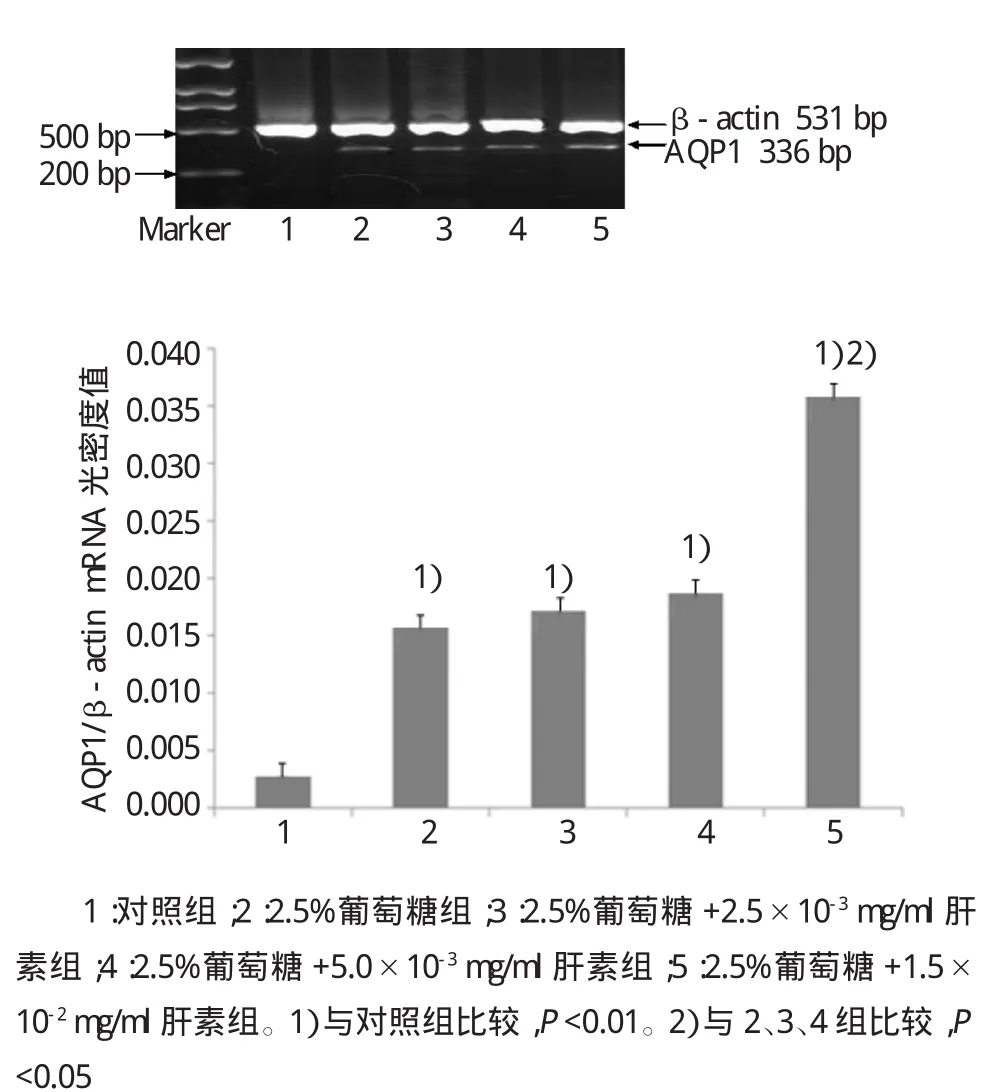
图7 不同剂量肝素+2.5%葡萄糖对AQP1 mRNA表达的影响
图8 对照组AQP1蛋白表达阳性 (×400)
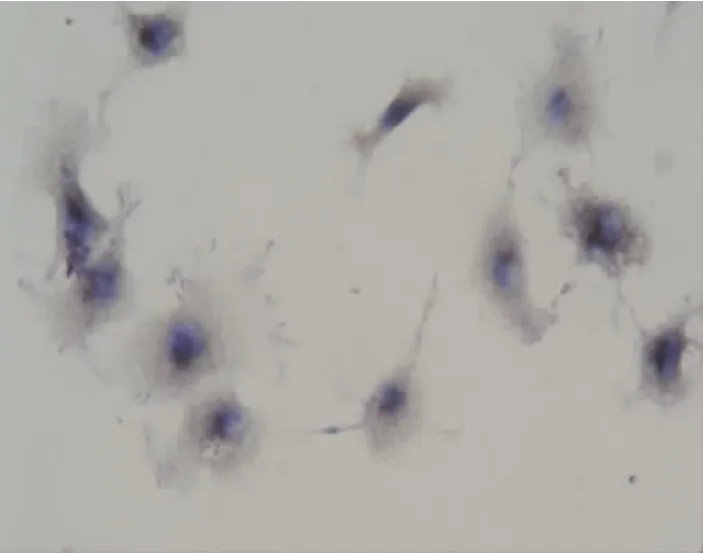
图9 2.5%葡萄糖组AQP1蛋白表达阳性 (×400)
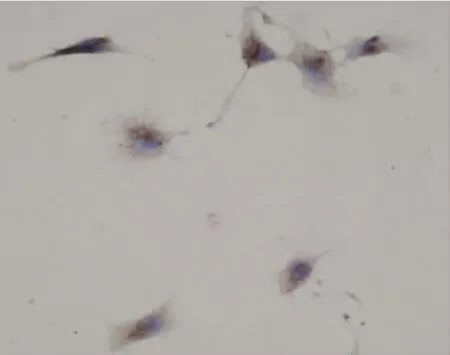
图10 2.5%葡萄糖+2.5×10-3mg/ml肝素组AQP1蛋白表达阳性 (×400)
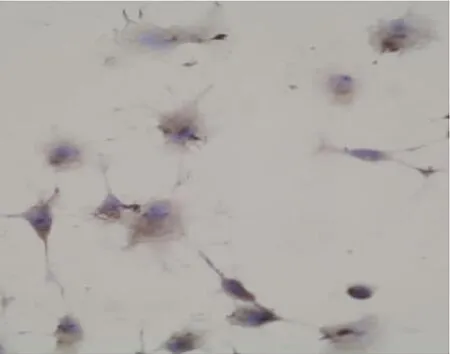
图11 2.5%葡萄糖+5.0×10-3mg/ml肝素组AQP1蛋白表达阳性 (×400)

图12 2.5%葡萄糖+1.5×10-2mg/ml肝素组AQP1蛋白表达阳性 (×400)
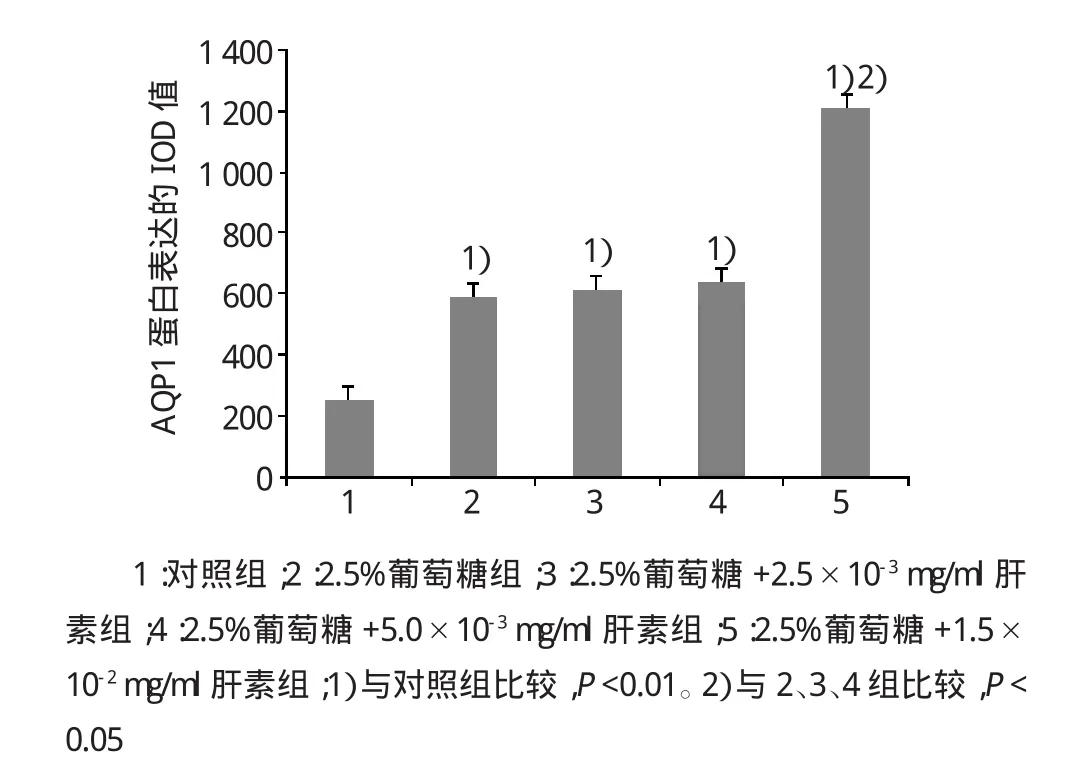
图13 不同剂量肝素+2.5%葡萄糖对AQP1蛋白表达的影响
3 讨论
一直以来,传统观点认为腹膜透析中水分子的跨膜转运方式是简单扩散,但Agre等[5]发现了28kD通道整合膜蛋白,提出水转运方式是通过通道蛋白介导的。Rippe等[6]首次运用大孔、小孔、超微孔的3孔模型对水的跨膜转进行了解释。超微孔(3~)对水分子具有选择通透性,水通道蛋白(aquaporins,AQPs)为超微孔的对应物,可选择性地跨膜转运水分子及甘油、尿素等某些小分子溶质。水通道蛋白广泛存在于动植物及微生物的细胞膜上,迄今为止已发现200余种,在哺乳动物中,已克隆并鉴定出13种,分为AQP0~AQP12[7]。
在某些特定条件下,水通道蛋白的表达受到激素、渗透压改变和某些药物的影响[8]。Tang等[9]提出AQP1存在于腹膜间皮细胞上,渗透剂葡萄糖可诱导其转录和表达。葡萄糖可引起人腹膜细胞形态改变,如微绒毛倒伏、缺失、细胞质内的线粒体出现空泡样变等[10]。Yang等[11]用氯化汞HgCl2阻断大鼠腹膜细胞上的AQP1,66%水分子转运受到抑制。腹膜间皮细胞水通道蛋白AQP1数量、结构或功能的改变对腹膜透析的水超滤有一定影响。陈生晓等[12]认为高糖腹膜透析液可以促进腹膜间皮细胞AQP1的表达。李正红等[13]认为高糖能增加AQP1从胞质转移到胞膜上,从而增加该细胞对水的通透性。这种转移机制的存在提示AQP1在细胞内分布的改变可能也与腹膜超滤衰竭的发生有关。
长期的腹膜透析使腹膜长期暴露在非生理性的高糖透析液中,可引起腹膜组织纤维化以致超滤衰竭,使患者被迫放弃透析治疗[14]。临床上肝素主要用于预防腹膜透析管堵塞。肝素作为抗凝剂能够通过抑制腹腔内纤维蛋白的聚集而间接减少腹膜纤维化的发生。同时有扩张血管的作用,增加腹膜的通透性,从而增加溶质的滤过。Kar等[15]的研究显示,高糖诱导的AQP1主要表达在胞浆及胞膜上,胞核亦有少量阳性表达。
本实验显示,无葡萄糖无肝素对照组中胞膜及胞浆AQP1表达阳性而胞核阴性,而2.5%葡萄糖组及2.5%葡萄糖+不同剂量肝素组与对照组比较,AQP1表达明显上调,同时显示胞核亦有阳性表达,尤以1.5×10-2mg/ml肝素+2.5%葡萄糖组更为明显(P<0.05),提示肝素和葡萄糖可协同上调腹膜间皮细胞水通道蛋白AQP1的表达。本研究的RT-PCR及免疫组织化学结果一致显示,与无糖无肝素的对照组比较,2.5%葡萄糖组及2.5%葡萄糖+不同浓度肝素组均能增加AQP1 mRNA和蛋白的表达,差异有统计学意义(P<0.01);且AQP1 mRNA和蛋白表达水平在2.5%葡萄糖+1.5×10-2mg/ml肝素组呈现明显上调,差异有统计学意义(P<0.05)。2.5%葡萄糖+1.5×10-2mg/ml肝素组可观察到人腹膜细胞胞核及胞浆有空泡样改变。由此推测1.5×10-2mg/ml肝素和2.5%葡萄糖对腹膜透析中腹膜间皮细胞可能存在一定程度的损伤作用,这一损伤的具体过程及分子机制有待深入研究。由此可进一步推测人腹膜间皮细胞中AQP1表达或功能的改变可影响跨腹膜水转运,甚至可导致腹膜超滤衰竭的发生。
总之,本研究证实在高糖环境下肝素对体外培养的腹膜间皮细胞的AQP1表达有上调作用,在正常剂量下增加其表达但不引起细胞凋亡等空泡样改变,说明中低剂量的肝素既能增加水通道蛋白AQP1的表达,又可能对人腹膜间皮细胞具有一定程度的保护作用,因此,在腹膜透析时具有较高的安全性,值得临床广泛应用及推广。
[1]Nakayama M,K awaguchi Y,Yamada K,et al.Immunohistochemical detection of advanced glycosylation end-products in the peritoneum and its possible patho-physiological role in CAPD[J]. Kidney Int,1997,51(1):182-186.
[2]周循,凌光辉,邹莎琳,等.腹膜透析流出液中人腹膜间皮细胞的培养及转分化特征[J].中国现代医学杂志,2010,20(17):2634-2638.
[3]殷莉波,赵文秀,尹震宇,等.人腹膜间皮细胞的改良分离及其鉴定[J].中国组织工程研究与临床康复,2011,15(27):5007-5010.
[4]徐庆,曾莉.人腹膜间皮细胞的体外培养[J].深圳中西医结合杂志, 2008,18(1):7-9.
[5]Agre P,King LS,Yasui M,et al.Aquaporin water channels: from atomic structure to clinical medicine[J].J Physiol,2002, 542(1):3-16.
[6]Rippe B,Stelin G,Haraldsson B.Computer simulations of peritoneal fluid transport in CAPD[J].Kidney Int,1991,40(2): 315-325.
[7]杜伟伟,杨洪涛.AQP1与腹膜透析超滤相关研究进展[J].中国中西医结合肾病杂志,2012,13(11):1020-1023.
[8]彭燕,仲建新.水通道蛋白结构、分布与功能[J].中国医学创新, 2011,8(9):194-196.
[9]Tang S,Leung JC,Lam CW,et al.In vitro studies of aquaporins 1 and 3 expression in cultured human proximal tubular cells: up-regulation by transferring but not albumin[J].Am J Kidney Dis,2001,38(2):317-330.
[10]李志明,马健飞,赵钢,等.腹透液相关浓度葡萄糖对体外腹膜间皮细胞的影响[J].中国现代医学杂志,2007,17(5):513-518.
[11]Yang B,Folkesson HG,Yang J,et al.Reduced osmotic water permeability of the peritoneal barrier in aquaporin-1 knockout mice.Am J Physiol[J].1999,276(1):76-81.
[12]陈生晓,任昊,刘郑荣,等.腹透液对大鼠腹膜间皮细胞水通道蛋白1表达的影响[J].解放军医学杂志,2008,33(1):72-74.
[13]李正红,张旭,曹丽萍,等.黄芪注射液对高糖腹透液作用下人腹膜间皮细胞AQP1表达的影响[J].中华中医药杂志,2012,27(4): 1148-1151.
[14]彭卫生,周巧玲,余学清,等.不同浓度葡萄糖透析液及LPS对腹膜透析大鼠腹膜组织VEGF及血管增生的影响及其意义[J].中国现代医学杂志,2007,17(17):2085-2088.
[15]Kar NL,Fu KL,Hao YL,et al.Expression of aquaporin-1 in human peritonealmesothelialcells and its up-regulation by glucose in vitro[J].J Am Soc Nephrol,2001,12(5):1036-1045.
(张蕾编辑)
Impact of different dosages'heparin on the expression of aquaporins 1 of human peritoneal mesothelial cells induced by high concentration glucose
Ge Li1,Jiu-yang Zhao2,Ze-yin Ren1,Wei Xiao1,Yong-feng Gui1
(1.Department of Nephrology,the First People's Hospital,Changde,Hunan 415000,China;2.Department of Nephrology,the Second Hospital Affiliated to Dalian Medical University,Dalian,Liaoning 116000,China)
Objective To investigate the impact of different dosages'heparin on the expression of aquaporin-1 (AQP1)of human peritoneal mesothelial cells(HPMCs)induced by high concentration glucose(2.5%W/W).Methods HPMCs were separated from patients and sub-cultured,and induced by high concentration glucose for 4,8,12,and 24 h respectively.This is to determinate the time when the mRNA of AQP1 reaches the maximum level.Heparin of different dosages and 2.5%glucose were added into the cell culture medium.The expression levels of AQP1 were detected by using RT-PCR and immunohistochemistry in both control and experimental groups.Results Compared with the control group,the mRNA expression level of AQP1 was up-regulated in an time-dependant manner,with the maximum expression at 24 h induced by high concentration glucose.The protein expression level of AQP1 was also up-regulated in all experimental groups,particularly by 2.5%glucose and 1.5×10-2mg/ml heparin.The difference was of statistical significance(P<0.05).The result of RT-PCR is consistent with that of immunohistochemistry.By using immunohistochemistry,vacuolation was observed in the nucleus and cytoplasm treated by 2.5%glu-cose and 1.5×10-2mg/ml heparin.Conclusion The mRNA and protein expression of AQP1 can be up-regulated by 2.5%glucose and heparin.Vacuolation can be observed in the nucleus and cytoplasm treated by glucose and heparin of high concentration.
heparin;human peritoneal mesothelial cells;aquaporin 1
R 572.2
A
10.3969/j.issn.1005-8982.2016.04.004
1005-8982(2016)04-0018-06
2015-11-12

