内皮抑素30肽对HepG2细胞黏附、侵袭能力影响的机制研究*
郭红艳,刘秀财,李淑艳(齐齐哈尔医学院 生物化学教研室,黑龙江 齐齐哈尔 161006)
论著
内皮抑素30肽对HepG2细胞黏附、侵袭能力影响的机制研究*
郭红艳,刘秀财,李淑艳
(齐齐哈尔医学院 生物化学教研室,黑龙江 齐齐哈尔 161006)
目的探讨R GD修饰的人内皮抑素30肽对HepG2细胞黏附、侵袭的影响及作用机制。方法人工合成人内皮抑素1~30位氨基酸(30肽,序列25~31由R GIR GAD改为R GDR GD)所对应的核苷酸序列,连接到质粒pTYB2中,再转化至大肠埃希菌BL21(DE3)中表达,同法合成人内皮抑素1~27位氨基酸构成的27肽作为对照。细胞黏附实验及Transwell实验分别检测30肽和27肽对HepG2细胞黏附能力和侵袭能力的影响,同时筛选与侵袭作用相关的整合素;免疫荧光检测30肽和27肽对αvβ3整合素的聚集作用,流式细胞仪检测30肽和27肽对HepG2细胞表面相应整合素表达的影响;逆转录-聚合酶链反应(R T-PCR)及Western blot检测30肽和27肽对HepG2细胞TIMP1和TIMP2 mR NA和蛋白质表达量的影响。结果30肽能明显抑制HepG2细胞黏附、侵袭,对侵袭作用的影响与整合素αvβ3相关,同时,30肽能上调HepG2细胞中TIMP1和TIMP2 mR NA及蛋白质的表达,30肽加αvβ3抗体后,上述作用明显增强。结论30肽可能是通过整合素αvβ3发挥其抗肿瘤侵袭转移作用,可以成为临床上肝癌的辅助化疗药物发挥作用。
内皮抑素;R GD序列;侵袭;TIMP
内皮抑素是O'Reilly等[1]发现的一种内源性血管生成抑制剂,由胶原蛋白ΧⅧ羧基端的184个氨基酸残基组成,研究发现其具有抑制肿瘤生长、改善肺纤维化等作用,且与其他多种疾病相关[2-3],因此,内皮抑素日益受到研究者的关注和重视。
已有研究证实,内皮抑素活性区主要在N端的1~27个Aa上[4],因此,本课题组构建并表达了人内皮抑素1~30位氨基酸(30肽,序列25~31由RGIRGAD改为RGDRGD)所对应的核苷酸序列,前期研究证明,30肽具有更强的抑制肿瘤细胞增殖和转移的能力[5],本文拟在前期工作的基础上,进一步研究30肽抑制肿瘤侵袭与转移的作用机制。本文以人HepG2细胞为实验材料,探讨经过RGD修饰的30肽通过与何种整合素特异性结合调节肿瘤转移相关基因的表达,进而影响肿瘤细胞的转移,为30肽用于临床治疗肿瘤提供理论指导和实验依据。
1 材料与方法
1.1材料与试剂
RPMI1640细胞培养基(Gibco)、新生牛血清(PAA)、胰酶(DIFCO)购买于美国Invitrogen公司,人工基底膜Matrigel(E1270)购买于美国sigma公司,antibody(anti-α5、anti-β1、anti-β3、anti-αvβ3、anti-TIMP1、anti-TIMP2、anti β-actin)以及二抗购自美国Santa Cruz公司,Transwell小室购自美国Corning Costar公司,R NA提取试剂盒购于美国Promega公司,DRR019A逆转录-聚合酶链反应(reversetranscription-polymerasechainreaction,RT-PCR)试剂盒购自日本TaKaRa公司;研究所用30肽和27肽是课题组分别从构建的30肽和27肽基因工程菌中提取纯化,并通过葡聚糖凝胶G15层析去除DTT、Tricine-SDS-PAGE鉴定。
1.2细胞培养
人肝癌细胞株HepG2(本室保存)用含10%胎牛血清的RPMI 1640培养基,5%二氧化碳CO2的37℃环境培养,细胞在60%~70%融合时进行相关实验。
1.3实验方法
1.3.130肽对HepG2细胞黏附能力的影响实验
实验参考文献[6]的方法,设立对照组、27肽组和30肽组。在96孔培养板孔中预先铺2μg人工基底膜(matrigel),加2%BSA 20μL/孔,置于22℃1h,PBS冲洗。HepG2细胞用0、20、40、60、80和100μg/ml的27肽和30肽预孵育24 h,5×104个细胞/孔,置于37℃90 min。用PBS冲洗掉未黏附的细胞,加入MTT 20μl/孔,37℃孵育 4 h,弃去 MTT,加入100μl/孔DMSO,用酶标仪在570 nm测定吸光度值,计算各组的相对黏附率,每组设3个平行对照,实验在不同时间进行3次。
1.3.230肽对HepG2细胞侵袭能力的影响及相关整合素筛选实验实验参考Liu等[7]人的方法。在Transwell小室的内表面涂5μg Matrigel,置于37℃干燥后形成一个基质屏障层。设立对照组、27肽处理组和30肽处理组,其中对照组细胞未经肽处理,27肽组和30肽组细胞分别经45μg/ml的27肽和30肽处理24 h。用胰酶消化细胞后,将细胞悬液加到Transwell小室中,每小室100μl,细胞数均为1×105个。在24孔培养板内加入含20%FBS的RPMI1640培养液,每孔500μl。将小室浸于24孔板的条件培养基中,37℃,5%二氧化碳CO2培养箱内孵育24h。吸弃上室中的溶液,用棉签轻轻擦去小室内侧壁未转膜的细胞,用0.1%结晶紫染小室膜20 min,晾干,在100倍显微镜下计数侵袭细胞数,拍照保存。每膜计数上下左右中5个不同视野的穿膜细胞数,计算平均值。同时,以单加30肽为对照,同时向 4个小室中对应加入抗 α5、β1、β3、αvβ3整合素抗体(终浓度为50μg/ml)。检测30肽分别加入α5、β1、β3、αvβ3整合素抗体后对HepG2细胞侵袭能力的影响。每组设3个平行孔,不同时间进行3次。
1.3.3流式细胞术分析30肽对细胞表面αvβ3整合素表达水平的影响参考Chen等[8]人的方法。设立对照组、27肽组和30肽组。其中对照组细胞未经肽处理,27肽组和30肽组细胞分别经45μg/ml的27肽和30肽处理24 h,HepG2细胞生长到融合状态后用0.25%胰酶消化,用PBS洗涤后制成单细胞悬液,与荧光标记的抗αvβ3抗体一抗37℃孵育30 min,用PBS冲洗后,按1×105个细胞/管分装,与FITC标记的二抗在37℃避光孵育30 min,用PBS冲洗,FACSCalibur流式细胞仪检测,实验在不同时间进行3次。
实验三:间歇采样重复转发干扰的采样周期Ts=3 μs,采样间隔τ=0.7 μs,干信比取40 dB,所得目标信息如表4所示,仿真结果如图5所示。
1.3.4免疫荧光检测30肽对细胞表面αvβ3整合素聚集作用的影响设立对照组、27肽组和30肽组。取对数生长期HepG2细胞,5×105个细胞/孔接种24孔培养板,孵育24 h,给药组分别加入终浓度为45μg/ml的27肽和30肽,对照组加入相同体积PBS,继续培养24 h,PBS冲洗2次,4%多聚甲醛固定20min,5%BSA封闭30min,每孔加入αvβ3一抗,置于4℃湿盒内过夜,PBS振洗3次,每孔加入FITC标记的二抗,37℃1 h,PBS冲洗3次,置于荧光显微镜下观察并拍照,实验在不同时间进行3次。
1.3.5R T-PCR检测30肽对TIMP1和 TIMP2 mR NA表达的影响用RT-PCR方法检测金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases,TIMP)家族TIMP1和TIMP2 mRNA在30肽及27肽作用下的变化,终浓度为45μg/ml的30肽和27肽分别作用HepG2细胞0、12、24及48 h后,提取总RNA,逆转录合成cDNA,PCR引物序列见附表,PCR反应条件如下:94℃预变性2 min,94℃变性30s,退火30 s,72℃延伸60 s,循环次数为35循环(β-actin为30循环);扩增产物经1.5%琼脂糖凝胶电泳,紫外线下凝胶置于成像系统下进行拍照,记录。
另外分别用45μg/ml的30肽、45μg/ml的αvβ3抗体和 45μg/ml的 30肽 +45μg/ml的αvβ3抗体作用于HepG2细胞24 h,后续处理同上,分别检测细胞中TIMP1和TIMP2 mRNA,以上实验重复3次。
1.3.6Western blot检测30肽对TIMP1和TIMP2表达的影响用Western blot方法检测TIMP1和TIMP2蛋白在30肽及27肽作用下表达的变化。终浓度为45μg/ml的30肽和27肽分别作用HepG2细胞0、12、24及48 h后,分别收集细胞(800 rpm,5 min)提取蛋白,检测细胞总蛋白浓度。取50μg蛋白进行SDS-PAGE凝胶电泳,转膜,封闭液中室温封闭2h,加入相应稀释倍数的一抗,4℃孵育过夜,洗膜后,加入1∶5000的HRP标记的二抗室温孵育2 h,采用化学发光法(ECL)曝光胶片,冲洗显色检测相应的蛋白条带,GPS8000型凝胶成像分析系统扫描分析蛋白条带。
另外设立30肽组、αvβ3抗体组和30肽+αvβ3抗体组,各组中分别用45μg/ml的30肽、45μg/ml 的αvβ3抗体和45μg/ml的30肽+45μg/ml的αvβ3抗体作用于HepG2细胞24 h,后续处理同上,分别检测细胞中TIMP1和TIMP2蛋白,实验重复3次。
1.4统计学方法
应用SPSS 19.0软件进行统计学分析,数据采用单因素方差分析,t检验进行组间比较,实验结果以均数±标准差(±s)表示,P<0.05为差异有统计学意义。
2 结果
2.130肽对HepG2细胞黏附能力的抑制作用
2.230肽对HepG2细胞侵袭能力的抑制作用
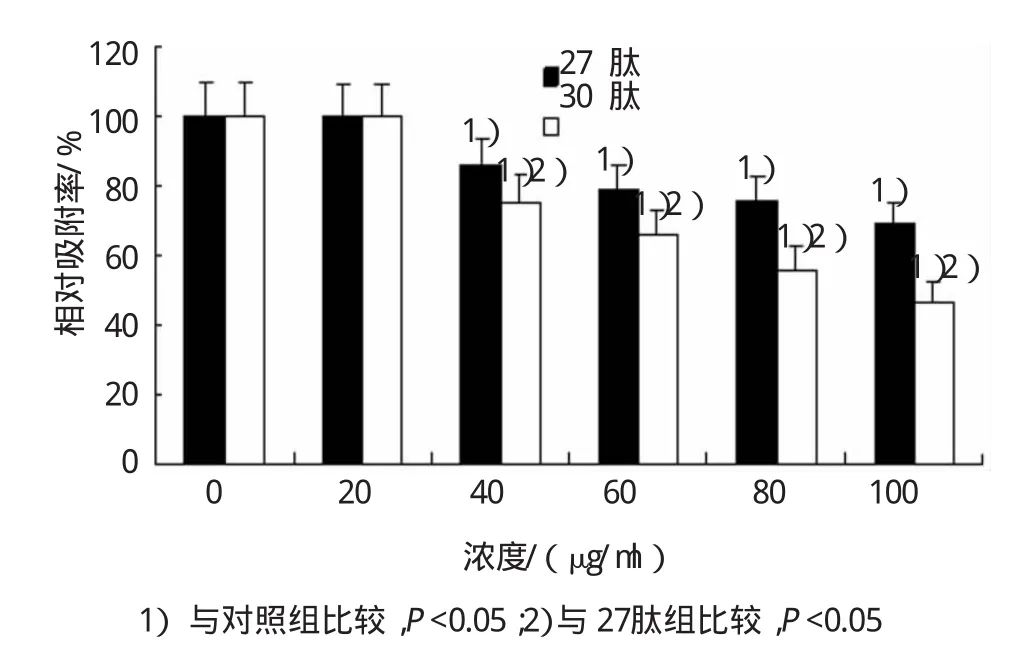
图1 30肽对HepG2细胞黏附能力的影响
体外侵袭实验检测30肽对细胞侵袭能力的影响,从图2A、B可见,3组细胞的穿膜细胞数分别是(205.6±20.13)、(132.9±13.55)和(71.25±9.45),肽处理组的穿膜细胞数均低于对照组,30肽组穿膜细胞数显著低于27肽组;30肽加入α5、β1、β3及αvβ3整合素抗体后,穿膜细胞数分别为(80±8.02)、(79.17±8.12)、(82.5±8.19)和(39.99±4.35)。可见只有加入αvβ3抗体后,30肽对HepG2细胞的侵袭能力得到进一步抑制,其余抗体对HepG2细胞的侵袭能力无明显影响(见图2C、D)。
2.330肽对细胞表面αvβ3整合素表达的影响
流式细胞仪检测结果显示:对照组、27肽组和30肽组细胞表面avβ3表达量变化无统计学意义(见图3)。
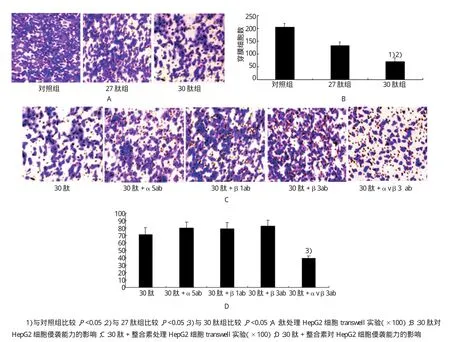
图2 30肽对HepG2细胞侵袭能力的抑制作用
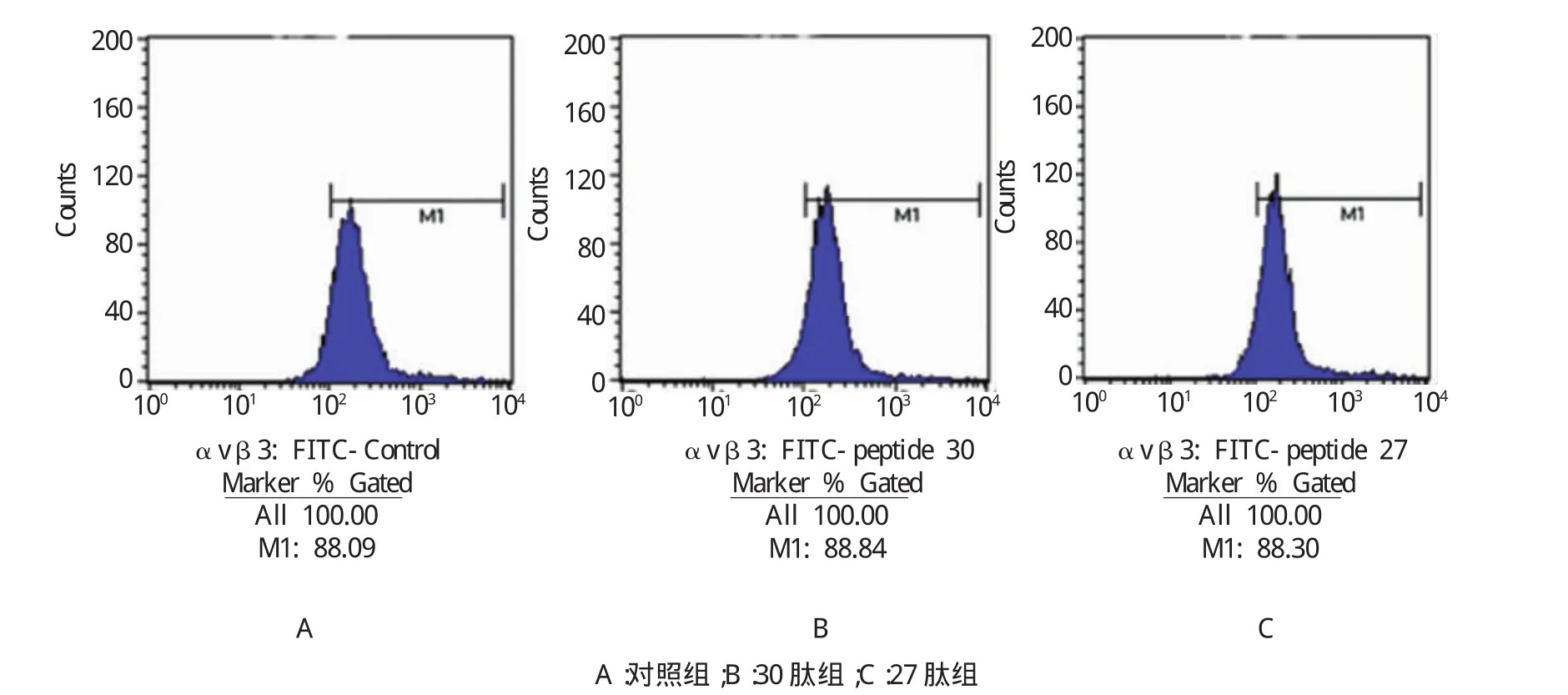
图3 流式细胞仪检测30肽对HepG2细胞表面αvβ3整合素表达水平的影响
2.430肽对αvβ3整合素的聚集作用
免疫荧光结果显示:与对照组及27肽组比较,30肽处理组HepG2细胞表面αvβ3明显聚集成簇(见图4)。
2.5RT-PCR检测TIMP1和TIMP2基因的表达
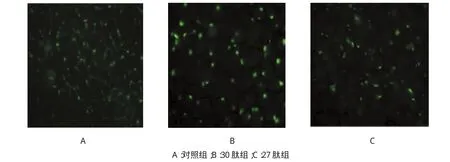
图4 30肽对HepG2细胞表面αvβ3整合素的聚集作用(×400)
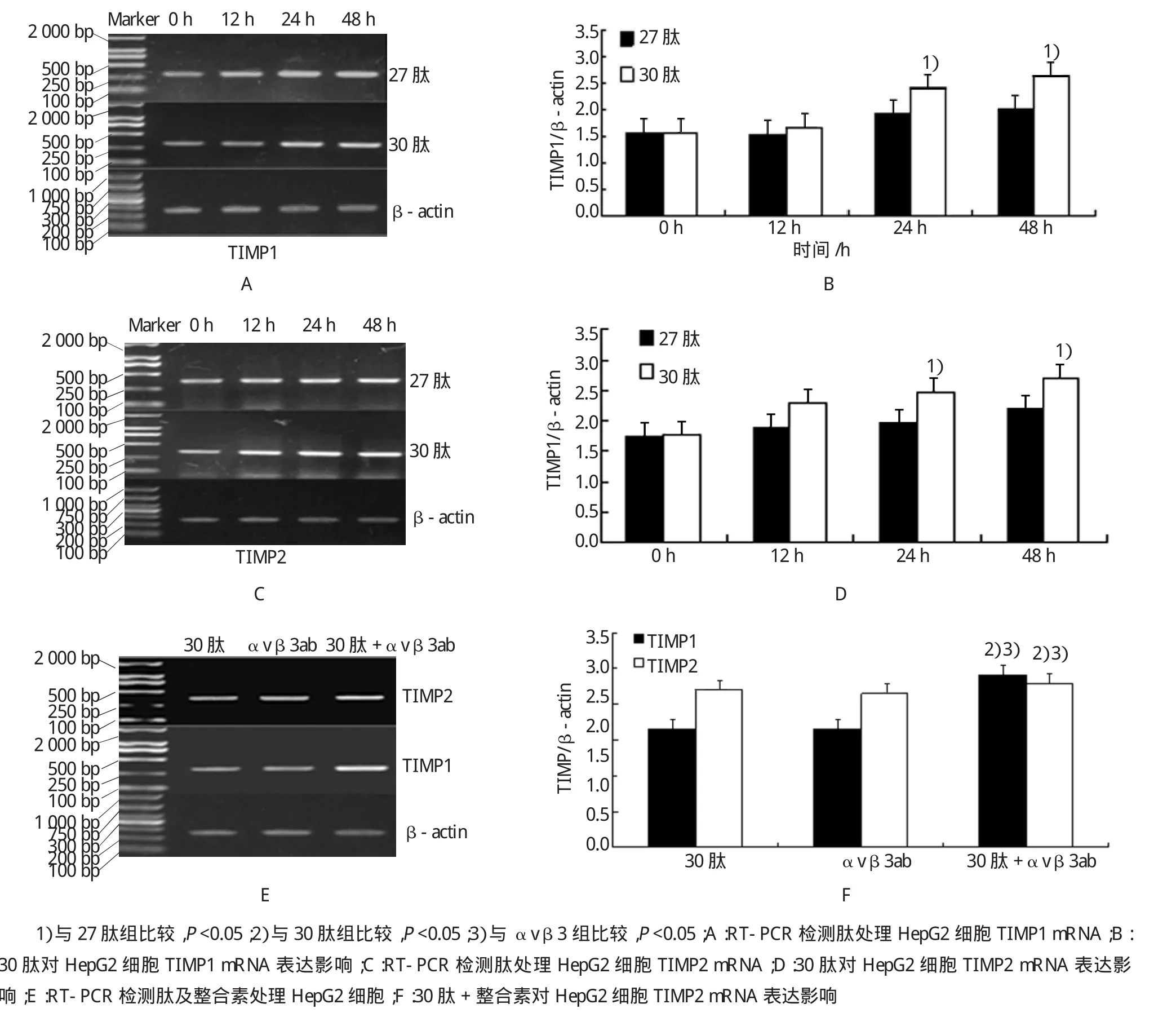
图5 30肽对HepG2细胞TIMP1和TIMP2 mRNA表达的影响及整合素的作用
如图5A-D,TIMP1和TIMP2的mRNA表达量随着27肽和30肽作用时间的延长而上调,30肽处理组在24 h开始上调TIMP1和TIMP2mRNA的表达(P<0.05);图5E-F中,与30肽组和αvβ3抗体组比较,30肽+αvβ3抗体组明显上调TIMP1和TIMP2mRNA表达量。
2.6Western blot检测TIMP1和TIMP2的表达
图6A-D中,反向TIMP1和TIMP2的表达量随着27肽和30肽作用时间的延长而上调,与27肽处理组比较,30肽处理组在24 h开始上调TIMP1和TIMP2蛋白的表达(P<0.05)。图6E-F中,与30肽组和αvβ3抗体组相比,30肽+αvβ3抗体组明显上调TIMP1和TIMP2蛋白的表达量。
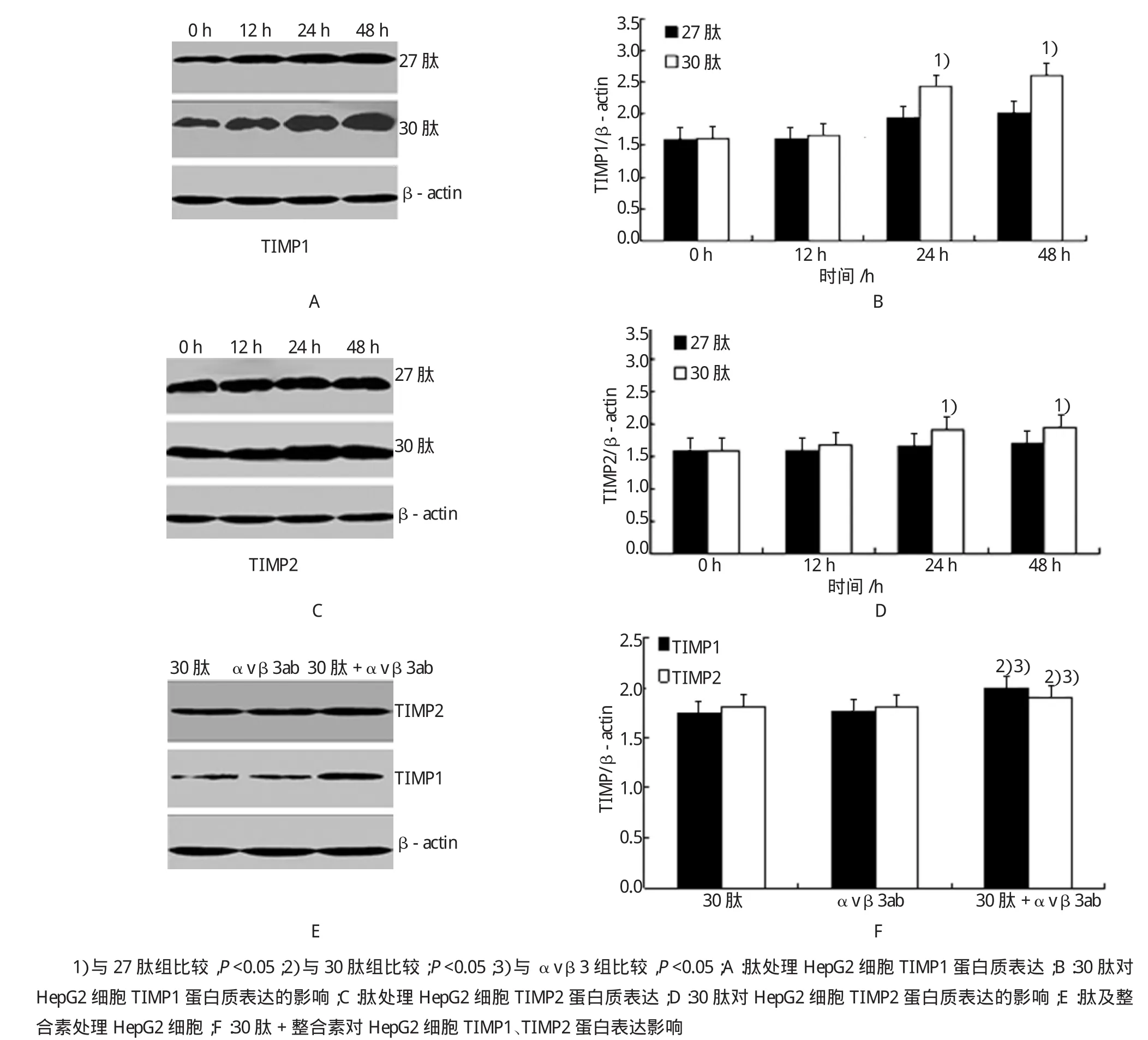
图6 30肽对HepG2细胞TIMP1和TIMP2蛋白表达的影响及整合素的作用
3 讨论
肿瘤转移是一个复杂的过程,黏附是肿瘤细胞侵袭的起始步骤,高侵袭的肿瘤细胞与基底膜成分的异质性黏附能力通常增高,而肿瘤细胞间的同质性黏附能力则会下降[9],上述特征有利于肿瘤细胞与肿瘤母体分离,并侵犯基底膜等正常组织。通过黏附实验检测30肽对肿瘤细胞与基底膜成分黏附能力的影响,结果表明,与27肽相比,30肽从40μg/ml开始,明显抑制HepG2细胞与matrigel的黏附,并呈剂量依赖性。
基底膜侵袭实验能较好地反映肿瘤细胞的侵袭能力,使用matrigel等基质成分模拟体内基底膜进行体外侵袭实验结果证明:与27肽组比较,30肽具有明显降低HepG2细胞侵袭能力的作用。30肽只比27肽多出一个RGDRGD序列,30肽抑制肿瘤细胞黏附、侵袭能力强于27肽,必定与其中的RGDRGD序列相关。RGD序列是指包含Arg-Gly-Asp3肽的序列,细胞外基质中的蛋白质借助其中的RGD序列识别并结合不同亚型的整合素,将细胞外信息传入细胞内,引发一系列病理生理变化,调节肿瘤细胞黏附,影响肿瘤细胞的增殖、转移及凋亡。
整合素在体内大多数细胞表面广泛表达,在多种生命活动中发挥关键作用[10],与肿瘤等疾病密切相关[11],具有RGD序列的小分子多肽会和细胞外基质蛋白质竞争与整合素的结合,产生去整合素效应。在侵袭实验中,分别加入α5、β1、β3及αvβ3整合素抗体,筛选30肽识别并结合的整合素亚型,结果加入αvβ3抗体能进一步抑制细胞的侵袭能力,而其他抗体都对30肽的活性无明显影响。
在肿瘤转移过程中,肿瘤细胞侵袭基底膜是重要环节,基质金属蛋白酶(matrix metalloproteinases,MMPs)被认为是该过程中主要的蛋白水解酶,是反映肿瘤侵袭能力的重要指标,其与多种疾病密切相关,本课题前期工作证明了30肽能下调肿瘤细胞MMP2和MMP9基因的表达及MMP2和MMP9的活性[5]。TIMP与MMP作用拮抗,是反映肿瘤侵袭能力的重要指标,近年来有关MMP和TIMP的研究越发引起重视[12-13],本研究中30肽引起MMP的特异性抑制剂TIMP1和TIMP2的表达上调,且在实验中加入αvβ3整合素抗体明显增强30肽对TIMP1 和TIMP2基因表达的调控作用。
流式细胞术检测,30肽没有改变细胞表面αvβ3整合素的表达;免疫荧光实验的结果中观察到了肿瘤细胞表面αvβ3整合素聚集成簇现象,因此考虑30肽不是通过改变整合素的表达量,而是引起细胞表面整合素αvβ3聚集成簇,使30肽借助其RGD序列提高了对整合素αvβ3受体的结合率和选择性,产生了去整合素效应,削减了整合素介导的对肿瘤转移的影响。
综上所述,RGD序列修饰的内皮抑素30肽不仅能显著抑制肿瘤组织新生血管的生成,抑制肿瘤细胞的生长与增殖,还能有效地抑制HepG2的侵袭与转移。30肽抑制肿瘤细胞侵袭、转移的能力明显大于内皮抑素27肽,其机制可能是30肽通过RGDRGD序列与αvβ3整合素结合,上调TIMP1、TIMP2的表达,进而降低肿瘤细胞降解细胞外基质的能力,抑制肿瘤细胞的体外黏附、侵袭和迁移能力。这些结果为以后30肽辅助化疗药物应用于肿瘤的治疗提供了理论依据。
[1]O'reilly MS,Boehm T,Shing Y,et al.Endostatin:An endogenous inhibitor of angiogenesis and tumor growth[J].Cell,1997,88(2): 277-285.
[2]Danielle BR,Roger C,Natália VM,et al.Anti-tumor therapy with macro encapsulated endostatin producer cells[J].BMC Biotechnol, 2010;10(5):1-9.
[3]Jonathan G,Paula C,Graeme J,etal.Serum Endostatin concentrations Are Higher in Men with Symptoms of Intermittent Claudication[J].Dis Markers,2014:2014(1):105-109.
[4]Tjin Tham Sjin RM,Satchi-Fainaro R,Birsner AE,et al.A 27-amino-acidsyntheticpeptidecorrespondingto theNH2 terminal zinc-binding domain of endostatin is responsible for its anti tumor activity1[J].Cancer Res,2005,65(9):3656-3663.
[5]刘哲丞、郭红艳、姚淑娟、张春晶、刘秀财、李淑艳.内皮抑素30肽对SGC-7901细胞增殖及转移能力的影响[J].肿瘤防治研究,2012, 39(12):1416-1419.
[6]Wickstrom SA,KariA,JormaKO.AnEndostatin-derived PeptideInteractswithIntegrinsandRegulatesActin Cytoskeleton and Migration of Endothelial Cells[J].J Biol Chem, 2004,279(19):20178-20185.
[7]LiuHK,Wang Q,Li Y,et al.Inhibitory effects of γ-tocotrienol on invasion and metastasis of human gastricadenocarcinoma SGC-7901 cells[J].Journal of Nutritional Biochemistry,2010,21 (9):206-213.
[8]Chen Q,Meng LH,Zhu CH,et al.ADAM15 suppresses cell motility by driving integrinα5β1 cell surface expression via Erk inactivation[J].The International Journal of Biochemistry&Cell Biology,2008,40(10):2164-2173.
[9]Fidler IJ.The pathogenesis of cancer metastasis:the'seed and soil'hypothesis revisited[J].Nat Rev Cancer,2003,3(6):453-458.
[10]Furie N,Shteynberg D,Elkhatib R,et al.Fibulin-5 regulates keloid-derived fibroblast-like cells hrough integrin beta-1[J].Int J Cosmet Sci,2015,Jun 11.doi:10.1111/ics.12245.
[11]Boudjadi S,Carrier JC,Groulx JF,et al.Integrin α1β1 expression is controlled by c-MYC in colorectal cancer cells[J]. Oncogene,2015,6,doi:10.1038/onc.
[12]Prideaux M,Staines KA,Jones ER,et al.MMP and TIMP temporal gene expression during osteocytogenesis[J].Gene Expr Patterns,2015,18(1-2):29-36.
[13]Falcao AS,Kataoka MS,Ribeiro NA,et al.A novel cell line derived from pleomorphic adenoma expresses MMP2,MMP9, TIMP1,TIMP2,and shows numeric chromosomal anomalies[J]. PLoS One,2014,9(8):105231.
(张蕾编辑)
Endostatin 30 peptide inhibit the cell adhesion and invasion of HepG2 cells*
Hong-yan Guo,Xiu-cai Liu,Shu-yan Li
(Department of Biochemistry,Qiqihar Medical University,Qiqihar,Heilongjiang 161006,China)
Objective To study the influence of human endostatin 30 peptide modified RGD on the cell adhesion and invasion of HepG2 cells and the mechanism.Methods The nucleotide sequence encoding amino acids 1-30 of endostatin(peptide 30,with amino acids 25-31 mutated from RGIRGAD to RGDRGD)was artificially synthesized and cloned into the plasmid pTYB2 and expressed in E.coli(DE3),Similarly,peptide 27,corresponding to amino acids 1-27 of endostatin,was produced as a control.The cell adhesion assay and transwell was used to inspect the influence of cell adhesion and invasion activity of HepG2 caused by 30 peptide and 27 peptide,respectively.Meanwhile,integrin associate with invasion was screened out;The aggregation of integrin αvβ3 was detected using by immunofluorescence The expression of integrin on the HepG2 cell surface was measured by flow cytometry in order to test the effect of 30 peptide and 27 peptide.The expression of mRNA and protein was tested by RT-PCR and Western blot,including TIMP1 and TIMP2.Results The cell adhesion and invasion of HepG2 was inhibited obviously by 30 peptide,and it's influence of invasive effect on HepG2 associate with integrin αvβ3.At the same time,the mRNA and protein expression of TIMP1 and TIMP2 were down-regulated by 30 peptide.Above function enhanced obviously after αvβ3 antibody joined to 30 peptide.Conclusions 30 peptide can give full play to its anti-transferance for tumor through integrin αvβ3,30 peptide may help chemotherapeutics to play their function of anti-hepatoma in the clinical treatment.
Endostatin;RGD sequence;invasion;TIMP
R 735
A
10.3969/j.issn.1005-8982.2016.04.003
1005-8982(2016)04-0011-07
2015-10-11
黑龙江省教育厅资助项目(No:12511619);齐齐哈尔医学院博士专项科研基金项目
李淑艳,E-mail:lsy6910553@163.com,Tel:0452-2663151

