S100A4真核表达载体构建及对鼻咽癌细胞侵袭转移的影响*
江青山,谭俞佳,邓珊(南华大学附属第一医院 耳鼻喉科,湖南 衡阳 421001)
论著
S100A4真核表达载体构建及对鼻咽癌细胞侵袭转移的影响*
江青山,谭俞佳,邓珊
(南华大学附属第一医院 耳鼻喉科,湖南 衡阳 421001)
目的构建S100A4稳定高表达的鼻咽癌细胞株,研究S100A4与鼻咽癌侵袭转移关系。方法PCR方法扩增S100A4片段,将产物插入pCMV载体,将重组质粒及其空白质粒分别转染到鼻咽癌细胞CNE2;MTT法绘制细胞生长曲线,Western blot检测S100A4、E-cadherin、Fibronectin、基质金属蛋白酶2(MMP2)、基质金属蛋白酶9(MMP9)的表达;Transwell实验检测细胞侵袭转移能力变化。结果成功构建了S100A4稳定高表达的重组细胞株;细胞生长曲线表明S100A4稳定高表达的重组细胞株生长较快;S100A4稳定高表达的重组细胞株中E-cadherin、Fibronectin低表达而MMP2、MMP9高表达;Transwell实验发现S100A4稳定高表达的重组细胞株的侵袭细胞计数明显高于空白载体转染组和未转染组(P>0.01)。结论S100A4能调控鼻咽癌上皮-间质转化(EMT)过程,并上调MMP2、MMP9表达而促进鼻咽癌细胞侵袭和转移。
鼻咽肿瘤;S100A4;上皮-间质转化;基质金属酶蛋白;侵袭转移
鼻咽癌(nasophargngenl carcinoma,NPC)发病具有地域特点,我国南方地区是鼻咽癌的高发区域,其发病部位比较隐蔽,容易早期发生淋巴转移。临床上鼻咽癌患者化疗和放疗治疗效果均不理想,其5年生存率约50%[1]。鼻咽癌的侵袭和转移是一个多步骤的复杂过程,其分子机制包括肿瘤细胞接触性抑制的丧失、运动性的增加和细胞外基质的降解等[2]。S100A4是一种低分子质量的钙结合调节蛋白,S100A4参与细胞增殖、分化、信号传导、细胞黏附、胞外基质重建及细胞运动等多种生命活动。其与恶性肿瘤的发生、侵袭、转移及预后差密切相关[3-4]。近年来研究发现,S100A4与肿瘤生物学行为的关系密切,但作用机制尚未完全阐明。本研究拟对S100A4在鼻咽癌中的作用进行探讨,现报道如下:
1 材料与方法
1.1材料
人鼻咽癌CNE2细胞株购自中南大学细胞中心。改良型1640培养基购自Hyclone公司,胎牛血清购自杭州四季青公司,DMSO购自德国Applichem公司,胰酶、G418及GIMSA染液购自Solarbio公司,pCMV载体购自上海碧云天有限公司,E-cadherin、Fibronectin、基质金属蛋白酶2(Matrix metallopeptidase 2,MMP2)、基质金属蛋白酶9(Matrix metallopeptidase 9,MMP9)单克隆抗体购自美国Sant Cruz公司。
1.2方法
1.2.1pCMV-S100A4真核表达载体的构建①细胞总RNA的提取:当细胞生长至80%~90%汇合时,收集细胞加Trizol冰上裂解。②逆转录反应:反应体系为 10μl:5×Primer ScriptBuffer 2μl;Primer Script RT Enzyme Mix 0.5μl;Random 6 mers 0.5μl;OligodT Primer 0.5μl;Total RNA 1μl;dH2O 5.5μl;反应条件为:37℃ 30 min,85℃ 5 min。③PCR反应:S100A4正向引物:5'-CGGCTCGAGGAGA AGGCCCTGGATGTGATG-3';反向引物:5'-CGGGAT CCACCTCGTTGTCCCTGTTGCTG-3'。PCR反应体系为25μl:Taq Master Mix 12.5μl;PCR正向引物1.0μl;PCR反向引物 1.0μl;cDNA2.0μl;dH2O 8.5μl;反应条件如下:95℃ 3 min,95℃ 30 s,60℃30s,35个循环,72℃ 45s,72℃ 5min。④重组DNA的构建:将目的DNA片段采用双酶切法插入,PCR扩增,回收PCR产物,转染感受态JM109菌,扩增后挑取阳性克隆送往上海生物工程技术服务有限公司测序。
1.2.2重组细胞系的建立1×103个/ml对数生长期细胞接种于24孔板,50μl培养基中加入质粒DNA 1.5μg,柔和混匀,再将稀释好的质粒DNA和LipofectamineTM2000轻柔混匀,室温放置20min。常规培养4~6 h后转染,72 h后改用G418持续筛选14d,挑出阳性单克隆扩大培养。获得2个重组细胞系:pCMV(+)-S100A4-CNE2细胞和 pCMV(-)-empty-CNE2,以未转染组(Control)为空白对照组。1.2.3Western blot检测Western blot收集不同细胞,加入含PMSF的RIPA裂解液(1 ml裂解液加入100mmol/L PMSF 10μl),BCA法测定蛋白浓度。加入上样缓冲液,制备好的样品置于-20℃冰箱保存;用枪在加样孔中加入蛋白样品及蛋白Marker进行电泳;将蛋白转膜至PVDF膜,恒压87 V转膜1.5 h;丽春红染色2 min;含有5%脱脂奶粉的封闭液,室温封闭1 h;TBST洗涤,加入一抗缓冲液(S100A4抗体,1∶3 000;β-actin抗体,1∶3 000),4℃孵育过夜;TBST洗涤,加入二抗缓冲液(1∶3 000),室温封闭1h;TBST洗涤,10min×3次,ECL化学发光法显影,使用Alpha Innotech系统进行扫描及分析。
1.2.4细胞生长曲线绘制分别收集处于对数生长期的鼻咽癌细胞,制成单细胞悬液。常规接种培养于24孔板中,每孔中加入1ml含10%小牛血清的培养基,最后调整细胞密度为104个/ml。每24h用胰酶消化后收集其中3孔的细胞,进行细胞计数。MTT法连续7d对活细胞进行计数。以日期作为X轴,细胞计数作为Y轴,绘出鼻咽癌细胞株的生长曲线。1.2.5Transwell侵袭实验用RPMI 1640无血清培养基1∶100稀释人工基底膜(Matrigel),浸泡上室约5min,加入100μl稀释的Matrigel;在侵袭小室腔的上下室分别加入200μl、600μl RPMI 1640无血清培养基;调整细胞数为12.5×104/ml,下室中加入600μl含10%FBS的RPMI 1640培养基,上室中加入200μl细胞悬液,孵育40 h;结晶紫染色,自来水漂洗;用棉签轻轻擦拭掉聚碳酯膜上表面的细胞,显微镜下计数穿过聚碳酯膜的细胞,观察8个高倍视野(×200),实验重复3次。
1.3统计学方法
采用SPSS 19.0统计学软件进行数据分析,两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1PCR结果
采用PCR扩增得到S100A4的DNA片段,琼脂糖凝胶电泳结果显示产物大小约200 bp,与S100A4基因片段194bp基本一致(见图1A)。酶切鉴定:重组质粒pCMV-S100A4双酶切结果大小约4 300 bp 和317 bp的两个片段,分别代表线性化pCMV质粒和插入的S100A4目的片段(见图1B)。经上述PCR和酶切鉴定正确的阳性克隆菌液送上海生物技术有限公司进一步测序鉴定,测序结果证实成功构建重组质粒pCMV-S100A4。
2.2重组细胞系的建立
将重组质粒pCMV-S100A4转染到鼻咽癌CNE2细胞,G418筛选,建立pCMV(+)-S100A4-CNE2细胞和pCMV(-)-empty-CNE2细胞系,Western blot检测S100A4蛋白在重组细胞系中的表达,发现S100A4蛋白在pCMV(+)-S100A4-CNE2中高表达(见图2)。
2.3生长曲线变化
观察S100A4蛋白表达对CNE2细胞生长、增殖的影响,发现pCMV(+)-S100A4-CNE2中高表达S100A4能促进肿瘤细胞生长(见图3)。
2.4EMT转移相关蛋白检测
通过Western blot检测上皮标志物E-钙黏蛋白(E-cadherin),间质标志物纤黏蛋白(Fibronectin)改变,发现pCMV(+)-S100A4-CNE2中E-cadherin 和Fibronectin表达下调(见图4,P<0.01)。说明S100A4高表达能抑制E-cadherin和Fibronectin的表达而影响肿瘤细胞的EMT过程。
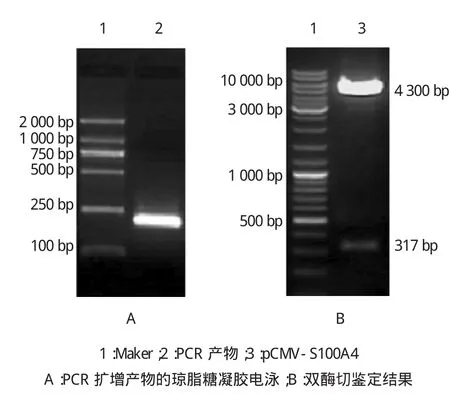
图1 PCR结果
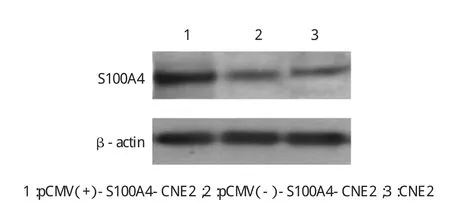
图2 S100A4蛋白在重组细胞系中表达情况
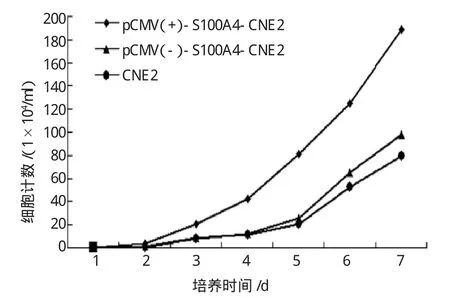
图3 S100A4蛋白表达对CNE2细胞生长的影响
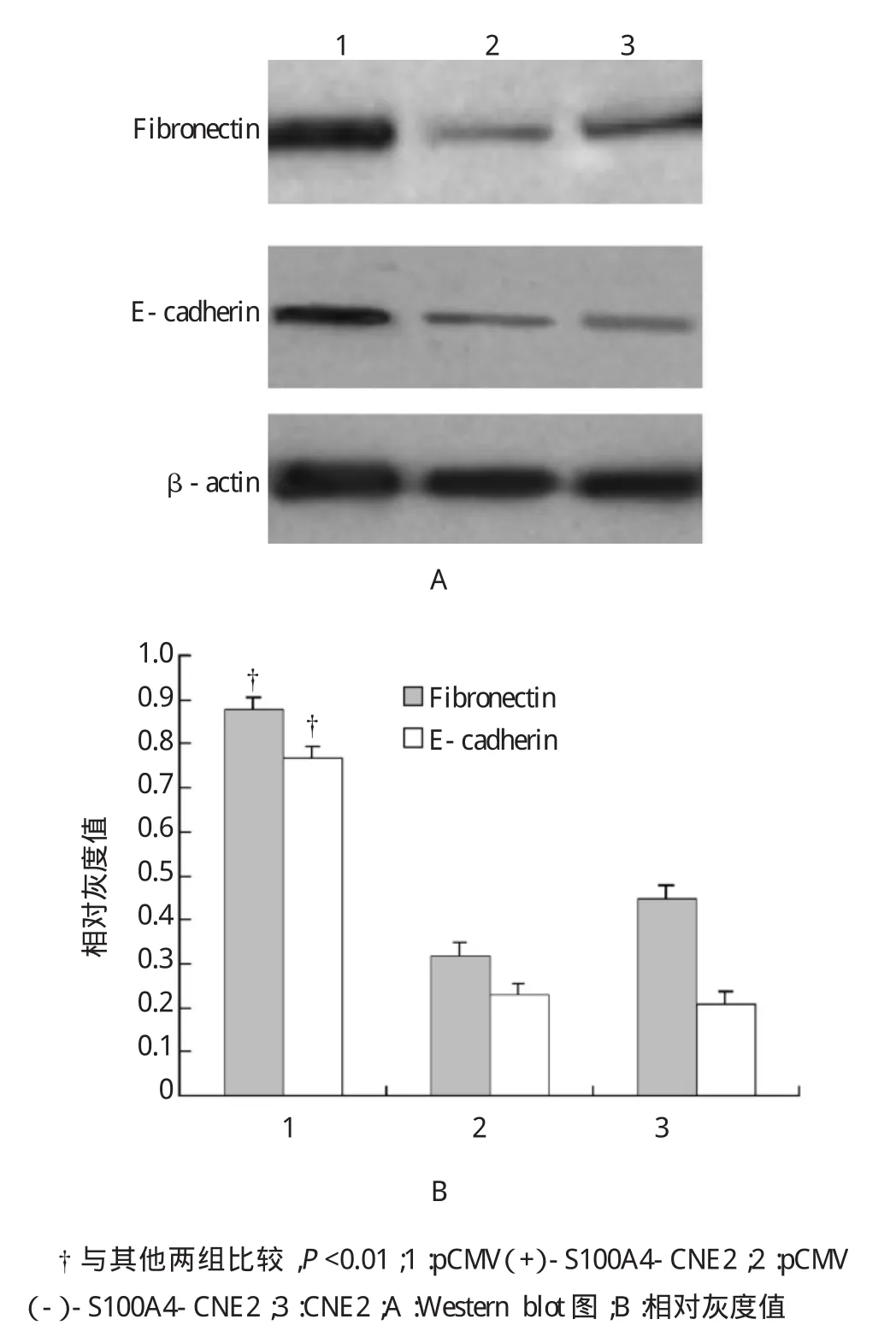
图4 重组细胞系中E-cadherin和Fibronectin表达变化
2.5Transwell侵袭细胞计数
观察肿瘤细胞侵袭能力的改变:pCMV(+)-S100A4-CNE2侵袭细胞计数明显高于pCMV(-)empty-CNE2细胞和CNE2细胞(见图6和附表,P<0.01)。
转移相关蛋白MMP2、MMP9检测结果发现:pCMV(+)-S100A4-CNE2中MMP2、MMP9表达增高(见图5,P<0.01),说明S100A4能通过提高MMP 2、MMP9表达促进鼻咽癌细胞转移。
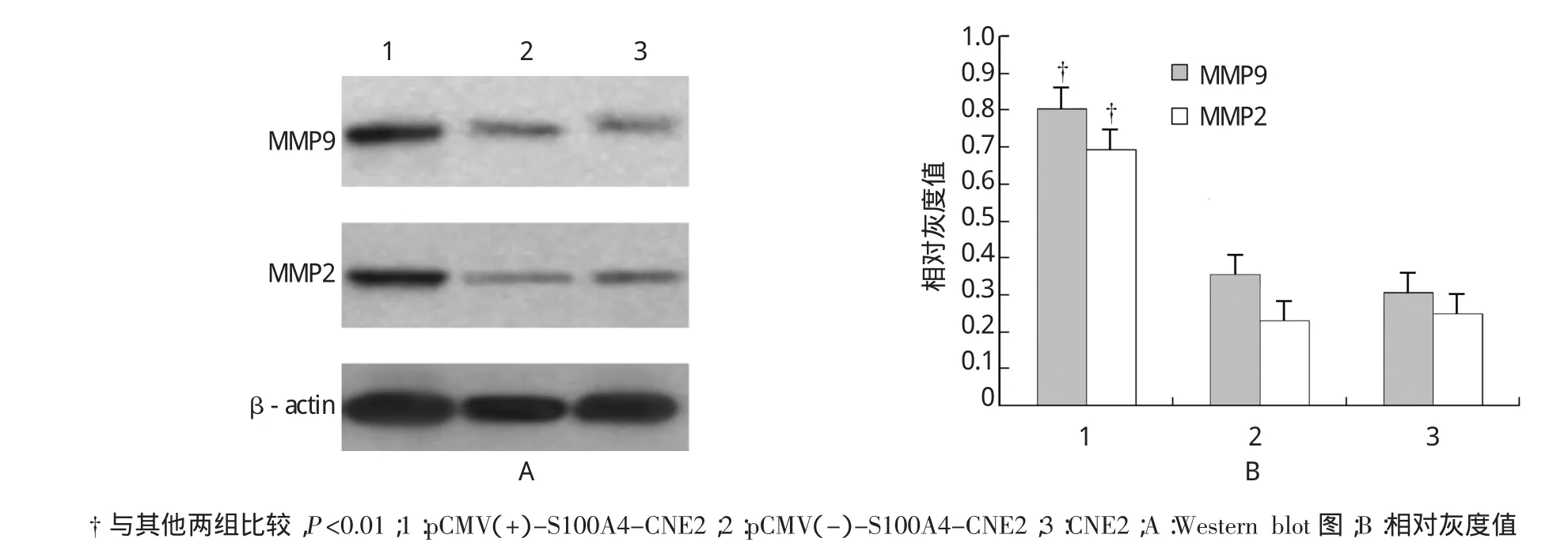
图5 重组细胞系中MMP2、MMP9表达变化
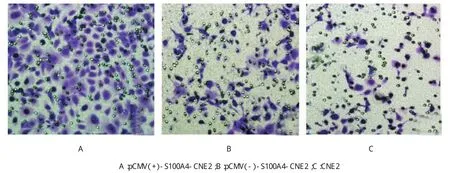
图6 Transwell侵袭细胞计数

附表 Traswell侵袭细胞计数
3 讨论
S100A4蛋白S-100蛋白家族的成员之一,是一种钙结合蛋白,其氨基酸序列具有EF双螺旋结构,可与钙离子高亲和性结合。当该EF结构域与钙离子结合后,S100A4蛋白的三维分子构象发生改变,暴露出其结合位点,可与反向靶蛋白进行结合,在细胞的运动、侵袭、转移以及凋亡等生物学过程中具有重要作用[5]。已有不少研究证实,S100A4在多种恶性肿瘤组织,如结肠癌、胰腺癌、黑色素瘤、非小细胞肺癌、肝癌等肿瘤中高表达[6-10],其高表达与恶性肿瘤的发生发展以及预后有关。
有研究发现,S100A4在正常结肠黏膜上皮中无或弱表达,在结肠癌组织中呈阳性表达,且S100A4的表达与肿瘤分期及淋巴结转移密切相关[6];有人通过RT-PCR技术检测胰腺癌中S100A4 mRNA表达情况,结果发现,胰腺癌细胞中S100A4 mRNA呈过表达;而免疫组织化学结果显示93%的有侵袭行为的胰腺癌表达S100A4,正常组织及慢性胰腺炎组织均不表达S100A4,胰腺癌中S100A4蛋白的表达与肿瘤不良分化显著相关[7];有研究发现,高转移能力的黑色素瘤细胞株中,S100A4表达明显高于低转移能力的细胞株,S100A4高表达是导致黑色素瘤细胞高转移能力的重要原因之一[8];S100A4蛋白在鼻咽癌中表达升高,与淋巴结N分期和临床分期密切相关,有望成为判断鼻咽癌恶性生物学行为的有效指标[11]。
近年来,为进一步研究S100A4基因在肿瘤中的作用,有人通过将S100A4基因转染小鼠B16细胞系和MCF-7细胞系后发现,转染后的两种肿瘤细胞发生肺转移的概率明显增加[12];有学者用S100A4 siRNA转染骨肉瘤细胞株后,发现肿瘤细胞中S100A4表达明显减少,并且下调CD44和MMP2,可能是通过影响细胞基质黏附能力下降来影响肿瘤细胞的侵袭转移[13]。以上研究表明,S100A4高表达能促进肿瘤的发生、发展,可能是一种肿瘤转移促进基因,抑制其表达可能是一种有效的分子靶向治疗策略。
为进一步研究S100A4在鼻咽癌中的作用,本研究成功构建S100A4高表达重组质粒,将重组质粒转染进鼻咽癌细胞株后,发现,重组细胞株中S100A4蛋白高表达,生长曲线检测高表达S100A4能促进肿瘤细胞生长。研究结果表明,S100A4高表达能促进鼻咽癌增殖。与上述研究结果一致。
上皮-间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程。在胚胎发育、慢性炎症、组织重建、肿瘤转移和多种纤维化疾病中发挥重要作用,其主要的特征有细胞黏附分子E-cadherin和间质标志物Fibronectin表达的减少[14]。研究发现,肝细胞癌中,S100A4高表达和E-cadherin低表达与肝细胞癌的侵袭有关,E-cadherin是肝癌的预后因子[15]。乳腺癌中S100A4和MMP13表达具有相关性,过表达S100A4能引起MMP13表达增加,而干扰S100A4表达后,MMP13表达下调且肿瘤细胞侵袭转移能力下降[16]。本研究发现,S100A4转染鼻咽癌细胞株后获得的重组细胞系中,S100A4表达增高,而E-cadherin和Fibronectin表达下调,说明高表达S100A4可能通过抑制E-cadherin和Fibronectin的表达来影响鼻咽癌的EMT过程,增强肿瘤细胞的迁移和运动能力,从而进一步影响鼻咽癌细胞的侵袭和转移能力。
肿瘤细胞发生转移除了首先发生EMT获得细胞活动能力增强外,还必须排除细胞外基质的阻碍,而基质金属蛋白酶则是降解细胞外基质的主要水解酶类[17]。本研究发现,S100A4高表达的重组细胞系中MMP2、MMP9表达增高;同时,Transwell实验表明,pCMV(+)-S100A4-CNE2中侵袭细胞计数高于空白载体对照组和未转染组,说明S100A4能通过提高MMP2、MMP9表达,降解细胞外基质,从而促进鼻咽癌细胞的侵袭和转移。
总之,本研究成功构建S100A4高表达的重组质粒,并转染进鼻咽癌细胞株,构建S100A4稳定高表达的重组细胞系,研究还发现,S100A4高表达能促进鼻咽癌细胞增殖;下调E-cadherin和Fibronectin的表达,降解细胞外基质,影响鼻咽癌的EMT过程,增强鼻咽癌细胞的侵袭和转移能力。S100A4在鼻咽癌细胞侵袭和转移过程中具有重要作用。
[1]Cao SM,Chen SH,Qian CN,et al.Familial nasopharyngeal carcinomas possess distinguished clinical characteristics in southern China[J].Chin J Cancer Res,2014,26(5):543-549.
[2]Tan G,Tang X,Huang D,et al.Dinitrosopiperazine-mediated phosphorylated-proteins are involved in nasopharyngeal carcinoma metastasis[J].Int J Mol Sci,2014,15(11):20054-20071.
[3]Huang H,Zheng HY,Liu ZL,et al.Prognostic significance of relaxin-2 and S100A4 expression in osteosarcoma[J].Eur Rev Med Pharmacol Sci,2014,18(19):2828-2834.
[4]Yu LJ,Li Y,Li C,et al.Restoration of S100A4 expression enhances invasive and metastatic potentials of COLO16 cutaneous squamous cancer cells[J].Cancer Biomark,2014,14(5):325-333.
[5]Oliveira MV,Fraga CA,Barros LO,et al.High expression of S100A4 and endoglin is associated with metastatic disease in head and neck squamous cell carcinoma[J].Clin Exp Metastasis, 2014,31(6):639-649.
[6]Dahlmann M,Okhrimenko A,Marcinkowski P,et al.RAGE mediates S100A4-induced cell motility via MAPK/ERK and hypoxia signaling and is a prognostic biomarker for human colorectal cancer metastasis[J].Oncotarget,2014,5(10):3220-3233.
[7]Ji YF,Huang H,Jiang F,et al.S100 family signaling network and related proteins in pancreatic cancer(Review)[J].Int J Mol Med,2014,3(4):769-776.
[8]Haase-Kohn C,Wolf S,Herwig N,et al.Metastatic potential of B16-F10 melanoma cells is enhanced by extracellular S100A4 derived from RAW264.7 macrophages[J].Biochem Biophys Res Commun,2014,446(1):143-148.
[9]Chen N,Sato D,Saiki Y,et al.S100A4 is frequently overexpressed in lung cancer cells and promotes cell growth and cell motility[J].Biochem Biophys Res Commun,2014,7(3):459-464.
[10]Zhang J,Zhang DL,Jiao XL,et al.S100A4 regulates migration andinvasioninhepatocellularcarcinomaHepG2cellsviaNF-κB-dependent MMP-9 signal[J].Eur Rev Med Pharmacol Sci,2013,17(17):2372-2382.
[11]黎思怡,李丽霞,邹振宁,等.鼻咽癌组织中S100A4蛋白的表达及其临床意义[J].临床与实验病理学杂志,2011,27(12):1364-1366.
[12]Chik F,Szyf M.Effects of specific DNMT gene depletion on cancer cell transformation and breast cancer cell invasion;toward selective DNMT inhibitors[J].Carcinogenesis,2011,32(2): 224-232.
[13]Ma X,Yang Y,Wang Y,et al.Small interfering RNA-directed knockdown of S100A4 decreases proliferation and invasiveness of osteosarcoma cells[J].Cancer Lett,2010,299(2):171-181.
[14]Kumar S,Das A,Sen S.Extracellular matrix density promotes EMT by weakening cell-cell adhesions[J].Mol Biosyst,2014,10 (4):838-850.
[15]ZhaiX,Zhu H,Wang W,et al.Abnormalexpression of EMT-related proteins,S100A4,vi mentin and E-cadherin,is correlatedwithclinicopathologicalfeaturesandprognosisin HCC[J].Med Oncol,2014,31(6):970.
[16]Wang L,Wang X,Liang Y,et al.S100A4 promotes invasion and angiogenesis in breast cancer MDA-MB-231 cells by upregulating matrix metalloproteinase-13[J].Acta Biochim Pol, 2012,59(4):593-598.
[17]Sampieri CL,León-córdoba k,Remes-Troche JM.Matrix metalloproteinases and their tissue inhibitors in gastric cancer as molecular markers[J].J Cancer Res Ther,2013,9(3):356-363.
(张蕾编辑)
Establishment of S100A4 eukaryotic expression vector and the effects to metastasis and invasion of NPC*
Qing-shan Jiang,Yu-jia Tan,Shan Deng
(Department of ENT,Clinical Research Institute,the First Affiliated Hospital,University of South China,Hengyang,Hunan 421001,China)
Objective To build a stable cell line with S100A4 high expression and study the relationship between S100A4 and metastasis and invasion of nasopharyngeal carcinoma(NPC).Methods To amplify the fragment of S100A4 by PCR method,and PCR products were inserted into pCMV vector.The reconstructed pCMV-S100A4 vector and empty vector were transferred into CNE2 cell line.Then the growth curve were drown by MTT method.The expression of S100A4,E-cadherin,Fibronectin,MMP2(matrix metallopeptidase 2)and MMP9(matrix metallopeptidase 9)were detected by Western blot.And the changes of ability of metastasis and invasion were examined by Transwell.Results Succeed to build a stable cell line with S100A4 high expression;The grow curves showed that the growth speed were more quickly in pCMV-S100A4-CNE2 than in pCMV-empty-CNE2 and CNE2.Western blot results showed that there were low expression of E-cadherin、Fibronectin and high expression of MMP2,MMP9 in pCMV-S100A4-CNE2 than in pCMV-empty-CNE2 and CNE2.Transwell results showed that there were more invaded cells in pCMV-S100A4-CNE2 than in pCMV-empty-CNE2 and CNE2(P<0.01).Conclusions S100A4 can regulate the process of EMT in NPC and upregulate the expression of MMP2 and MMP9 to promote the metastasis and invasion of NPC cells.
NPC;S100A4;EMT;MMP;invasion and metastasis
R 739.63;R 392.31
A
10.3969/j.issn.1005-8982.2016.04.002
1005-8982(2016)04-0005-06
2015-09-30
湖南省科技厅资助项目(No:2012SK3159)

