AEG1与钙黏附蛋白E在食管癌中表达的相关性及其意义
赵润根,张彩凤,姬娟娟,张利利,肖怀葱,夏永华,韩宇(新乡医学院第一附属医院.消化内科,.皮肤科,河南 卫辉 45300)
AEG1与钙黏附蛋白E在食管癌中表达的相关性及其意义
赵润根1,张彩凤1,姬娟娟1,张利利1,肖怀葱1,夏永华2,韩宇1
(新乡医学院第一附属医院1.消化内科,2.皮肤科,河南 卫辉 453100)
目的研究星形细胞上调基因1(AEG1)和钙黏附蛋白E(E-cad)在食管癌中的表达的相关性,并分析与临床病理特征的关系。方法采用免疫组织化学方法和Western blot两种方法检测58例食管癌组织及其相应的癌旁组织中AEG1和钙黏附蛋白E的表达,并分析与临床病理特征的相关性。结果在58例食管癌组织中AEG1表达的阳性率82.7%明显高于相应的癌旁组织的51.7%(P<0.05),且表达阳性率与性别、年龄、肿瘤的部位、肿瘤病理类型无相关性(P>0.05),而与肿瘤分化程度、浸润深度、临床分期、淋巴结转移相关(P< 0.05);在58例食管癌组织中钙黏附蛋白E的阳性率为31%,明显低于相应癌旁组织的94.8%(P<0.05),且表达阳性率与性别、年龄、肿瘤的部位、肿瘤病理类型无相关性(P>0.05),而与肿瘤分化程度、浸润深度、临床分期、淋巴结转移相关(P<0.05);食管癌中AEG1与钙黏附蛋白E的表达呈明显的负相关(r=-0.483,P<0.05)。结论AEG1和钙黏附蛋白E在食管癌中的表达分别表现为高表达和表达缺失,且两者与食管癌的侵润、转移密切相关,AEG1可能介导食管癌中钙黏附蛋白E的表达下调。
星形细胞上调基因1;钙黏附蛋白E;食管癌;免疫组织化学
食管癌是我国常见的恶性肿瘤,由于早期症状不典型,多数患者发现时已属晚期,具有较高的死亡率,居全国各类恶性肿瘤的第4位[1],其中深度浸润和转移是主要的死因。目前对于食管癌的治疗除传统的外科手术、放化疗治疗外,随着人们对肿瘤发病的分子水平的研究不断加深,针对新分子靶点的分子靶向治疗成为食管癌治疗的新方向。星形细胞上调基因1(astrocyte elevated gene 1,AEG1)是新近发现的癌基因。研究发现AEG1在多种肿瘤(如乳腺癌[2]、神经胶质瘤[3]、前列腺癌[4]、胃癌等[5])中存在高表达,并与肿瘤的进展、转移与侵袭、不良预后密切相关[6-7]。钙黏附蛋白E(E-cadherin,E-cad)是表达于正常上皮细胞表面的黏附分子,介导上皮细胞间的黏附性。E-cad在多种肿瘤中存在明显表达减少甚至缺失,与肿瘤的转移与侵袭、不良预后密切相关[8]。然而两者在食管癌中表达的相关性并未见报道。本研究拟通过免疫组织化学和Western blot检测食管癌及相应癌旁食管黏膜中AEG1和E-cad表达水平,并分析两者与临床病理特征的关系,探讨两者在食管癌中表达的相关性及其意义。
1 材料与方法
1.1组织材料
选取58例新乡医学院第一附属医院胃镜室取得的食管癌病理活检标本,所有标本均经2位高年资病理科医师确诊;所有患者均为首次就诊,均未接受治疗。
1.2试剂与仪器
鼠多克隆AEG1抗体(稀释倍数1∶100)和鼠多克隆钙黏附蛋白E抗体(稀释倍数1∶100)、DAB显色剂均购自武汉博士德生物有限公司,免疫组织化学SP法二抗试剂盒购自北京中杉金桥生物有限公司,改进型枸橼酸盐缓冲抗原修复液(50×)购自碧云天生物科技有限公司,蛋白提取试剂盒、蛋白定量试剂盒、凝胶试剂盒、山羊抗鼠二抗、ECL显色液均购自碧云天生物科技有限公司,组织包埋机(湖北孝感,BM-IX);石蜡切片机(上海Thermo Shadon,Finesse 325);Amersham Imager 600凝胶成像系统(美国 GE Healthcare),垂直电泳系统(美国Bio-rad)。
1.3方法与结果判定
1.3.1免疫组织化学将取得的组织标本用4%中性甲醛固定,进行石蜡包埋切片。常规脱蜡复水、微波法抗原修复、过氧化氢中和内源性的过氧化氢酶、山羊血清封闭、滴加一抗、4℃过夜、滴加二抗、滴加生物素-卵链霉素蛋白、DAB显色、复染、中性树胶封片、观察。用PBS代替一抗作为阴性对照。对于阳性染色结果的判定采用双盲法进行,由2位高年资病理科医师独立读片。AEG1阳性表达主要定位于细胞质,少量表达于细胞膜,阳性表达为棕黄色颗粒。每张切片随机挑选5个视野(×400),每个视野计数100个完整的肿瘤细胞,先根据阳性细胞所占的百分数计分:<5%为0分,5%~25%为1分,26% ~50%为2分,51%~75%为3分,>75%为4分;再根据阳性细胞着色程度计分:无着色为0分,淡黄色为1分,棕黄色为2分,褐黄色为3分.将两者相乘所得的总分进行结果判定:分别对应4种表达强度:阴性:-(评分0~1)、弱阳性:+(评分2~4)、中度阳性:++(评分5~8)和强阳性:+++(评分9~12);(+~+++)统计为阳性,(-)为阴性。
1.3.2免疫蛋白印迹对新鲜的食管癌组织和癌旁组织标本进行总蛋白的提取并定量;将蛋白用8% 的SDS-PAGE胶电泳,电泳后取下凝胶将蛋白电转到聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉封闭2 h,加入一抗(AEG1和E-cad浓度均为1∶670)4℃过夜;第2天加入二抗,室温孵育1 h,在Amersham Imager 600化学发光成像系统曝光,蛋白表达的灰度值运用mage-Pro Plus 5.0软件分析。蛋白相对表达为目的基因表达量与内参基因表达量的比值,Gapdh为内参。
1.4统计学方法
采用SPSS 11.5统计软件进行数据分析,计数资料用χ2检验或Fisher's精确检验,相关性用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1AEG1和E-cad在食管癌组织和癌旁组织中的表达
AEG1在食管癌组中表达的阳性率明显高于癌旁组,两者比较差异有统计学意义(P<0.05)。与癌旁组比较,食管癌中E-cad的表达明显减少,差异有统计学意义。见图1和表1。
2.2AEG1和E-cad在食管癌组织中表达的相关性
AEG1阳性组中E-cad阳性率为20.8%,明显低于AEG1阴性组中E-cad的阳性率83.3%;两者在食管癌中的表达呈明显负相关(r=-0.483),差异有统计学意义(P<0.05)。见表2。
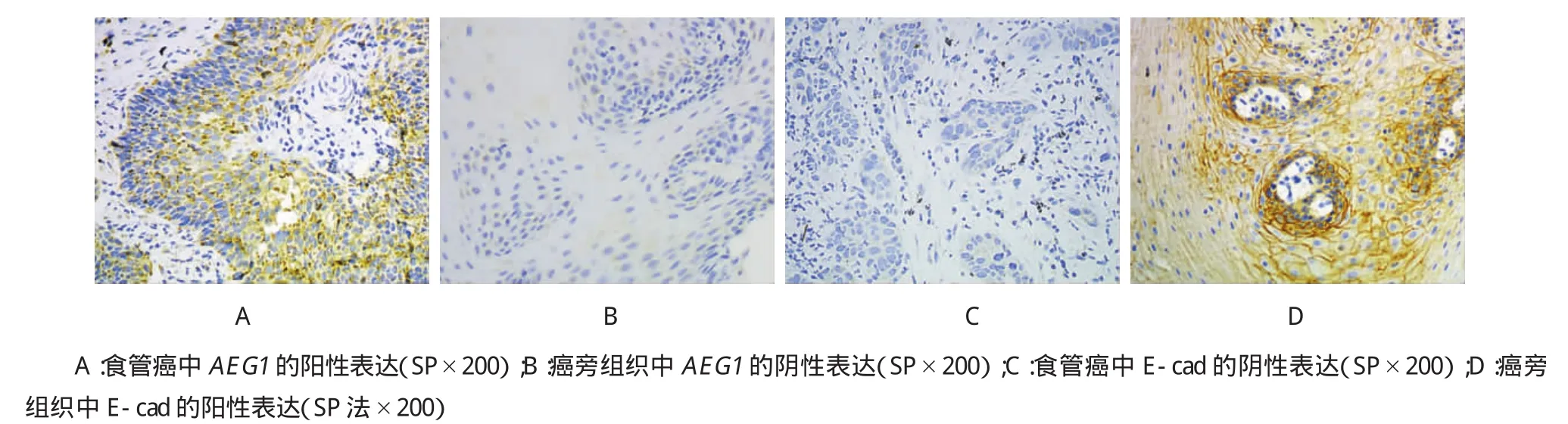
图1 AEG1和E-cad在食管癌及癌旁组织中的表达
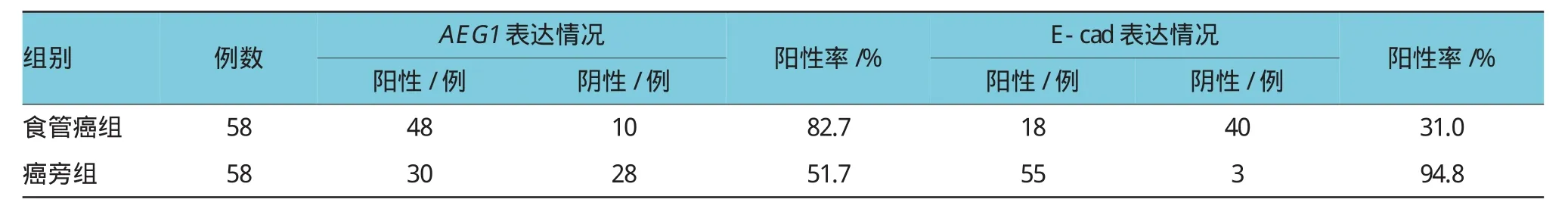
表1 AEG1、E-cad在食管癌及其癌旁组织中的表达情况
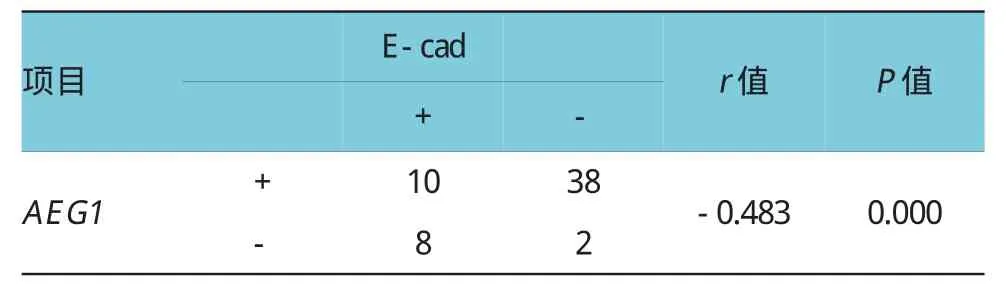
表2 AEG1与E-cad在食管癌中表达的相关性
2.3AEG1和E-cad在食管癌中表达与临床病理因素之间的关系
食管癌组织中AEG1的表达与患者的性别、年龄、肿瘤的部位及病理类型无关(P>0.05);而与肿瘤的分化程度、侵润深度、淋巴结转移情况、临床分期相关(P<0.05),随着分化程度的降低、浸润深度的加深,AEG1的表达阳性率越高,有淋巴转移的患者中AEG1的阳性率明显高于无淋巴结转移的患者。食管癌组织中E-cad的表达与患者的性别、年龄、肿瘤的部位及病理类型无相关性(P>0.05);而与肿瘤的分化程度、侵润深度、淋巴结转移情况、临床分期相关(P<0.05),随着分化程度的降低、浸润深度的加深,E-cad的表达阳性率逐渐降低,有淋巴转移的患者中E-cad的阳性率明显低于无淋巴结转移的患者。见表3。
2.4食管癌和癌旁组织中AEG1和E-cad蛋白表达水平的比较
食管癌和癌旁组织中AEG1和E-cad蛋白表达水平的比较见图2、3、4。食管癌中AEG1蛋白表达水平明显高于相应的癌旁组织(P<0.05),食管癌组织中E-cad的表达水平明显低于相应的癌旁组织(P<0.05),两者差异有统计学意义。见图5、6。

图2 AEG1、钙黏附蛋白E在食管癌与相应的癌旁组织中的表达情况
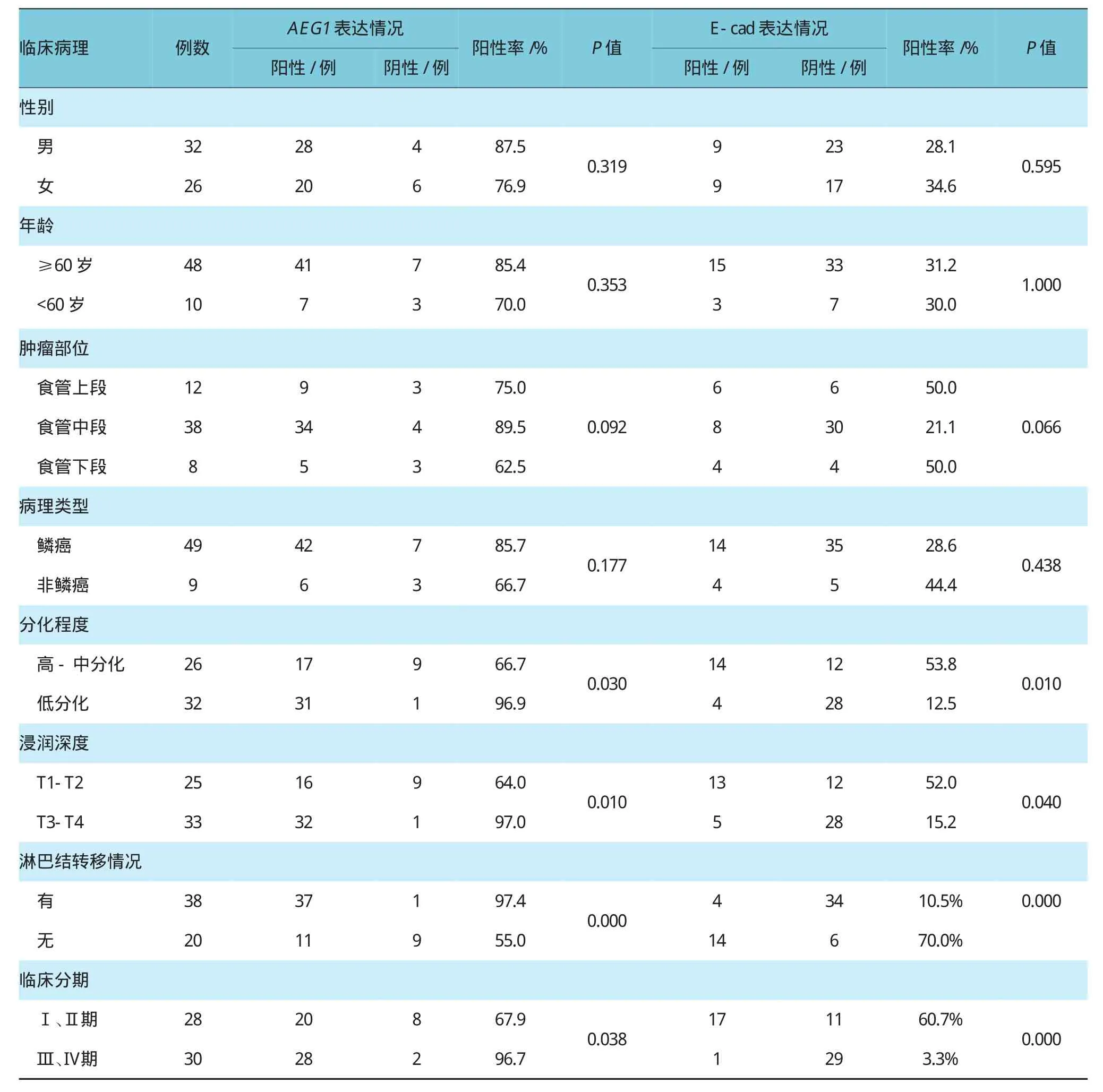
表3 AEG1、E-cad在食管癌中的表达与临床病理因素之间的关系
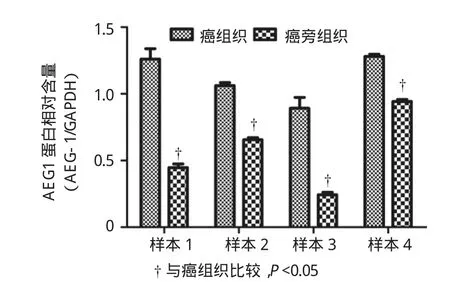
图3 食管癌与相应的癌旁组织中AEG1表达的比较
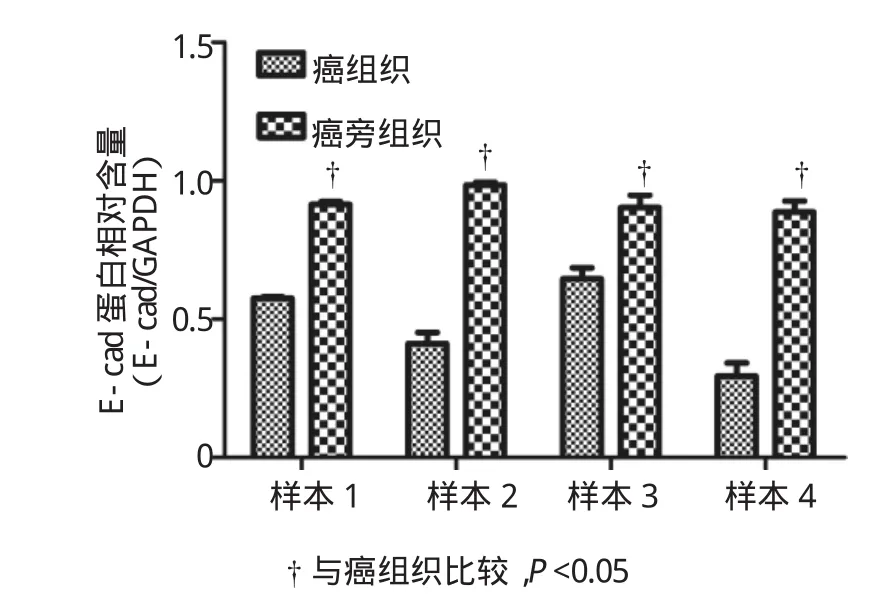
图4 食管癌与相应癌旁组织中的E-cad表达的比较
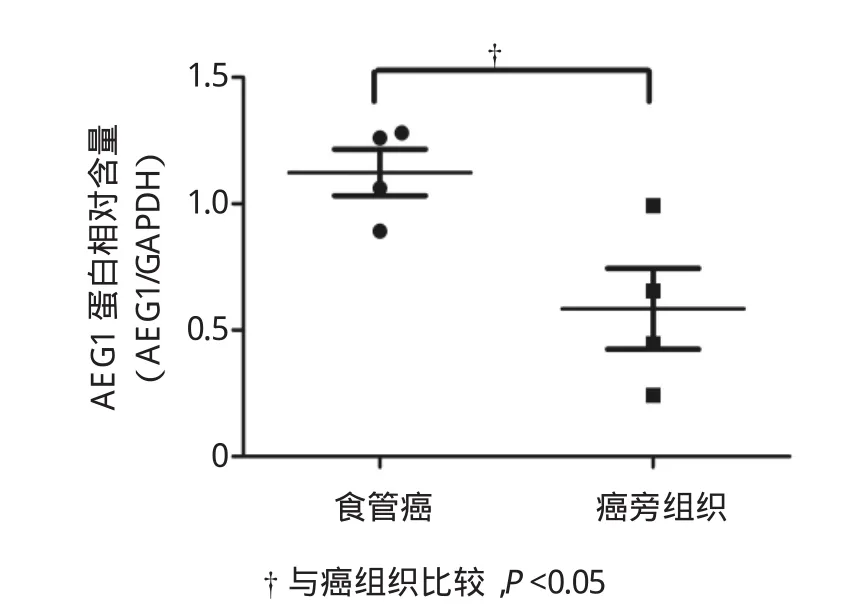
图5 食管癌与癌旁组织中AEG1含量的比较
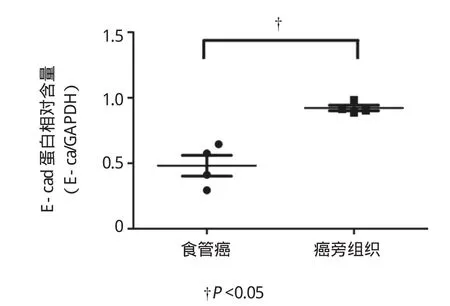
图6 食管癌与癌旁组织中E-cad含量的比较
3 讨论
AEG1是新近发现的原癌基因,其cDNA序列全长3 611 bp,包含12个外显子和11个内含子,位于人类8号染色体上[9]。大量研究表明,AEG1有促进肿瘤细胞的增殖[10]、抑制细胞凋亡[11]、促进细胞侵袭和转移、增加化疗抗性[12]、促进肿瘤血管形成等[13]生物学功能。提示AEG1在肿瘤的发生、发展及恶性进程中发挥重要作用。近年来的研究发现,神经胶质瘤[3]、前列腺癌[4]、胃癌[5]、卵巢癌等[14]多种肿瘤中都存在AEG1的高表达。为研究食管癌中AEG1的表达情况,本实验采用免疫组织化学和Western blot方法对58例食管癌组织和相对应的癌旁组织中AEG1的表达情况进行检测。结果显示食管癌组织中AEG1的表达阳性率明显高于相对应的癌旁组织(P<0.05),两者比较差异有统计学意义。为进一步探讨AEG1在食管癌中表达的意义,本研究比较分析58例食管癌患者的临床病理资料。
浸润和转移是导致肿瘤患者死亡的主要原因,浸润深度和远处转移与患者的不良预后密切相关[15]。研究证实,AEG1能促进乳腺癌细胞转移到小鼠的肺部[16],在转移的淋巴结中AEG1表达水平明显高于无淋巴结转移的肿瘤组织[13];AEG1的表达可以明显抑制肿瘤组织向淋巴结的转移[12]。这提示AEG1在肿瘤细胞的浸润和转移密切相关。本研究比较分析58例食管癌标本,其中浸润深度在T1-T2之间的病例25例,AEG1的阳性率为64.0%,显著低于浸润深度在T3-T4的97.0%(P=0.01)。其中有淋巴结转移的患者38例,AEG1的阳性率为97.4%,显著高于无淋巴结转移的55.0%(P=0.00),也支持这一观点。同时本研究还发现在食管癌组织中AEG1的表达与肿瘤的分化程度和临床分期密切相关(P<0.05),而与肿瘤的部位、病理类型、患者的年龄及性别无关。其具体分子机制目前尚不清楚。
肿瘤细胞的转移是一个多阶段的过程[17]。目前多数研究表明,肿瘤细胞的转移的发生起始于上皮间质转化(epithelial-mesenchymal transition,EMT)[18],EMT的过程包括细胞表面的紧密连接蛋白减少或重新排列以及一些间质细胞蛋白的表达的增多;从而导致细胞失去上皮极性并获得间质特性,使细胞获得较强的侵袭和转移能力。钙黏附蛋白E是一种钙依赖性的细胞跨膜蛋白;其功能的发挥主要是E-cad与β连环素结合形成E-cad/β连环素复合体,锚定于细胞骨架上,从而介导同种细胞间的黏附并维持组织结构的功能。研究证实,E-cad在包括食管癌在内的多种肿瘤中都存在表达的缺失,并与肿瘤的浸润深度和远处转移密切相关[19]。本研究通过对58例食管癌标本中钙黏附蛋白E的表达进行比较分析发现,在AEG1表达阳性的48例标本中仅有10例出现E-cad的阳性,阳性率为20.8%;而在AEG1表达阴性的10例食管癌标本中8例钙黏附蛋白E表现为阳性,阳性率为80%;相关分析结果显示,AEG1和E-cad在食管癌的表达中呈明显负相关(r=-0.483,P=0.00),差异有统计学意义。另外,在实验中还发现在食管癌标本中随着AEG1阳性程度的增强,E-cad表达水平相应的降低,因此可推测AEG1在食管癌中的过表达可能通过某种通路下调E-cad的表达。有文献报道,在肺癌[20]、宫颈癌等[18]的研究中发现AEG1表达上调具有诱导上皮细胞间质化的生物功能,其中Wnt/β-catenin信号通路在此过程中发挥重要作用。其可能的机制为AEG1通过激活酪蛋白激酶(CKIδ)从而诱导糖原合酶激酶-3β(GSK-3β)的磷酸化激活Wnt/β-catenin信号通路,导致细胞中β-catenin水平表达下降,介导上皮细胞的表面黏附分子的表达。这与本结果相一致。
研究表明,在食管癌中分别存在AEG1的表达上调和E-cad的表达缺失,且其表达水平与食管癌的分化程度、浸润深度、转移情况密切相关;AEG1和E-cad有望成为评估食管癌患者转移和浸润的重要生物指标。相关分析显示两者在食管癌中表达呈显著负相关。AEG1可能通过Wnt/β-catenin信号通路介导E-cad的表达下调,在食管癌的局部浸润和转移中发挥重要作用。然而在本研究中还有诸多不足之处,还需要进一步研究验证。
[1]郝捷,邵康.中国食管癌流行病学现状,诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501-504.
[2]Wan L,Kang Y.Pleiotropic roles of AEG-1/MTDH/LYRIC in breast cancer[J].Adv Cancer Res,2013,120(1):113-134.
[3]Guo J,Chen X,Xi R,et al.AEG-1 expression correlates with CD133 and PPP6c levels in human glioma tissues[J].Journal of Biomedical Research,2014,28(5):388.
[4]Bhatnagar A,Wang Y,Mease RC,et al.AEG-1 promoter-mediated imaging of prostate cancer[J].Cancer Res,2014,74(20): 5772-5781.
[5]Dong L,Qin S,Li Y,et al.High expression of astrocyte elevated gene-1 is associated with clinical staging,metastasis,and unfavorable prognosis in gastric carcinoma[J].Tumour Biol,2015, 36(3):2169-2178.
[6]Meng F,Luo C,Ma L,et al.Clinical significance of astrocyte elevated gene-1 expression in human epithelial ovarian carcinoma[J]. International Journal of Gynecologic Pathology,2011,30(2):145-150.
[7]Xu JB,Wu H,He YL,et al.Astrocyte-elevated gene-1 overexpression is associated with poor prognosis in gastric cancer[J].Medical Oncology,2011,28(2):455-462.
[8]Hu XK,Ruan Y,Cheng F,et al.p130Cas,E-cadherin and β-catenin in human transitional cell carcinoma of the bladder: expressionandclinicopathologicalsignificance[J].International Journal of Urology,2011,18(9):630-637.
[9]Kang DC,Su ZZ,Sarkar D,et al.Kang DC,Su ZZ,Sarkar D, et al.Cloning and characterization of HIV-1-inducible astrocyte elevated gene-1,AEG-1[J].Gene,2005,353:8-15.
[10]刘海燕,姜玉杰,孙若鹏.SiRNA下调astrocyte elevated gene-1对神经母细胞瘤细胞增殖和凋亡影响的体外研究[J].中国病理生理杂志,2011,27(4):705-710.
[11]秦瑞英,王宏伟,赵建华,等.AEG-1 siRNA对宫颈癌细胞株增殖和凋亡影响的研究[J].重庆医学,2014,43(17):2139-2141.
[12]Liu XW,Wang DG,Liu HL,et al.Knockdown of astrocyte elevated gene-1(AEG-1)in cervical cancer cells decreases their invasiveness,epithelial to mesenchymal transition,and chemoresistance[J].Cell Cycle,2014,13(11):1702-1707.
[13]Yu JQ,Zhou Q,Zhu H,et al.Overexpression of astrocyte elevated gene-1(AEG-1)in cervical cancer and its correlation with angiogenesis[J].Asian PacificJournalofCancerPrevention Apjcp,2015,16(6):2277-2281.
[14]Li C,Chen K,Cai J,et al.Astrocyte elevated gene-1:a novel independent prognostic biomarker for metastatic ovarian tumors[J]. Tumor Biology,2014,35(4):3079-3085.
[15]Von KS,Conti A,Nobis M,et al.Cancer Cell-Autonomous TRAIL-R Signaling Promotes KRAS-Driven Cancer Progression, Invasion,and Metastasis[J].Cancer Cell,2015,27(4):561-573.
[16]Brown DM,Ruoslahti E.Metadherin,a cell surface protein in breast tumors that mediates lung metastasis[J].Cancer Cell, 2004,5(4):365-374.
[17]Wang Z,Cao CJ,Huang LL,et al.EFEMP1 promotes the migration and invasion of osteosarcoma via MMP-2 with induction by AEG-1 via NF-κB signaling pathway[J].Oncotarget,2015. 6(16):14191-14208.
[18]Song E,Yu W,Xiong X,et al.Astrocyte Elevated Gene-1 Promotes Progression of Cervical Squamous Cell Carcinoma by Inducing Epithelial-Mesenchymal Transition via Wnt Signaling[J]. International Journal of Gynecological Cancer,2015,25(3):345-355.
[19]俞岚,周蕾,武世伍,等.上皮性卵巢癌中CD133与EMT相关因子表达的关系[J].南方医科大学学报,2015,35(9):1297-1302.
[20]He WL,He SY,Wang Z,et al.Astrocyte elevated gene-1 (AEG-1)induces epithelial-mesenchymal transition in lung cancer through activating Wnt/β-catenin signaling[J].Bmc Cancer, 2015,15(1):1-13.
(张蕾编辑)
临床论著
Correlationship and significance ofAEG1and expression of E-cad in esophageal carcinoma
Run-gen Zhao1,Cai-feng Zhang1,Juan-juan Ji1,Li-li Zhang1,Huai-cong Xiao1,Yong-hua Xia2,Yu Han1
(1.Department of Gastroenterology;2.Department of Dermatology,the First Affiliated Hospital of Xinxiang Medical University,Weihui,Henan 453100,China)
Objective To explore the correlationship of astrocyte elevated gene 1(AEG1)and expression of E-cadherin(E-cad)protein in esophageal carcinoma,and analyze its relationship with clinical pathological features. Methods Immunohistochemical and Western Blot test methods were used to detect the expression ofAEG1and E-cadherin protein in 58 cases of esophageal carcinoma tissues and its corresponding adjacent tissues.Then we analyzed the relationship ofAEG1,E-cadherin and clinicopathologic correlation.Results In 58 cases of esophageal carcinoma tissues,the positive expression rate ofAEG1was 82.7%;The positive expression rate ofAEG1was 51.7 %in the corresponding adjacent tissues,the positive expression rate ofAEG1in esophageal carcinoma tissues was obviously higher than that in the corresponding adjacent tissues(P<0.05),and the expression positive rate ofAEG1 in esophageal carcinoma tissues was related to differentiated degree,depth of invasion,clinical stage,and lymph node metastasis(P<0.05);but no relation with sex,age,tumor site,and pathologic types(P>0.05);in 58 cases of esophageal carcinoma tissues,the positive expression rate of E-cadherin protein was 31%,the positive expressionrate of E-cadherin was 94.8%;the positive expression rate of E-cadherin in esophageal carcinoma tissues was obviously less than that in the corresponding adjacent tissues(P<0.05);It is related to differentiated degree,depth of invasion,clinical stage,and lymph node metastasis(P<0.05);but no relation with sex,age,tumor site,and pathologic types(P>0.05);the expression ofAEG1and E-cadherin protein was significantly negative correlation(r=0.483,P<0.05). Conclusions The expression ofAEG1and E-cadherin in esophageal carcinoma was characterized by over-expression and loss-expression,and they were closely associated with invasion and metastasis of esophageal carcinoma,AEG1may be mediated E-cadherin less-expression in esophageal carcinoma.
astrocyte elevated gene1;E-cadherin;esophageal carcinoma;immunohistochemistry
R 735.1
A
10.3969/j.issn.1005-8982.2016.04.007
1005-8982(2016)04-0033-06
2015-10-28
韩宇,E-mail:hy198317@126.com,Tel:13837315730

