影响肝母细胞瘤儿童术后生存的因素分析
蒋文军,曹李明,李治熹
影响肝母细胞瘤儿童术后生存的因素分析
蒋文军,曹李明,李治熹
目的分析影响肝母细胞瘤儿童术后生存期的因素。方法选择2003年1月~2010年3月手术治疗的肝母细胞瘤患儿76例,进行定期随访,统计术后5 a生存率,并分析其影响因素。结果本组肝母细胞瘤儿童术后5 a生存率为48.68%(37/76);在≤2岁、血清LDH水平>240 U/L、血清CRP水平>10 mg/L患儿,5 a生存率分别为46.15%、35.90%、37.84%,明显低于>2岁、血清LDH水平≤240 U/L、血清CRP水平≤10 mg/L患儿(分别为54.16%、62.16%、58.97%);血清AFP水平>10000 μg/L患儿5a生存率为10.71%,明显低于<100 μg/L、100~10000μg/L患儿的68.75%、71.88%;PretextⅠ期、Ⅱ期、Ⅲ期患者5 a生存率分别为80%、55.56%、8.33%,病理分型胎儿型、胚胎型、混合型分别为60.98%、44.44%、23.53%,5 a生存率均依次减低,组间差异有统计学意义(P<0.05);血清AFP水平、Pretext分期、病理分型是影响肝母细胞瘤儿童术后生存期的独立危险因素(OR1=4.223,OR2=5.826,OR3=9.342,P<0.05)。结论肝母细胞瘤儿童术后5 a生存期仍较低,血清AFP水平、Pretext分期和病理分型是需要重点考虑的问题。
肝母细胞瘤;儿童;生存期;影响因素
【Key words】Hepatoblastoma;Children;Survival;Influencing factors
肝母细胞瘤(Hepatoblastoma)是儿童常见的肝脏恶性肿瘤,约占儿童原发性肝脏恶性肿瘤的50%~60%,多发于3岁以下的儿童[1],具有恶性程度高,术后生存期短的临床特点[2]。近年来,随着外科手术治疗技术的不断进步和铂类化疗药物的应用,该肿瘤患儿5 a生存率有所提高,但仍不理想。国外Ismail et al[2]研究发现血清AFP水平的稳定性对肝母细胞瘤的复发与生存期有一定的影响。美国儿童肿瘤研究组报告术前临床分期(Pretext)越高,肝母细胞瘤患儿预后越差[3]。我们对影响肝母细胞瘤患儿生存的因素进行了分析,现报道如下。
1 资料与方法
1.1一般资料选择2003年1月~2010年3月接受手术治疗并经术后病理学检查证实的肝母细胞瘤患儿76例,男49例,女27例;年龄6个月~12岁,平均年龄(2.45±1.75)岁。腹部肿块67例,腹痛22例,腹胀21例,黄疸6例。根据国际儿童肿瘤协会(SIOP)治疗前病变范围临床分期(Pretext)[4]:Ⅰ期25例、Ⅱ期27例、Ⅲ期24例。纳入标准:术前MRI/CT增强扫描和腹部超声检查符合肝母细胞瘤表现;均行手术切除治疗,病理证实为肝母细胞瘤,术后给予规范化辅助化疗。排除合并其他恶性肿瘤、远处转移、依从性差和术后未进行规范化化疗者。
1.2影像学检查使用MRI(美国GE Signa 1.5 T超导MRI)/CT(德国西门子SOMATOM Emotion64排螺旋CT)增强扫描及腹部超声(日本HITACHI公司HI VISION 900型多功能彩色多普勒超声诊断仪)进行腹部检查。
1.3治疗方法依据患儿术前CT/MRI等影像学检查结果,确定手术切除范围。采用外科根治手术切除联合辅助化疗。先行手术切除肿瘤,然后再给予化疗6个疗程;对肿瘤体积较大,一期手术难以完全切除的患儿,先行小切口切除部分肿瘤,在获得病理学明确诊断后,行2个疗程化疗,待影像学检查证实肿瘤体积显著缩小后,再行二次根治性手术完整切除肿瘤,术后给予规范化化疗4个疗程。选择DA与IEV化疗方案交替进行。DA方案:顺铂50 mg/m2(或卡铂200 mg/m2),1次/d,第1~3 d,阿霉素20 m/m2,1次/d,第1~3 d;IEV方案:异环磷酰胺300 mg/m2,1次/d,第1~5 d,足叶乙甙50 mg/m2,1次/d,第1~5 d,长春新碱1.0 mg/m2,1次/d,第1 d。每次化疗间隔3~4周,4个周期为一疗程。
1.4统计学方法应用SPSS 19.0医学统计学软件进行分析,计数资料采用x2检验,相关因素分析采用多因素Logistic回归分析,以P<0.05表示具有统计学差异。
2 结果
2.1一般情况患儿入院时血常规检查显示,白细胞(WBC)计数>10×109/L 38例,血红蛋白(HGB)<120 g/L 30例,血小板(PLT)计数>300×109/L 33例,乳酸脱氢酶(LDH)>240 U/L 37例,碱性磷酸酶(ALP)>500 U/L 40例,血清CRP>10mg/L 39例,血清AFP<100 μg/L 16例,100~10000 μg/L 32例,>10000 μg/L 28例。术后参照《诸福棠实用儿科学》[5]肝母细胞瘤分型标准分为:胎儿型41例、胚胎型18例、混合型17例。
2.2肝母细胞瘤儿童术后5 a生存率的单因素分析肝母细胞瘤儿童术后5 a生存率为48.68%(37/76);≤2岁、术前血清LDH水平>240 U/L、血清CRP水平>10 mg/L的患儿5 a生存率明显低于>2岁、血清LDH水平≤240 U/L、血清CRP水平≤10 mg/L患儿,差异有显著性统计学意义(P<0.05);血清AFP水平>10000μg/L患儿5a生存率明显低于<100 μg/L、100~10000 μg/L患儿,差异有统计学意义(P<0.05);在PretextⅠ期、Ⅱ期、Ⅲ期和组织病理学分型为胎儿型、胚胎型和混合型儿童,其5a生存率均依次降低,差异有统计学意义(P<0.05,表1)。
2.3影响肝母细胞瘤儿童术后生存期的多因素分析血清AFP水平、Pretext分期、病理分型是影响肝母细胞瘤患儿术后生存期的独立危险因素(OR1=4.223,OR2=5.826,OR3=9.342,P<0.05,表2)。
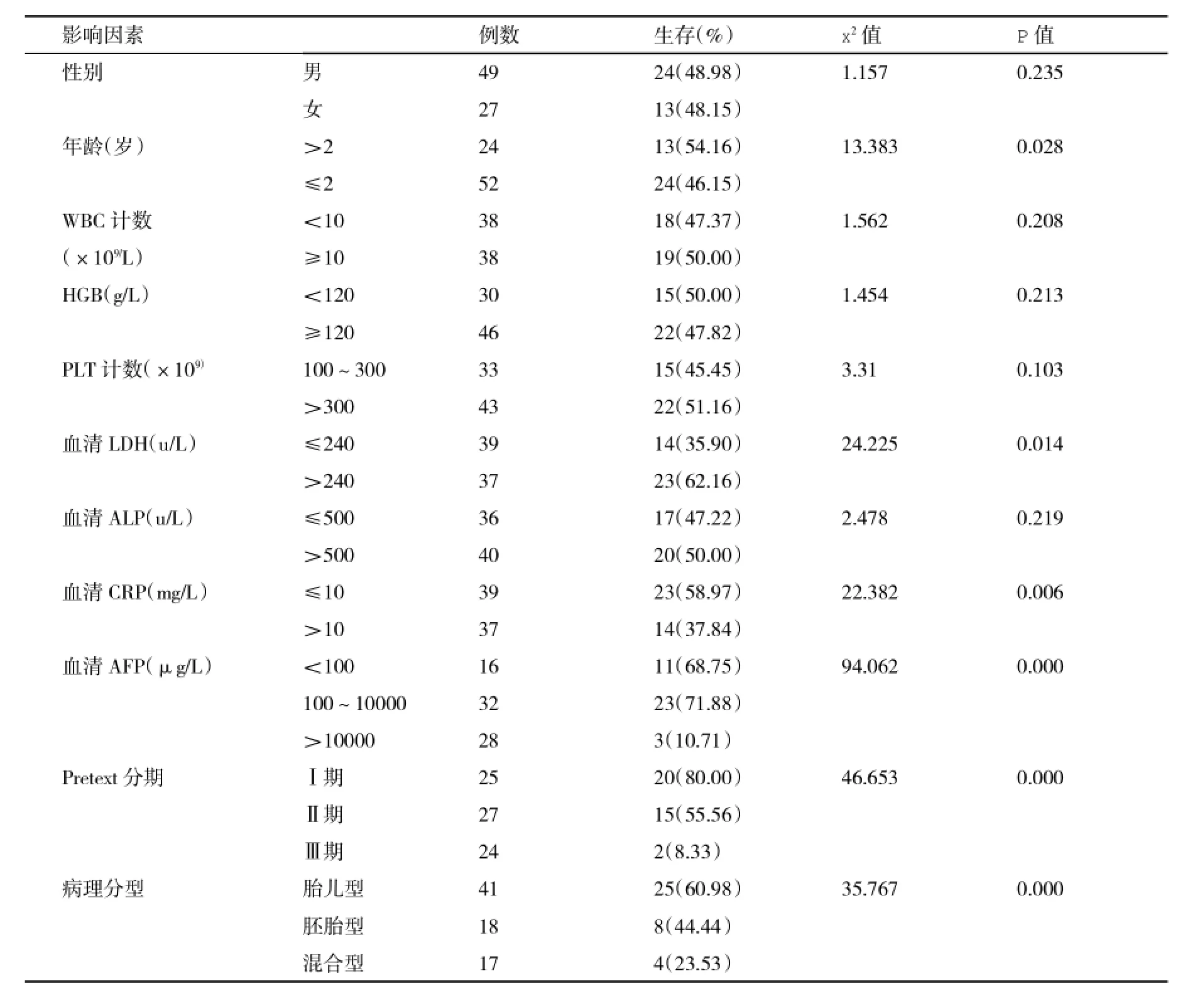
表1 影响肝母细胞瘤儿童术后5 a生存率的单因

表2 影响肝母细胞瘤术后生存期的多因素分析
3 讨论
肝母细胞瘤是一种多发生于婴幼儿的肝脏恶性肿瘤,其中3岁以下幼儿构成比达80%以上[6],手术根治性切除是治疗该肿瘤的首选,以往单纯手术治疗其疗效不佳,5 a生存率不足20%[7]。近年来,随着化疗药物研究的不断进展,应用于儿童的化疗药物越来越多。目前,根治术联合辅助化疗治疗儿童肝母细胞瘤,已使其5 a生存率达到50%左右,但仍有40%以上的患儿生存期低于5年[8,9]。本研究发现肝母细胞瘤患儿5 a生存率仅48.68%。因此,探讨影响儿童肝母细胞瘤术后生存的因素具有重要的临床价值。
本研究发现血清AFP水平是影响肝母细胞瘤患儿术后生存期的独立危险因素。临床研究充分证实AFP是肝脏恶性肿瘤的重要标志物,在肝母细胞瘤患者,其水平显著增高,不仅对初诊具有重要的参考意义,且在整个治疗过程中始终是评估患儿治疗效果及预后的重要客观指标[10~12]。Ismail et al[2]报道,在初诊、术后和化疗后血清AFP水平是否降低对获得良好预后具有重要意义。Von研究显示[13],血清AFP水平>10000 μg/L或<100 μg/L为儿童肝母细胞瘤预后不良的危险因素。本研究根据患儿AFP水平,将其分为<100 μg/L,100~10000 μg/L和>10000 μg/L三组,结果发现AFP>10000 μg/L患儿5 a生存率明显低于<100 μg/L和100~10000μg/L组,AFP<100 μg/L组患儿生存率略低于100~10000μg/L组,但尚无统计学差异(P>0.05),AFP<100 μg/L组患儿生存率略低的原因被认为系小细胞未分化型肝母细胞瘤的患者,通常AFP升高不明显,而该类患儿对化疗不敏感,术后容易复发,导致生存期限缩短[14]。本研究与以往研究存在差异,可能与选择样本量较小有关,提示定期检测AFP有助于评估肝母细胞瘤患儿治疗效果及疾病进展情况。
本研究发现PretextⅠ期、Ⅱ期、Ⅲ期,病理分型胎儿型、胚胎型、混合型患者5 a生存率均依次减低。Logistic回归分析发现Pretext分期、病理分型也是影响肝母细胞瘤患儿术后生存期的独立危险因素。国内外研究发现高水平AFP通常伴有Pretext高分期及病理学高恶性分型[15,16]。美国儿童肿瘤研究组报告证实Pretext分期越高,手术切除难度越大,对肝脏的损伤越大,不论是术后康复还是机体免疫功能的恢复均有直接的影响[17]。同时,诸多研究发现胚胎型和混合型肝母细胞瘤分化程度较低,PretextⅢ期、Ⅳ期构成比高,术后易复发[18]。另外,本研究发现部分PretextⅢ期患儿因病情较重、肿瘤体积较大,术前、术后处理均较复杂,术后化疗在周期及剂量掌握上通常更注重安全性,对治疗效果也有一定的影响。
本研究单因素分析发现血清CRP、LDH水平越高,患儿预后越差。LDH是糖酵解中重要的同工酶,肿瘤细胞代谢旺盛、坏死加速及细胞膜通透性改变均可导致血清LDH活性增高[19]。CRP是一种肝脏产生的急性期蛋白,其水平越高表明机体炎症状态与组织损伤程度越重[20],故血清CRP和LDH可反映患儿病情的严重程度,可间接估计预后。
肝母细胞瘤术后生存期仍处于较低的水平,血清AFP水平、Pretext分期、病理分型为其独立影响因素,术后重点加强对高水平AFP、Pretext高分期及胚胎型、混合型肝母细胞瘤患儿的检测及规范化化疗将有利于改善预后。
[1]Meyers RL,Czauderna P,Otte JB.Surgical treatment of hepatoblastoma.Pediatr Blood Cancer,2012,59(5):800-808.
[2]Ismail H,Broniszczak D,Kaliciński P,et al.Changing treatment and outcome of children with hepatoblastoma:analysis of a single center experience over the last 20 years.J Pediatr Surg,2012,47(7):1331-1339.
[3]张伟令,张谊,黄东生,等.儿童晚期肝母细胞瘤综合治疗的疗效观察.中华实用儿科临床杂志,2013,28(7):521-524.
[4]Gupta K,Rane S,Das A,et al.Relationship of beta-catenin and postchemotherapy histopathologic changes with overall survival inpatientswithhepatoblastoma.JPediatrHematolOncol, 2012,34(8):320-328.
[5]胡亚美,江载芳.诸福棠实用儿科学.7版,北京:人民卫生出版社,2002:16-42.
[6]Zsiros J,Brugieres L,Brock P,et al.Dose-dense cisplatin-based chemotherapy and surgery for children with high risk hepatoblastoma(SIOPEL4):a prospective,single-arm,feasibility study. Lancet Oncol,2013,14(9):834-842.
[7]Tsay PK,Lai PK,Yang CP,et al.Treatment outcomes for hepatoblastoma:Experience of 35 cases at a single institution.J Formos Med Assoc,2011,110(5):322-325.
[8]Arora RS.Outcomes of hepatoblastoma in the Indian context.Indian Pediatrics,2012,49(4):307-309.
[9]Barrena S,Hernandez F,Miguel M,et al.High-risk hepatoblastoma:results in a pediatric liver transplantation center.Eur J Pediatr Surg,2011,21(1):18-20.
[10]Sail MW,Li J,Lamb L,et al.First-in-human phase II trial of the botanical formulation PHY906 with capecitabine as secondline therapy in patients with advanced pancreatic cancer.Cancer Chemother Pharmacol,2014,73(2):373-380.
[11]Karski EE,Dvorak CC,Leung W,et al.Treatment of hepatoblastoma with high-dose chemotherapy and stem cell rescue:the pediatric blood and marrow transplant consortium experience and review of the literature.J Pediatr Hematol Oncol,2014,36(5):362-368.
[12]Malogolowkin MH,Katzenstein HM,Meyers RL,et al.Complete surgical resection is curative for children with hepatoblastoma with pure fetal histology:a report from the Children's Oncology Group.J Clin Oncol,2011,29(24):3301-3306.
[13]Von Schweinitz D.Hepatoblastoma:recent developments in research and treatment.Semin Pediatr Surg,2012,21(1):21-30.
[14]Maibach R,Roebuck D,Brugieres L,et al.Prognostic stratification for children with hepatoblastoma:the SIOPEL experience. Eur J Cancer,2012,48(10):1543-1549.
[15]UedaY,HiyamaE,KamimatsuseA,et al.Wntsignalingand telomeraseactivationofhepatoblastoma:correlationwith chemosensitivityandsurgicalrespectability.JPediatrSurg,2011,46(12):2221-2227.
[16]乔晓红,赵强,胡月,等.儿童肝母细胞瘤综合治疗27例疗效探讨.中华小儿外科杂志,2012,33(9):647-650.
[17]李丹妮,于新生,赵爱芝,等.影响儿童肝母细胞瘤预后的多因素分析.中国实用儿科杂志,2013,28(2):126-128.
[18]KohKN,ParkM,Kim BE,et al.Prognosticimplicationsof serumalpha-fetoproteinresponseduringtreatmentof hepatoblastoma.Pediatr Blood Cancer,2011,57(4):554-560.
[19]吴艳梅,王珊,胡显良,等.术前应用经导管动脉化疗栓塞治疗儿童肝母细胞瘤的疗效分析.重庆医科大学学报,2014,39(2):241-245.
[20]葛军涛,李龙,乔国梁,等.肝母细胞瘤预后评分系统的建立并比较其与常见预后模型的预测价值.中华小儿外科杂志,2015,36(1):21-25.
(收稿:2015-04-23)
(本文编辑:陈宗炳)
Factor affecting survival of children with hepatoblastoma after operation
Jiang Wenjun,Cao Liming,Li Zhixi.Department of Children Surgery,Sichuan Provincial People's Hospital,Chengdu 610072
10.3969/j.issn.1672-5069.2016.01.030
610072成都市四川省人民医院儿外科
蒋文军,男,43岁,大学本科,主治医师。主要从事新生儿普外科疾病诊治研究。E-mail:jiangwenjun335@163.com

