具有高选择性吸附的表面分子印迹磁性纤维素微球的制备与性能
葛 昊, 黄海龙, 徐 敏
(华东师范大学物理与材料学院, 上海市磁共振重点实验室, 上海 200062)
具有高选择性吸附的表面分子印迹磁性纤维素微球的制备与性能
葛昊, 黄海龙, 徐敏
(华东师范大学物理与材料学院, 上海市磁共振重点实验室, 上海 200062)
以纤维素和纳米Fe3O4为原料制得磁性纤维素微球, 在纤维素微球表面选择合适的模板分子, 以甲基丙烯酸、丙烯酰胺和N,N′-亚甲基双丙烯酰胺为功能单体, 采用水溶液聚合法制得表面分子印迹磁性纤维素微球. 采用傅里叶变换红外光谱(FTIR)、X射线衍射(XRD)和振动样品磁强计(VSM)等表征了分子印迹聚合物微球的结构. 以罗丹明B(RhB)为模板分子, 通过吸附动力学与吸附热力学实验研究了表面分子印迹磁性纤维素微球对RhB的吸附性能, 结果表明, 制备的表面分子印迹磁性纤维素微球对罗丹明B具有特异性识别作用, 饱和吸附量达到0.542mg/mg, 吸附平衡时间为10h左右. 表面分子印迹磁性纤维素微球大大降低了对吸附环境的依赖, 并可重复利用.
纤维素微球; 四氧化三铁; 分子印迹聚合物; 罗丹明B; 选择性吸附
分子印迹聚合物(MIP)由于具有特异性识别位点成为近年来关注的热点[1~3]. 通过选择目标印迹分子作为模板分子, 利用共价键与非共价键结合模板分子与功能单体, 应用于包括化学、生物传感器和人工酶抑制剂/抗体等领域[4,5]. 但传统的分子印迹聚合物存在吸附量少、吸附速率慢、重复利用率低、形状不规则、吸附受环境温度和pH值影响较大等问题, 限制了MIP的应用.
近年来, 包括磁性纤维素微球(MCM)在内的磁性天然高分子微球正迅速发展并成为一种新型载体[6~10]. 由于天然高分子微球具有多孔结构及较为丰富的—OH/—NH2基团, 磁性Fe3O4纳米粒子又赋予其磁响应性, 因此磁性天然高分子微球在金属离子及染料吸附等环境治理方面有着广泛的应用.Yang等[11~13]通过改性修饰的方法制备了一系列的壳聚糖磁性微球, 其对Hg2+和甲基橙/酸性绿25等重金属或有机染料有着很高效的吸附作用. 李江等[14]制备的甘氨酸修饰的大孔纤维素微球对Cr3+和Fe3+具有较好的吸附作用. 由于磁性天然高分子微球具有生物无毒、磁响应及形貌可控等性能而广泛应用于蛋白载体、酶固定化、靶向药物和磁共振成像等领域, 并发挥重要作用[15].
本文将磁性纤维素微球(MCM)与分子印迹技术(MIP)结合, 不仅提供了印迹聚合物稳定可控的微球状结构, 同时赋予其磁响应及可回收等特性. 以纤维素和纳米Fe3O4为原料制得MCM, 在MCM表面以罗丹明B(RhB)为模板分子, 以甲基丙烯酸、丙烯酰胺和N,N′-亚甲基双丙烯酰胺为功能单体, 采用水溶液聚合法制备得到表面分子印迹RhB分子的磁性纤维素微球(MIP-MCM), 研究了MIP-MCM对RhB的吸附性能, 并讨论了pH值和温度对吸附性能的影响及磁响应和重复利用性能.
1 实验部分
1.1试剂与仪器
纤维素(Mw=8×104), 湖北化纤集团有限公司; 氯化铁(FeCl3)、硫酸亚铁(FeSO4·7H2O)、氢氧化钠、尿素、丙烯酸、丙烯酰胺、N,N′-亚甲基双丙烯酰胺、过硫酸钾、液体石蜡和吐温80, 分析纯, 上海阿拉丁生化科技股份有限公司; 实验用水为去离子水.
日本Hitachi公司S-4800型扫描电子显微镜(SEM), 加速电压为 5kV; 中国Phenix公司XDS200型生物倒置显微镜; 美国Nicolet公司Nexus670型傅里叶变换红外光谱(FTIR)仪; 荷兰Panalytical公司PROPW3040/60型X射线衍射(XRD)仪; 美国LakeShore公司7404型振动样品磁强计(VSM); 美国Agilent公司CARY-100型紫外-可见(UV-Vis)分光光度计; 日本Horiba公司LA-950V2型激光粒度分析仪(DLS).
1.2实验过程
1.2.1Fe3O4粒子制备在N2气保护下, 向250mL三口瓶中加入摩尔比为2∶1的FeCl3和FeSO4·7H2O的水溶液, 在100Hz功率下超声振荡下, 向混合溶液中缓慢滴加1mol/LNaOH水溶液, 调节溶液pH值为10, 水浴加热到40 ℃, 反应1h, 冷却至室温, 调节pH值为7, 抽滤, 真空干燥, 研磨得到Fe3O4粒子.
1.2.2MCM的制备配制NaOH/尿素/H2O水溶液, 其中NaOH的质量分数为7%, 尿素的质量分数为81%, 预冷至-12 ℃[9]. 将8.00g纤维素和1.00gFe3O4粒子加入200g经过预冷的NaOH/尿素/水溶液中, 快速搅拌得到黑色浑浊状磁性纤维素溶液. 将20gFe3O4/纤维素混合溶液缓慢滴入包含60mL液体石蜡和4.00g吐温80的混合溶液中, 剧烈搅拌5h, 反应结束后用HCl调节pH值至7, 得到MCM. 产物依次用丙酮、乙醇和蒸馏水洗涤3次, 并保存在5%的乙醇水溶液中(5 ℃).
1.2.3MIP-MCM的制备在50mL三口瓶中加入50mgMCM和25mL去离子水, 再依次加入0.025mmolRhB、0.1mmol丙烯酰胺、0.1mmol甲基丙烯酸和0.02mmolN,N′-亚甲基双丙烯酰胺, 超声溶解并脱气. 在N2气保护下, 机械搅拌, 加入质量分数为6%的过硫酸铵, 于70 ℃水浴中引发聚合反应, 24h后将所得分子印迹磁性纤维素微球依次用丙酮、乙醇和水洗涤, 以体积比为9∶1的甲醇/乙酸混合液进行索氏提取, 直到紫外检测不到模板分子, 用磁铁吸附分离, 得到MIP-MCM, 保存于5%乙醇水溶液中.
不加模板分子, 重复上述实验过程, 制得非模板分子印迹磁性微球(NIP-MCM).
1.2.4吸附性能将5mgMIP-MCM或NIP-MCM分别加入5mLRhB水溶液中, 室温振荡24h后用磁铁分离, 取上清液, 在紫外-可见分光光度计上测定552nm处RhB的浓度. 吸附量(Q)根据下式计算:
(1)
式中: c0和ce分别为RhB的初始浓度和吸附后浓度(mg/mL); V为溶液体积(mL); m为磁性纤维素微球的干燥质量(mg).
1.2.5解吸附和再吸附实验将5mgMIP-MCM加入到5mL1.777mg/mL的RhB水溶液中, 室温振荡24h, 用磁铁分离MIP-MCM. 取上清液, 在紫外-可见分光光度计上测定RhB在552nm处的浓度; 再将分离后的MIP-MCM用体积比为9∶1的甲醇/乙酸进行索氏提取, 直到通过紫外检测不到模板分子, 测定洗脱液中RhB的浓度. 将洗脱处理后的MIP-MCM再加入1.777mg/mL的RhB水溶液中, 再次进行吸附. 重复上述过程多次, 测定MIP-MCM的重复利用效率.
2 结果与讨论
2.1MIP-MCB的合成
Scheme1为MIP-MCM的构建过程示意图. 首先, 纤维素包裹在纳米Fe3O4的外面得到MCM; 然后以RhB为模板分子, 甲基丙烯酸, 丙烯酰胺和N,N′-亚甲基双丙烯酰胺为聚合单体在MCM的外围聚合, 形成外层包裹物. 洗脱模板分子RhB即可得到MIP-MCM.Scheme1中左下示意图即为甲基丙烯酸、丙烯酰胺和N,N-亚甲基双丙烯酰胺交联共聚物与RhB的相互作用示意图.

Scheme 1 Preparation process of MIP-MCM
2.2MCM的结构和磁性能表征


Fig.1 FTIR spectra of Fe3O4(a), cellulose(b), MCM(c), NIP-MCM(d) and MIP-MCM(e)

Fig.2 XRD of MIP-MCM(a), MCM(b), cellulose(c) and Fe3O4(d)
2.2.2XRD分析图2给出Fe3O4、纤维素、MCM和MIP-MCM的XRD谱图.MCM的3个特征峰2θ=12.4°, 20.2°和22.2°为纤维素的(110), (110)和(200)面, 说明纤维素从晶型Ⅰ转变为晶型Ⅱ[17].Fe3O4的特征衍射峰2θ=30.1°, 35.5°, 43.1°, 53.4°, 57°分别对应(111), (220), (400), (422)和(511)晶面[18]. 在MCM的特征谱图中, 可以同时观察到纤维素和Fe3O4的特征峰, 表明纤维素已包覆在Fe3O4外面. 在MIP-MCM的XRD谱图中已经很难看到Fe3O4的特征谱峰, 并且纤维素的特征峰强度减弱, 表明MCM已经被分子印迹聚合物包裹, 所以衍射峰强度下降.
2.2.3MIP-MCM形貌分析图3给出MCM和MIP-MCM的SEM照片. 图4给出MIP-MCM的DLS结果和倒置生物显微镜照片. 比较图3(A)和(B)可见, 包裹印迹聚合物后,MIP-MCM的表面更加严密规整, 且微球粒径均匀; 从图3(B)插图中可见,MIP-MCM仍具有微孔结构且气孔平均直径约为100nm. 从图4(A)可以看出, 微球的平均粒径约为22.79μm. 在图4(B)中可以清楚地观察到核-壳结构, 许多Fe3O4纳米粒子埋在纤维素内部, 外壳包裹一层聚合物且大部分颗粒呈规则球形. 结合红外谱图与XRD的结果, 证明得到了表面分子印迹磁性纤维素微球MIP-MCM.

Fig.3 SEM images of MCM(A) and MIP-MCM(B) Insets: magnifications images of (A) and (B).

Fig.4 DLS(A) and microscope image(B) of MIP-MCM
2.2.4磁响应分析在室温下测定±1.2×106A/m范围内的Fe3O4,MCM和MIP-MCM的磁滞回线(图5), 所有样品均具有灵敏的磁响应性. 虽然MIP-MCM的饱和磁化强度为6.46A·m2/kg, 远远低于Fe3O4(48.1A·m2/kg)和MCM(46.7A·m2/kg), 但仍然表现出明显的磁响应性[19]. 表明分子印迹聚合物已包覆在MCM的表面, 并且MIP-MCM具有超顺磁性, 可在外加磁场的作用下快速与目标磁靶向分离. 从图5插图可以看出, 在外加磁场下,MIP-MCM可以快速地从水溶液中聚集.
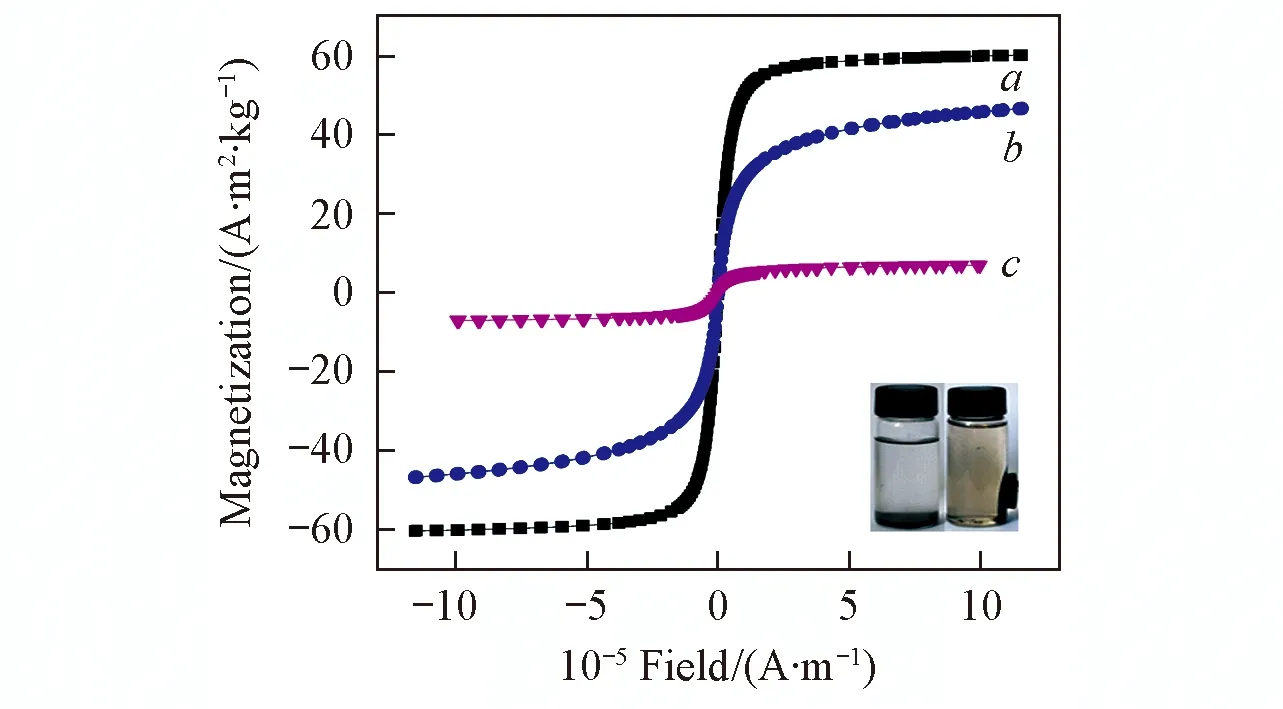
Fig.5 Hysteresis loops of the Fe3O4(a), MCM(b) and MIP-MCM(c) Inset: magnetic separation picture of MIP-MCM.

Fig.6 Adsorption kinetic of MIP-MCM(■), NIP-MCM(◆) and fitting model(—) of RhB on the MIP-MCM and NIP-MCM
2.3分子印迹磁性纤维素微球的吸附性能
2.3.1吸附时间对吸附性能的影响用动态吸附实验测定MIP-MCM和NIP-MCM对RhB的吸附量随时间变化的吸附曲线. 由图6可见,MIP-MCM和NIP-MCM对RhB的吸附量随着吸附时间的累加而逐渐增加. 在吸附时间为5h之前,RhB的吸附量随吸附时间的延长快速增加, 这主要是吸附初始阶}段表面有大量空位点, 使MIP-MCM和NIP-MCM能够快速地吸附RhB分子; 8h之后, 吸附速率逐渐减慢, 吸附量趋于稳定, 表面的吸附位点逐渐被占满, 同时由于空间位阻效应, 吸附作用趋于平衡.
为了研究MIP-MCM和NIP-MCM对RhB的吸附动力学, 用一级动力学模型和二级动力学模型拟合吸附量与时间关系[20, 21]:
(2)
(3)
式中: Qe和Qt分别为MIP-MCM或NIP-MCM对RhB在平衡阶段和某个时间t时的吸附量(mg/mg); k1(h-1)和k2(h-1)分别是一级动力学模型和二级动力学模型的速率常数. 动力学模型参数列于表1. 尽管2个动力学模型拟合的R2都大于0.95, 但对于MIP-MCM或NIP-MCM来说, 二级吸附的R2都要大于一级吸附的R2, 说明整体的吸附动力学更加符合二级吸附模型, 说明整体的吸附过程是一个化学吸附控制的过程.
根据2种吸附动力学模型拟合出的饱和吸附量数值与图6吸附拟合结果一致.NIP-MCM的吸附能力明显地弱于MIP-MCM, 这是由于NIP-MCM的表面并不存在特异性结合位点, 虽然也会对RhB分子产生一定的吸附行为, 但是由于没有功能单体与模板分子之间的相互作用位点, 使得吸附量大大降低. 同时, 由于吸附与解吸附过程很快达到动态平衡, 所以虽然仍然有吸附但是吸附效率和吸附量都远远低于MIP-MCM. 两者的吸附量比值αMIP/NIP为15.11, 说明MIP-MCM对RhB具有明显的特异性吸附作用.

Table 1 Kinetic parameters of the adsorption of RhB by MIP-MCM and NIP-MMCl

Fig.7 Static adsorption isotherms of MIPMCM(■) and NIP-MCM(◆)
2.3.2RhB初始浓度对吸附性能的影响用静态吸附实验测定MIP-MCM和NIP-MCM对不同初始浓度的RhB的吸附量变化等温曲线. 在5mL不同RhB浓度的水溶液中分别加入5mgMIP-MCM或NIP-MCM, 室温振荡24h后, 取上清液, 用紫外-可见分光光度计测定溶液中剩余的RhB浓度;RhB的初始浓度为0.197~1.777mg/mL. 由图7可见,MIP-MCM和NIP-MCM对于RhB的吸附量随RhB浓度的增加逐渐增加, 当初始浓度达到1.11mg/mL时, 吸附量逐渐趋于平缓.
吸附等温线是研究模板分子与结合位点之间相互作用的基础, 通过Langmuir和Freundlich方程拟合对其吸附性能进行研究[22,23].
(4)
(5)
式中: Qe为吸附平衡量(mg/mg); ce为吸附平衡时溶液浓度(mg/mL); b, Qm, KF, 1/n分别为常数.
将吸附数据代入拟合方程, 通过相关性(表2)比较可以看出,Langmuir和Freundlich模型都能很好地描述吸附过程, 2种吸附模型的R2都大于0.960, 说明MIP-MCM对RhB分子的吸附过程同时存在物理吸附和化学吸附.Freundlich吸附模型的1/n参数和吸附材料的吸附性能有关, 1/n的数值一般在0与1之间, 其值的大小表示浓度对吸附量影响的强弱. 1/n越小, 吸附性能越好. 1/n在0.1~0.5之间, 则易于吸附. 在本文中,MIP-MCM对RhB的吸附参数1/n为0.261, 小于NIP-MCM的1/n值(0.338), 说明MIP-MCM比NIP-MCM具有更好的吸附性能.
Table2LangmuirandFreundlichdatafortheadsorptionofRhBontheMIP-MCMat25 ℃

AdsorptionLangmuirmodelFreundlichmodelQm/(mg·mg-1)bR21/nKFR2MIP-MCM0.5426.470.9970.2610.4860.986NIP-MCM0.03903.130.9940.3380.02850.960
根据Langmuir模型拟合吸附材料的最大吸附量Qe, 其中MIP-MCM对RhB的最大拟合吸附量可以达到0.542mg/mg,NIP-MCM的最大拟合吸附量为0.0390mg/mg. 与NIP-MCM相比,MIP-MCM具有非常高的饱和吸附量, 这是由于在预聚合阶段, 在MCM表面形成的三维空穴和聚合完成移去RhB分子后形成的结合位点, 而NIP-MCM上没有结合位点, 因此吸附量远远小于MIP-MCM.MIP-MCM对RhB的最大吸附量显著提高, 此前文献[24~27]报道的最大吸附量为0.0460~0.201mg/mg. 这主要由于MCM具有较大的表面积, 同时由于分子印迹聚合物包裹在MCM表面, 使溶液中模板分子与识别位点的接触变得更加容易. 纤维素微球内部的大量空腔, 也可以提供吸附浓度差, 从而进一步增加对RhB的吸附量.
2.3.3特异性吸附选择与RhB结构相近的罗丹明6G(Rh6G)进行吸附对比实验, 利用等温吸附平衡实验测定MIP-MCM对于RhB和Rh6G的吸附性能. 通常分子印迹的特异性吸附以印迹因子β表示:
(6)
Tabe3KineticparametersoftheadsorptionofRhBandRh6GbyMIP-MCM(*)andNIP-MCM(**)
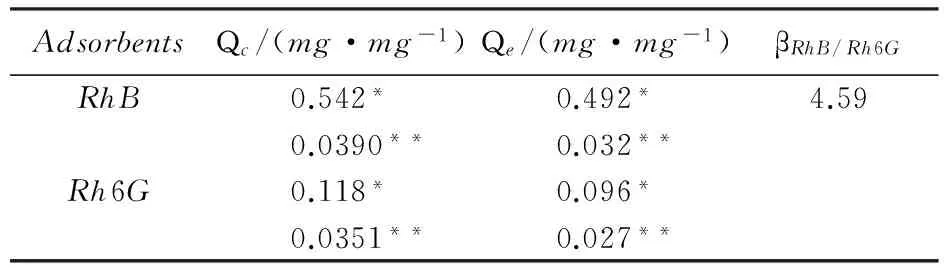
AdsorbentsQc/(mg·mg-1)Qe/(mg·mg-1)βRhB/Rh6GRhB0.542*0.492*4.590.0390**0.032**Rh6G0.118*0.096*0.0351**0.027**
式中: QRhB和QRh6G分别为MIP-MCM对RhB和Rh6G的吸附量. 将MIP-MCM对RhB和Rh6G的吸附行为进行吸附热力学拟合, 拟合结果列于表3. 其中Qe为实验所得最大吸附量, Qc为Langmuir模型拟合所得饱和吸附量.
MIP-MCM对RhB和Rh6G吸附热力学行为见图8. 可见,MIP-MCM对RhB和Rh6G都有一定的吸附能力, 但是对比拟合得到的饱和吸附量,MIP-MCM对RhB的吸附能力(0.542mg/mg)远远高于Rh6G(0.118mg/mg), βRhB/Rh6G为4.59, 说明MIP-MCM对于RhB具有明显的选择吸附性, 这是由于聚合阶段模板分子与功能单体形成互补的特异性识别位点, 印迹过程即空位点对模板分子的筛选过程. 虽然RhB和Rh6G的结构相似, 但RhB具有羧基能够稳固地结合在功能单体上, 因此特异性位点具有与羧基结合的孔穴, 没有相同的结构和功能团的分子结构不能匹配微球上的空穴. 而NIP-MCM对RhB和Rh6G的吸附量差别不大,说明NIP-MCM对RhB不具备特异性识别能力. 证明所制备的MIP-MCM对模板分子RhB具有较高的选择识别性.

Fig.8 Adsorption selectivity of MIP-MCM toward different targets

Fig.9 Effect of solution pH on RhB adsorption on MIP-MCM at 298 K
2.3.4溶液pH对吸附性能的影响在不同pH值溶液中吸附结果见图9,pH值在3~11的范围内,MIP-MCM对RhB仍然保持较高的稳定吸附效率, 当11
2.3.5溶液温度对吸附性能的影响溶液温度是影响吸附性能的另一个重要因素, 由于溶液中温度不同, 分子运动性改变, 吸附过程可能会受到影响. 在不同温度下吸附结果如图10所示. 在283~333K范围内,MIP-MCM对RhB保持着较高的吸附能力, 这主要是由于纤维素微球在溶液中稳定性好, 同时分子印迹的吸附位点与RhB之间有较强的相互作用, 即使温度变化也仍能较为稳定地吸附RhB.

Fig.10 Effect of solution temperature on RhB adsorption of MIP-MCM
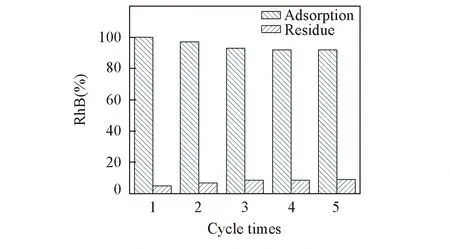
Fig.11 Regeneration cycles for MIP-MCM
2.3.6再生和重复利用由于MIP-MCM具有磁响应性能, 可以快速地分离纯化, 为重复利用提供了条件. 通过吸附与解吸附的重复过程测定MIP-MCM对RhB的吸附性能, 结果示于图11. 由图11可见, 以第一次吸附量作为100%, 经过5次的重复吸附-解吸附过程,MIP-MCM对RhB的吸附量虽然有所降低, 但吸附效率仍保持在90%以上, 并且吸附效率基本保持稳定, 残留量不再增加. 说明MIP-MCM是一种稳定、高效并可重复利用的材料, 在染料吸附及水处理领域有着潜在的应用前景.
3 结 论
以纤维素和纳米Fe3O4为原料制得MCM, 在MCM表面以RhB为模板分子, 甲基丙烯酸、丙烯酰胺和N,N′-亚甲基双丙烯酰胺为功能单体, 采用水溶液聚合法制备了MIP-MCM. 利用FTIR,XRD,VSM和SEM对MIP-MCM进行了表征, 利用吸附动力学与吸附热力学对MIP-MCM的吸附性能进行了研究. 结果表明, 合成的MIP-MCM不仅可以驱动模板分子快速富集在其表面, 同时具有很高的选择吸附性能.MIP-MCM可以在广泛的吸附环境下仍然能够保持稳定的吸附效率, 在pH值为3~12及283~333K的温度范围内保持优良的吸附性能. 此外,MIP-MCM还可以通过超顺磁性快速分离纯化, 并可重复利用. 这些特点使MIP-MCM不仅能够对RhB具有优异的选择吸附效果, 在染料吸附处理领域有着潜在的应用前景, 并且可以通过改变模板分子与功能单体的聚合体系, 设计出具有不同用途的印迹磁性纤维素微球, 在靶向药物传递、生物检测及药物缓释和跟踪等领域具有广阔的应用前景.
[1]HauptK.,MosbachK., Chem. Rev., 2000, 100(7), 2495—2504
[2]YouQ.P.,PengM.J.,ZhangY.P.,GuoJ.F.,ShiS.Y., Anal. Bioanal. Chem., 2013, 406(3), 831—839
[3]CourtensE.,SzökeA., Phys. Rev. A, 2014, 30(1), 42—48
[4]PanJ.M.,HangH.,DaiX.H.,DaiJ.D.,HuoP.W.,YanY.S., J. Mater. Chem., 2012, 22(33), 17167—17175
[5]TursonM.,DawutG.,EminR.,ChuG.H.,JelilM.,TurhonM., Chem. J. Chinese Universities, 2015, 36(12), 2402—2408(买买提·吐尔逊, 古丽巴哈尔·达吾提, 热萨莱提·伊敏, 楚刚辉, 买合木提江·杰力, 木合塔尔·吐尔洪. 高等学校化学学报, 2015, 36(12), 2402—2408)
[6]HanL.,WeiW.,ChenL.L.,LiX.C.,YiB.,LeD.,HanL.,WeiW.,ChenL.L.,LiX.C., Enzyme. Microb. Tech., 2004, 35(1), 15—21
[7]PanM.R.,SunY.F.,JinZ.,YangW.L., ACS. Appl. Mater. Inter., 2013, 5(17), 8351—8358
[8]PengS.,MengH.C.,OuyangY.,ChangJ., Ind. Eng. Chem. Res., 2014, 53(6), 2106—2113
[9]CaiJ.,ZhangL.N., Macromol. Biosci., 2005, 5(6), 539—548
[10]GuJ.,ZhouG.C.,WuW.B.,GongM.R.,DaiH.Q., Acta Polym. Sin., 2014, 4, 491—498(谷军, 周冠成, 吴伟兵, 龚木荣, 戴红旗. 高分子学报, 2014, 4, 491—498)
[11]LiK.,LiP.,CaiJ.,XiaoS.J.,YangH.,LiA.M., Chemosphere, 2016, 154, 310—318
[12]HanY.,YangL.Y.,ZhenY.,HuY.,LiA.M.,ChengR.S., J. Hazard. Mater., 2012, 229/230, 371—380
[13]XueT.,LiK.,HanY.,YangH.,LiA.M., Environ. Pollut., 2015, 209, 21—29
[14]LiJ.,DuK.F.,ZhuW.X.,WangQ.Y.,SongH., Industrial Water Treatment, 2011, 31(5), 58—60(李江, 杜开峰, 朱卫霞, 汪全义, 宋航. 工业水处理, 2011, 31(5), 58—60)
[15]FangL.J.,ChenS.J.,ZhangY.,ZhangH.Q., J. Mater. Chem., 2011, 21(21), 2320—2329
[16]DengY.H.,QiD.W.,DengC.H.,ZhangX.M.,ZhaoD.Y., J. Am. Chem. Soc., 2008, 130(1), 28—29
[17]LiR.,ChangC.Y.,ZhouJ.P.,ZhangL.N.,GuW.Q.,LiC.T.,LiuS.L.,KugaS., Ind. Eng. Chem. Res., 2010, 49(22), 11380—11384
[18]LiY.,DingM.J.,WangS.,WangR.Y.,WuX.L.,WenT.T.,YuanL.H.,DaiP.,LinY.H.,ZhouX.M., ACS. Appl. Mater. Inter., 2011, 3(9), 3308—3315
[19]YanL.F.,TanL.,YangF.,ZhouM., Chinese J. Chem. Phys., 2004, 17(6), 762—766(阎立峰, 谭琳, 杨帆, 周密. 化学物理学报, 2004, 17(6), 762—766)
[20]RepoE.,WarcholJ.K.,KurniawanT.A.,SillanpääM.E.T., Chem. Eng. J., 2010, 161(1/2), 73—82
[21]HoY.S.,MckayG., Process Biochem., 1999, 34(5), 451—465
[22]ZhouL.M.,WangY.P.,LiuZ.R.,HuangQ.W., J. Hazard. Mater., 2009, 161(2/3), 995—1002
[23]QiuB.,XuC.X.,SunD.Z.,YiH.,GuoJ.,ZhangX.,QuH.L.,GuerreroM.,WangX.F.,NoelN.,LuoZ.P.,GuoZ.H.,WeiS.Y., ACS Sustain. Chem. Eng., 2014, 2(8), 2070—2080
[24]XuanG.S.,SunQ.Y.,ZhengX., Advanced Materials Research, 2014, 998—999, 19—22
[25]LiuK.P.,LiH.M.,WangY.M.,GouX.J.,DuanY.X., Colloid Surface A, 2015, 477, 35—41
[26]YaoZ.P.,ZhangY.,WangH.,WuM.L.,HuangY.M., Journal of Southwest University(Natural Science), 2015, 37(7), 166—169(姚志鹏, 张颖, 王慧, 吴茂玲, 黄玉明. 西南大学学报: 自然科学版, 2015, 37(7), 166—169)
[27]ShiC.,FengJ.W.,PengS.L.,HuZ.H., Environ. Chem., 2013, 3, 394—401(施超, 冯景伟, 彭书传, 胡真虎. 环境化学, 2013, 3, 394—401)
(Ed.:W,Z)
PreparationandPropertiesofSurfaceImprintedMagneticCelluloseMicrospherewithHighlySelectiveAdsorption†
GEHao,HUANGHailong,XUMin*
(School of Physics and Materials Science, Shanghai Key Laboratory of Magnetic Resonance,East China Normal University, Shanghai 200062, China)
Molecularlyimprintedmagneticcompositemicrospheres(MIP-MCM)werepreparedbyasurfacefunctionalmonomer-directingsystem.CelluloseandFe3O4compositemicrospherewasthecoreandthenwascoatedalayerofMIPonthesurface.FouriertransformInfraredspectra(FTIR),X-raypowderdiffraction(XRD),vibratingsamplemagnetometry(VSM)methodswereusedtocharacterizethestructureofMIP-MCM.Inthisarticle,RhodamineB(RhB)waschosenasthetemplatemolecule.TheadsorptionabilitiesofMIP-MCMtowardRhBwerestudiedthroughadsorptionkineticsandadsorptionthermodynamics.Theadsorptionkineticscurvesmetpseudo-second-ordermodelmore.TheadsorptionisothermscouldbedescribedbybothLangmuirandFreundlichisothermmodels.Themaximumadsorptionamountwascalculatedtobe0.542mg/mg,muchhigherthanthecommonadsorbents.MIP-MCMwasalsoadsorption-selectivetoRhBwithhighlyregenerateandkeptstableinawildpHandtemperaturerange.Inbrief,MIP-MCMisverypotentialintheapplicationofremovalofdyeandsewagetreatment.
†SupportedbytheNationalNaturalScienceFoundationofChina(Nos.51273067, 21544003).
Cellulose;Fe3O4;Molecularlyimprintedpolymer;RhodamineB;Selectiveadsorption
2016-04-18. 网络出版日期: 2016-07-19.
国家自然科学基金(批准号: 51273067, 21544003)资助.
O631
A
联系人简介: 徐敏, 女, 博士, 教授, 主要从事核磁共振在化学中的应用研究.E-mail:xumin@phy.ecnu.edu.cn

