注射用头孢西丁钠无菌检查方法适用性试验
王林 石晶萍 黄加秀 谢春娟(扬子江药业集团有限公司,江苏泰州225321)
注射用头孢西丁钠无菌检查方法适用性试验
王林石晶萍黄加秀谢春娟
(扬子江药业集团有限公司,江苏泰州225321)
【摘要】目的:建立注射用头孢西丁钠无菌检查的方法适用性试验。方法:参照《中国药典》2015年版无菌检查法中的薄膜过滤法进行试验,通过冲洗量和β-内酰胺酶加入量等条件的优化,建立该品种的无菌检查方法。结果:以pH 7.0无菌氯化钠-蛋白胨缓冲液作为冲洗液,约每管800 mL的冲洗量,每管培养基中加入β-内酰胺酶2 mL,可以消除头孢西丁钠的抑菌作用。结论:该方法有效可行,可用于该品种的无菌检查。
【关键词】注射用头孢西丁钠;无菌检查;方法适用性试验
头孢西丁钠是由链霉素产生的甲氧头孢菌素C经半合成制得的一类新型头霉素类抗生素,对革兰阴性菌有较强的抗菌作用,具有高度抗β-内酰胺酶的性质。临床主要用于敏感菌所致的心内膜炎,呼吸道感染以及骨、关节、皮肤和软组织等感染的治疗[1-3]。
根据《中国药典》2015年版的要求,所有用于市场销售的注射制剂必须进行无菌检查且合格。当进行产品的无菌检查时,应进行方法适用性试验,以确认所采用的方法适合于该产品的无菌检查[5]。目前注射用头孢西丁钠的无菌检查方法在国内尚无文献报道。据此,本文建立了注射用头孢西丁钠无菌检查的方法,并进行了方法适用性试验。
1 材料
1.1仪器
ZH-2型旋涡混合仪(上海沪西医疗仪器厂);HTY-601型智能集菌仪(浙江泰林生物技术股份有限公司);NKF330型全封闭集菌培养器(浙江泰林生物技术股份有限公司);KB400型生化培养箱(德国宾得公司)。
1.2样品与试剂
注射用头孢西丁钠(批号:15082831,15091831,15091931),由扬子江药业集团有限公司生产。
0.9%无菌氯化钠溶液(批号:15031541)、pH 7.0的无菌氯化钠-蛋白胨缓冲液(批号:15090141),均为自制。
β-内酰胺酶(批号:130441-201502),由中国食品药品检定研究院提供。
1.3试验用菌种(第4代)
金黄色葡萄球菌CMCC(B)26003,枯草芽孢杆菌CMCC(B)63501,大肠埃希菌CMCC(B)44102,生孢梭菌CMCC(B)64941,白色念珠菌CMCC (F)98001,黑曲霉菌 CMCC(F)98003,铜绿假单胞菌CMCC(B)10104,均来自中国工业微生物菌种保藏管理中心。
1.4培养基
沙氏葡萄糖液体培养基(批号:20150820),沙氏葡萄糖琼脂培养基(批号:20150828),胰酪大豆胨液体培养基(批号:20150916),硫乙醇酸盐流体培养基(批号:20150810),均由北京奥博星生物技术有限责任公司提供。
2 方法与结果
2.1菌液制备
分别接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至胰酪大豆胨液体培养基,30~ 35℃培养18~ 24 h;接种生孢梭菌的新鲜培养物至硫乙醇酸盐流体培养基中,30~35℃培养18~ 24 h;接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基中,20~ 25℃培养24~ 48 h。上述培养物用0.9%无菌氯化钠溶液稀释成每1 mL含菌数小于100 cfu的菌悬液;接种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂斜面培养基中,20~ 25℃培养5~ 7 d,使大量孢子产生,加入3~ 5 mL含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,吸出孢子悬液(管口带有薄的无菌棉花过滤菌丝)至灭菌试管内,用含 0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液将菌液稀释至每1 mL小于100 cfu的菌悬液,备用[5]。结果见表1。

表1 验证用菌液计数结果 (cfu)
2.2培养基的灵敏度检查
取每管 12 mL的硫乙醇酸盐流体培养基7支,分别接种小于 100 cfu的金黄色葡萄球菌、铜绿假单胞菌、生孢梭菌各2支,另1支不接种作为空白对照;取每管9 mL的胰酪大豆胨液体培养基7支,分别接种小于100 cfu的枯草芽孢杆菌、白色念珠菌、黑曲霉各2支,另1支不接种作为空白对照,培养5天。逐日观察结果,见表2。

表2 培养基灵敏度检查结果 (d)
2.3培养基的无菌性检查
取两种培养基各5瓶,置于各培养基规定的温度培养14 d,均无菌生长。判该批硫乙醇酸盐流体培养基、胰酪大豆胨液体培养基的无菌性检查符合规定。
2.4验证方法——薄膜过滤法
2.4.1操作方法用0.9%无菌氯化钠溶液50 mL润湿集菌培养器的滤膜,以发挥滤膜的最大过滤效率。将30瓶样品用0.9%无菌氯化钠溶液溶解后平行抽入集菌培养器的3支滤筒内,过滤。每张滤膜过滤量为10瓶。每只培养器的滤筒用pH 7.0无菌氯化钠-蛋白胨缓冲液(以下简称“缓冲液”)冲洗,100 mL/次,边冲洗边振摇。在最后一次冲洗液中加入1 mL小于100 cfu的试验菌过滤,将胰酪大豆胨液体培养基和硫乙醇酸盐流体培养基加至集菌培养器的滤筒内,每个滤筒内加入适量β-内酰胺酶,置规定温度培养,培养时间不得超过5天。
2.4.2预试验组选择金黄色葡萄球菌和白色念珠菌为预试验组的敏感菌株,取30瓶供试品按“2.2.1”操作步骤进行操作,每个集菌管冲洗量、加入的β-内酰胺酶量及试验结果见表3。
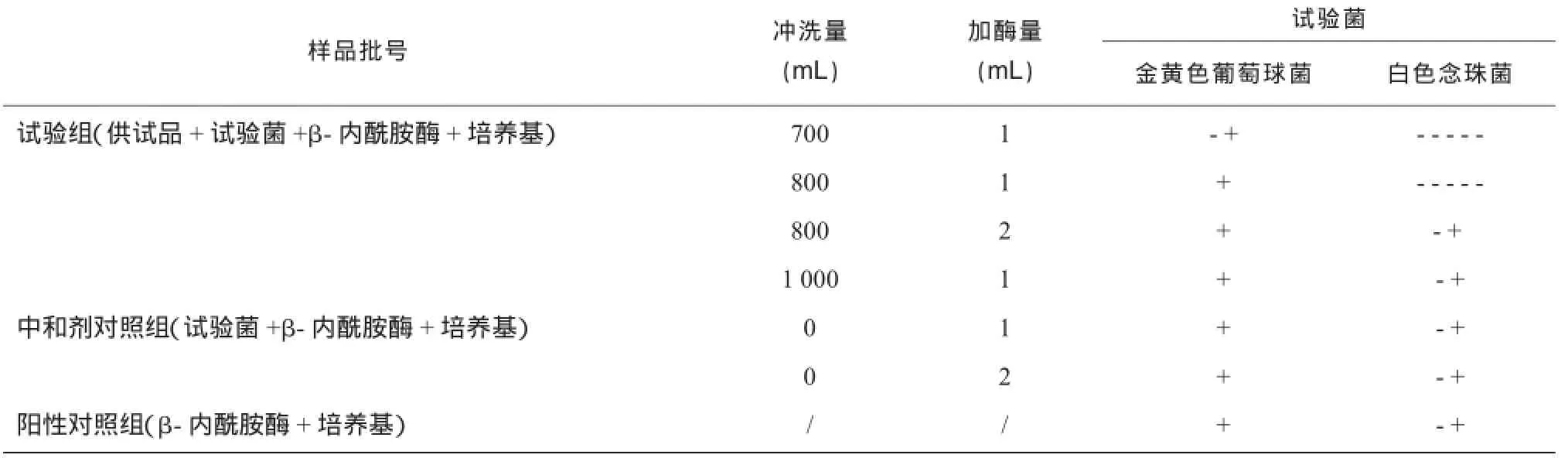
表3 预试验结果
由表3可知,当每个集菌培养器的滤筒用700,800 mL缓冲液冲洗并加1mL β-内酰胺酶进行操作时,含白色念珠菌的集菌培养器在规定时间内是不生长的;而当用每管冲800 mL缓冲液加2 mL β-内酰胺酶和每管冲1 000 mL缓冲液加1 mL β-内酰胺酶的方法进行操作时,含金黄色葡萄球菌和白色念珠菌的集菌培养器均生长良好。因此冲洗800 mL缓冲液加2 mL β-内酰胺酶和冲洗1 000 mL缓冲液加1 mL β-内酰胺酶的冲洗条件都是可行的,但考虑到冲洗量越大,越可能对滤膜造成损坏,越易造成对结果的误判,故最终选用800 mL缓冲液加2 mL β-内酰胺酶对6种试验菌进行3次平行试验。
2.4.3平行试验组1次试验取30瓶供试品按“2.2.1”操作方法进行操作,每管冲洗800 mL缓冲液,取3批不同的批号样品分别进行3次独立平行试验,并在每管最后一次冲洗液中加入1 mL小于100 cfu金黄色葡萄球菌、大肠埃希菌、生孢梭菌、枯草芽孢杆菌、白色念珠菌、黑曲霉,再向集菌培养器中加入相应的培养基100 mL及2 mL β-内酰胺酶。具体结果见表4。

表4 3批平行试验结果
由表4可知,3批平行试验中,含金黄色葡萄球菌、大肠埃希菌及生孢梭菌的集菌培养器均在24 h内生长良好,含枯草芽孢杆菌、白色念珠菌及黑曲霉菌的集菌培养器均在24~ 48 h内生长良好。结果表明,在此冲洗条件下能够消除头孢西丁钠的抑菌作用。
2.5样品的无菌检查
另取注射用头孢西丁钠30瓶按 “2.2.1”操作方法进行操作,每管用800 mL缓冲液冲洗,最后向1支含硫乙醇酸盐流体培养基的集菌培养器中加入1 mL小于100 cfu的大肠埃希菌[4-5],3支集菌培养器分别按规定温度培养14 d,每日观察,结果符合规定。
3 讨论
通过“2.4.3”和“2.5”可以看出,每管冲800 mL缓冲液加 2 mL β-内酰胺酶和每管冲 1 000 mL缓冲液加1 mL β-内酰胺酶的方法都能消除头孢西丁钠的抑菌作用,对试验结果不会造成影响。但考虑到无菌检查中冲洗量越大,对滤膜的损伤越大,故最终选用每管冲800 mL缓冲液加 2 mL β-内酰胺酶的方法用于注射用头孢西丁钠日常的无菌检查。
参考文献:
[1] 尹伟成,彭东明,周汨,等.头孢西丁钠的合成工艺改进[J].中国新药杂志,2014,23(24):2930-2932.
[2] 尹伟成,彭东明,周汨,等.头孢西丁钠的合成进展[J].精细化工中间体,2014,4(44):18-22.
[3]任冰,徐英春,谢秀丽,等.头孢西丁对210株细菌的体外抑菌活性[J].中华医院感染学杂志,1999,1(9):55-56.
[4] 张新妹,李会轻,胡昌情,等.无菌检查法中有关阳性对照菌规定的探讨[J].中国药师,2003,6(11):730-732.
[5] 国家药典委员会.中华人民共和国药典 (2015年版)四部[S].北京:中国医药科技出版社,2015:附录136-140.
◆医药快讯◆
EMA批准治疗发作性睡病药物Pitolisant上市
欧洲药品评审局(EMA)于2016年3月31日批准 Bioprojet制药公司的 Pitolisant(商品名:Wakix)片剂上市,用于治疗成人伴或不伴猝倒的发作性睡病。
Pitolisant为组胺H3受体拮抗药/反向激动药,通过阻断组胺自身受体增强脑部组胺能神经元的活性。Pitolisant还可调节多种神经递质系统,增加脑内乙酰胆碱、去甲肾上腺素、多巴胺的释放。
Pitolisant的有效性主要通过2项多中心、随机、双盲、安慰剂对照、平行组对照试验(Harmony I、Harmony CTP)确定,试验时长8周。Harmony I试验使用Epworth嗜睡量表(ESS)作为首要疗效标准评估Pitolisant对白日睡眠过多(EDS)的作用。试验结果显示,Pitolisant组ESS评分变化显著优于安慰剂组,但与莫达非尼组相比无显著差别,Pitolisant组猝倒发作频率亦较安慰剂组显著降低。Harmony CTP试验的首要疗效终末指标为试验结束时稳定治疗期4周与基线期2周相比,每周平均猝倒发作次数的变化。试验结果显示,Pitolisant组每周猝倒发作频率显著低于安慰剂组,Pitolisant组ESS评分降低亦显著优于安慰剂组。
Pitolisant最常见的不良反应为失眠、头痛、恶心、焦虑、易激惹、头晕、抑郁、震颤、睡眠障碍、疲劳、呕吐、眩晕、消化不良、体质量增加和上腹疼痛。
(来源:http://www.ema.europa.eu)
doi:10.3969/j.issn.1672-5433.2016.08.005
收稿日期:(2016-03-14)
作者简介:石晶萍,女,副高级工程师。研究方向:药品检验。通讯作者E-mail:sjp@yangzijiang.com
Suitability Test on Method for Sterility Test of Cefoxitin Sodium for Injection
Wang Lin,Shi Jingping,Huang Jiaxiu,Xie Chunjuan(Yangtze River Pharmaceutical Group Co.,Ltd.,Jiangsu Taizhou 225321,China)
ABSTRACTObjective:To establish a suitability test on method for sterility test of cefoxitin sodium for injection. Methods:According to the requirements in Chinese Pharmacopoeia(2015 edition),the method for sterility test of cefoxitin sodium for injection was validated by membrane-filter procedure.The method of the variety are established by choosing washing volumes and adding β-lactamasein sterlity test.Results:When using pH 7.0 sterile sodium chloride-peptone buffer as a washing solution,800 mL for each tube,a portion of 2 mL of β-lactamase was added into each tube,the bacteriostatic action of cefoxitin sodium can be eliminated.Conclusion:The developed method was effective and feasible,which was suitable for sterility test of cefoxitin sodium for injection.
KEY WORDSCefoxitin Sodium for Injection;Sterility Test;Method Suitability Test

