水陆生境和氮沉降对香菇草(Hydrocotylevulgaris)入侵湿地植物群落的影响
全 晗, 董必成, 刘 录, 李红丽
北京林业大学自然保护区学院, 北京 100083
水陆生境和氮沉降对香菇草(Hydrocotylevulgaris)入侵湿地植物群落的影响
全晗, 董必成, 刘录, 李红丽*
北京林业大学自然保护区学院, 北京100083
大气氮沉降对湿地外来植物入侵的影响已成为生态学研究的热点之一。选用梭鱼草(Pontederiacordata)、水菖蒲(Acoruscalamus)、黄花鸢尾(Iriswilsonii)和粉绿狐尾藻(Myriophyllumaquaticum)模拟湿地植物群落,设置有无香菇草入侵、水生和陆生生境(水位分别为15 cm和0 cm)及有无氮沉降处理(15 g N m-2a-1和0)交叉组成的8种处理组合,进行为期70d的温室控制实验,以分析水陆生境及氮沉降对香菇草入侵湿地植物群落的影响。结果表明:(1)水生生境下,香菇草的总生物量、叶生物量、叶片数和节点数与陆生生境相比显著降低;水生生境下氮沉降处理对香菇草各指标无显著影响,陆生生境下氮沉降处理的香菇草叶片数、节点数显著多于无氮沉降处理。(2)实验周期内氮沉降和香菇草入侵没有对群落的多样性指数及群落内4种湿地植物的生物量产生显著影响;水生生境下植物群落的总生物量及梭鱼草和粉绿狐尾藻的生物量与陆生生境相比显著提高。(3)水生生境下香菇草的相对优势度相比陆生生境下显著下降;氮沉降只在陆生生境下显著提高了香菇草的相对优势度。因此,香菇草向水生生境扩散和入侵的能力不强,其入侵在短时间内对湿地植物群落影响较小。研究结果可以为入侵植物生态学研究提供案例借鉴。
植物入侵;香菇草;生境;氮沉降;植物群落
外来植物入侵已成为严重的环境和社会问题,了解外来植物的入侵机制是有效控制其入侵的前提[1]。外来植物入侵的成功与否不仅取决于自身的入侵性,还取决于入侵地环境的可入侵性(Invasibility)[2]。湿地是陆地和水生生态系统之间的过渡带,极易遭受外来物种的入侵[3]。水分及养分等环境因子是决定植物分布和生长的重要因素,其单独或复合的变化都可能影响湿地植物群落结构格局和演替,并改变群落的可入侵性[4]。近年来,随着全球变化及人类活动的加剧,自然或人为原因导致的生境水位及氮沉降等环境因子的改变显著影响着外来种的入侵过程[5]。
水位是湿地生态系统形成及演化过程中的主导因子[6],水位条件的差异造成了水陆生境之间不同的溶氧量、光照强度和土壤的氧化还原状态,这些环境要素直接影响湿地植物群落的物种组成和物种多样性[7]。较低的水位更有利于外来陆生种的入侵[8],对于可以适应水生和陆生生境的外来入侵植物,水生生境可能会促进其入侵过程[9]。例如,研究表明喜旱莲子草(Alternantheraphiloxeroides)较之其本地近缘种莲子草(Alternantherasessilis)具有更强的光合能力和水淹耐受性,对水陆环境变异更敏感,具有更有效的渗透调节能力[10],这些生理特性与喜旱莲子草对不同水陆生境的广泛适应性和较强的表型可塑性有关,帮助其在不同生境中成功入侵相应植物群落[11]。
氮沉降是指大气中的含氮化合物,在降水或重力、吸附的作用下降落到地表的过程[12]。由于化石燃料及含氮化肥的大量使用,大气中的含氮化合物激增,进而导致大气氮沉降的相应增加[13]。氮元素是影响植物生长繁殖的重要营养元素[14],由于不同植物对氮元素的利用效率存在差异,氮沉降的改变可能会引起植物种间关系的变化,进而影响到整个生态系统的稳定性[15]。当氮沉降水平在一定范围内增加,植物的生物量增加、根冠比减小[16],并且可能会促进外来植物对本地植物群落的入侵[17]。而当氮沉降水平超过一定水平时,其对植物的生长及其种间关系的影响尚不明确[18]。
香菇草(Hydrocotylevulgaris)原产于欧洲、北美洲南部及中美洲地区,是一种常见于沼泽、峡谷和沙地草原的多年生草本克隆植物[19]。自然条件下,香菇草能够产生复杂的芽系统以适应资源异质性及种间竞争产生的各种微环境[20]。Miao等[21]采用外来物种入侵风险指数法对香菇草入侵我国热带、亚热带湿润区的风险进行了评估,认为香菇草入侵风险极高。繁殖体假说表明,高繁殖体压力有利于香菇草种群的建立和入侵[22],而土壤异质性并没有改变香菇草的种内竞争[20]。近年来,虽然存在有关环境因子的交互作用对影响外来植物入侵的相关研究[23-25],然而对于水陆生境及氮沉降对香菇草入侵植物群落的影响的研究尚无报道。因此,开展相关研究对于进一步理解外来植物入侵过程对环境因子交互作用的响应机制具有一定意义,同时为更好的管理香菇草这一具有高入侵风险的外来植物提供参考。
选取了自然生境条件下与香菇草伴生的4种常见湿地植物梭鱼草(Pontederiacordata)、水菖蒲(Acoruscalamus)、黄花鸢尾(Iriswilsonii)和粉绿狐尾藻(Myriophyllumaquaticum) 进行模拟试验,分析不同生境条件下,氮沉降是否有利于香菇草的生长?氮沉降是否影响香菇草入侵植物群落的能力?香菇草入侵是否影响群落中四种植物的生长?是否与氮沉降存在交互效应?通过回答以上科学问题以期为入侵植物生态学研究提供案例借鉴。
1 材料与方法
1.1实验材料
香菇草,又名南美天胡荽,原产欧洲、北美洲南部及中美洲地区,为伞形科天胡荽属多年生草本植物。可以通过节点进行无性繁殖,也可产生种子进行有性繁殖,其中无性繁殖为其最主要的扩散方式。香菇草株高10—45 cm,根茎呈发达的交错网状,或露出地面呈匍匐状,能够适应水生、湿生乃至陆生等多种生境,近年来因园林绿化及湿地造景的应用而被广泛引种[26]。
选取4种湿地植物来构建湿地植物群落,分别为:梭鱼草(Pontederiacordata),雨久花科多年生挺水或湿生草本植物,株高80—150 cm,适宜在20 cm以下的静水及水流缓慢的水域中生长[27]。水菖蒲(Acoruscalamus),为天南星科多年生挺水型草本植物,具横走粗壮而稍扁的根状茎,常生于池塘、河流、湖泊岸边的浅水处[28]。黄花鸢尾(Iriswilsonii),为鸢尾科多年生挺水型水生草本植物,植株高大,能在水畔和浅水中正常生长[29]。粉绿狐尾藻(Myriophyllumaquaticum),为小二仙草科多年生挺水或沉水草本植物,株高约10—20 cm,茎呈半蔓性,能匍匐湿地生长[30]。这四种湿地植物均为常见多年生的克隆植物,并在杭州西溪湿地中能够与香菇草共存。
1.2材料采集与实验设计
实验中采用的香菇草于2012年5月10日采集自杭州西溪湿地公园,之后放置在北京林业大学林业科技股份有限公司的温室中进行培养。4种湿地群落植物幼苗于2012年6月中旬自花卉市场购买。
2012年6月23日,从4种湿地群落植物中各选出144个长势相似的植株幼苗,香菇草选取96个大小相似并带有节点和叶各一个的茎段进行实验。分别将梭鱼草、水菖蒲、黄花鸢尾和绿狐尾藻按照每种植物各3株定植在48个实验容器中(图1),实验容器的长宽高分别为37、37、40 cm。实验容器内为河沙与河岸土以4∶1体积比混合而成的基质,深度为18 cm左右。河岸土采自北京翠湖湿地河岸,其有机质含量为(14.00±1.00) g/kg、总氮含量为(0.80±0.004) g/kg,总磷含量为(6.70±0.04) g/kg (平均值±标准误差,n=3,下同)。河沙的有机质、总氮和总磷含量分别为(1.40±0.07) mg/g,(0.065±0.003) mg/g、(0.64±0.02) mg/g。
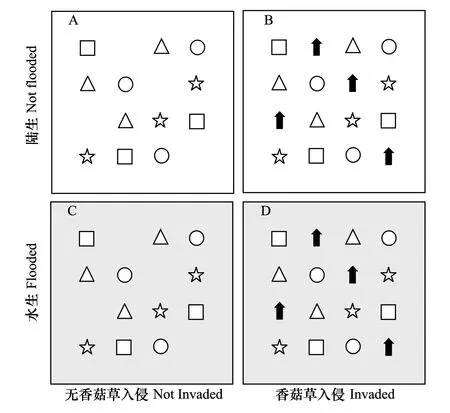
图1 实验设计图Fig.1 Experimental design 每个实验容器中种植4种湿地植物各3株(每种空心的标志代表一种植物),并进行香菇草(黑色箭头)入侵处理和生境处理:无香菇草入侵-陆生(A),香菇草入侵-陆生(B),无香菇草入侵-水生(C),香菇草入侵-水生(D);以上处理与两种氮沉降处理(无氮沉降0 g m-2a-1,氮沉降5g m-2a-1)交叉组合,共8种处理
实验采用三因素实验设计,包括有无香菇草入侵(2个水平)、模拟水陆生境(2个水平)及有无氮沉降(2个水平)3个因素,共8个处理,每个处理设置6个重复,完全随机排列。两个入侵水平分别为有4株香菇草的入侵处理和无香菇草定植的无入侵处理,其中入侵处理中香菇草的定植格局如图1所示,无入侵处理则在相应位置保留空位。模拟水陆生境两个水位水平,其中水生生境,保持15 cm水位,而陆地生境无积水,水位为0 cm。模拟氮沉降为每周喷洒200 mL浓度为5 g/L的NH4NO3溶液的氮沉降处理,相当于施加的氮总量相当于15 g m-2a-1,而无氮沉降处理为每周喷洒200 mL去离子水。
实验于7月1日开始,于9月10日收获。实验期间,每周向容器内补充一定量的自来水以保持水位和土壤湿润。实验过程中温室日均温度为25℃,平均湿度为74.2%。
1.3数据收集
实验收获时测量并统计每个容器内香菇草的叶片数、叶柄长和节点数,扫描香菇草叶片照片并使用WinFOLIA(Pro2004a, Regent Instruments, Québec, Canada)阔叶分析系统计算叶面积;同时收获每个容器内4种湿地植物。之后,将收获的各部分植物材料清洗,放置在70℃烘箱内烘干72 h,测定生物量。
群落的总生物量为4种湿地植物的生物量之和,计算群落基于生物量的Shannon-Winner多样性指数。多样性指数计算公式如下:
式中,S是群落的物种总数,此处物种总数为4,Pi是物种i的生物量与群落总生物量的比值。
计算香菇草的相对优势度指数(RDI),计算公式如下:
式中,A表示香菇草入侵处理中的香菇草生物量,B表示对应的4种群落植物的总生物量[31]。
1.4数据分析
采用双因素方差分析(Two-way ANOVA)检验水陆生境、氮沉降及两者交互作用对香菇草各生长形态指标和相对优势度指数的影响(表1)。采用三因素方差分析(Three-way ANOVA)检验香菇草入侵、水陆生境和氮沉降以及实验处理之间的交互作用对植物群落总生物量、多样性指数和4种植物生物量的影响(表2)。再分别对各处理中的指标进行单因素方差分析(One-way ANOVA),然后采用Duncan法进行多重比较。在进行方差分析前, 对数据进行正态性检验和方差齐性检验(Levene′s test),所有数据均满足正态分布和方差齐性。所有数据分析均在统计学软件SPSS 19.0中完成。
2 结果
2.1水陆生境和氮沉降对香菇草生长繁殖的影响
水陆生境对香菇草生物量、叶生物量、叶片数及节点数有显著影响,而对其它生长繁殖指标无显著影响;氮沉降对香菇草所有生长指标无显著影响;除节点数和叶片数外,两者的交互作用对其余生长繁殖指标均无显著影响(表1)。陆生生境下,氮沉降显著增加了香菇草的叶片数及节点数(表1,图2),对其它生长指标无显著影响(图2)。

表1 水陆生境和氮沉降处理对香菇草生长繁殖指标及相对优势度的ANOVA分析Table 1 ANOVAs for effects of flooded and nitrogen deposition on growth, morphology and RDI ofH.vulgaris
所有效应的自由度均为(1,20);显著水平:***P< 0.001;**P< 0.01;*P< 0.05;nsP≥ 0.05

图2 水陆生境和氮沉降处理下香菇草的各项生长繁殖指标 (平均值±标准误)Fig.2 The growth and reproduction traits of H. vulgaris under the treatments of habitat type and nitrogen deposition (mean±SE)*代表交互作用显著,不同的字母代表处理之间差异显著(P < 0.05)
2.2香菇草入侵、水陆生境及氮沉降对湿地植物群落的影响
水生生境中群落的总生物量显著高于陆生生境,香菇草入侵、氮沉降及各因素交互作用对群落生物量、多样性指数无显著效应(表2,图3)。
水生生境中的梭鱼草和粉绿狐尾藻的生物量显著高于陆生生境(表2,图4)。氮沉降对黄花鸢尾的影响取决于水陆生境 (表2)。水生生境下,氮沉降处理的黄花鸢尾的生物量显著低于无氮沉降处理(图4)。除此之外,香菇草入侵、水陆生境、氮沉降及各因素的交互作用对四种湿地植物生物量均无显著影响(表2)。

表2 香菇草入侵、水陆生境和氮沉降对3个群落指标及群落内四种植物生物量的ANOVA分析Table 2 ANOVAs for effects ofH.vulgaris, flooded and nitrogen deposition on total dry biomass, diversity, evenness of artificial wetland communities, and total dry biomass of each four species

图3 香菇草入侵、水陆生境和氮沉降处理下湿地植物群落指标 (平均值±标准误)Fig.3 Indicators of mass of wetland communities under the treatment of H. vulgaris, habitat type and nitrogen depsition (mean±SE)

图4 香菇草入侵、水陆生境和氮沉降处理下4种湿地植物的生物量 (平均值±标准误)Fig.4 Total biomass of each four wetland plants under the treatment of H. vulgaris, habitat type and nitrogen depsition (mean±SE)
2.3水陆生境和氮沉降处理对香菇草相对优势度的影响
陆生生境中香菇草的相对优势度指数显著高于水生生境。氮沉降对相对优势度的影响取决于水陆生境和氮沉降水平,只有在陆生生境中,氮沉降才会提高香菇草的相对优势度(表1,图5)。

图5 水陆生境、氮沉降处理下香菇草的相对优势度指数 (平均值±标准误)Fig.5 The relative dominance index of H. vulgaris under the treatment of habitat type and nitrogen depsition (mean±SE)
3 讨论
3.1水陆生境和氮沉降处理对香菇草生长繁殖的影响
自然状态下的香菇草能适应水陆生境,本实验中水生生境条件下香菇草生物量、叶片数及节点数等生长繁殖指标均显著小于陆生生境条件(图2,表1),表明香菇草虽然对生境的水位条件具有一定的可塑性,相对水生生境,不积水的湿生环境更利于其生长繁殖,这与以前的研究结果是一致的[32]。香菇草虽然可以通过改变叶片表皮气孔大小及上、下表皮细胞厚度等形态特征来适应生境变化,但是在水生生境中,水位增加使香菇草遭受一定程度的水淹胁迫。由于水淹环境中溶解氧的总量和扩散速率较低,植物的呼吸作用受到抑制,有害代谢物的积累和潜在有害气体的富集也会对植物器官造成损害[33]。缺氧还会抑制植物碳水化合物的合成和其他溶质物质向细胞内的主动运输,进而导致细胞渗透势的升高,抑制植物生长[34-35]。许建平等的研究发现,水淹处理使喜旱莲子草的叶片数和叶片厚度迅速减少,却增加了喜旱莲子草的节间数[36],这与本实验的结果有一定的差异,可能主要是由于不同种类的植物对水淹胁迫的响应存在差异所致。
氮沉降在一定程度上会促进植物的生长发育,进而改变物种间的竞争关系[15,37]。研究表明,在富营养化处理下香菇草生物量显著提高[38],而本实验中氮沉降对香菇草的各项指标没有产生显著影响(表1),这可能是由实验处理条件不同所导致。Persson等的研究表明[39],氮素对植物生长的促进作用存在一个临界值,超过这一临界值时氮沉降可能会抑制植物的生长。过量的氮沉降会导致土壤中铵离子增加,影响植物对Ca、Mg、K的吸收,引起营养失衡并进而降低植物的光合效率[40]。可能本实验设计的浓度在这一临界值附近,而且水生生境一定程度上缓解或消除了氮沉降的作用,进而导致氮沉降处理效果微弱。
水陆生境和氮沉降对香菇草的叶片数和节点数存在显著的交互作用(表1),陆生条件下,氮沉降处理显著增加了香菇草的叶片数和节点数,而在水生生境中,氮沉降对以上两项指标却没有产生显著效应(图2)。水生生境条件下,水淹环境和氮的耦合作用对湿地植物的生物量和生长速率都有不同程度的影响[6]。周江明等的研究发现[41],淹水条件下高氮肥水稻田产量增幅显著低于低氮肥水稻田;翟晶等发现高氮处理下淹水灌溉的水稻叶片丙二醛(MDA)含量达到4—4.5 μmol/g,超过湿润灌溉处理下3—3.5 μmol/g的含量[42]。丙二醛可对多种酶和膜系统造成严重损伤,是植物组织衰老的重要标志[43]。较高的水位与氮沉降协同作用下引起的香菇草组织损伤与衰老,可能是本实验中水生生境下氮沉降没有产生显著效应的原因。
3.2香菇草入侵、生境处理及氮沉降对湿地植物群落的影响
香菇草入侵对群落的总生物量、多样性指数,以及4种群落植物各自的生物量均没有显著影响(表 2)。入侵植物往往通过排挤本地土著种形成高密度的单优群落,然而在入侵植物定居初期,其对本地植物群落的影响可能并不明显[44]。此外杨琴琴等研究发现[45],香菇草叶水浸提取液对萝卜(Raphanussativus)、黄瓜(Cucumissativus) 和白菜(Brassicachinensis)等3种植物种子的萌发具有显著抑制作用。由于本实验选用的群落植物个体均为萌发后的幼苗,且4种植物幼苗个体相对较大。这可能是在实验期间(2个多月)内没有观察到香菇草对入侵地湿地植物群落的影响的原因。
水生生境中群落的生物量显著高于陆生生境,而对群落的多样性指数没有显著效应(表2,图3),表明本群落更适应水生生境条件。不同湿地植物对水陆生境具有不同的响应机理,水陆生境直接影响湿地植物群落的生物量[46]。对比群落中4种植物的生物量发现,水生生境处理下梭鱼草和粉绿狐尾藻的总生物量显著升高(表2,图4),这是导致水生生境中群落总生物量显著增加的主要原因。
氮沉降对群落的总生物量、多样性指数,以及4种群落植物各自的生物量均没有显著影响(表2)。然而对于黄花鸢尾,水生生境处理和氮沉降处理表现出一定的交互作用,水生条件下施氮处理使黄花鸢尾的生物量明显下降(表2,图4)。不同的物种对于水体中的氮素吸收能力存在差异,以往研究表明梭鱼草和粉绿狐尾藻吸收利用水体中氮的能力较强[27],而黄花鸢尾和水菖蒲对水体中氮的吸收能力有限[47],水体中过高的氮素含量可能抑制了黄花鸢尾的生长。
3.3生境和氮沉降处理对香菇草相对优势度的影响
水生生境处理下香菇草的相对优势度降低,表明水生处理下香菇草的竞争力相对较低(表1,图5)。主要是由于香菇草更适宜湿生生境,而在水生生境中其长势下降。对于一些外来入侵植物,其入侵性与生境具有一定的相关性[48-49],如芦苇在北美地区的入侵[50],相对水生,湿生环境更有利于芦苇定居和扩散,进而更有利于其入侵。
本实验周期内氮沉降没有对相对优势度产生显著影响,然而水位与氮沉降对相对优势度存在显著的交互作用。氮沉降在陆生生境下提高了香菇草的优势度,而在水生生境下没有显著效应(表1,图5)。这种变化与生境处理和氮沉降对香菇草的作用是一致的(表1,图2)。具有入侵性的克隆植物往往比本地植物具有更高的资源利用效率[37],氮沉降对陆生生态系统中优势种种间竞争力的影响更为显著和普遍[51]。然而,本实验中香菇草的优势度较低,其入侵在短期内对4种植物组成的群落的生物量、多样性指数并没有任何显著效应(表2)。入侵植物的优势度存在较高的时间异质性,例如,以一年蓬(Erigeronannuus)为代表的菊科植物对草坪的入侵,其优势度在一年半的时间内明显增大[52];而对美国蒙大拿州矢车菊(Centaureacyanus)入侵严重的草原生态系统观察发现,在起初3a里矢车菊具有很高的种群密度,然而在接下来的12a里其优势度大幅下降,生物量减少达93%[53]。有关时间-空间尺度的交互条件下香菇草的入侵机制和对湿地生态系统的影响有待深入研究。
[1]刘建, 李钧敏, 余华, 何维明, 于飞海, 桑卫国, 刘国方, 董鸣. 植物功能性状与外来植物入侵. 生物多样性, 2010, 18(6): 569-576.
[2]何锦峰. 外来植物入侵机制研究进展与展望. 应用与环境生物学报, 2008, 14(6): 863-870.
[3]李洪远, 孟伟庆. 湿地中的植物入侵及湿地植物的入侵性. 生态学杂志, 2006, 25(5): 577-580.
[4]Mack R N. Temperate grasslands vulnerable to plant invasions: characteristics and consequences // Drake J A, Mooney H. A, Castri F D, Groves R H, Kruger F J, Rejmánek M, Williamson M, eds. Biological Invasions: a Global Perspective. Chichester, England: Wiley, 1989: 155-179.
[5]高增祥, 季荣, 徐汝梅, 谢宝瑜, 李典谟. 外来种入侵的过程、机理和预测. 生态学报, 2003, 23(3): 559-570.
[6]徐治国, 何岩, 闫百兴, 任慧敏. 营养物及水位变化对湿地植物的影响. 生态学杂志, 2006, 25(1): 87-92.
[8]Catford J A, Downes B J, Gippel C J, Vesk P A. Flow regulation reduces native plant cover and facilitates exotic invasion in riparian wetlands. Journal of Applied Ecology, 2011, 48(2): 432-442.
[9]Casanova M T, Brock M A. How do depth, duration and frequency of flooding influence the establishment of wetland plant communities? Plant Ecology, 2000, 147(2): 237-250.
[10]高乐旋. 不同水陆生境下入侵种喜旱莲子草与土著种莲子草表型变异和细胞渗透势调节能力的比较研究. 植物科学学报, 2015, 33(2): 195-202.
[11]Chen Y, Zhou Y, Yin T F, Liu C X, Luo F L. The invasive wetland plantAlternantheraphiloxeroidesshows a higher tolerance to waterlogging than its native congenerAlternantherasessilis. PLoS One, 2013, 8(11): e81456.
[12]樊后保, 黄玉梓, 裘秀群, 王强, 陈秋凤, 刘文飞, 徐雷. 模拟氮沉降对杉木人工林凋落物氮素含量及归还量的影响. 江西农业大学学报, 2007, 29(1): 43-47.
[13]Holland E A, Dentener F J, Braswell B H, Sulzman J M. Contemporary and pre-industrial global reactive nitrogen budgets // Townsend A R ed. New Perspectives on Nitrogen Cycling in the Temperate and Tropical Americas. Netherlands: Springer, 1999: 7-43.
[14]Bozzolo F H, Lipson D A. Differential responses of native and exotic coastal sage scrub plant species to N additions and the soil microbial community. Plant and Soil, 2013, 371(1): 37-51.
[15]吕超群, 田汉勤, 黄耀. 陆地生态系统氮沉降增加的生态效应. 植物生态学报, 2007, 31(2): 205-218.
[16]Meziane D, Shipley B. Interacting components of interspecific relative growth rate: constancy and change under differing conditions of light and nutrient supply. Functional Ecology, 1999, 13(5): 611-622.
[17]Burke M J W, Grime J P. An experimental study of plant community invasibility. Ecology, 1996, 77(3): 776-790.
[18]Nordin A, Strengbom J, Witzell J, Näsholm T, Ericson L. Nitrogen deposition and the biodiversity of boreal forests: implications for the nitrogen critical load. AMBIO: A Journal of the Human Environment, 2005, 34(1): 20-24.
[19]Dong M. Morphological responses to local light conditions in clonal herbs from contrasting habitats, and their modification due to physiological integration. Oecologia, 1995, 101(3): 282-288.
[20]Dong B C, Wang J Z, Liu R H, Zhang M X, Yu F H. Effects of heterogeneous competitor distribution and ramet aggregation on the growth and size structure of a clonal plant. PLoS One, 2013, 8(7): e68557.
[21]Miao L H, Ji M C, Wang Y Y, Qiao D D, Chen Y C. Study on invasion risk ofHydrocotylevulgarisas an alien species in wetlands. Journal of Zhejiang University: Agriculture and Life Sciences, 2011, 37(4): 425-431.
[22]Liu R H, Chen Q W, Dong B C, Yu F H. Effects of vegetative propagule pressure on the establishment of an introduced clonal plant,Hydrocotylevulgaris. Scientific Reports, 2014, 4: 5507.
[23]Johnson D J, Flory S L, Shelton A, Huebner C, Clay k. Interactive effects of a non-native invasive grassMicrostegiumvimineumand herbivore exclusion on experimental tree regeneration under differing forest management. Journal of Applied Ecology, 2015, 52(1): 210-219.
[24]Prevéy J S, Seastedt T R. Seasonality of precipitation interacts with exotic species to alter composition and phenology of a semi-arid grassland. Journal of Ecology, 2014, 102(6): 1549-1561.
[25]Zhang D Y, Jiang X H. Interactive effects of habitat productivity and herbivore pressure on the evolution of anti-herbivore defense in invasive plant populations. Journal of Theoretical Biology, 2006, 242(4): 935-940.
[26]周根余, 蒋雄龙, 贺名蓉. 香菇草的快速繁殖. 上海师范大学学报: 自然科学版, 1995, 24(2): 105-106.
[27]余红兵, 杨知建, 肖润林, 张树楠, 刘锋, 向佐湘, 单武雄. 梭鱼草(Pontederiacordata)拦截沟渠中氮、磷的效果研究. 农业现代化研究, 2012, 33(4): 508-512.
[28]易春, 艾伟霞. 浅谈石菖蒲、水菖蒲、九节菖蒲的鉴别. 北方药学, 2012, 9(8): 104-104.
[29]马牧源, 王兰, 孙红文. 黄花鸢尾对富营养化水体净化的试验研究. 农业环境科学学报, 2006, 25(2): 448-452.
[30]伍华雯. 固定化微生物联合粉绿狐尾藻(Myriophyllumaquaticum)净化养殖废水的研究[D]. 宁波: 宁波大学, 2013.
[31]朱文泉, 何兴元, 陈玮, 陈云浩, 张粤, 宁祝华. 城市森林结构的量化研究——以沈阳树木园森林群落为例. 应用生态学报, 2003, 14(12): 2090-2094.
[32]杨琴琴. 入侵植物香菇草(Hydrocotylevulgaris)对水分的表型可塑性研究及其演变预测[D]. 杭州: 浙江农林大学, 2013.
[33]Visser E J W, Blom C W P M, Voesenek L A C J. Flooding-induced adventitious rooting inRumex: morphology and development in an ecological perspective. Acta Botanica Neerlandica, 1996, 45(1): 17-28.
[34]Jackson M B, Armstrong W. Formation of aerenchyma and the processes of plant ventilation in relation to soil flooding and submergence. Plant Biology, 1999, 1(3): 274-287.
[35]Voesenek L A C J, Colmer T D, Pierik R, Millenaar F F, Peeters J. How plants cope with complete submergence. New Phytologist, 2006, 170(2): 213-226.
[36]许建平, 张小萍, 曾波, 袁慎鸿, 刘建辉, 刘明智. 完全水淹环境中光照和溶氧对喜旱莲子草表型可塑性的影响. 生态学报, 2014, 34(2): 258-268.
[37]Li H L, Ning L, Alpert P, Li J M, Yu F H. Responses to simulated nitrogen deposition in invasive and native or non-invasive clonal plants in China. Plant Ecology, 2014, 215(12): 1483-1492.
[38]金树权, 周金波, 朱晓丽, 姚永如, 蔡国成, 陈若霞. 10种水生植物的氮磷吸收和水质净化能力比较研究. 农业环境科学学报, 2010, 29(8): 1571-1575.
[39]Persson H, Ahlström K, Clemensson-Lindell A. Nitrogen addition and removal at Gårdsjön—effects on fine-root growth and fine-root chemistry. Forest Ecology and Management, 1998, 101(1/3): 199-205.
[40]McNulty S G, Aber J D, Newman S D. Nitrogen saturation in a high elevation New England spruce-fir stand. Forest Ecology and Management, 1996, 84(1/3): 109-121.
[41]周江明, 姜家彪, 姜新有, 詹丽钏. 不同肥力稻田晚稻水氮耦合效应研究. 植物营养与肥料学报, 2008, 14(1): 28-35.
[42]翟晶. 水肥互作对水稻生长、产量及品质的影响[D]. 武汉: 华中农业大学, 2009.
[43]Yamaguchi J, Tanaka A. An image processing method to measure plant root traits. Soil Science and Plant Nutrition, 1990, 36(2): 337-343.
[44]吴昊, 丁建清. 入侵生态学最新研究动态. 科学通报, 2014, 59(6): 438-448.
[45]杨琴琴, 缪丽华, 洪春桃, 王媛, 季梦成. 香菇草水浸提液对3种植物种子萌发和幼苗生长的化感效应. 浙江农林大学学报, 2013, 30(3): 354-358.
[46]Keddy P A, Constabel P. Germination of ten shoreline plants in relation to seed size, soil particle size and water level: an experimental study. Journal of Ecology, 1986, 74(1): 133-141.
[47]徐德福, 徐建民, 王华胜, 罗安程, 谢丹超, 应求实. 湿地植物对富营养化水体中氮、磷吸收能力研究. 植物营养与肥料学报, 2005, 11(5): 597-601.
[48]Deiller A F, Walter J M N, Trémolières M. Effects of flood interruption on species richness, diversity and floristic composition of woody regeneration in the upper Rhine alluvial hardwood forest. Regulated Rivers: Research & Management, 2001, 17(4/5): 393-405.
[49]Décamps H, Planty-Tabacchi A M, Tabacchi E. Changes in the hydrological regime and invasions by plant species along riparian systems of the Adour River, France. Regulated Rivers: Research & Management, 1995, 11(1): 23-33.
[50]Hudon C, Gagnon P, Jean M. Hydrological factors controlling the spread of common reed (Phragmitesaustralis) in the St. Lawrence River (Québec, Canada). Ecoscience, 2005, 12(3): 347-357.
[51]Field C D, Dise N B, Payne R J, Britton A J, Emmett B A, Helliwell R C, Hughes S, Jones L, Lees S, Leake J R, Leith I D, Phoenix G K, Power S A, Sheppard L J, Southon G E, Stevens C J, Caporn S J M. The role of nitrogen deposition in widespread plant community change across semi-natural habitats. Ecosystems, 2014, 17(5): 864-877.
[52]肖宋高, 李娟, 张卓文, 王文恩, 吴笛. 草坪杂草入侵及其竞争效应. 草业科学, 2009, 26(1): 111-118.
[53]Rinella M J, Mangold J M, Espeland E K, Sheley R L, Jacobs J S. Long-term population dynamics of seeded plants in invaded grasslands. Ecological Applications, 2012, 22(4): 1320-1329.
The effects of habitat type and nitrogen deposition on the invasion ofHydrocotylevulgarisin wetland plant communities
QUAN Han, DONG Bicheng, LIU Lu, LI Hongli*
SchoolofNatureConservation,BeijingForestryUniversity,Beijing100083,China
Biological invasions can have strong negative impacts on native biodiversity and ecosystem functions. Water level and nitrogen deposition are important factors that can affect plant invasions in wetlands.Hydrocotylevulgarisof the Apiaceae family is a perennial herb introduced to China that can be established and multiplied rapidly in a variety of habitats. Although it is considered highly invasive, few studies have tested the effects of habitat and nitrogen deposition on invasion byH.vulgaris. We designed a greenhouse experiment to test the following hypotheses: nitrogen deposition promotes invasion byH.vulgarisin both flooded and unflooded habitats; and invasion byH.vulgarisaffects the growth of native plants in both flooded and unflooded habitats. Four perennial, herbaceous species were selected to measure the competitive effect ofH.vulgarisin wetland communities:Pontederiacordata,Acoruscalamus,Iriswilsonii, andMyriophyllumaquaticum. These are among the most common species that co-exist withH.vulgarisin the XiXi National Wetlands Park. We assessed two levels of invasion byH.vulgaris(present or absent) with two levels of flooding (water levels of 0 cm [not flooded] and 15 cm [flooded]) and two levels of nitrogen deposition (0 and 15 g N/m2as NH4NO3). We measured the stem length, leaf area, numbers of leaves and nodes, and relative dominance ofH.vulgaris; and the biomass and diversity of the other four plant species. Compared to the non-flooded treatment, the total mass, leaf mass, numbers of leaves and nodes, and relative dominance ofH.vulgariswere significantly lower in the flooded treatment. Nitrogen deposition significantly increased the numbers of leaves and nodes in the unflooded treatment. Total mass of the other plant species combined and ofP.cordataandM.aquaticumindividually were significantly greater in flooded than in unflooded treatments. Neither nitrogen deposition nor the presence ofH.vulgarisaffected the biomass or diversity of the other four plant species. These results suggest that invasion byH.vulgarismight not exert significant adverse effects on native wetland plant communities in the short term and that flooding might decrease invasion byH.vulgaris. Control of the water level might also be a helpful measure to controlH.vulgarisinvasion in wetlands.
biological invasion;Hydrocotylevulgaris; habitat type; nitrogen deposition; plant community
10.5846/stxb201506241284
国家自然科学基金项目(31200313, 31470475);北京市大学生科学研究与创业行动计划项目(S201510022099)
2015-06-24; 网络出版日期:2016-03-17
Corresponding author.E-mail: lihongli327@163.com
全晗, 董必成, 刘录, 李红丽.水陆生境和氮沉降对香菇草(Hydrocotylevulgaris)入侵湿地植物群落的影响.生态学报,2016,36(13):4045-4054.
Quan H, Dong B C, Liu L, Li H L.The effects of habitat type and nitrogen deposition on the invasion ofHydrocotylevulgarisin wetland plant communities.Acta Ecologica Sinica,2016,36(13):4045-4054.

