木犀草素对肥大细胞脱颗粒影响及机制的研究
余 洁 骆晓蓉
(重庆三峡中心医院妇儿分院儿内一科,万州404000)
木犀草素对肥大细胞脱颗粒影响及机制的研究
余洁骆晓蓉①
(重庆三峡中心医院妇儿分院儿内一科,万州404000)
目的:探讨木犀草素(Luteolin)的抗I型变态反应的作用机制。方法:通过建立DNP-BSA-IgE激发致敏的大鼠RBL-2H3细胞模型,分别采用MTT法检测不同浓度(5、15、25 μmol/L)Luteolin对RBL-2H3肥大细胞活性的影响;ELISA法检测不同浓度Luteolin对RBL-2H3细胞分泌β-hexosa minidase(β-HEX)及细胞因子TNF-α影响;Flou-4AM荧光探针检测细胞内Ca2+浓度变化;Western blot检测AKT,P-AKT的表达。结果:成功建立致敏的细胞模型,低浓度的Luteolin对RBL-2H3细胞活性无明显影响;不同浓度Luteolin刺激RBL-2H3细胞后,对β-HEX和TNF-α的释放抑制作用呈线性相关,且细胞内Ca2+明显减少;Western blot结果显示随着Luteolin浓度的增加AKT磷酸化水平明显下降。结论:Luteolin呈剂量依赖性抑制RBL-2H3肥大细胞脱颗粒,且通过调节细胞内Ca2+浓度与AKT活性参与其中。
木犀草素;肥大细胞;脱颗粒;Ⅰ型变态反应;过敏性鼻炎与支气管哮喘
过敏性鼻炎与支气管哮喘是儿童常见的慢性炎症性疾病,均属于Ⅰ型超敏反应性疾病,两者组成一个疾病的统一体,在流行病学、免疫病理生理等方面有密切联系,常以相互影响的方式并存于同一患儿,严重影响患者及其家庭的生活质量[1-3]。研究发现过敏性鼻炎与支气管哮喘患者都存在肥大细胞的活化以及嗜酸性粒细胞的浸润[4,5]。
肥大细胞活化脱颗粒是Ⅰ型超敏反应过程中的关键步骤,抑制肥大细胞活化脱颗粒可以有效的降低炎症反应的强度,进而抑制过敏性哮喘反应[6],因而近年来治疗Ⅰ型超敏反应疾病的药物主要围绕抑制肥大细胞脱颗粒而产生。Luteolin是存在于多种植物中的天然黄酮类化合物,具有抗菌,抗病毒,抗肿瘤,抗过敏等多种药理活性[7],本研究通过在体外构建DNP-BSA-IgE激发致敏的大鼠RBL-2H3细胞模型,通过不同浓度的Luteolin作用于RBL-2H3细胞,观察其对肥大细胞活化脱颗粒的影响并探讨其可能机制,为治疗儿童过敏性鼻炎及支气管哮喘药物的开发提供新的思路。
1 材料与方法
1.1主要材料DNP-BSA,MTT,anti-DNP IgE购自美国Sigma公司;Luteolin,P-AKT购自美国Santa Cruz公司;大鼠β-hexosa minidase和 TNFα ELISA检测试剂盒购自上海碧云天生物技术有限公司;Flou-4AM Ca2+荧光探针购自美国Invitrogen公司;一抗AKT,一抗β-actin购自美国Bioworld公司。
1.2方法
1.2.1细胞培养大鼠嗜碱性粒细胞性白血病细胞RBL-2H3细胞购自中国科学院上海细胞库,采用由含15%胎牛血清,1%双抗(100 U/ml青霉素和100 μg/ml链霉素)的MEM培养基,于37℃、5%CO2培养箱中培养,2~3 d传代一次,取对数生长期细胞用于后续实验。实验分组为:Blank组(正常细胞),Control组(致敏模型细胞未加药处理),Luteolin(5、15、25 μmol/L)浓度处理组。
1.2.2MTT法取对数生长期RBL-2H3细胞,血球计数板计数,以每孔2×104/100 μl浓度接种于96孔板中,5% CO2,37℃ 培养过夜,吸去培养基后PBS清洗,分别加入无血清培养基稀释的不同浓度(5、15、25 μmol/L)的Luteolin于孵箱中培养24 h后,吸去培养基,并每孔加入10 μl MTT和 90 μl无血清培养基,37℃孵育4 h后,加入100 μl DMSO于酶标仪上570 nm处检测各组OD值。
1.2.3ELISA法检测β-HEX和TNFα的释放消化收集2×105个/ ml细胞量,接种于24孔细胞培养板过夜,加入anti-DNP IgE 0.3 μg/ml培养箱中孵育过夜使其致敏后,Tyrode′ s buffer 清洗2~3次,将Luteolin按5、15、25 μmol/L浓度溶于Tyrode′ s buffer,5%CO2,37℃孵育30 min后,加入DNP-BSA(30 μg/ml) 40 μl继续孵育1.5 h活化肥大细胞,冰浴10 min终止反应。β-HEX及TNFα释放率的检测步骤按照ELISA试剂盒说明书操作。按以下公式计算样品的β-HEX释放率(%):β-HEX(%)=(上清样品酶活性A 值-空白对照上清酶活性A 值)/(总酶活性A 值)×100%。
1.2.4Ca2+influx assay消化收集2×105个/ml细胞量,接种于24孔细胞培养板过夜,加入anti-DNP IgE 0.3 μg/ml培养箱中孵育过夜使其致敏后,Tyrode′s buffer 清洗2~3次,加入含有Fluo-4AM(5 μmol/L)孵育30 min后,清洗细胞并加入不同浓度(5、15、25 μmol/L)的Luteolin孵育5%CO2,37℃孵育30 min后,再次清洗后加入40 μl DNP-BSA(30 μg/ml),孵育1.5 h后,使用荧光显微镜观察并计算平均荧光强度。
1.2.5Western blot 将anti-DNP IgE致敏的RBL-2H3细胞,5%CO2,37℃孵育过夜后,加入不同浓度的Luteolin作用30 min,洗净并加入DNP-BSA(30 μg/ml)40 μl孵育1.5 h后,收集细胞提取蛋白,采用BCA法测蛋白浓度,取50 μg/孔蛋白样品上样,经SDS-PAGE电泳后,将目的蛋白转移到PVDF膜上,在5%脱脂奶粉或BSA-TBST于室温封闭2 h,分别加入一抗(AKT、P-AKT、β-actin)4℃过夜后,TBST清洗3次并分别与相应HRP标记的二抗杂交2 h,ECL化学发光并显影。
2 结果
2.1对RBL-2H3细胞活性的影响MTT结果显示,Luteolin在5、15、25 μmol/L 浓度作用于RBL-2H3细胞24 h后,对细胞的活性无明显影响,(P>0.05,表1)差异无统计学意义。
2.2对RBL-2H3细胞活化脱颗粒释放β-HEX及TNF-α影响
2.2.1Luteolin抑制RBL-2H3细胞活化脱颗粒释放β-HEX实验结果显示Luteolin在5、15、25 μmol/L浓度作用RBL-2H3细胞时,β-HEX的释放率明显减少,分别为[(54.75 ± 2.04)%,(34.59 ± 3.24)%,(23.19 ± 3.03)%],且随着浓度的增加,β-HEX的释放率呈剂量依赖性明显减少,如图1所示,差异均有统计学意义(P<0.05,P<0.01)。
2.2.2Luteolin抑制RBL-2H3细胞活化脱颗粒释放TNF-α如图2所示,随着Luteolin浓度的增加,TNF-α的释放浓度与模型Control组相比显著减少,且呈剂量依赖性,差异均有统计学意义(P<0.05)。
2.3对RBL-2H3细胞内Ca2+影响如图3所示,与模型Control组相比,Luteolin浓度梯度组中Ca2+荧光强度明显减弱,提示Luteolin可有效抑制细胞外Ca2+的摄入。
2.4对RBL-2H3细胞内AKT、P-AKT表达的影响Western blot结果条带光密度分析显示,Luteolin浓度梯度组与Control组相比,P-AKT蛋白的表达量随着浓度的增加逐渐减少(图4),提示Luteolin可能通过降低AKT活性,进而抑制肥大细胞RBL-2H3脱颗粒的发生。
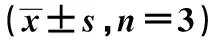
表1 不同浓度Luteolin对肥大细胞RBL-2H3细胞活力的影响Tab.1 Effect of cell viability at different concentrations of Luteolin pretreated RBL-2H3 ±s,n=3)
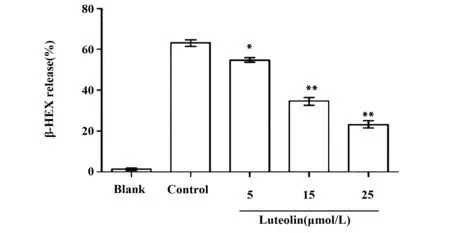
图1 ELISA检测不同浓度Luteolin对RBL-2H3细胞释放β-HEX的影响Fig.1 Effect of different concentration on β-HEX release was detected by ELISA assayNote: *.P<0.05,**.P<0.01,compare with control group.
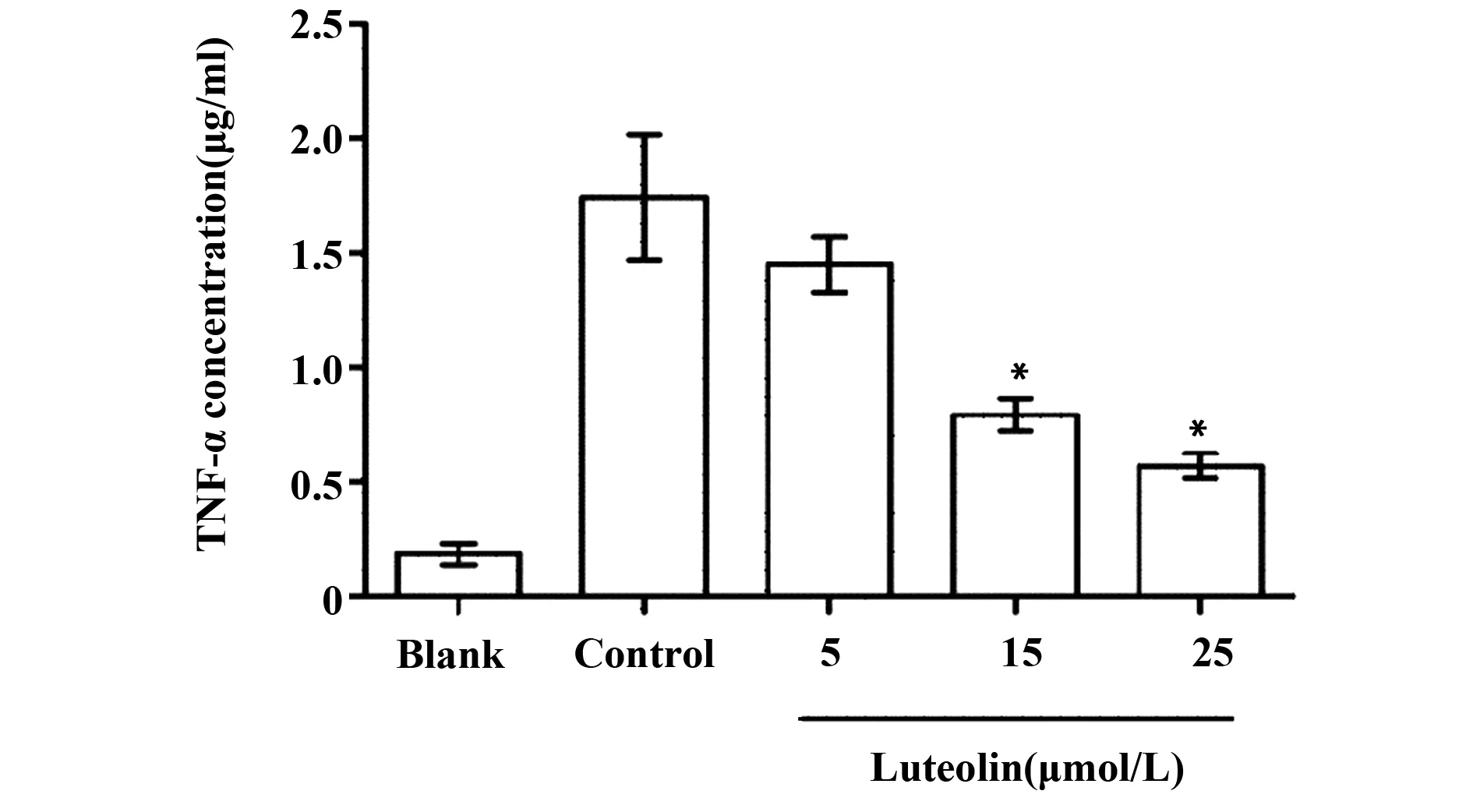
图2 ELISA检测不同浓度Luteolin对RBL-2H3细胞释放TNF-α的影响Fig.2 Effect of different concentration on TNF-α release was detected by ELISA assayNote: *.P<0.05,compare with control group.
3 讨论
肥大细胞是Ⅰ型超敏反应性炎症的主要启动细胞,特异性抗原通过与肥大细胞膜表面高特异性受体(FcεRI)结合,使之发生交联,进而启动活化信号,诱导肥大细胞脱颗粒并释放组胺、β-HEX、白三烯,TNF-α等多种生物活性介质,这些介质通过作用上皮、内皮、神经、平滑肌细胞等进而引起多种症状和综合征的发生[8,9]。大鼠RBL-2H3细胞是常用的研究Ⅰ型超敏反应机制的重要细胞模型,本研究通过在体外构建DNP-BSA-IgE激发致敏的大鼠RBL-2H3细胞模型,进而探讨Luteolin对肥大细胞活化脱颗粒的影响,研究发现通过不同浓度的Luteolin作用致敏的肥大细胞后,随着Luteolin浓度的增高,β-HEX的释放率明显减少,且呈剂量依赖性。β-HEX是肥大细胞脱颗粒的重要指标,参与糖蛋白、糖脂、氨基多糖的降解[10]。提示Luteolin可有效抑制肥大细胞的活化脱颗粒,在对细胞因子TNF-α的检测结果进一步验证了这一现象。
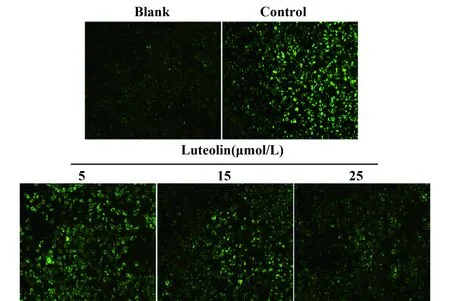
图3 Fluo-4AM检测不同浓度Luteolin对RBL-2H3细胞内Ca2+的影响Fig.3 Effect of intracellular Ca2+ was detected by fluo-4AM when pretreated with different concentration of Luteolin in RBL-2H3 cells

图4 Western blot检测不同浓度Luteolin对RBL-2H3细胞P-AKT和AKT蛋白表达的影响Fig.4 Expression of P-AKT and AKT levels were detected by Western blot when pretreated with different concentration of Luteolin in RBL-2H3 cells
近几年通过对肥大细胞活化脱颗粒现象机制的研究发现,FcεRI交联导致细胞内Lyn、Fyn 和Syk蛋白酪氨酸激酶活化,形成肥大细胞脱颗粒的启始信号,进而引起Ca2+/CaM、DAG/PKC,Rho GTPase三条主要信号转导途径的级联反应,促进肥大细胞脱颗粒的发生[11]。Ca2+参与了细胞内众多的生理生化反应,肥大细胞脱颗粒现象的发生依赖于细胞内Ca2+浓度的增加,研究发现当胞浆内Ca2+浓度升高时,Ca2+与CaM结合引起CaM构型发生改变,继而激活CaM蛋白激酶,CaM蛋白激酶可激活微管蛋白、肌球蛋白轻链参与囊泡的转运及定向[12],进而促进生物活性因子的释放。在本研究中,通过Flou-4AM Ca2++荧光探针检测Luteolin作用于肥大细胞后细胞内的Ca2+浓度明显减低,提示Luteolin可能通过影响细胞内Ca2+浓度变化进而抑制肥大细胞活化脱颗粒的发生。PI3K是细胞内重要的信号转导分子,其介导的AKT信号途径的激活可引起肥大细胞脱颗粒释放组胺、IL6等多种炎性细胞因子[13]。本研究通过Western blot检测Luteolin刺激肥大细胞后,AKT及P-AKT蛋白的表达,发现随着Luteolin浓度的增加,P-AKT蛋白表达呈剂量依赖性减少,提示Luteolin可通过抑制AKT活性,进而阻断细胞内PI3K/AKT信号途径,进一步说明Luteolin可能通过阻断PI3K/AKT信号途径抑制RBL-2H3肥大细胞活化脱颗粒。
综上所述,Luteolin呈剂量依赖性抑制RBL-2H3肥大细胞脱颗粒,其可能通过影响细胞内Ca2+浓度与AKT活性参与其中,而其具体的作用机制,有待于我们进一步的研究,本实验为Luteolin可能作为一种治疗药物用于Ⅰ型超敏反应引起的过敏性鼻炎及支气管哮喘提供一定的实验依据。
[1]Sih T,Mion O.Allergic rhinitis in the child and associated comorbidities [J].Pediatr Allergy Immunol,2010,21(1 Pt 2):e107-113.
[2]Mehta P.Allergic rhinitis and bronchial asthma [J].J Assoc Physicians India,2014,62(3 Suppl):23-26.
[3]Srivastava D,Arora N,Singh BP.Current immunological approaches for management of allergic rhinitis and bronchial asthma [J].Inflamm Res,2009,58(9):523-536.
[4]王菲,陈若希,程雷.儿童过敏性鼻炎与支气管哮喘 [J].中华临床免疫和变态反应杂志,2011,5(2):120-123.
[5]Irvin CG.The nose:a window into the asthmatic lung [J].Clin Exp Allergy,2010,40(6):839-840.
[6]Je IG,Shin TY,Kim SH.Mosla punctulata inhibits mast cell-mediated allergic reactions through the inhibition of histamine release and inflammatory cytokine production [J].Indian J Pharm Sci,2013,75(6):664-671.
[7]Nabavi SF,Braidy N,Gortzi O,etal.Luteolin as an anti-inflammatory and neuroprotective agent:A brief review [J].Brain Res Bull,2015,119(Pt A):1-11.
[8]Lopes-Ferreira M,Gomes EM,Bruni FM,etal.First report of interruption of mast cell degranulation and endothelial cells activation by anti-inflammatory drugs controlling the acute response provoked by Pseudoplatystoma fasciatum fish venom [J].Toxicon,2014,90:237-248.
[9]Nakagome K,Nagata M.Pathogenesis of airway inflammation in bronchial asthma [J].Auris Nasus Larynx,2011,38(5):555-563.
[10]Fukuishi N,Murakami S,Ohno A,etal.Does β-hexosa minidase function only as a degranulation indicator in mast cells? The primary role of β-hexosa minidase in mast cell granules [J].J Immunol,2014,193(4):1886-1894.
[11]Yasunaga S,Nishi K,Nishimoto S,etal.Methoxychlor enhances degranulation of murine mast cells by regulating FcεRI-mediated signal transduction [J].J Immunotoxicol,2015,12(3):28-29.
[12]Yang C,Mo X,Lv J,etal.Lipopolysaccharide enhances FcεRI-mediated mast cell degranulation by increasing Ca2+entry through store-operated Ca2+channels:implications for lipopolysaccharide exacerbating allergic asthma [J].Exp Physiol,2012,97(12):1315-1327.
[13]Hochdörfer T,Kuhny M,Zorn CN,etal.Activation of the PI3K pathway increases TLR-induced TNF-α and IL-6 but reduces IL-1β production in mast cells [J].Cell Signal,2011,23(5):866-875.
[收稿2015-11-02修回2015-11-17]
(编辑许四平)
·消息·
《中国免疫学杂志》被国际著名检索机构收录通知
根据国际检索机构给中国科学技术期刊编辑学会国际交流工作委员会、中国高校科技期刊研究会对外联络委员会发来的电子邮件及其附件统计整理,《中国免疫学杂志》被以下八种国际重要检索系统列为来源期刊:
1)美国《化学文摘(网络版)》(CA);
2)美国《剑桥科学文摘(自然科学)》(CSA(NS),Cambridge Scientific Abstracts(Natural Science));
3)波兰《哥白尼索引》(IC, Index of Copurnicus);
4)《日本科学技术振兴机构(中国文献数据库)》(JST, Japan Science & Technology Agency(Chinese Bibliographic Database));
5)美国《乌利希期刊指南(网络版)》(UPD,Ulrich's Periodicals Directory);
6)英国《国际农业与生物科学研究中心》(CABI,Centre for Agriculture and Bioscience International);
7)WHO西太平洋地区医学索引(Western Pacific Region Index Medicus,WPRIM);
8)英国《公共健康研究数据库》(Global Health)。
《中国免疫学杂志》编辑部
Effect of Luteolin on mast cell degranulation and its mechanism of action
YU Jie,LUO Xiao-Rong.Department of Internal Medicine,Women and Children′s Hospital of Chongqing Three Gorges Central Hospital,Wanzhou 404000,China
Objective:To investigate the effect of Luteolin on the degranulation function of RBL-2H3 mast cells and its mechanism of action.Methods: DNP-BSA-IgE was used to establish the sensitized cell model in RBL-2H3 cells.Cell viability was exa mined by MTT assay at different concentrations(5,15,25 μmol/L)of Luteolin pretreated RBL-2H3 cells.The effect of Luteolin on β-hexosa minidase(β-hex)and TNF-α was evaluated by ELISA.The change of Ca2+influx was detected by Flou-4AM calcium ion fluorescent probe.The expression of AKT and P-AKT were detected by Western blot.Results: The sensitized cell model was established successfully.Cell viability had not significantly changes stimulated by different concentrations of Luteolin,and a significantly inhibition role showed the release of β-hex and TNF-α from RBL-2H3 cells.The concentration of intracellular Ca2+was significantly decreased.However,the Western blot results showed that the level of Phosphorylation AKT was decreased.Conclusion: Luteolin suppress RBL-2H3 cell degranulation in dose dependence,which may via impacting the Ca2+influx and the activity of AKT.
Luteolin;Mast cell;Degranulation;Ⅰ type allergic reaction;Allergic rhinitis and Bronchial asthma
10.3969/j.issn.1000-484X.2016.08.015
R725.6R915文献标志码A
1000-484X(2016)08-1153-04
①,E-mail:xrl12@sina.com。
余洁(1980年-),女,硕士,主治医师, 主要从事儿童呼吸系统疾病临床及研究,E-mail:yujiewfp@126.com。

