TIPE家族生物活性及作用研究进展
张 丽 陈有海 谢伟东
(山东大学附属千佛山医院检验科,济南250014)
·专家述评·
TIPE家族生物活性及作用研究进展
张丽陈有海①②谢伟东②③
(山东大学附属千佛山医院检验科,济南250014)
①美国宾夕法尼亚大学医学院病理和实验医学系,费城19104。
③清华大学深圳研究生院健康科学与技术重点实验室,深圳518055。
TIPE (Tumor necrosis factor-alpha-induced protein 8-like )家族是新近报道的免疫和肿瘤调节因子。该家族拥有四个高度同源的成员:TNFAIP8 (Tumor necrosis factor-α-induced protein 8), TIPE1 (TNFAIP8L1), TIPE2 (TNFAIP8L2)和TIPE3 (TNFAIP8L3)。它们虽然结构相似,但在组织、器官上的表达不同,在生物学功能及疾病中的作用存在较大的差别。TNFAIP8具有抑制细菌感染与促肿瘤迁移的作用;TIPE2是一种免疫和炎症负调控因子,可抑制某些肿瘤的生长;TIPE1可诱导细胞凋亡具有抑瘤效应;TIPE3可特异性结合磷脂第二信使,促进肿瘤生成。随着研究的深入,TIPE家族在多种疾病的发生发展过程中表现出重要的调控作用,然而其具体生物活性与分子机制有待进一步的研究。
肿瘤坏死因子α诱导的蛋白8;肿瘤坏死因子α诱导的蛋白8类似1;肿瘤坏死因子α诱导的蛋白8类似2;肿瘤坏死因子α诱导的蛋白8类似3;炎症;肿瘤

张丽(1974年-),山东大学附属千佛山医院检验科,副主任检验师。2013年入选山东省千佛山医院第二批优秀中青年人才。2011年毕业于山东大学医学院,获免疫学博士学位。2015年2月至2016年2月,作为访问学者,在美国宾夕法尼亚大学医学院,从事免疫学研究工作。主要研究方向为肿瘤免疫和临床免疫。发表SCI论文3篇。承担山东省自然基金课题1项,作为主要成员参加国家自然基金课题2项,973计划前期研究专项课题1项。

陈有海(1963年-),国际著名免疫学家,美国宾夕法尼亚大学终身正教授、中国科学院深圳先进技术研究院首席科学家。1986年毕业于山东大学医学院,获医学硕士学位;1993年于加拿大马尼托巴大学免疫学系获医学博士学位;1993~1995年于美国哈佛大学医学院免疫学专业从事博士后研究;1995年起于美国宾夕法尼亚大学任职。陈有海教授主要从事炎症与癌症的发生机制与治疗方法的研究,在Science、Nature、Cell等国际顶尖学术期刊上发表学术论文100余篇,并担任Journal of Immunology、Science等多个国际权威杂志编辑及审稿人,同时兼任美国神经硬化协会科学委员会主席,中国科技部973基金项目评审专家、 美国科学进步协会会员、纽约科学院成员、美国免疫学家协会会员、美国基因治疗学会免疫学委员会委员、美国国立卫生院科学评审中心委员、加拿大免疫学会会员,以及奥地利科学基金会、爱尔兰卫生研究委员会、英国癌症研究协会委员及基金评审专家等。

谢伟东(1974年-),清华大学深圳研究生院,副教授、硕士生导师。2005年毕业于北京协和医学院,获生药学博士学位; 2005年于清华大学深圳研究生院从事博士后研究工作,2007年出站后留校,先后任讲师、副教授至今,主要从事药理学研究工作; 2014年12月至2015年12月受国家留学基金委资助,在美国宾夕法尼亚大学医学院从事访学研究。目前以第一作者或通讯作者身份发表SCI论文28篇,授权专利3项,主要研究方向:糖尿病与炎症生物学基础研究及创新药物研发。
TIPE[Tumor necrosis factor (TNF)-alpha-induced protein 8-like]家族是新确认的一组蛋白,包括4个家族成员:TNFAIP8 (Tumor necrosis factor-α-induced protein 8),TIPE1 (TNFAIP8-like 1,or TNFAIP8L1),TIPE2 (TNFAIP8L2)和TIPE3 (TNFAIP8L3),家族成员之间具有高度同源的序列,具有不同于其他蛋白的独特结构,代表一类新的蛋白家族。但TIPE家族不同成员之间,存在细微的蛋白序列差异,且在机体组织中存在表达差异,使它们在机体中表现出不同的生物学功能和作用。以下我们将对TIPE家族的近几年来生物学功能、以及在疾病中的作用研究进展,做以下综述。
1 TNFAIP8 家族成员的结构生物学特征
肿瘤坏死因子-α诱导的蛋白8(Tumor necrosis factor-α-induced protein8,TNFAIP8)也称为SCC-S2,GG2-1和MDC-3.13,是TNFAIP8家族最早被发现的成员。Patel首次报道,TNFAIP8表达在一例人头颈部鳞状细胞癌(Head and neck squamous cell carcinoma,HNSCC)患者及来自该患者的转移性细胞系[1]。
Carmody等[2]利用基因芯片的方法,检测小鼠在发展为自身免疫性脑脊髓炎 (Experimental autoimmune encephalomyelitis,EAE) 前后脊髓中基因表达谱的变化,141个新基因在正常脊髓中不表达,但在发生炎症的脊髓中表达。其中一个基因与TNFAIP8序列具有高度同源性,命名为TIPE2(Tumor necrosis factor-α-induced protein 8-like 2)。根据预测的开放阅读框,TIPE2编码184个氨基酸。人类TIPE2与小鼠TIPE2氨基酸有94%序列同源性,人类TIPE2与TNFAIP8大约有53%一致性/78%相似性。推测TNFAIP8家族至少含有4个成员,TIPE(TNFAIP8),TIPE1(TNFAIP8L1),TIPE2(TNFAIP8L2)和TIPE3(TNFAIP8L3),不同成员之间有高度保守的序列同源性。TIPE2在人类定位于1号染色体(1q21.2-1q21.3),小鼠定位于3号染色体(3f1-3f3)。
TIPE家族成员均含有高度保守的TH域(TIPE homology domain),由7个α螺旋组成[3]。高分辨率晶体结构显示,人TIPE2由六个反向平行的a螺旋组成,具有与死亡受体结构域(DED)类似的结构,但在拓扑学上与caspase8和cFLIP经典的DED成镜像关系,提示TIPE2的功能可能不同于其他的DED蛋白(图1A、B)。人TIPE2中央有一个巨大的疏水性空腔,推测可能作为协同分子的结合位点,对于维持免疫平衡起重要作用[3]。高分辨率晶体结构显示,TIPE3同样含有一个疏水性的巨大空腔(图1C、D),该空腔被磷脂类分子占据,TIPE3优先捕获两类脂质第二信使:磷脂酰肌醇4,5-二磷酸(Phosphatidylinositol 4,5-bisphosphate)和磷酸肌醇-3,4,5三磷酸(Phosphatidylinositol 3,4,5-trisphosphate),能够提高在细胞膜的表达水平[4]。
小鼠中,TIPE家族成员,均能够与磷脂酰肌醇结合,TIPE2也参与调节磷酸肌醇3,4,5 -三磷酸信号途径,但是TH域的功能可能受其他因子调控。如TIPE3含有独特的19个氨基酸序列的N-末端,命名为NT区 (图2),TIPE3 NT区与其他家族成员不同,该区可能与TIPE3促进细胞的生长和增殖有关[4]。因此,尽管TIPE3和TIPE2具有高度同源的TH域,但他们似乎执行不同的功能。如TIPE2能够与Rac1和Rgl/RalGDS 分子相互作用[5-7],从而起到抑癌作用;而TIPE3没有发现这种相互作用。因此,TIPE家族成员,可能由于氨基酸序列和分子机构的细微差异而发挥不同的作用。
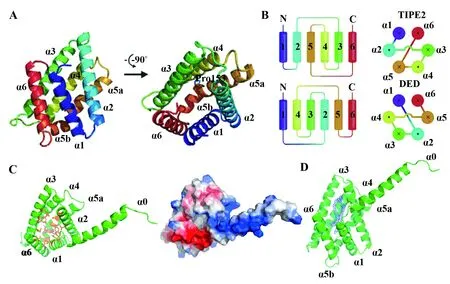
图1 TIPE家族结构生物学研究Fig.1 Biological structure characteristis of TIPE familyNote: A.Crystal structure of human TIPE2;B.Topology structure of TIPE2 (above) and DED (below);C.Crystal structure of the human TIPE3 (The left is shown in a green cartoon representation;amino acids with hydrophobic side chains that line the cavity are shown in orange.The right is eletrostatic surface:blue with positive;red with negative.);D.TH-domain of human TIPE3 (The two long connected tubes of 2Fo-Fc electron density found in TIPE3 cavity is shown in blue mesh).
2 TIPE 与炎症和肿瘤
2.1TNFAIP8与炎症TNFAIP8在正常组织广泛表达,在淋巴和胎盘组织中高表达。TNFAIP8基因敲除小鼠,在正常生理情况下,与野生型小鼠比较,主要器官包括淋巴组织和肠道在内,均没有出现明显的变化;但在化学诱导结肠炎模型时,敏感性增加,表现为体重减轻,白细胞和细菌入侵增加,炎症因子生成增多,动物存活减少[8]。TNFAIP8基因缺失小鼠,肠道上皮细胞增殖明显抑制,肠道修复可能出现障碍,表现为炎性反应增加。因此,TNFAIP8可发挥抗炎效应,是肠道炎症的保护性蛋白。但TNFAIP8敲除的小鼠,能够抵抗Listeria菌的感染,降低肝脏和脾脏的细菌数量。TNFAIP8能从胞浆转位到胞膜,抑制Rac1活性,而TNFAIP8的缺失可以导致Rac1的激活而发挥抗菌效应[9]。因此,TNFAIP8在细菌感染及炎症性疾病起重要的调节作用。
2.2TNFAIP8与肿瘤TNFAIP8最初是通过Northern blot和mRNA差异显示方法,对两株原发性和转移性头及颈部鳞状细胞癌(Head and neck squamous cell carcinoma,HNSCC)细胞系进行比较而被发现的,是一个癌基因蛋白和细胞凋亡的调节因子。TNFAIP8 能抑制Caspase诱导的细胞凋亡[10]。TNFAIP8在胰腺癌患者的胰腺组织,乳腺癌组织,肺癌组织均出现高表达[11-13]。乳腺癌细胞过表达TNFAIP8能显著促进细胞增殖、细胞迁移与肿瘤生长,这暗示TNFAIP8可能在肿瘤发生发展过程中起促癌的作用。然而,关于TNFAIP8在肿瘤生长调控方面的机制仍不是很清楚。

图2 小鼠TIPE家族蛋白序列比对图Fig.2 Protein sequence alignments of mouse TIPE family
3 TIPE2与炎症和肿瘤
3.1TIPE2与炎症不论是小鼠还是人类,TIPE2在免疫细胞及免疫器官如单核细胞、中性粒细胞、淋巴细胞,胸腺和淋巴结均丰富表达[14-16]。人TIPE2除表达于免疫细胞外,尚表达于多种非免疫组织和器官,如复层鳞状上皮细胞、肝细胞、生精上皮细胞和变移上皮细胞等,TIPE2表达具有组织和器官特异性[16]。
研究发现在慢性炎症性疾病中,如人类系统性红斑狼疮患者和乙型肝炎病毒感染导致的肝炎,外周血单个核细胞TIPE2 mRNA的表达显著降低,并且与病情进展有关[17]。与健康人比较,糖尿病肾病患者肾小球TIPE2蛋白表达显著增加[18]。因此TIPE2可能参与机体病理进程,在疾病发生发展过程中起重要的作用。
越来越多的研究表明,TIPE2在炎症性疾病中发挥重要的调控作用。TIPE2是一种先天免疫的负调控因子[14]。敲除TIPE2将削弱对免疫系统的抑制,减少炎性结肠炎小鼠模型细菌入侵及抑制炎性因子的生成[19]。TIPE2高表达可以抑制Rac1,抑制免疫细胞吞噬与呼吸爆发,从而加重细菌感染[6]。TIPE2 抑制NOD2诱导的MAPK和NF-κB 的激活,同时减少炎症的发生,起保护心肌缺血再灌注损伤作用[20]。TIPE2表达减少将引起单核细胞对TLR配体的过度反应[21]。
3.2TIPE2与肿瘤TIPE2在调控肿瘤生长方面起十分重要的作用,主要发挥抑癌效应。在人原发性肝细胞肝癌患者中,TIPE2在肿瘤组织中呈弱阳性/缺失表达,而在癌旁标本呈强阳性表达[7]。TIPE2表达减少可促进小细胞肺癌的增殖[22],TIPE2通过上调p27抑制胃癌细胞的增殖[23],TIPE2可通过ERK1/2通路抑制肝癌细胞的转移[24],另外TIPE2能够与内源性Rac1结合并抑制其活化,TIPE2通过Rac1信号通路抑制肝癌的侵袭和迁移[7]。
Ras基因是第一个被鉴定的人类癌基因,对细胞的存活、增殖和迁移具有重要调节作用。研究发现TIPE2能够与RalGEFs的C端相结合,该部位含有与Ras相互作用的域(Ras interacting domain:RID),活化的Ras与RalGEFs的RID部位相结合,进一步促进鸟嘌呤核苷酸交换因子(GEF)的活性。TIPE2也能与RalGEFs的RID区相结合,当TIPE2与RGL的RID区相结合时,Ras则不能与RGL的RID部位结合,因此TIPE2参与Ras-RalGDS/RalGEFs-Ral信号通路的调节,从而抑制Ras作用,起到抑癌基因作用,TIPE2通过Ras影响细胞的存活、增殖和迁移功能。
4 TIPE3与肿瘤
在大部分的组织器官中,TIPE3均有表达,如:胃、肺脏、前列腺、肾脏和脑组织,且TIPE3表达在人类和小鼠几乎一致。TIPE3蛋白表达主要限于上皮起源的特定细胞,特别是具有腺体结构的上皮组织,如消化道上皮细胞、乳腺导管上皮细胞和内分泌腺,包括肾近端小管、肾上腺皮质激素分泌细胞,胰腺胰岛,胃壁细胞等。TIPE3蛋白表达在阳性细胞的胞浆,优先表达在具有分泌功能的上皮来源细胞。TIPE3蛋白在人类大多数肿瘤细胞中表达,包括U-87 MG、U251、K-562、A549、HGC-27、ECC-1和人肝癌细胞系BEL-7402[25]。
人类超过一半的癌症有异常上调的磷脂酰肌醇信号。但在肿瘤发生过程中,磷脂酰肌醇信号如何调控尚不完全清楚。TIPE3 是第二信使磷脂酰肌醇的转移蛋白,从而促进肿瘤发生。高分辨率的晶体结构显示,TIPE3含有疏水性的巨大空腔,该空腔被磷脂类分子占据,TIPE3优先捕获两类脂质第二信使:磷脂酰肌醇4,5-二磷酸和磷酸肌醇3,4,5 -三磷酸,能够提高这些磷脂信号分子在细胞膜的表达水平,激活PI3K-AKT通路。在人部分肿瘤组织样本,TIPE3表达明显上调。TIPE3敲除能够抑制肿瘤发生;TIPE3过表达促进肿瘤生长。
5 TIPE1与肿瘤
Cui等[26]对TIPE1在小鼠和人类部分细胞系的表达进行研究,发现TIPE1在体内广泛表达,表达在生殖细胞、肌肉组织、多种上皮来源的细胞,在成熟的T、B淋巴细胞均不表达,但TIPE1 mRNA在人源B细胞系HMy2.CIR细胞和鼠源T细胞系EL4细胞均表达。TIPE1 mRNA在部分人源和鼠源肿瘤细胞系表达,如HEK-293、HeLa、MOVAS、RAW264.7和J774A.1等,提示TIPE1与肿瘤的发生可能有关[26]。
Pei等[27]利用生物信息学相关网络及软件,对TIPE1结构进行预测,在哺乳动物,氨基酸序列保守;人TIPE1无信号肽、无跨膜结构域。TIPE1是一种稳定蛋白质,预测与FBXW5和caspase8等分子相互作用。微阵列分析表明TIPE1可能与心脏代谢失调与糖尿病有关[28]。Hitomi等[29]利用全基因组小干扰RNA(siRNA)数据库,筛选大量参与程序性细胞死亡的基因,明确TIPE1为坏死性凋亡的调节因子,进一步证明TIPE1能够调节L929细胞或NIH3T3细胞程序性坏死和凋亡。

图3 TIPE家族组织表达、生物学功能及作用靶点关系示意图Fig.3 Histological expressions,biological functions and molecular targets of TIPE family
TIPE1蛋白在人肝细胞肝癌(HCC)癌组织中表达下调,与患者病理分级及预后相关。体内、体外试验显示:TIPE1能够抑制肝癌细胞的生长。TIPE1通过抑制Rac1的活性及其下游p65和C-Jun N端激酶途径,诱导细胞凋亡,而发挥抑癌作用[30]。
6 小结
通过以上综述,我们发现TIPE家族活性主要表现为免疫炎症与肿瘤调控方面(图3)。在免疫炎症调节方面,TNFAIP8 和TIPE2研究较为详尽,然而TIPE1和TIPE3的研究较少。TNFAIP8 和TIPE2 在淋巴样组织均高表达,发挥相似的免疫抑制作用,从而可能介导相关免疫、炎症及感染性疾病的发生。在肿瘤调控方面,TIPE1 和TIPE2主要发挥抑癌效应,而TNFAIP8 与TIPE3则具有促癌作用。尽管TNFAIP8 和TIPE2有相似的免疫抑制作用,但在肿瘤调控方面却显示相反的作用。因此,不同的TIPE家族成员具有不同的生物活性。这种生物活性的差异可能与其本身结构的细微差异、不同的分子靶点以及在机体组织中的不同表达有关。随着研究的深入,TIPE家族在其他疾病的发生发展中也表现出一定的调控作用,然而具体生物活性与分子机制有待进一步的研究。
[1]Patel S,Wang FH,Whiteside TL,etal.Identification of seven differential displayed transcripts in human primary and matched metastatic head and neck squamous cell carcinoma cell lines:implications in metastasis and/or radiation response[J].Oral Oncol,1997,33(3):197-203.
[2]Carmody R,Hilliard B,Chodosh L,etal.Genomic scale profiling of autoimmune inflammation in the central nervous system:the nervous response to inflammation[J].J Neuroimmunol,2002,133(1-2):95-107.
[3]Zhang X,Wang J,Fan C,etal.Crystal structure of TIPE2 provides insights into immune homeostasis[J].Nat Struct Mol Biol,2009,16(1):89-90.
[4]Svetlana A,Fayngerts,Wu JP,etal.TIPE3 is the transfer protein of lipid second messengers that promote cancer[J].Cancer Cell,2014,26(4):465-478.
[5]Gus-Brautbar Y,Johnson D,Zhang L,etal.The anti-inflammatory TIPE2 is an inhibitor of the oncogenic Ras[J].Mol Cell,2012,45(5):610-618.
[6]Wang Z,Fayngerts S,Wang P,etal.TIPE2 protein serves as a negative regulator of phagocytosis and oxidative burst during infection[J].Proc Natl Acad Sci,2012,109(38):15413-15418.
[7]Cao XL,Zhang L,Shi YY,etal.Human tumor necrosis factor (TNF)-alpha-induced protein 8-like 2 suppresses hepatocellular carcinoma metastasis through inhibiting Rac1[J].Molecular Cancer,2013,12(1):149-159.
[8]Sun H,Lou Y,Porturas T,etal.Exacerbated experimental colitis in TNFAIP8-deficient mice[J].J Immunol,2015,194(12):5736-5742.
[9]Porturas TP,Sun H,Buchlis G,etal.Crucial roles of TNFAIP8 protein in regulating apoptosis and Listeria infection[J].J Immunol,2015,194(12):5743-5750.
[10]Kumar D,Whiteside TL,Kasid U.Identification of a novel tumor necrosis factor-alpha-inducible gene,SCC-S2,containing the consensus sequence of a death effector domain of fas-associated death domain-like interleukin- 1beta-converting enzyme-inhibitory protein[J].J Biol Chem,2000,275(4):2973-2978.
[11]Liu K,Qin CK,Wang ZY,etal.Expression of tumor necrosis factor-alpha-induced protein 8 in pancreas tissues and its correlation with epithelial growth factor receptor levels[J].Asian Pac J Cancer Prev,2012,13(3):847-850.
[12]Kumar D,Gokhale P,Broustas C,etal.Expression of SCC-S2,an antiapoptotic molecule,correlates with enhanced proliferation and tumorigenicity of MDA-MB 435 cells[J].Oncogene,2004,23(2):612-616.
[13]Dong QZ,Zhao Y,Liu Y,etal.Over expression of SCC-S2 correlates with lymph node metastasis and poor prognosis in patients with non-small-cell lung cancer[J].Cancer Sci,2010,101(6):1562-1569.
[14]Sun H,Gong S,Carmody RJ,etal.TIPE2,a negative regulator of innate and adaptive immunity that maintains immune homeostasis[J].Cell,2008,133(3):415-426.
[15]Zhang G,Hao C,Xi W,etal.Tissue-specific expression of TIPE2 provides insights into its function[J].Mol Immunol,2010,47(15):2435-2442.
[16]Zhang L,Shi Y,Wang Y,etal.The unique expression profile of human TIPE2 suggests new functions beyond its role in immune regulation[J].Mol Immunol,2011,48(9-10):1209-1215.
[17]Xi W,Hu Y,Liu Y,etal.Roles of TIPE2 in hepatitis B virus-induced hepatic inflammation in humans and mice[J].Mol Immunol,2011,48(9-10):1203-1208.
[18]Zhang S,Zhang Y,Wei X,etal.Expression and regulation of a novel identified TNFAIP8 family is associated with diabetic nephropathy[J].Biochim Biophys Acta,2010,1802(11):1078-1086.
[19]Lou Y,Sun H,Morrissey S,etal.Critical roles of TIPE2 protein in murine experimental colitis[J].J Immunol,2014,193(3):1064-1070.
[20]Zhang H,Zhu T,Liu W,etal.TIPE2 acts as a negative regulator linking NOD2 and inflammatory responses in myocardial ischemia/reperfusion injury[J].J Mol Med (Berl),2015,93(9):1033-1043.
[21]Qin B,Wei T,Wang L,etal.Decreased expression of TIPE2 contributes to the hyperreactivity of monocyte to TLR ligands in primary biliary cirrhosis[J].J Gastroenterol Hepatol,2016,31(6):1177-1183.
[22]Li Y,Li X,Liu G,etal.Downregulated TIPE2 is associated with poor prognosis and promotes cell proliferation in non-small cell lung cancer[J].Biochem Biophys Res Commun,2015,457(1):43-49.
[23]Zhao Q,Zhao M,Dong T,etal.Tumor necrosis factor-α-induced protein-8 like-2 (TIPE2) upregulates p27 to decrease gastric cancer cell proliferation[J].J Cell Biochem,2015,116(6):1121-1129.
[24]Zhang YH,Yan HQ,Wang F,etal.TIPE2 inhibits TNF-α-induced hepatocellular carcinoma cell metastasis via Erk1/2 downregulation and NF-κB activation[J].Int J Oncol,2015,46(1):254-264.
[25]Cui J,Hao CY,Zhang WQ,etal.Identical expression profiling of human and murine TIPE3 protein reveals links to its functions[J].J Histochem Cytochem,2015,63(3):206-216.
[26]Cui J,Zhang G,Hao C,etal.The expression of TIPE1 in murine tissues and human cell lines[J].Mol Immunol,2011,48(12-13):1548-1555.
[27]Shen P,Zhang H,Su ZL,etal.In silico analysis of tumor necrosis factor α-induced protein 8-like-1 (TIPE1) protein[J].PLoS One,2015,10(7):e0134114.
[28]Wilson KD,Li Z,Wagner R,etal.Transcriptome alteration in the diabetic heart by rosiglitazone:implications for cardiovascular mortality[J].PLoS One,2008,3(7):e2609.
[29]Hitomi J,Christofferson DE,Ng A,etal.Identification of a molecular signaling network that regulates a cellular necrotic cell death pathway[J].Cell,2008,135(7):1311-1323.
[30]Zhang Z,Liang X,Gao L,etal.TIPE1 induces apoptosis by negatively regulating Rac1 activation in hepatocellular carcinoma cells[J].Oncogene,2015,34(20):2566-2574.
[收稿2016-04-13]
(编辑许四平)
TIPE family:biological activities and functions
ZHANG Li, CHEN You-Hai, XIE Wei-Dong.Department of Clinical Laboratory, Shandong Provincial Qianfoshan Hospital,Ji′nan 250014, China
The TIPE(tumor necrosis factor-alpha-induced protein 8-like)family has been recently described as regulators of tumorigenesis and inflammation.The family consists of four highly homologous members: TNFAIP8 (tumor necrosis factor-α-induced protein 8), TIPE1 (TNFAIP8L1), TIPE2 (TNFAIP8L2) and TIPE3 (TNFAIP8L3).Although TNFAIP8 family share high degrees of sequence homology, the members have different histological expressions, biological functions and molecular targets.TNFAIP8 shows the functions of inhibiting bacterial infection and promoting tumor migration.As a negative regulator of immunity and inflammation, TIPE2 is also an inhibitor of the oncogenic Ras in some neoplastic diseases.TIPE1 can induce cell apoptosis and inhibit tumor.TIPE3 is the transfer protein of phosphoinositide second messengers and can promote cancer.Emerging studies show TIPE family play important regulatory roles in many diseases;however, specific biological activities and exact molecular mechanisms need to be further elucidated.
TNFAIP8;TIPE1;TIPE2;TIPE3;Inflammation;Tumor
10.3969/j.issn.1000-484X.2016.08.001
R392文献标志码A
1000-484X(2016)08-1089-05
②,E-mail:yhc@mail.med.upenn.edu;E-mail:xiewd@sz.tsinghua.edu.cn。

