特发性膜性肾病相关自身抗体研究进展
程桂雪 李永哲 秦晓松
(中国医科大学附属盛京医院检验科,沈阳110004)
特发性膜性肾病相关自身抗体研究进展
程桂雪李永哲秦晓松
(中国医科大学附属盛京医院检验科,沈阳110004)
膜性肾病是成人肾病综合征最常见的病理表现之一,为我国原发性肾小球疾病的第二大病因。大约70%的膜性肾病患者表现为持续反复的蛋白尿,可致肾脏损伤,危及生命。约1/3膜性肾病患者可以自发缓解、逐渐好转,还有约1/3的患者在5~10年后发展为终末期肾病,其余患者则表现为持续蛋白尿[1,2]。膜性肾病可分为特发性和继发性两类,其中特发性膜性肾病(Idiopathic membranous nephropathy,IMN)占70%~80%,主要指没有明确病因引起的肾小球基底膜改变,其治疗主要应用激素、免疫抑制剂,如环孢素、环磷酰胺、甲基泼尼松等[3,4];继发性膜性肾病(Secondary membranous nephropathy,SMN) 占20%~30%,一般继发于系统性红斑狼疮(Systemic lupus erythematosus,SLE)等自身免疫疾病,感染(乙型/丙型肝炎病毒感染),恶性肿瘤和药物中毒等。IMN的发病机理、病因尚不明确,目前缺乏诊断的特异性实验室指标。现就目前发现的IMN相关靶抗原及其作用机制综述如下(表1)。
1 特发性膜性肾病的相关足细胞靶抗原及其作用机制
1.1小鼠Heymann肾炎的靶抗原1959 年Heymann等[5]用大白鼠肾匀浆和佐剂反复免疫健康同种大白鼠,制作出类似人类MN(Membranous Nephropathy,MN) 模型,称为Heymann肾炎(Heymann nephropathy,HN)。免疫荧光显示IgG、C3 沿GBM(Glomerular basement membrane,GBM)呈颗粒样沉积。其后Edgingiton证实引起HN的抗原为肾小管刷状缘Fx1A的主要成分之一,大量存在于近曲小管上皮细胞刷状缘。Kerjaschki等[6]在小鼠的肾小球基底膜内皮下足细胞膜沉淀物发现糖蛋白抗原-megalin,属低密度脂蛋白受体家族,为鼠膜性肾病的靶抗原,形成的抗原抗体复合物与C5b-9形成膜攻击复合物可使足细胞NADPH过氧化物酶复合体的表达上调,使活性氧在GBM产生,进而氧化足细胞表面脂蛋白,随后,二聚单体NC1域IV型胶原蛋白与氧化的脂蛋白共价结合,这些结构的改变影响肾小球基底膜结构,进而影响肾小球滤过功能,产生蛋白尿[7]。由于人肾小球足细胞无megalin蛋白表达,故HN模型未能揭露人膜性肾病的发病机制,但该模型为探索人膜性肾病免疫机制及发现自身抗体奠定了基础。
1.2新生儿同源性免疫膜性肾病的靶抗原-中性内切酶2002年,Debiec等[8,9]在少见的新生儿同种免疫性膜性肾病中发现肾小球原位免疫复合物,并首次发现人膜性肾病的相关抗体-中性内切酶抗体(Neutral endopeptidase,NEP),这为人们进一步探索膜性肾病的发病机理奠定了基础。研究组通过肾脏病理活检确诊新生儿膜性肾病,分析其病因在于该患儿母亲是先天NEP基因缺陷,其患者母亲在早期的流产史中被该种蛋白免疫,此次怀孕中的胎儿表达NEP,此时母体中抗NEP循环抗体经胎盘进入胎儿体内,与胎儿肾小球基底膜足细胞结合,进而激活补体,使足细胞受累,随之引起胎儿肾单位损伤、肾小球发生病理变化,导致新生儿膜性肾病。2004年,Debiec研究组[10]对5组家庭的核型分析,认为母体金属弹力酶 (Metallomembrane endopeptidase,MME)基因缺失引起中性内切酶缺陷,在妊娠期间母体即可产生抗胎儿NEP的抗体。另外,有研究指出患儿母亲产生的补体IgG亚型不同,则患儿膜性肾病的严重程度有差异,并明确指出母体产生的抗体中IgG1比例越高,患儿患病越严重。因此检测孕妇血清中抗NEP抗体及核型分析可以早期发现新生儿膜性肾病,从而其预防该病的发生,降低新生儿同源免疫性膜性肾病的发病率[11]。
1.3成人膜性肾病主要靶抗原-M型磷脂酶A2受体为了深入研究特发性膜性肾病的发病机制,在2009年,Beck等[12]人对IMN患者肾小球提取物采用Western blot方法获得一种与疾病相关的蛋白质,由质谱分析等方法证实存在一种185-kD的肾小球蛋白,即M型磷脂酶A2受体(M-phospholipase A2 receptor,PLA2R)为引起特发性膜性肾病的靶抗原。该蛋白可在70%的特发性膜性肾病患者中表达,并且在继发性膜性肾病等其他对照组患者中未检测到该种蛋白。PLA2R1主要表达于肾小球基底膜足细胞,属于甘露糖受体家族[12],其结构包括N末端富含胱氨酸区域(Cysteine-rich,CysR)、Ⅱ型纤连蛋白区域(Fibronectin-like type Ⅱ,FnⅡ)、8个C型凝集素区域(C-type lectin-like domain 1,CTLD1)以及跨膜区域和细胞内的C末端(图1)。该蛋白空间构想的改变可使机体产生抗PLA2R抗体,进而形成循环免疫复合物[13,14],这些循环抗体可以在膜性肾病患者的血清和肾小球免疫沉淀物中被检测到。
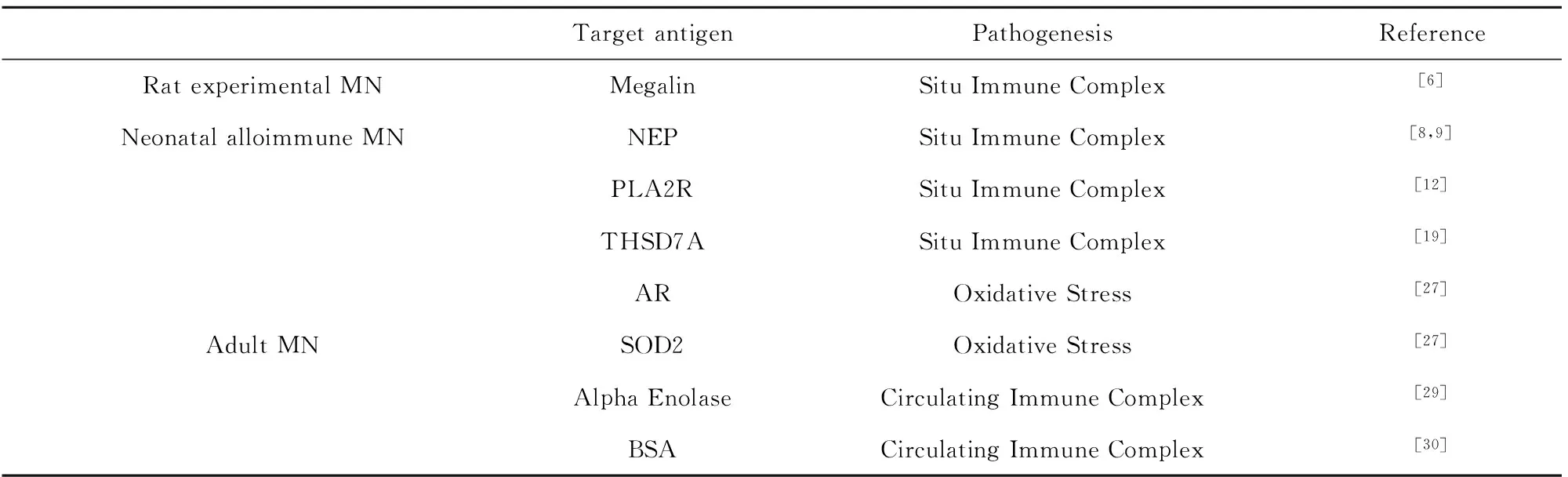
表1 特发性膜性肾病的靶抗原及作用机制Tab.1 Target antigens and their pathogenesis of idiopathic membranous nephropathy

图1 PLA2R分子结构Fig.1 Molecular structure of PLA2R
许多研究都说明了抗PLA2R自身抗体与特发性膜性肾病的关系,在不同国家、种族的IMN患者对PLA2R的特异性稍有差异;在不同的研究中,抗体检出率不同。如:Beck等人在37个IMN患者中检测出26个患者抗PLA2R自身抗体阳性(70%)[12],而欧洲IMN患者抗体阳性率为78%[15];随后,伊朗、日本和中国的研究显示该抗体阳性率分别为74%、53%、82%[16-18]。除地域和人种的差异,其原因还可能是由于检测方法或小样本测试的差异等因素所引起的,研究表明PLA2R与新生儿膜性肾病相关性不大,其主要是成人特发性膜性肾病靶抗原。
1.41型血小板反应蛋白7A域尽管对自身抗体的研究发现,大约70%的IMN患者可以采用特异性高的抗PLA2R自身抗体检测来诊断,但还有少数的患者体内未检测到该抗体。2014年,Tormas等[19]人在154例抗PLA2R1抗体阴性的IMN患者中,发现其中15例患者血清存在抗1型血小板反应蛋白7A域(Thrombospondin Type-1 Domain-Containing 7A,THSD7A)抗体,THSD7A表达于足细胞膜上,其抗体亚型与PLA2R抗体相同,均为IgG4亚型[19]。THSD7A与PLA2R有相似的结构和许多相似的生化特征,如N-糖基化、膜位置以及只在还原状态下才能检测到,但二者的存在又具有互斥性,即在IMN患者血清抗PLA2R抗体阴性的血清中才可发现THSD7A抗体。抗THSD7A自身抗体可在9.7%的PLA2R阴性的患者中检测到,在IMN患者中的检出率大约为3%[19]。
1.5足细胞靶抗原及其自身抗体的致病机制虽然目前尚未清楚IMN确切的发病机制,但众多研究表明抗体水平与足细胞表面成分和疾病的活动进展密切相关。自2009年人们发现PLA2R,普遍认为机体产生的自身抗体与足细胞靶抗原形成的原位免疫复合物,可激活补体,形成膜攻击复合物,从而引起肾小球损伤和蛋白尿的形成[20]。2009年Beck[12,20]的研究证实了IMN患者中抗PLA2R自身抗体的类型主要是IgG4,随后的研究支持了这一结论,并提出继发性膜性肾病中主要是IgG1亚型,研究还指出IMN患者体内有多种亚型的免疫球蛋白,IgG4为主要类型,其次也存在IgG1、IgG2、IgG3,但其含量有较大差异。还有观点认为病程的不同阶段,抗体亚型有差异,即原发性性膜性肾病早期阶段可能主要以IgG1为主,而发展的后期阶段IgG4占优势[21-23]。
为进一步研究患者体内产生的自身抗体是通过怎样的潜在的病理机制激活补体引起足细胞损伤,研究者进行了动物实验及移植后膜性肾病等研究。由于传统上认为IgG4类抗体不能激活经典补体途径,因此可能是机体产生的少量IgG1类抗体激活了经典补体途径,但膜性肾病患者的C1q水平低甚至检测不到,故可排除经典的补体激活途径,间接证实了IMN是通过其他途径激活补体系统的。而旁路途径或甘露糖交联凝集素途径可能是该病的补体激活途径,含量较高的甘露聚糖凝集素的结合物可在特发性膜性肾病患者被检测,支持了这一观点[24,25]。补体活化后形成C5b-9,通过对足细胞DNA损伤、氧化剂和蛋白酶作用、及对足细胞裂孔蛋白的破坏等,导致滤过屏障破坏,从而产生蛋白尿。
研究者认为特发性膜性肾病的发病机制可能与补体的激活不相关,可能是自身抗体本身介导的一种激活反应。足细胞表面PLA2R的生理功能还不是很清楚,抗PLA2R自身抗体可能干扰了PLA2R的正常功能,或是作为异常的激活剂或抑制剂,而引起足细胞的病理改变[26]。
2 特发性膜性肾病相关非足细胞靶抗原及其作用机制
2.1抗醛糖还原酶、超氧化物歧化酶Prunotto[27]发现IMN患者血清中存在抗醛糖还原酶(Aldose reductase,AR)、超氧化物歧化酶(Superoxide dismutase 2,SOD2)的两种抗体,并且患者肾组织中,这两种物质相应的抗体、补体成分共存在于足突细胞电子致密物中。AR属于醛酮还原酶家族可催化NADPH介导的脂肪族和芳香族醛或酮的还原,它特殊的功能是可把糖转化成山梨醇,并调节组织的紧张性和渗透性。正常肾脏组织的AR被髓质的肾小管上皮细胞遏制而不能表达;SOD2是保护细胞,防止氧化。在肾脏SOD2广泛的表达于肾小管上皮细胞,尤其是皮质区可防护肾脏缺血再灌注损伤,但并没有报道证实肾小球上也表达SOD2。有动物研究表明肾小球损伤是由足细胞产生的氧自由基引起足细胞膜损伤,当机体存在抗AR和SOD2抗体时,就会使AR和SOD2失去可对细胞的保护作用。然而膜性肾病的患者,在采用还原性药物进行治疗后,可有效地缓解蛋白尿症状。因此, AR和SOD2抗体阻碍了这两种还原性蛋白在机体中的作用,使氧化应激作用引起了肾小球的损伤。但两种抗体对膜性肾病不具有特异性,AR与SOD2的在IMN患者中检出率分别为25%~34%、28%~50%[28]。
2.2α-烯醇化酶在成人膜性肾病的患者中,不断有其他引起疾病的靶抗原被发现,如α-烯醇化酶(Alpha enolase),可能是IMN潜在的靶抗原,但α-烯醇化酶也在其他自身免疫性疾病中被检出,对于IMN的特异性较低[29],其致病可能与足细胞表面的抗原表达的相关。
2.3阳离子化牛血清白蛋白国外的研究[30]指出阳离子化牛血清白蛋白与膜性肾病的发生有关,同时在成人及儿童患者体内可以测得高浓度的牛血清白蛋白(Bovine serum albumin,BSA)及其特异性抗体,但成人血清内的BSA为中性的,而儿童患者体内的BSA带有阳性电荷,并且只在儿童患者的肾小球内皮下沉积物中发现牛血清白蛋白及其IgG抗体。动物模型研究中,只有给予动物注射阳离子牛血清白蛋白才会引起MN[31]。因此,阳离子BSA引起MN的机制可能是进入血液循环的该物质会与肾小球毛细血管网上的阴离子结合,而形成的原位免疫复合物,激活体内的免疫反应,引起肾小球损伤。
3 用于膜性肾病诊断的自身抗体
目前,已发现的自身抗体中,唯有PLA2R与IMN的相关性和特异性较高,许多研究表明在特发性膜性肾病的进程中,PLA2R自身抗体含量的变化与疾病的严重程度及病程进展密切相关[32],复发时抗体滴度会再度升高[33]。当采用药物如糖皮质激素、环磷酰胺、利妥昔单抗等治疗一段时期后,可以观察到患者病情改善的同时PLA2R抗体浓度也下降,并且血清抗体消失要早于蛋白尿的消失[3,34]。因此可将PLA2R自身抗体用于IMN的诊断、鉴别诊断、治疗评估以及预后随访观察。
早期Beck研究组采用非还原SDS-PAGE电泳和Western blot检测到PLA2R,但该方法操作复杂、耗时、实验技术要求高,不适用于大样本量的临床实验室使用[12]。随后发展了基于重组细胞的间接免疫荧光法(Indirect immunofluorescence cell based assay,IIF-CBA),在体外重组PLA2R,使其与患者血清中含有的抗PLA2R自身抗体结合,使用荧光标记的二抗与抗原抗体复合物结合,在荧光显微镜下观察到荧光物质,便证明该患者体内PLA2R抗体阳性,但其结果的判读受主观因素的影响较大[35,36]。为了进行高通量样本的定量检测,研究者将可定位激光小珠免疫测定法(Addressable laser bead immunoassay,ALBIA)应用于抗PLA2R自身抗体的检测。该方法是使用承载着完整重组蛋白质的可定位激光小珠免疫测定平台检测IMN患者血清中PLA2R抗体[35,37]。ALBIA是一个特定抗原的多路激光下的免疫荧光技术,该技术中特异的抗原(PLA2R)会与内部标记两种不同比例荧光微球共价结合,孵化后与人类血清和荧光染料标记的二抗结合,并用两种激光分析。一种激光检测小珠上结合的特异性目标抗原(PLA2R),而第二种激光用来检测小珠上与荧光二抗结合的抗原抗体复合物。ALBIA可在一个实验中同时检测多种抗原但所需要的血清量只需2~20 μl。该法可以避免主观因素对结果的影响。此外,为了能够更精确地检测抗体浓度,Hofstra等人采用了酶联免疫吸附试验(ELISA)对试验患者血清进行测定,该方法在微孔板上包被PLA2R抗原,已稀释的血清抗体与抗原结合,通过与酶标二抗的特异性结合,而催化底物反应,经过酶标仪的检测得出样本中抗PLA2R抗体的含量。该方法可对PLA2R抗体进行定性或定量检测,其敏感性、特异性较高,操作方便,适用于高通量检测[21,38]。
THSD7A自身抗体只在PLA2R阴性的IMN患者中的检出,故检出率较低,敏感性较差,对人群中IMN患者诊断效能差。而非足细胞靶抗原AR、SOD2、α-烯醇化酶、BSA及其自身抗体的研究,虽然它们在IMN的发病机制中起一定作用,但也在其他多种疾病中发挥作用,对于IMN的诊断缺乏特异性。因此,目前这些自身抗体的检测并未应用于IMN的临床诊断。
4 展望
近年来,IMN的发病率呈逐年上升趋势,尽管具体发病机制的研究仍不是很透彻,已发现NEP、PLA2R、THSD7A等自身抗体与该病的发病机制有关,这些抗体的发现推动了膜性肾病的诊断、疾病分期、预后判断、治疗策略及疗效监测的改变,并且相关自身抗体的测定也逐渐广泛的应用到了临床。然而,目前发现的自身抗体对IMN的诊断特异性与IMN诊断的金标准-肾组织活检相比,尚有一定的差距。因此,还需要对疾病自身抗体进行进一步的研究,以期找到新的该病特异性的抗体,加深对疾病的发病机制认识,同时也可以通过多种与疾病相关的自身抗体的联合检测,提高特发性膜性肾病的检出率,以减少患者接受有创检查的损伤,可有助于推动膜性肾病的诊断、鉴别诊断、预后和治疗策略的改进。
[1]Glassock RJ.Diagnosis and natural course of membranous nephropathy[J].Semin Nephrol,2003,23(4):324-332.
[2]Lindskog A,Ebefors K,Johansson ME,etal.Melanocortin 1 receptor agonists reduce proteinuria [J] .J Am Soc Nephrol,2010,21(8):1290-1298.
[3]Bech AP,Hofstra JM,Brenchley PE,etal.Association of anti-PLA2R antibodies with outcomes after immunosuppressive therapy in idiopathic membranous nephropathy [J].Clin J Am Soc Nephrol,2014,9(8):1386-1392.
[4]Saito T,Iwano M,Matsumoto K,etal.Significance of combined cyclosporine-prednisolone therapy and cyclosporine blood concentration monitoring for idiopathic membranous nephropathy with steroid-resistant nephrotic syndrome: a randomized controlled multicenter trial [J].Clin Exp Nephrol,2014,18(5):784-794.
[5]Heymann W,Hackel DB,Harwood S,etal.Production of nephrotic syndrome in rats by Freund's adjuvants and rat kidney suspensions [J].Proc Soc Exp Biol Med,1959,100(4):660-664.
[6]Kerjaschki D,Neale TJ.Molecular mechanisms of glomerular injury in rat experimental membranous nephropathy (Heymann nephritis) [J].J Am Soc Nephrol,1996,7(12):2518-2526.
[7]Borza DB,Zhang JJ,Beck LH,etal.Mouse models of membranous nephropathy: the road less travelled by [J].Am J Clin Exp Immunol,2013,2(2):135-145.
[8]Debiec H,Guigonis V,Mougenot B,etal.Antenatal membranous glomerulonephritis due to anti-neutral endopeptidase antibodies [J].N Engl J Med,2002,346(26):2053-2060.
[9]Debiec H,Guigonis V,Mougenot B,etal.Antenatal membranous glomerulonephritis with vascular injury induced by anti-neutral endopeptidase antibodies: toward new concepts in the pathogenesis of glomerular diseases [J].J Am SocNephrol,2003,14 Suppl 1:S27-32.
[10]Debiec H,Nauta J,Coulet F,etal.Role of truncating mutations in MME gene in fetomaternalalloimmunisation and antenatal glomerulopathies [J].Lancet,2004,364(9441):1252-1259.
[11]Vivarelli M,Emma F,Pellé T,etal.Genetic homogeneity but IgG subclass-dependent clinical variability of alloimmune membranous nephropathy with anti-neutral endopeptidase antibodies [J].Kidney Int,2015,87(3):602-609.
[12]Beck LH,Bonegio RG,Lambeau G,etal.M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy [J].N Engl J Med,2009,361(1):11-21.
[13]Fresquet M,Jowitt TA,Gummadova J,etal.Identification of a major epitope recognized by PLA2R autoantibodies in primary membranous nephropathy [J].J Am Soc Nephrol,2015,26(2):302-13.
[14]Kao L,Lam V,Waldman M,etal.Identification of the immunodominant epitope region in phospholipase A2 receptor-mediating autoantibody binding in idiopathic membranous nephropathy [J].J Am Soc Nephrol,2015,26(2),291-301.
[15]Hofstra JM,Beck LH,Beck DM,etal.Anti-phospholipase A2 receptor antibodies correlate with clinical status in idiopathic membranous nephropathy [J].Clin J Am Soc Nephrol,2011,6(6):1286-1291.
[16]Ardalan M,Ghafari A,Hamzavi F,etal.Anti-phospholipase A2 receptor antibody in idiopathic membranous nephropathy: A report from Iranian population [J].J Nephropathol,2013,2(4):241-248.
[17]Akiyama S,Akiyama M,Imai E,etal.Prevalence of anti-phospholipase A2 receptor antibodies in Japanese patients with membranous nephropathy [J].Clin Exp Nephrol,2014.
[18]Qin W,Beck LH,Zeng C,etal.Anti-phospholipase A2 receptor antibody in membranous nephropathy [J].J Am Soc Nephrol,2011,22(6):1137-1143.
[19]Tomas NM,Beck LH,Meyer-Schwesinger C,etal.Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy [J].N Engl J Med,2014,371(24):2277-2287.
[20]Ronco P,Debiec H.Anti-phospholipase A2 receptor antibodies and the pathogenesis of membranous nephropathy [J].Nephron Clin Pract,2014,128(3-4):232-237.
[21]Hofstra JM,Debiec H,Short CD,etal.Antiphospholipase A2 receptor antibody titer and subclass in idiopathic membranous nephropathy [J].J Am Soc Nephrol,2012,23(10):1735-1743.
[22]Huang CC,Lehman A,Albawardi A,etal.IgG subclass staining in renal biopsies with membranous glomerulonephritis indicates subclass switch during disease progression [J].Mod Pathol,2013,26(6):799-805.
[23]Kanda H,Koya J,Uozaki H,etal.Membranous nephropathy with repeated flares in IgG4-related disease[J].Clin Kidney J,2013,6(2):204-207.
[24]Schlumberger W,Hornig N,Lange S,etal.Differential diagnosis of membranous nephropathy with autoantibodies to phospholipase A2 receptor 1 [J].Autoimmun Rev,2014,13(2):108-113.
[25]Yamashina M,Takami T,Kanemura T,etal.Immunohistoche-mical demonstration of complement components in formalin-fixed and paraffin-embedded renal tissues [J].Lab Invest,1989,60(2):311-316.
[26]Beck LH,Salant DJ.Membranous nephropathy: recent travels and new roads ahead [J].Kidney Int,2010,77(9):765-770.
[27]Prunotto M,Carnevali ML,Candiano G,etal.Autoimmunity in membranous nephropathy targets aldose reductase and SOD2 [J].J Am Soc Nephrol,2010,21(3):507-519.
[28]Herrmann SM,Sethi S,Fervenza FC.Membranous nephropathy: the start of a paradigm shift.[J].Curr Opin Nephro Hypertens,2012,21(2):203-210.
[29]Bruschi M,Carnevali ML,Murtas C,etal.Direct characterization of target podocyte antigens and auto-antibodies in human membranous glomerulonephritis: Alfa-enolase and borderline antigens [J].J Proteomics,2011,74(10):2008-2017.
[30]Debiec H,Lefeu F,Kemper MJ,etal.Early-childhood membranous nephropathy due to cationic bovine serum albumin [J].N Engl J Med,2011,364(22):2101-2110.
[31]Chen JS,Chen A,Chang LC,etal.Mouse model of membranous nephropathy induced by cationic bovine serum albumin: antigen dose-response relations and strain differences [J].Nephrol Dial Transplant,2004,19(11):2721-2728.
[32]Hoxha E,Harendza S,Pinnschmidt H,etal.PLA2R antibody levels and clinical outcome in patients with membranous nephropathy and non-nephrotic range proteinuria under treatment with inhibitors of the renin-angiotensin system [J].PLoS One,2014,9(10):e110681.
[33]Stahl R,Hoxha E,Fechner K. PLA2R autoantibodies and recurrent membranous nephropathy after transplantation [J].N Engl J Med,2010,363(5):496-498.
[34]Segarra-Medrano A,Jatem-Escalante E,Carnicer-Cáceres C,etal.Evolution of antibody titre against the M-type phospholipase A2 receptor and clinical response in idiopathic membranous nephropathy patients treated with tacrolimus [J].Nefrologia,2014,34(4):491-497.
[35]Behnert A,Fritzler MJ,Teng B,etal.An anti-phospholipase A2 receptor quantitative immunoassay and epitope analysis in membranous nephropathy reveals different antigenic domains of the receptor [J].PLoS One,2013,8(4):e61669.
[36]Timmermans SA,Damoiseaux JG,Heerings-Rewinkel PT,etal.Evaluation of anti-PLA2R1 as measured by a novel ELISA in patients with idiopathic membranous nephropathy: a cohort study [J].Am J Clin Pathol,2014,142(1):29-34.
[37]Behnert A,Schiffer M,Müller-Deile J,etal: Antiphospholipase A2 receptor autoantibodies: a comparison of three different immunoassays for the diagnosis of idiopathic membranous nephropathy [J].J Immunol Res,2014,2014:143274.
[38]Dähnrich C,Komorowski L,Probst C,etal.Development of a standardized ELISA for the determination of autoantibodies against human M-type phospholipase A2 receptor in primary membranous nephropathy [J].Clin Chim Acta,2013,421:213-218.
[收稿2015-07-10修回2015-08-07]
(编辑许四平)
10.3969/j.issn.1000-484X.2016.08.037
R392 文献标志码A
1000-484X(2016)08-1245-05
程桂雪(1990年-),女,在读硕士,主要从事膜性肾病分子诊断方面的研究。
及指导教师:李永哲(1964年-),男,博士,教授,主要从事自身免疫性疾病相关研究,E-mail:yongzhelipumch@126.com 。
秦晓松(1972年-),女,博士,教授,主要从事肾病分子诊断方面研究,E-mail:qinxs@sj-hospital.org。