Ag/AgCl电极的制备与性能测试
张雯昭,张新坤
(1.中国矿业大学 矿业学院,江苏 徐州 2211161;2.华北理工大学 轻工学院 ,河北 唐山 063000)
Ag/AgCl电极的制备与性能测试
张雯昭1,张新坤2
(1.中国矿业大学 矿业学院,江苏 徐州 2211161;2.华北理工大学 轻工学院 ,河北 唐山 063000)
Ag/AgCl;参比电极;电解法
以1 mol/L HCl溶液作为电解液,并以聚乙二醇-10000作为电解液添加剂,采用电解氯化法制备Ag/AgCl参比电极。通过实验确定了最佳电流密度及添加剂的最佳含量,将最佳条件下制得的Ag/AgCl参比电极在AgCl悬浊液中陈化24 h。性能测试结果表明:该电极具有制备方法简单、条件容易控制、电极稳定性好、温度系数低等特点,可以满足电化学测定的要求。
电极电势是电化学测量中经常用到的重要物理量之一[1,2],但单个电极电势的绝对值还无法测量,一般采用标准氢电极与待测电极组成原电池,测得原电池电动势是2个电极电势的相对差值[6],因此规定氢电极的电极电势相对地作为零,但由于氢电极在制备和使用过程中要求严格,所以实际测量电极电势时,经常使用一种易于制备、使用方便、电势稳定的可逆电极作为参比电极来代替,如甘汞电极、银-氯化银电极等。这些电极与标准氢电极比较而得到的电极值已精确测出,故只要将此参比电极与待测电极组成电池,测得其电动势,就可求出待测电极的电势值。
常用的参比电极有甘汞电极、氢电极和Ag/AgCl电极。以氢电极作为标准电极测定电动势时,在正常情况下,电动势可以达到很高的精确度(±0.000 001 V)[3]。但它对使用时的条件要求十分严格,而且它的制备和纯化也比较复杂,在一般的实验室中难以有这样的设备[3],故在实验测定时,往往采用2级标准电极。甘汞电极、银-氯化银电极就是其中最常用的2种2级标准电极。Ag/AgCl电极具有结构简单、性能稳定、没有滞后、温度系数较小等优点,由于在高温高压下,水溶液体系中AgCl具有很小的溶解度,极高的稳定性和可逆性,且即使在有氢存在的情况下,电极表面也会得到很好的保持,这些特性使其得到了广泛的应用[4-6]。实验研究表明,将参比电极直接插入待测液中使用,可使电极具有较好的热稳定性和较小的阻抗值[6-8]。该项研究探讨了通过向电解液中加入添加剂聚乙二醇-10000制备Ag/AgCl电极,通过改变电流、添加剂聚乙二醇-10000的添加量来改善Ag/AgCl电极膜层的致密程度和牢固程度,提高Ag/AgCl电极电势的稳定性,并对其性能进行测试。
1实验内容
1.1实验仪器
1.1.1主要仪器与设备
直流稳压电源、SCD数字电位差综合测试仪(南京桑力电子设备厂)、恒温槽(SYRⅢ型 南京桑力电子设备厂)、电子天平(梅特勒·托利多仪器,上海有限公司);银电极、铂电极、饱和甘汞电极、电流表、滑动变阻器、小烧杯、量筒、量瓶、滴管、导线等。
1.1.2主要试剂
HCl溶液(1 mol/L)、KCl溶液(饱和)、聚乙二醇-10000 。
1.2实验方法
1.2.1 Ag电极的制备与处理
取1支银电极,对其表面进行预处理:此过程包括除去表面硫化物、除油、活化和清洗等。首先用细纱纸打磨直至光亮,然后活化、蒸馏水冲洗、氯化、蒸馏水冲洗。
1.2.2 Ag/AgCl电极膜层的制备
(1)将铂电极与电源负极连接,作为阴极,将上述制备的银电极与电源正极连接作为阳极,并将电流表与滑动变阻器串联在电路中,如图1所示。
(2)取精确配制的1 mol/L HCl的溶液置于小烧杯中,按上述的方法连接电路,找出最佳电流密度。
(3)将聚乙二醇-10000作为电解液添加剂,以增强Ag/AgCl电极膜层的致密及牢固程度,在最佳电流条件下电解3 h,氯化过程中需不断摇动银电极,将制得的Ag/AgCl电极与电解液中未添加聚乙二醇-10000时所制得的Ag/AgCl电极进行实验比较。
(4)将电解氯化后的Ag/AgCl电极,在AgCl悬浊液中陈化24 h 可以使制备的Ag/AgCl参比电极膜层更致密,均匀而无斑点,与未经陈化的Ag/AgCl电极进行实验比较。
(5)电解氯化结束后,检验Ag/AgCl电极质量是否合格,银电极表面应为灰色致密的AgCl膜层,均匀而无明显的斑点;在0.1 mol/L KCl溶液中饱和甘汞电极的电位差应在35 mV左右[1],否则应重新氯化。
由于“现代性”的冲击与侵入,社会转型的加快,不少乡村的传统社会结构开始解体与崩塌,面临着价值理念内向化、虚无化,人际关系疏离化、理性化,乡村治理高成本、碎片化的事实,[2]乡村传统的人际结构和社会生态逐渐变形和扭曲,村民的原子化趋势和不信任感加剧。而农村基层自治组织文化的涵养与培育,村民自治制度的完善和健全以及基层治理格局的优化无疑将有助于重构村民之间的社会联结,增强村民之间的利益纽带,建构乡村共同体意识,从而修补乡村社会生态,增加乡村社会资本。
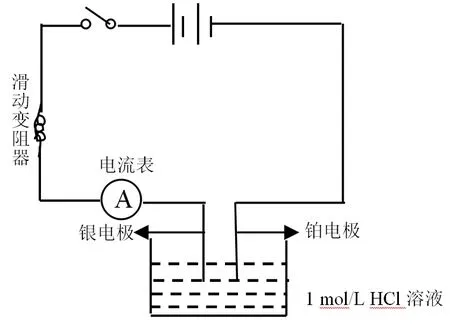
图1 电解装置示意图
1.2.3测试Ag/AgCl电极的性能
(1)温度系数变化测试
在25 ℃条件下,将制得的Ag/AgCl电极与饱和甘汞电极置于饱和KCl溶液中,饱和甘汞电极与SCD数字电位差综合测试仪正极连接,Ag/AgCl电极与负极连接,测定时,电池电动势值开始时较不稳定,每隔一定时间测定1次,直至稳定,每隔5 ℃测定1次。
(2)电极的稳定性测试
将制得的Ag/AgCl电极,先用蒸馏水冲洗数次,然后再在0.1 mol/L KCl溶液中浸泡12 h,测其在12 h中的电位差变化情况。
2 结果与讨论
2.1电解电流对Ag/AgCl电极电势的影响
选择不同的电流值,固定电解时间进行电解实验,每改变一次电流密度,当待测电极的电极电势达稳定后就可以测出一个稳定的电势值,不同电流值对Ag/AgCl电极电势的影响如表1所示;Ag/AgCl电极电势随电流变化曲线如图2所示。

表1 不同的电流值对Ag/AgCl电极电动势的影响
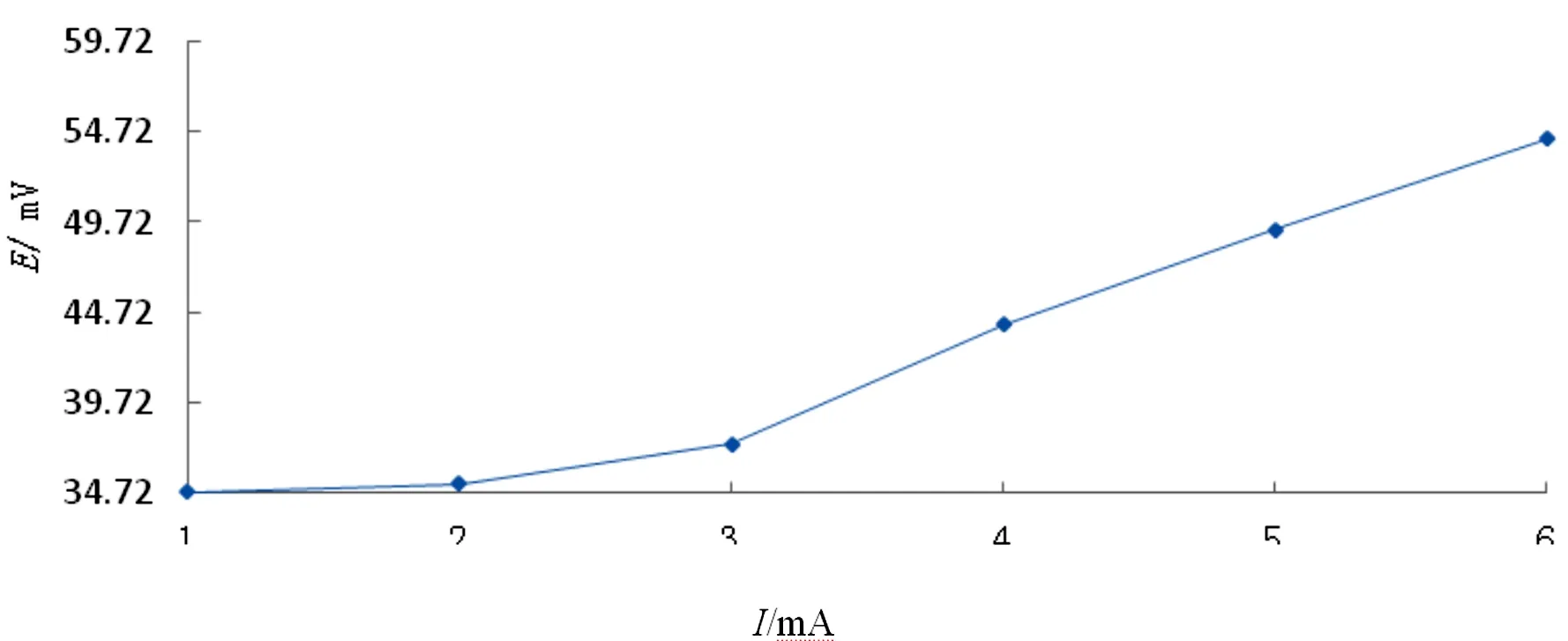
图2 Ag/AgCl电极电势随电流变化曲线
由图2可以看出:固定电解时间,选择不同的电流值,测其Ag/AgCl电极电势。随着电流密度的增大,电极电势也增大,开始时电极电势随着电流值变化比较小,当电流值增大到2 mA时电极电势较稳定。
选取不同的添加剂含量,固定电解时间和电流,进行电解实验,以电极电势值对添加剂含量作图。加入添加剂是为了增大银电极表面的极化电位,使Ag+析出速度减慢,形成AgCl颗粒均匀地附着在银电极表面,形成致密膜层。不同添加剂对Ag/AgCl电极电势的影响如表2所示,Ag/AgCl电极电势随添加剂变化曲线如图3所示。

表2 不同添加剂对Ag/AgCl电极电势的影响
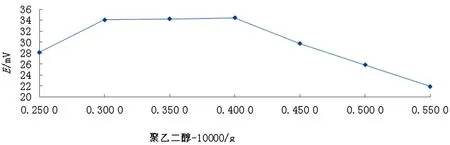
图3 Ag/AgCl电极电势随添加剂变化曲线
由图3可以看出:在每毫升 1 mol/L HCl溶液中加入0.003 8~0.005 0g添加剂,在最佳电流条件下电解3 h,使Ag/AgCl膜层更致密且牢固程度也好,电极电势稳定,说明在这段添加剂的含量适合,如果在每毫升1 mol/L HCl溶液中加入添加剂的含量不在0.003 8~0.005 0 g范围之内时,Ag/AgCl膜层的牢固程度不佳,电极电势不稳定。
2.3温度系数测试
随着温度的不同Ag/AgCl电极电势的变化情况如表3所示;Ag/AgCl电极电势随温度的变化曲线如图4所示。

表3 随着温度的不同Ag/AgCl电极电势的变化情况
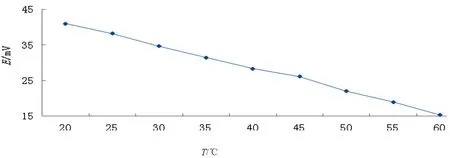
图4 Ag/AgCl电极电势随温度变化曲线
由图4可以看出:将0.300 0~0.400 0g聚乙二醇-10000作为电解液添加剂,在最佳电流(4 mA)条件下电解3 h,测得电极电势随着温度的降低而减小。通过作图可知,电极的电位随着温度呈线性变化,且变化的幅度基本一致,将此电极的ESCE,25℃~T曲线线性组合,得到的温度系数为﹣0.630 5 mV与文献报道的Ag/AgCl电极的理论温度系数﹣0.537 8 mV/℃比较接近[4],表明温度对电位的影响较小。
2.4电极稳定性测试
Ag/AgCl电极在0.1 mol/L KCl溶液中浸泡12 h的电位差变化情况如表4所示;Ag/AgCl电极电势随时间变化曲线如图5所示:

表4 Ag/AgCl电极在0.1 mol/L KCl溶液中连续浸泡12 h的电位变化
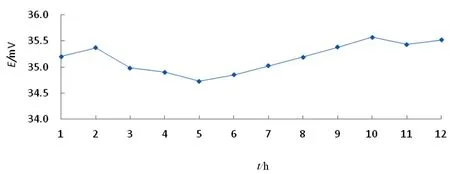
图5 Ag/AgCl电极电势随时间变化曲线
由图5可以看出:Ag/AgCl电极在0.1 mol/L KCl溶液中连续浸泡12 h的电位变化情况,可见,每2只电极之间的电位差值在0.60 mV以内,说明电极平行性良好,单只电极的电位漂移均在0.20 mV以内,去除饱和甘汞电极本身的电位漂移,可以认为本实验制备的电极稳定性良好。由于极差的大小是所处环境电场强弱的反映,图中极差波动较大的点很可能是由于实验室周围马达启动造成的,这一点在文献[4]中可以得到证明,而且实验发现在夜深人静时测得的数据要比白天波动小。换一个角度讲,这说明所制备电极对所处环境电场的变化比较敏感,可尝试作为较高精度测试装置的敏感元件,来探测阴极保护体系的微小电位变化或探测其周围电场的变化。
3 结论
(1)采用电极法制备的Ag/AgCl参比电极其制备方法简单,条件容易控制,在制取的过程中每毫升1 mol/L HCl溶液加入添加剂聚乙二醇-100000在0.003 8~0.005 0 g之间时,可以促使膜层致密,然后再在AgCl悬浊液中陈化24 h,使制备的Ag/AgCl参比电极膜层更致密,均匀而无斑点。
(2)性能测试结果表明:Ag/AgCl参比电极在0.1 mol/L KCl溶液中电位稳定性好,12 h内电极电位漂移在0.20 mV以内;同时具有温度系数低等优良性能,可以满足电化学测定的要求。
[1]傅献彩,沈文霞,姚天扬,等.物理化学(第五版)下册[M].北京:高等教育出版社,2006:60-107.
[2]东北师范大学.物理化学实验[M].北京:高等教育出版社,1989:143-151.
[3]周海晖,陈范才,张小华,等.Ag/AgCl固体参比电极的研究[J].腐蚀科学与防护技术,2001,13(4):234-235.
[4]王金龙,王佳,贾红刚,等.Ag/AgCl固体参比电极研究与应用的现状与进展[J],中国腐蚀与防护学报,2013,33(2):81-89.
[5]张清,李萍,白真权.Ag/AgCl高温参比电极的制备[J]:应用科技,2005,32(6):62-63.
[6]尹鹏飞,马长江,徐丽坤.工程用Ag/AgCl参比电极性能对比研究[J].装备环境工程,2011,8(3):27-29,53.
[7]张燕,宋玉苏,王源升.Ag/AgCl参比电极性能研究[J]. 中国腐蚀与防护学报,2007,27(3):176-180.
[8]张新坤.涂敷法制备Ag-AgCl参比电极及其性能[J],材料保护,2011,44(10):63-64.
Preparation and Performance Measurement of Ag/AgCl Electrade
ZHANG Wen-zhao1, ZHANG Xin-kun2
(1.College of Mining Technology, China University of Mining and Technology, Xuzhou Jiangsu 221116, China;2. Qinggong College,North China University of Science and Technology, Tangshan Hebei 063000,China)
Ag/AgCl;reference electrode;electrolytic method
Ag/AgCl solution reference electrodeof 1 mol as the HCl was prepared by using electrolyte and polyethylene glycol -10000 as the electrolyte additive. The optimal current density and the optimal content of the additive were determined by experiment, then the Ag/AgCl reference electrode was aged in the turbid liquid of AgCl for 24 hours. The results show that the Ag/AgCl electrode has characteristies of simple preparation methods,easy coutrol of experiment conditions good stability of the electrode and low temperatare coefficient,so it could meets the requirements of the electrochemistry measurements.
2095-2716(2016)03-0053-05
O646.54
A

