披碱草根际促生菌筛选及其接种剂的促生作用
马骢毓, 张 英, 孙广正, 3, 刘 婷, 姚 拓*
(1 甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 甘肃兰州 730070;2 青海大学农牧学院草业科学系, 青海西宁 810016; 3 旱区作物逆境生物学国家重点实验室, 西北农林科技大学植物保护学院, 陕西杨凌 712100)
披碱草根际促生菌筛选及其接种剂的促生作用
马骢毓1, 张 英2, 孙广正1, 3, 刘 婷1, 姚 拓1*
(1 甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 甘肃兰州 730070;2 青海大学农牧学院草业科学系, 青海西宁 810016; 3 旱区作物逆境生物学国家重点实验室, 西北农林科技大学植物保护学院, 陕西杨凌 712100)
【目的】体外促生能力是衡量微生物菌株作用的一个重要指标,测定获取的植物根际促生菌并明确其对披碱草的促生效果,可为其在生产中的应用提供依据。【方法】2014年9月从西藏阿里地区采集披碱草根系及根际土壤,以常规方法分离出其中的溶磷菌、 固氮菌和分泌3-吲哚乙酸(IAA)细菌的10株菌株。测定其溶磷量、 固氮酶活性及分泌生长素能力,并将其制成植物根际接种剂,测定接种剂对披碱草生长的影响及其在根际的定殖能力。【结果】菌株PWXZ10溶磷能力较好,达40.89 mg/L; 菌株003PWXZ6固氮酶活性较强,达421.21 nmol/(mL·h); 菌株NXP17分泌生长素能力较强,达31.33 μg/mL。与对照菌株(Pseudomonassp. Jm92)相比,菌株003PWXZ6和NXP17制备的接种剂可显著增加披碱草株高、 地上生物量和地下生物量(P<0.05),但两者之间差异不显著(P>0.05); 接种剂003PWXZ6对披碱草根总长、 根表面积、 根体积、 根直径、 含磷量、 含氮量和粗蛋白含量增加显著(P<0.05),分别较对照菌株(Pseudomonassp. Jm92)增加了330%、 199%、 118%、 187%、 70%、 15%和19%,并且该菌株在根际定殖能力很强。 【结论】植物根际促生菌003PWXZ6和NXP17对披碱草具有良好促生效果,可为开发经济环保的生物肥料提供了菌种资源。
促生菌(PGPR); 接种剂; 披碱草; 生长; 根系
微生物肥料又称生物肥料、 菌肥或接种剂,是一类以微生物生命活动及其产物使农作物得到特定肥料效应的微生物活体制品[1-2]。现代生态农业和有机农业对非化学肥料的需求及人们环境保护意识的提高,使微生物肥料的开发和研究具有巨大的潜力[3]。菌种资源收集与保存是发展微生物肥料的根本。农用生物制剂常用的微生物素材是植物根际促生菌(plant growth promoting rhizobacteria,PGPR),是自由生活在土壤或附生于植物根际、 茎叶,通过产生次生代谢物促进矿质营养吸收利用及植物生长,且能抑制有害微生物的一类有益菌[4-5]。它们是促生微生物肥料的主要菌种类群,一般通过多种机制促进植物生长,如溶磷、 产铁载体、 生物固氮、 产植物激素、 诱导系统性抗性、 促进植物与有益微生物共生及产抗生素等[6]。

微生物肥料主要在根际发挥植物促生作用,而根际是一个独特的环境,受宿主植物根系分泌物和根际脱落物的影响。微生物肥料的功能发挥受土著微生物的竞争和根际复杂环境的调控,提高根际竞争定殖能力是保障微生物肥料功能稳定发挥的前提。根系分泌物指在一定生长条件下,活的且未被扰动的植物根释放到根际环境中的有机物的总称,可为微生物提供重要的能量物质[10]。根围内的各类微生物每时每刻都在争夺着这一生境中有限的营养。某些PGPR可抢占作物根表的一些分泌物较多、 水分湿度大、 适合细菌生长和繁殖的有利位点,有效地利用根际营养和根系分泌物[11],实现根际定殖。
根系是植物吸收水分和养分的重要组织器官,其形态发育影响作物的生长及对营养的吸收,其中根系长度和根表面积对主要借扩散抵达根表面的那些养分有效性具有决定性作用,因此研究根的形态学特征(总根长、 根系表面积、 根系平均直径及根系体积等)有着重要意义。Belimov等[12]发现在接种了能够产生IAA的促生菌后,Brassicanapus的根部增长明显; Sheng和Xia[13]发现当与Variovoraxparadoxus5C-2共同接种时B.napus的根长度可增加41%,根的干重增加20%。但是,目前关于生物因素尤其是微生物对披碱草根系形态的影响鲜有报道。
披碱草(Elymusdahuricus)属禾本科(Gramineae)小麦族(Triticeae)披碱草属(Elymus),主要分布在欧亚大陆和北美洲北部,其垂直分布从海拔几米的海滩一直到海拔5200m以上的喜马拉雅山区[14]。披碱草属植物多数物种为草原和草甸的重要组成成分,许多种是饲用价值较高的优良牧草,具有优质、 高产、 抗病、 抗虫、 抗旱、 耐盐碱等优异基因。披碱草茎直立,根系发达,能吸收土壤深层水分,具有很强的抗寒和耐旱能力。
鉴于此,本研究以披碱草为研究对象,从披碱草根际分离筛选优良促生菌,并研制微生物接种剂,研究接种剂对披碱草生长及根系形态的影响,以及优良PGPR在根部定殖的能力,为披碱草的优质、 高产生产及推广提供菌种素材和理论依据。
1 材料与方法
1.1供试材料

1.2培养基
LB (Luria Bertani)培养基用于分离和保存根际细菌[15]; PKO (pikovskaya)用于溶磷菌的分离培养[16]; King’s B用于分泌3-吲哚乙酸(IAA)菌株的分离培养[17]; NFM (nitrogen-free medium)用于固氮菌的分离培养[18-19]。
1.3优良促生菌株分离筛选
1.3.1 菌株分离按常规分离细菌法分别涂布样品悬液于PKO及NFM固体培养基平板上,28℃倒置于恒温培养箱中培养,挑取在PKO平板上出现透明圈的分离物进行纯化并保存; 在NFM平板上挑取长势较好的分离物进行纯化保存。
1.3.2 菌株溶磷能力测定按照Sundara等[20]的方法。将菌株点接种至PKO固体培养基上,28℃条件下培养7 d,观察菌落周围有无溶磷圈出现,并测定菌落直径与溶磷圈直径,定性判断菌株溶磷能力; 制备上述菌株悬浮液(浓度约108cfu/mL),接种0.5 mL菌悬液于盛有经灭菌的50 mL PKO液体培养基的三角瓶中,每菌株3次重复,置于轨道摇床上(28℃,160r/min)培养10 d,在4℃下离心(10000 r/min) 15 min,取上清液用钼蓝比色法测定有效磷(P)的含量。

1.3.4 菌株分泌IAA能力测定按照Glick[22]的方法。取30 mL在KB液体培养基上生长12 d的悬浮液,盛于50 mL离心管中,在4℃,10000 rpm离心10 min,将上清液在冷冻干燥仪中干燥至10 mL,转移至分液漏斗中,用1 mol/L HCl调节pH值至2.8,再加入20 mL乙酸乙酯,剧烈震荡5 min,两相分层后转移乙酸乙酯层于另一分液漏斗中,下层溶液用20 mL乙酸乙酯再提取一次,合并乙酸乙酯层于50 mL磨口烧瓶中。将磨口烧瓶在45℃水浴中加热,用旋转蒸发仪真空浓缩,溶于0.6 %冰乙酸中,然后定容于2 mL,将溶液过0.45 μm有机系滤膜,供高效液相色谱仪测定。
1.4对披碱草生长影响测定
1.4.1 接种剂制备将斜面保存的供试菌株于灭菌的LB平板培养基进行活化,然后分别接种于灭菌的LB液体培养基中,于28℃,150 r/min培养48 h。待菌株充分生长后,用无菌水调节各菌株菌悬液浓度为1×108cfu/mL (波长660 nm,OD值≥0.5)。



1.4.4 测定项目与方法播种46 d后收获并及时测定各指标,植株的自然高度(每盆随机测定10株,取平均值),然后将植株的地上和地下部分分开,用扫描仪(Deskscan System-Root Law Program,美国)对根系进行扫描并计算根长、 根直径、 根体积、 根表面积等生长指标。地上植物量和地下植物量(每盆分别收获地上茎叶部分和地下根系部分,于105℃杀青1 h,70℃烘干至恒重,称重),采用氢醌亚硫酸钠法测定植株地上部分和地下部分的全磷量[23],采用凯氏定氮法测定植株含氮量和粗蛋白的含量[23]。
1.5优良PGPR菌株植物根际定殖能力研究
1.5.1 菌株的利福平标记用95%的酒精配制一定浓度的利福平溶液,过滤灭菌后加入培养基中配成一定浓度。将所有菌株在LB培养液中培养48 h,经离心洗脱后,用无菌水稀释菌液至1×105cfu/mL。取100 μL菌液涂于含100 μg/mL利福平的LB培养基平板上,继续培养72 h后,再用无菌水稀释至1×105cfu/mL,取菌液100 μL涂于含200 μg/mL利福平LB培养基平板上,由低浓度逐渐向高浓度的利福平培养基上生长筛选,最后形成500 μg/mL利福平标记菌株。将在LB培养液中培养72 h的利福平标记所有菌株的菌液制作成接菌剂。
1.5.2 标记菌株分离与测定分别将利福平标记所有菌株制备的接菌剂接种于披碱草种子,进行盆栽培养。以后分别在接菌后10、 20、 30、 40 d时,从植株幼苗根际各取土1g,分别加无菌水稀释后,测定每克土中所含标记菌株的菌落数。分离抗利福平标记菌株采用LB选择性培养基,即在LB培养基中加入含500 μg/mL利福平液。
1.6数据处理
采用SPSS 16.0软件中的Duncan氏新复极差法对所有数据进行单因素分析; 多重比较采用LSD法; 制图用Excel 2007。
2 结果与分析
2.1优良促生菌株促生特性
通过测定菌株溶磷、 固氮和分泌生长素能力,筛选得到10株优良菌株(表1),6株具有溶磷活性,菌株PWXZ10溶磷能力较好,达40.89 mg/L,但D/d值不是最大; 7株具有固氮活性,菌株003PWXZ6固氮酶活性较强,达421.21 nmol/(mL·h); 5株菌具有分泌生长素能力,菌株NXP17分泌生长素能力较强,达31.33 μg/mL。菌株NXZ4和003PWXZ6兼具溶磷、 固氮和分泌生长素性能。菌株NXY18、 PYXP1、 PWXZ10、 PYXZ23和003PWXZ6生长速度较快。

表1 优良菌株促生特性
注(Note): D/d—Diameter of P dissolve circle/Diameter of bacterial colony; CK—参照菌株Control strains(Pseudomonassp. Jm92); 数据后不同小写字母表示处理间差异显著(P<0.05)Values followed by different small letters are significantly different at the 0.05 level.
2.2接种剂对披碱草株高影响
图1表明,与CK(Pseudomonassp. Jm92)相比,各处理接种剂对披碱草株高增加明显,且差异显著(P<0.05),其中,接种003PWXZ6和NXP17对披碱草株高的促进作用最显著(P<0.05),较对照增加19.01和17.36 cm,但两者之间差异不显著(P>0.05)。
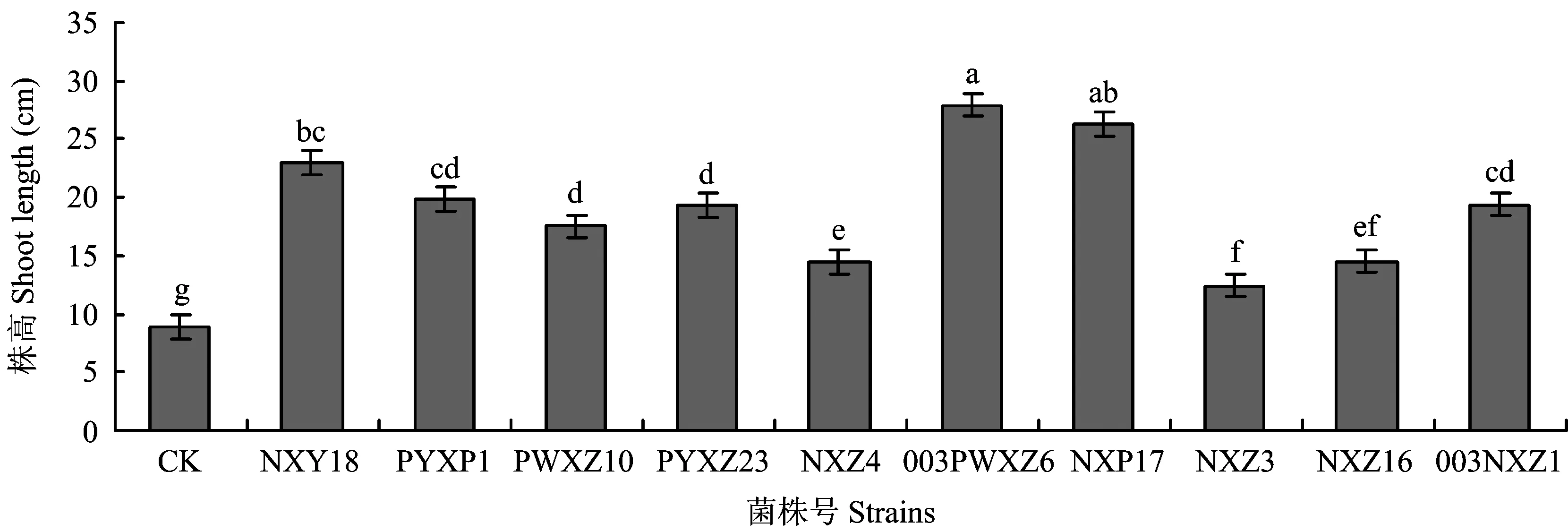
图1 接种剂对披碱草株高影响Fig.1 Effects of inoculation on the shoot length of E. dahuricus[注(Note): 方柱上不同小写字母表示处理间差异显著(P<0.05)Different small letters above the bars indicate significant difference at the 0.05 level.]
2.3接种剂对披碱草生物量影响
图2表明,和CK(Pseudomonassp. Jm92)相比,各接种剂处理地上生物量不同程度显著增加(P<0.05),其中,接种剂003PWXZ6和NXP17对披碱草地上生物干重增加最大,较对照分别增加了5.46和4.37 g,但两者之间差异不显著(P>0.05)。同CK(Pseudomonassp. Jm92)相比,各接种剂处理对披碱草地下生物干重增加显著(P<0.05),其中,接种剂NXY18、 003PWXZ6和NXP17处理对披碱草地下生物干重增加最明显,植株干重分别为3.01、 3.16和2.93 g。
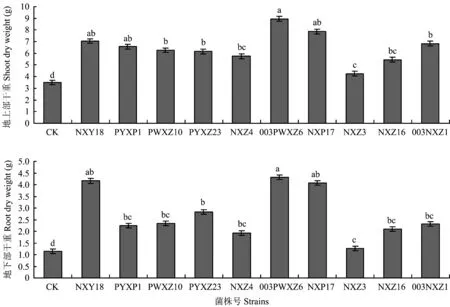
图2 接种剂对披碱草植物干重影响Fig. 2 Effects of inoculation on the dry weight of E. dahuricus[注(Note): 方柱上不同小写字母表示处理间差异显著(P<0.05)Different small letters above the bars indicate significant difference at the 0.05 level.]
2.4接种剂对披碱草根系形态影响
接种剂对披碱草根系形态的影响显著(图3),使用接种剂后各处理均根系发达,侧根较多且细,主根较长; 对照侧根短粗,数量较少,主根较短。与对照相比,所有接种剂对披碱草根总长和根表面积均影响显著(P<0.05),其中,接种剂003PWXZ6对披碱草根总长和根表面积的增加最明显,分别达到245.7025 cm/plant和16.8455 cm2/plant,较对照分别增加了330%和199%; 接种剂NXP17和003PWXZ6对根体积的影响较显著(P<0.05),分别达到0.1060和0.0930 cm3/plant,但两者之间差异不显著(P>0.05),接种剂PYXP1和003NXZ1与对照差异不显著(P>0.05); 接种剂003PWXZ6对根直径的影响较显著(P<0.05),达到0.4034 mm,较对照增加了187.32% (表2)。
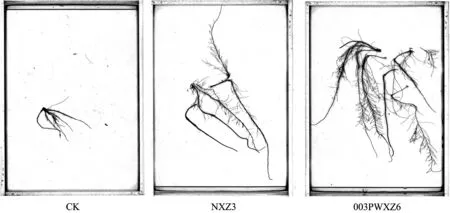
图3 接种剂对根系形态的影响Fig. 3 Root morphology affected by inoculation of strains
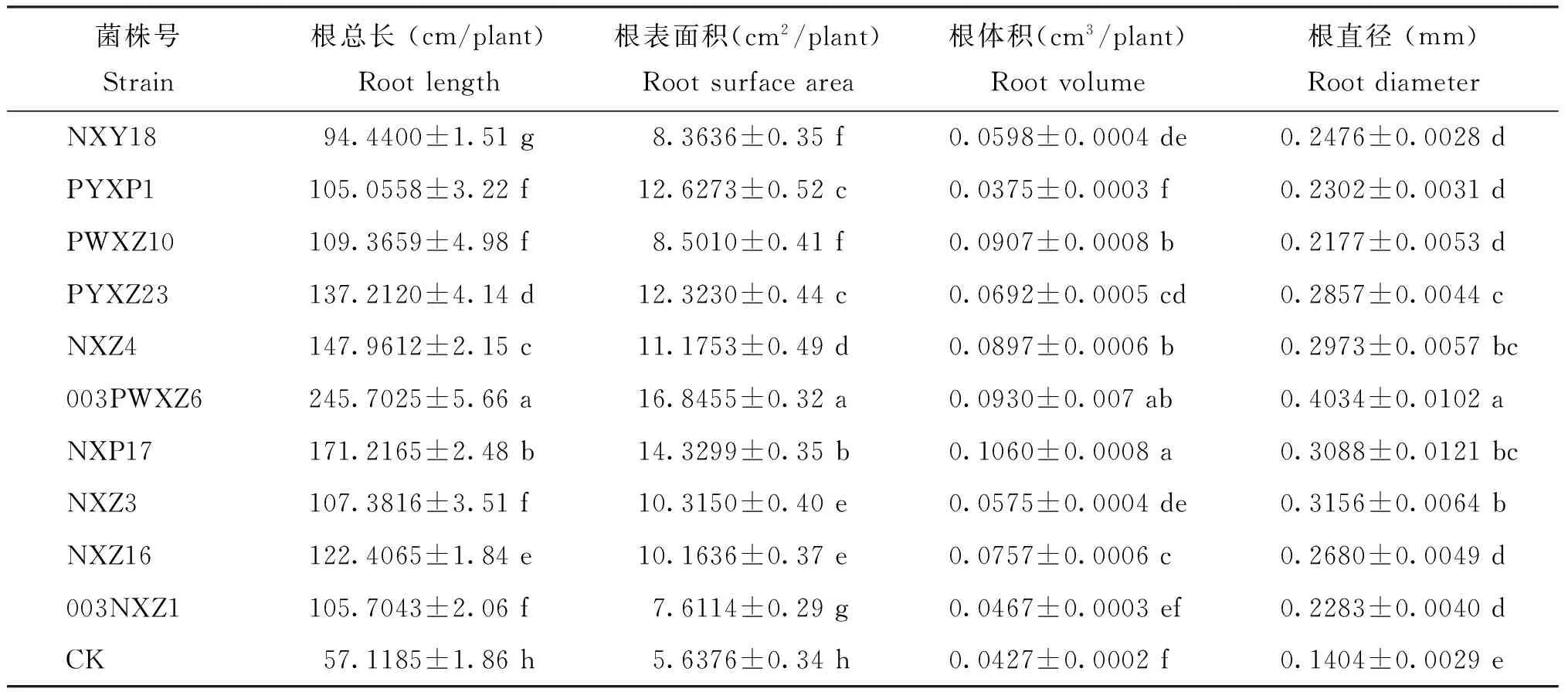
菌株号Strain根总长(cm/plant)Rootlength根表面积(cm2/plant)Rootsurfacearea根体积(cm3/plant)Rootvolume根直径(mm)RootdiameterNXY1894.4400±1.51g8.3636±0.35f0.0598±0.0004de0.2476±0.0028dPYXP1105.0558±3.22f12.6273±0.52c0.0375±0.0003f0.2302±0.0031dPWXZ10109.3659±4.98f8.5010±0.41f0.0907±0.0008b0.2177±0.0053dPYXZ23137.2120±4.14d12.3230±0.44c0.0692±0.0005cd0.2857±0.0044cNXZ4147.9612±2.15c11.1753±0.49d0.0897±0.0006b0.2973±0.0057bc003PWXZ6245.7025±5.66a16.8455±0.32a0.0930±0.007ab0.4034±0.0102aNXP17171.2165±2.48b14.3299±0.35b0.1060±0.0008a0.3088±0.0121bcNXZ3107.3816±3.51f10.3150±0.40e0.0575±0.0004de0.3156±0.0064bNXZ16122.4065±1.84e10.1636±0.37e0.0757±0.0006c0.2680±0.0049d003NXZ1105.7043±2.06f7.6114±0.29g0.0467±0.0003ef0.2283±0.0040dCK57.1185±1.86h5.6376±0.34h0.0427±0.0002f0.1404±0.0029e
注(Note): CK—对照菌株Control strains(Pseudomonassp. Jm92); 数据后不同小写字母表示处理间差异显著(P<0.05)Values followed by different small letters are significantly different at the 0.05 level.
2.5对披碱草氮、 磷含量的影响
由表3可知,接种剂003PWXZ6处理植株地上部分与整株的含磷量和含氮量均较高,显著高于其他处理(P<0.05),整株含磷量和含氮量较对照分别增加了70.45%和14.77%,接种剂003NXZ1、 PYXZ23和NXZ17处理整株含氮量与对照差异不显著(P>0.05); 接种剂PYXZ23、 003PWXZ6和NXP17处理可显著提高植株地上部分粗蛋白含量(P<0.05),其中,接种剂003PWXZ6处理粗蛋白含量较对照增加19.11%。
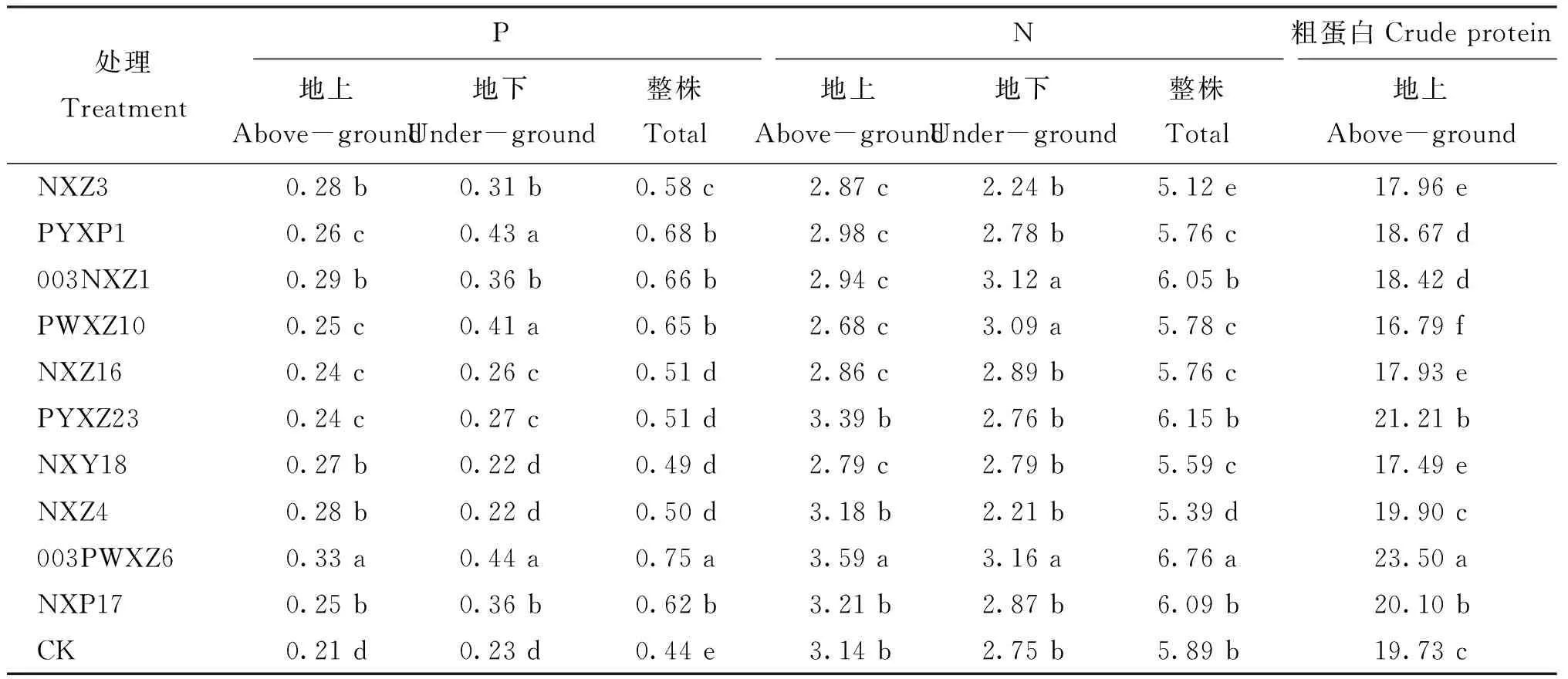
表3 接种菌剂后披碱草磷、 氮及粗蛋白含量 (%)
注(Note): CK—对照菌株Control strains(Pseudomonassp. Jm92); 数据后不同小写字母表示处理间差异显著(P<0.05)Values followed by different small letters are significantly different at the 0.05 level.
2.6PGPR菌株在披碱草根际的定殖
采用抗生素标记法测定PGPR菌株在披碱草根际的定殖能力,各菌株在披碱草根际的数量变化如表4,各菌株均能在披碱草根际成功定殖,但各菌株在根际的数量差异显著,各菌株数量均表现出逐渐增加的变化趋势。在40 d时,菌株003PWXZ6的数量显著多于其他处理(P<0.05),达到1.87×109cfu/g。
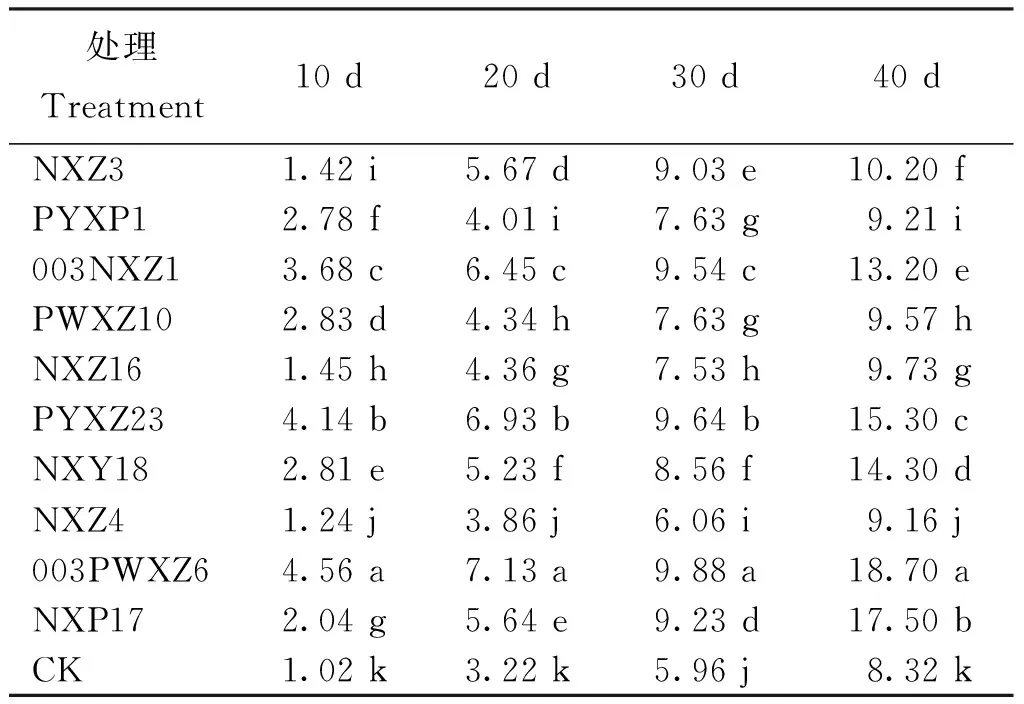
表4 定植后不同时间PGPR菌株在披碱草根际的数量变化(×108 cfu/g)
注(Note): CK—对照菌株Control strains(Pseudomonassp. Jm92); 数据后不同小写字母表示处理间差异显著(P<0.05)Values followed by different small letters are significantly different at the 0.05 level.
3 讨论
3.1促生菌促生特性

3.2接种剂对披碱草生长影响
牧草的生长特性受多种因素制约,其中株高、 根长、 地上和地下植物量等指标能够直接反映牧草生长状况和生产能力;另外,粗蛋白含量是反映牧草营养价值的重要指标,是饲草资源开发及其营养价值评定的主要依据。近年来,国内学者就各种接种剂对植物的促生作用和品质的影响进行了大量的研究,马文彬等[34]研究证实,接种不同处理组合的接种剂对箭筈豌豆生长的影响各异,大多数菌株明显促进箭筈豌豆生长(株高、 根长、 根表面积和生物量)。韩文星等[35]利用从牧草根际筛选的优良促生菌株制作PGPR菌肥,并进行田间完全区组随机试验,研究其对燕麦生长和品质的影响,结果表明燕麦各生育期株高、 地上植物量、 地下植物量均明显高于对照,并能显著增加燕麦粗蛋白和粗脂肪的含量。张堃等[36]研究了不同剂型的联合固氮菌肥对青稞的促生效应和固氮能力的影响,结果表明不同剂型的联合固氮菌肥对青稞的株高、 生物量、 根冠比等都有促进效果。Orhan等[37]采用Bacillussp. M3和OSU-142混合接种剂接种草莓,产量增加75%,茎长增加15%,叶片中的N、 P、 K、 Ca、 Mg、 Fe、 Mn和Zn含量增加,土壤中有效磷的含量从1.55增加到4.71。本研究10种PGPR菌株制成的接种剂对披碱草株高、 生物量及根系形态等生长指标有不同程度的促进作用,但处理之间差异较大。部分可提高披碱草植株的氮、 磷含量,也有部分接种剂并非起到促进效应,可能与菌株的适应能力有关。与对照相比,接种剂003PWXZ6和NXP17可显著增加披碱草的株高和生物量(P<0.05); 接种剂003PWXZ6对披碱草根总长、 根表面积、 根体积、 根直径、 含磷量、 含氮量和粗蛋白含量增加显著(P<0.05),分别较对照增加了330%、 199%、 118%、 187%、 70%、 15%和19%。一般认为,根系形态能反映根系吸收能力的强弱,其强弱直接影响植株对营养物质的吸收,进而影响地上部的生长发育。接种剂003PWXZ6能够显著促进披碱草根系生长的原因可能是该菌株兼具较强溶磷、 固氮和分泌生长素特性。
3.3优良PGPR定殖能力
目前研究促生菌和生防菌在植物体内定殖的方法主要有抗生素标记、 荧光标记法、 电镜观察、 抗血清法及免疫胶体金染色法[38],其中抗利福平标记法为普遍接受和采用的方法,其优点是可以定量分析细菌在植物组织和器官中的定殖量。本研究利用此方法研究了10种促生菌在披肩草根际定殖能力,发现菌株003PWXZ6在披肩草根部土壤以较高数量稳定定殖(1.87×109cfu/g),这可能是由于菌株在披肩草根部能优先利用基质及披碱草根部分泌物等作为生长营养,从而为菌株早期的繁殖、 生长提供了生长条件,使菌株能稳定定殖在土壤中。其定殖能力明显好于其他学者研究的菌株[39-40],促生细菌在植物根际定殖能力主要因菌种和植物品种而异。目前,有学者研究了细菌在植物根际良好定殖的优势,丁婷等[41]研究发现菌株DZJ07-2在小麦根际的定殖能诱导小麦植株根部的PPO、 POD和PAL 3种防御酶活性的提高,在一定程度上增强了小麦对纹枯病的抗性。有关菌株003PWXZ6能在披肩草根际良好定殖的作用机理有待进一步的研究。
[1]葛诚. 微生物肥料生产应用基础[M]. 北京: 中国农业科技出版社, 2000.1-28.
Ge C. Application of microbial fertilizer production[M]. Bingjing: Agricultural Science and Technology Press in China, 2000.1-28.
[2]张瑞福, 颜春荣, 张楠, 等. 微生物肥料研究及其在耕地质量提升中的应用前景[J]. 中国农业科技导报, 2013, 15(5): 8-16.
Zhang R F, Yan C R, Zhang N,etal. Studies on microbial fertilizer and its application prospects in improving arable land quality[J]. Journal of Agricultural Science and Technology, 2013, 15(5): 8-16.
[3]刘静洋, 崔松松, 韩国民, 等. 棉花根际细菌的生理活性和促生效果[J]. 中国土壤与肥料, 2013, (6): 88-92.
Liu J Y, Cui S S, Han G M,etal. The physiological activities and growth-promoting effects of cotton PGPR[J]. Soils and Fertilizers Sciences in China, 2013, (6): 88-92.
[4]Malik K A, Bilal R, Mehnaz S,etal. Association of nitrogen-fixing, plant-growth-promoting rhizobacteria (PGPR) with kallar grass and rice[J]. Plant and Soil, 1997, 194(1-2): 37-44.
[5]Se-Weon L, Seo-Hyun L, Balaraju K,etal. Growth promotion and induced disease suppression of four vegetable crops by a selected plant growth-promoting rhizobacteria (PGPR) strainBacillussubtilis21-1 under two different soil conditions[J]. Acta Physiologiae Plantarum, 2014, 36: 1353-1362
[6]Bhattacharyya P N, Jha D K. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture[J]. World Journal of Microbiology and Biotechnology, 2012, 28: 1327-1350.
[7]张小兰, 韦中, 梅新兰, 等. 一种基于根际定殖能力筛选溶磷菌的方法[J]. 南京农业大学学报, 2014, 37(2): 79-84.
Zhang X L, Wei Z, Mei X L,etal. A method for screening phosphate solubilizing bacteria based on the rhizosphere colonization ability of strains[J]. Journal of Nanjing Agricultural University, 2014, 37(2): 79-84.
[8]俞新玲. 桉树土壤高效解磷菌的筛选及其对桉树生长的影响[D]. 福州: 福建农林大学博士学位论文, 2011.
Yu X L. Screening of high-effect phosphatesoluble microorganisms inEucalyptussoils and that effect on the growth ofEucalyptus[D]. Fuzhou: PhD Dissertation of Fujian Agricultural and Forest University, 2011.
[9]王国基, 柴强, 张玉霞, 等. 干旱区玉米专用菌肥对玉米生长特性的影响[J]. 草地学报, 2015, 23(1): 173-179.
Wang G J, Chai Q, Zhang Y X,etal. Effects of maize special biofertilizer on maize growth in arid area[J]. Acta Agrectir Sinica, 2015, 23(1): 173-179.
[10]高子勤, 张淑香. 连作障碍与根际微生态研究I. 根系分泌物及其生态效应[J]. 应用生态学报, 1998, 9(5): 549-554.
Gao Z Q, Zhang S X. Continuous cropping obstacle and rhizospheric microecology I. Root exudates and their ecological effects[J]. Chinese Journal of Applied Ecology, 1998, 9(5): 549-554.
[11]刘淑琮, 冯炘, 于洁. 植物根际促生菌的研究进展及其环境作用[J]. 湖北农业科学, 2009, 48(11): 2882-2887.
Liu S Z, Feng X, Yu J. Research progress of plant growth-promoting rhizobacteria and its environmental effects[J]. Hubei Agricultural Sciences, 2009, 48(11): 2882-2887.
[12]Belimov A A, Hontzeas N, Safronova V I,etal. Cadmium-tolerant plant growth-promoting bacteria associated with the roots of Indian mustard (BrassicajunceaL. Czern.)[J]. Soil Biology Biochemistry, 2005, 37(2): 241-250.
[13]Sheng X F, Xia J J. Improvement of rape (Brassicanapus) plant growth and cadmium uptake by cadmium-resistant bacteria[J]. Chemosphere, 2006, 64(6): 1036-1042.
[14]卢宝荣. 披碱草属与大麦属系统关系的研究[J]. 植物分类学报, 1997, 35(3): 193-207.
Lu B R. A study on systematic relationships betweenElymusandHordeum(Poaceae)[J]. Acta Phytotaxonomica Sinica, 1997, 35(3): 193-207.
[15]李凤霞, 张德罡, 姚拓. 高寒地区燕麦根际高效PGPR菌培养条件研究[J].甘肃农业大学学报, 2004, 39(3): 316-320.
Li F X, Zhang D G, Yao T. Study on cultural conditions of plant growth promoting rhizobacteria in rhizosphere of oat in alpine region[J]. Journal of Gansu Agricultural University, 2004, 39(3): 316-320.
[16]Pikovskaya R I. Mobilization of phosphorus in soil in connection with the vital activity of some microbial species[J]. Mikrobiologiya, 1948, 17: 362-370.
[17]Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796.
[18]Hafeez F Y, Malik K A. Manual on biofertilizer technology[M]. Pakistan: Nibge, 2000. 132-135.
[19]Malik K A, Bilal R. Survival and colonization of inoculated bacteria in kallar grass rhizosphere and quantification of N2-fixation[A]. Skinner F A, Bodderand R M, Fendrik I. Nitrogen Fixation with Nonlegumes [C]. The Netherlands: Kluwer Academic Publishers, 1989. 301-310.
[20]Sundara Rao W V B, Sinha M K. Phosphate dissolving microorganisms in the soil and rhizosphere[J]. India Journal of Agriculture Science, 1963, 33(4): 272-278.
[21]Boddey R M, Knowles R. Methods for quantification of nitrogen fixation associated with gramineae[J]. Critical Reviews in Plant Sciences, 1987, 6(3): 209-266.
[22]Glick B R. The enhancement of plant growth of free living bacteria[J]. Canadian Journal of Microbiology, 1995, 41: 109-117.
[23]鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 1999.
Bao S D. Soil chemical analysis[M]. Beijing: China Agriculture Press, 1999.
[24]Palus J A, Borneman J, Ludden P W,etal. A diazotrophie bacterial endophyte isolated from stems ofZeamaysL. andZealuxurtansIhis and Doebley[J]. Plant Soil, 1996, 186: 135-142.
[25]马文彬, 姚拓, 荣良燕, 等. 无外源氮素条件下接种促生菌对箭筈豌豆生长及根系特性影响[J]. 草地学报, 2015, 23(3): 496-501.
Ma W B, Yao T, Rong L Y,etal. Effects of PGPR inoculum without exogenous nitrogen on the growth and root system characteristics ofViciasativaL[J]. Acta Agrectia Sinica, 2015, 23(3): 496-501.
[26]朱颖, 姚拓, 李玉娥, 等. 红三叶根际溶磷菌分离及其溶磷机制初探[J]. 草地学报, 2009, 17(2): 259-263.
Zhu Y, Yao T, Li Y E,etal. Screening of phosphate-solubilizing bacteria and their acting mechanisms in the rhizosphere of red clover[J]. Acta Agrectia Sinica, 2009, 17(2): 259-263.
[27]辛桢凯, 龚文琪, 胡纯, 等. 溶磷微生物的选育及除磷研究[J]. 武汉理工大学学报, 2011, (1): 121-124.
Xin Z K, Gong W Q, Hu C,etal. Study on screening of phosphate-solubilizing microbes and their ability of phosphorus removal[J]. Journal of Wuhan University of Technology, 2011(1): 121-124.
[28]冯瑞章, 姚拓, 周万海, 等. 溶磷菌和固氮菌溶解磷矿粉时的互作效应[J]. 生态学报, 2006, 26(8): 2764-2769.
Feng R Z, Yao T, Zhou W H,etal. Studies on the interactions between phosphate-solubilizing bacteria and nitrogen-fixing bacteria in rock phosphate solubilization[J]. Acta Ecologica Sinica, 2006, 26(8): 2764-2769.
[29]赵小蓉, 林启美, 李保国. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J]. 微生物学杂志, 2003, 23(3): 5-7.
Zhao X R, Lin Q M, Li B G. The Relationship between rock phosphate solubilization and pH and organic acid production of microorganisms[J]. Journal of Microbiology, 2003, 23(3): 5-7.
[30]王光华, 周可琴, 金剑. 不同碳源对三种溶磷真菌溶解磷矿粉能力的影响[J]. 生态学杂志, 2004, 23(2): 32-36.
Wang G H, Zhou K Q, Jin J. Effect of different C sources on the solubilization of rock phosphate by three phosphate solubilizing fungi (PSF)[J]. Chinese Journal of Ecology, 2004, 23(2): 32-36.
[31]李永兴, 王继文, 李久蒂, 等. 玉米根际联合固氮菌57-7菌株的基本特性的研究[J]. 微生物学报, 1993, 33(6): 151-158.
Li Y X, Wang J W, Li J D,etal. The study of basic characterization on maize rhizosphere associative nitrogen fixation bacteria 57-7[J]. Acta Microbiologica Sinica, 1993, 33(6):151-158.
[32]Malik K A, Rasul G, Hassan U,etal. Role of N2fixation and growth hormones producing bacteria in improving growth of wheat and rice [A]. Hegazi N A, Fayez M, Monib M. Proceedings of 6th international Symposium on “Nitrogen Fixation with Non-legumes”[C]. Ismailia, Egypt Cairo University, 1994. 409-422.
[33]Esitken A, Yildiz H E, Ercisli S,etal. Effects of plant growth promoting bacteria (PGPB) on yield, growth and nutrient contents of organically grown strawberry[J]. Science and Hortic-Amsterdam, 2010, 124: 62-66.
[34]马文彬, 姚拓, 王国基, 等. 根际促生菌筛选及其接种剂对箭筈豌豆生长影响的研究[J]. 草业学报, 2014, 23(5): 241-248.
Ma W B, Yao T, Wang G J,etal. Assessment of rhizobacteria strains forViciasativa[J]. Acta Prataculturae Sinica, 2014, 23(5): 241-248.
[35]韩文星, 姚拓, 席琳乔, 等. PGPR菌肥制作及其对燕麦生长和品质影响的研究[J]. 草业学报, 2008, 17(4): 75-84.
Han W X, Yao T, Xi Q L,etal. PGPR bio-fertilizers producing and its effect on Arena sativa growth and quality development[J]. Acta Prataculturae Sinica, 2008, 17(4): 75-84.
[36]张堃, 姚拓, 张德罡, 等. 高寒地区联合固氮菌肥对青稞的促生效应研究[J]. 植物营养与肥料学报, 2010, 16(3): 708-713.
Zhang K, Yao T, Zhang D G,etal. Effects of associative nitrogen-fixing biofertilizer on growth ofHordeumvulgarein alpine region[J]. Plant Nutrition and Fertilizer Science, 2010, 16(3): 708-713.
[37]Orhan E, Esitken A, Ercisli S,etal. Effects of plant growth promoting rhizobacteria (PGPR) on yield, growth and nutrient contents in organically growing raspberry[J]. Scientia Horticulturae, 2006, 110: 38-43.
[38]高增贵, 庄敬华, 陈捷, 等. 应用免疫胶体金银染色技术定位玉米内生细菌[J]. 植物病理学报, 2005, 35(3): 262-266.
Gao Z G, Zhuang J H, Chen J,etal. Detection of endophytic Bacillus subtilis B20-006 in corn plant with immuno-gold silver staining techniques[J]. Acta Phytopathologica Sinica, 2005, 35(3): 262-266.
[39]魏娇洋, 冯龙, 陈英化, 等. 解淀粉芽孢杆菌X-278片剂的研制、 定殖及田间防效[J]. 农药学学报, 2014, 16(3): 347-353.
Wei J Y, Feng L, Chen Y H,etal. Development, colonization and field control efficacy ofBacillusamyloiquefaciensX-278 tablets[J]. Chinese Journal of Pesticide Science, 2014, 16(3): 347-353.
[40]杨洪凤, 余向阳, 薛雅蓉, 等. 内生解淀粉芽孢杆菌CC09在小麦根部定殖的电镜观察及防病效果[J]. 中国生物防治学报, 2014, 30(6): 839-844.
Yang H F, Yu X Y, Xue Y R,etal. Colonization of endophyticBacillusamyloliquefaciensCC09 in wheat roots observed under transmission electron microscopy and its biocontrol efficiency against diseases[J]. Chinese Journal of Biological Control, 2014, 30(6): 839-844.
[41]丁婷, 孙微微, 韩亚惠, 等. 杜仲内生真菌DZJ07在小麦根际定殖及对根部酶活的影响[J]. 核农学报, 2015, 29(6): 1149-1157.
Ding T, Sun W W, Han Y H,etal. Rhizosphere colonization and effects of an endophytic fungus DZJ07 fromEucommiaulmoideson enzyme activities of wheat root[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(6): 1149-1157.
Identification of plant growth promoting rhizobacteriaElymusdahuricusand their effectives
MA Cong-yu1, ZHANG Ying2, SUN Guang-zheng1, 3, LIU Ting1, YAO Tuo1*
(1CollegeofPratacultureScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/Sino-USCentersforGrazinglandEcosystemSustainability,Lanzhou730070,China; 2DepartmentofGrasslandScience,AgricultureandAnimalHusbandryCollege,QinghaiUniversity,Xining810016,China; 3StateKeyLaboratoryofCropStressBiologyforAridAreas/CollegeofPlantProtection,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objectives】 The ability of external growth promotion is an important indicator to measure the microbiological strain. To measure the selected plant growth promoting rhizobacteria and clarify their promoting growth efficiency toElymusdahuricuscanprovide the basis for the application in production.【Methods】 The root morphology ofElymusdahuricusand rhizosphere soil were collected from Ali Region of Tibet in September 2014. Ten rhizobacteria strains, which could dissolve P, fix N and excrete 3-indole acetic acid (IAA) were isolated from root and rhizosphere soil with the conventional separation method of bacteria. The capacity of dissolving P and excreting IAA, the activity of fixing N in rhizosphere were investigated, and the effect of rhizobacteria inoculants on the growth ofElymusdahuricuswere assessed.【Results】 Strains PWXZ10, 003PWXZ6, NXP17 showed the strongest phosphate solubilizing capacity (40.89 mg/L), nitrogenase activity [421.21 nmol/(mL·h)], and IAA secreting ability (31.33 μg/mL), respectively. Compared with the control strainsPseudomonassp. Jm92, inoculum 003PWXZ6 and NXP17 significantly increased plant height, aboveground biomass and underground biomass (P<0.05), but the increase effects were not significantly different between the two strains (P>0.05). In addition, inoculum 003PWXZ6 significantly increased root length, root surface area, root volume, root diameter, phosphorus content, containing nitrogen and crude protein content (P<0.05). Compared with the control strainsPseudomonassp. Jm92, above items were improved by 330%, 199%, 118%, 187%, 70%, 15%, and 19%, respectively, showing the strongest colonization ability in the rhizosphere.【Conclusions】 These results suggest that strains 003PWXZ6 and NXP17 has the best growth promoting effect toElymusdahuricusamong the strains. Therefore the strain resources is potential for the development of economy and environmental protection.
plant growth promoting rhizobacteria (PGPR); inoculums;Elymusdahuricus; growth; root
2015-11-05接受日期: 2016-03-15
国家自然科学基金项目(31360584, 31260025)资助。
马骢毓 (1987—), 女, 甘肃兰州人, 博士研究生, 主要从草地生物多样性研究。 E-mail: 1401893955@qq.com
E-mail: yaotuo@gsau.edu.cn
S543+.9; S154.3
A
1008-505X(2016)04-1039-10

