钙卫蛋白在肾脏缺血再灌注损伤大鼠中的表达及其作用*
陈萍祯, 朱 晔, 张慧涛, 徐晓嫦, 郑 晶, 贾 宁, 林宇静, 李玲玲, 张 桦△
(中山大学附属第五医院1肾内科,2病理科,3中心实验室,广东珠海519000)
钙卫蛋白在肾脏缺血再灌注损伤大鼠中的表达及其作用*
陈萍祯1, 朱 晔1, 张慧涛1, 徐晓嫦1, 郑 晶1, 贾 宁1, 林宇静2, 李玲玲3, 张 桦1△
(中山大学附属第五医院1肾内科,2病理科,3中心实验室,广东珠海519000)
目的:探讨钙卫蛋白(CALP)在肾脏缺血再灌注损伤(IRI)大鼠中的表达及其在炎症反应中的作用。方法:50只雄性SD大鼠随机分为IRI组和假手术组(sham组),每组25只。各组分别于缺血再灌注后6 h、12 h、24 h、48 h和72 h观察肾脏病理改变,检测大鼠血清尿素氮(BUN)和肌酐(SCr)水平,ELISA法检测大鼠血清CALP、肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6的含量,免疫组织化学法和Western blot法分别检测大鼠肾脏CALP、Toll样受体4(TLR4)和NF-κB p65蛋白表达水平。结果:IRI组大鼠肾脏呈现不同程度的肾小管上皮细胞和间质损伤,伴炎细胞浸润。血清BUN、SCr、CALP及促炎细胞因子TNF-α、IL-6的含量在各时点均显著高于sham组(P<0.05)。CALP、TLR4和NF-κB p65主要表达于肾小管上皮细胞胞质中,在IRI组呈高表达,在各时点各因子的表达与sham组相比均显著增强(P<0.05)。结论:肾脏IRI大鼠的血清CALP、TNF-α和IL-6水平升高,CALP、TLR4和NF-κB p65在肾组织中表达增强。CALP在大鼠肾脏IRI的炎症反应中可能起重要作用。
肾脏;缺血再灌注损伤;钙卫蛋白;Toll样受体4
肾脏缺血再灌注损伤(ischemia-reperfusion injury,IRI)是引起急性肾损伤(acute kidney injury,AKI)的常见原因,也是心肺复苏、肾移植、多种类型休克、造影剂肾病等临床事件中不可避免的重要环节。缺血再灌注引发肾脏持续的病理生理学改变,如细胞凋亡、炎症反应、氧化应激、内皮功能障碍、肾小管堵塞和回漏等,加重缺血本身所致损伤,而其中的炎症反应是近年研究的热点[1-4]。
Toll样受体4(Toll-like receptor 4,TLR4)通过与生物配体相互识别并结合,激活细胞内信号转导,促发下游通路核因子(nuclear factor,NF)-κB活化,诱导促炎细胞因子TNF-α、IL-1β、IL-6等的产生和释放,从而引起和加重组织的炎症损伤[5-8]。近年研究表明,由S100蛋白家族成员S100A8和S100A9两种蛋白通过钙离子连接形成的异二聚体——钙卫蛋白(calprotectin,CALP)可作为内源性危险信号分子通过激活膜受体TLR4介导细胞内炎症信号转导,从而激活免疫效应细胞,参与到炎症免疫反应,故与炎症的病理生理过程密切相关[9-10]。为了探讨在肾脏IRI 中CALP是否通过TLR4/NF-κB通路参与肾脏IRI的炎症反应,本实验通过建立大鼠肾脏IRI模型,观察大鼠血清CALP、TNF-α和IL-6的变化,检测肾组织CALP、TLR4和NF-κB p65的蛋白表达水平,以探讨CALP在大鼠肾脏IRI炎症反应中的可能作用。
材料和方法
1 实验动物和主要试剂
健康雄性、SPF级Sprague-Dawley(SD)大鼠50只,体质量220~250 g,购于中山大学实验动物中心[合格证号为SCXK(粤)2011-0029],饲养于动物实验室SPF级环境。
CALP ELISA试剂盒(上海源叶);大鼠TNF-α 和IL-6 ELISA试剂盒、兔抗大鼠TLR4多克隆抗体、兔抗大鼠NF-κB p65多克隆抗体、辣根过氧化物酶标记山羊抗兔、小鼠多克隆抗体及组织蛋白抽提试剂(武汉博士德);小鼠抗大鼠CALP单克隆抗体(Abcam);小鼠抗人CALP单克隆抗体(Santa Cruz); PVDF膜(Millipore);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)等试剂(艺佳生物)。
2 实验方法
2.1 研究对象及分组 大鼠适应性喂养1周后,随机分为IRI组和假手术组(sham组),每组25只。
2.2 模型建立和标本采集 大鼠术前禁食8 h,不禁水,10%水合氯醛(3.5 mL/kg)腹腔注射麻醉,常规固定、消毒、铺巾,腹正中切口,游离肾蒂,IRI组用无创小血管夹同时阻断双侧肾蒂50 min,之后松开血管夹,血流再通;sham组手术方式同IRI组,但不阻断肾蒂血流。各组分别于再灌注后6 h、12 h、24 h、48 h和72 h取血(腹主动脉穿刺法)和采集肾脏标本。右肾用冰生理盐水冲洗后置液氮保存,待Western blot法测定蛋白;左肾用10%甲醛固定缓冲液固定,待制备石蜡切片。
2.3 检测指标及方法 全自动生化分析仪检测大鼠血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)水平;ELISA法检测大鼠血清CALP、TNF-α和IL-6含量,具体步骤按各试剂盒说明书进行;肾组织石蜡切片行苏木素-伊红(HE)染色,光镜下观察病理学改变;免疫组织化学法检测大鼠肾组织CALP、TLR-4和NF-κB p65的表达水平:石蜡切片常规脱蜡,梯度乙醇水化,柠檬酸盐(检测CALP时用EDTA)抗原修复液高温高压修复,3%过氧化氢阻断内源性过氧化物酶,5%牛血清白蛋白室温封闭,滴加适当浓度I抗,4℃过夜孵育,复温,滴加II抗,二氨基联苯氨显微镜下控制显色,复染细胞核、分化、返蓝,梯度乙醇脱水干燥,中性树胶封片。各指标均用磷酸盐缓冲液(PBS)代替I抗作为空白对照。细胞质染色呈棕黄色为阳性结果。Western blot法检测肾组织CALP、TLR-4和NF-κB p65的表达:大鼠肾组织称重后,加入100 g/L的裂解液制备组织匀浆,匀浆转入EP管,加入PMSF(100 mmol/ L),冰浴裂解30 min,于4℃下12 000 r/min离心15 min,取上清液,测定蛋白含量。取肾组织匀浆蛋白100 μg与等体积的缓冲液混合,煮沸10 min,经10% SDS-PAGE电泳分离蛋白质,转移至硝酸纤维素膜上,2%脱脂奶粉封闭膜,室温1 h,加入小鼠抗人CALP(1∶200)单克隆抗体、兔抗大鼠TLR4(1∶200) 和NF-κB p65(1∶200)多克隆抗体,4℃孵育过夜,TBST洗膜3次,加辣根过氧化物酶标记的II抗,37℃孵育30 min,TBST洗膜3次,化学发光试剂处理后于暗室曝光。将胶片进行扫描存档,Alpha软件处理系统分析目标带的吸光度值。以GAPDH为内参照行吸光度分析,比较目的条带/内参照条带灰度值,测定各组蛋白质的相对含量。
3 统计学处理
应用SPSS 20.0软件进行统计分析。计量资料采用均数±标准差(mean±SD)表示。两组间的均数比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结果
1 肾脏病理学改变
Sham组的肾小球、肾小管及肾间质结构基本正常。IRI组大鼠随再灌注时间的延长出现不同程度的肾脏病理改变,可见肾小管上皮细胞浑浊肿胀,出现水样或空泡样变,刷状缘消失,部分小管上皮细胞凝固性坏死、脱落,小管腔内可见细胞管型,间质水肿及炎细胞浸润,而肾小球病变不明显。
2 肾功能改变
IRI组大鼠的BUN和SCr于再灌注6 h即显著升高,且随着再灌注时间的延长呈进行性升高,于24 h达高峰,之后逐渐下降,在各时点均显著高于sham 组(P<0.05),见表1。
3 血清CALP、TNF-α和IL-6含量的变化
IRI组大鼠血清CALP、TNF-α和IL-6含量于再灌注6 h即显著升高,且随着再灌注时间的延长呈进行性升高,于24 h达高峰,之后逐渐下降,在各时点均显著高于sham组(P<0.05),见表1。
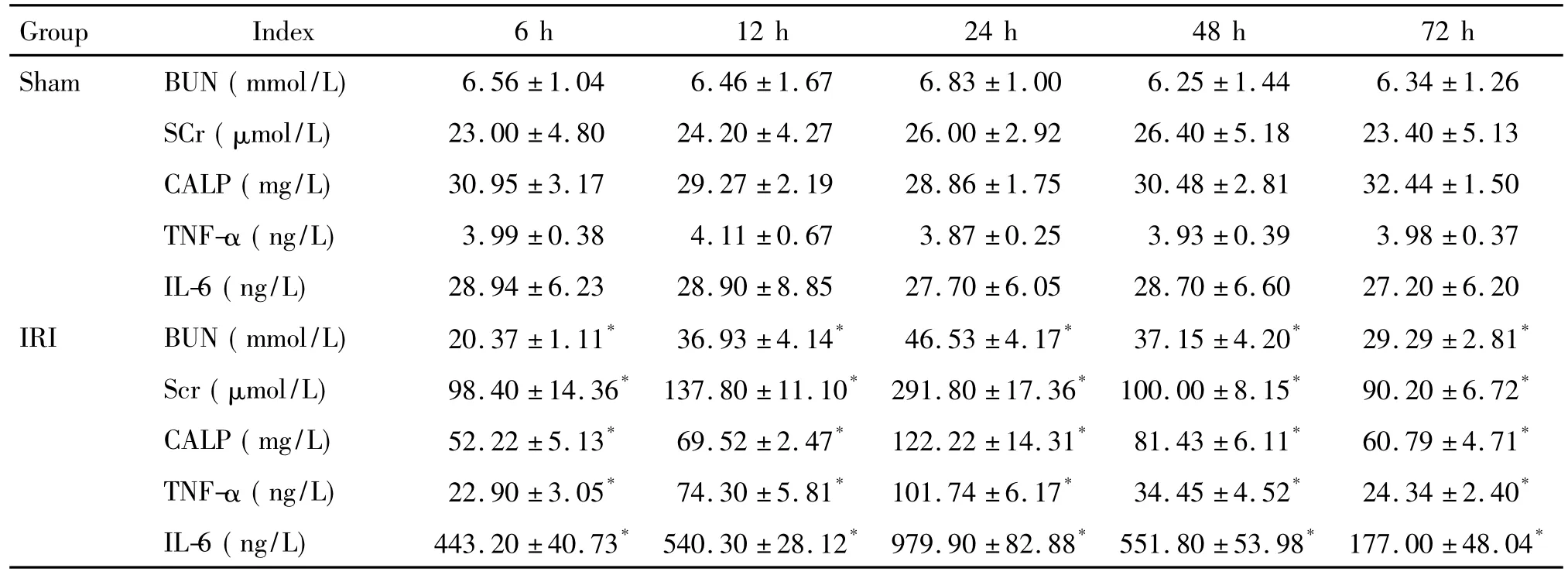
表1 各组大鼠血清BUN、SCr、CALP、TNF-α和IL-6含量的变化Table 1.The serum levels of BUN,SCr,CALP,TNF-α and IL-6 in rats(Mean±SD.n=5)
4 肾组织CALP、TLR4和NF-κB p65蛋白的表达
4.1 免疫组化结果 CALP、TLR4和NF-κB p65主要在肾小管上皮细胞胞质中表达,sham组表达较弱,IRI组则呈高表达,于再灌注6 h即有明显表达,于再灌注24 h表达最强,之后表达减弱,见图1~3。

Figure 1.The expression of CALP in the renal tissue of the rats(immunohistochemical staining,×200).A:sham group;B:reperfusion for 6 h in IRI group;C:reperfusion for 12 h in IRI group;D:reperfusion for 24 h in IRI group;E:reperfusion for 48 h in IRI group;F:reperfusion for 72 h in IRI group.图1 各组大鼠肾组织CALP的表达
4.2 Western blot检测结果 CALP、TLR4和NF-κB p65在sham组大鼠肾组织有弱表达,而在IRI组则呈高表达,且随着再灌注时间延长表达逐渐增强,于再灌注24 h达到峰值,在各时点的表达水平均显著高于sham组(P<0.05),见图4。
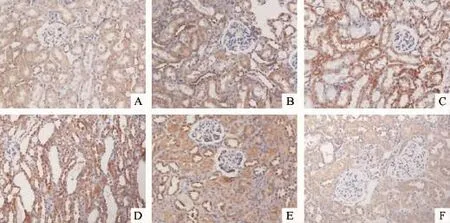
Figure 2.The expression of TLR4 in the renal tissue of the rats(immunohistochemical staining,×200).A:sham group;B:reperfusion for 6 h in IRI group;C:reperfusion for 12 h in IRI group;D:reperfusion for 24 h in IRI group;E:reperfusion for 48 h in IRI group;F:reperfusion for 72 h in IRI group.图2 各组大鼠肾组织TLR4的表达
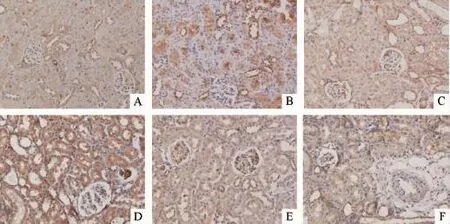
Figure 3.The expression of NF-κB p65 in the renal tissue of the rats(immunohistochemical staining,×200).A:sham group;B: reperfusion for 6 h in IRI group;C:reperfusion for 12 h in IRI group;D:reperfusion for 24 h in IRI group;E:reperfusion for 48 h in IRI group;F:reperfusion for 72 h in IRI group.图3 各组大鼠肾组织NF-κB p65的表达
讨论
研究表明,炎症反应是肾脏IRI的一个重要的病理生理机制,也是AKI的首要启动及贯穿因素[2-4]。本实验观察到,IRI组大鼠血清炎性因子TNF-α和IL-6含量显著增加,并随着再灌注时间的延长呈现进行性升高;同时,大鼠血清BUN和SCr水平显著升高,且与血清TNF-α和IL-6的浓度变化趋势一致。在肾脏病理上,呈现急性肾小管和间质的损伤,伴显著炎性细胞浸润,且肾脏病理改变随着再灌注时间延长逐渐加重。上述结果和本课题组前期研究一致,说明缺血再灌注诱发了炎症反应的发生,并导致肾脏的功能和病理异常。
近年研究发现[5-8,11-12],TLR4可作为“门户”蛋白启动机体的炎症链式反应,此作用在跨膜信号转导受体家族Toll样受体(Toll-like receptors,TLRs)中占有重要位置。TLRs能通过识别外源性病原相关分子模式监控微生物入侵,也能通过识别内源性危险相关分子模式(damage-associated molecular pattern,DAMP)诱导无菌性炎症反应而参与组织损伤。TLRs与配体结合后,可导致下游信号转导途径如NF-κB、丝裂原活化蛋白激酶的激活,从而诱导促炎细胞因子如 TNF-α、IL-1β、IL-6等的分泌与表达。TLR4是TLRs家族的重要成员,它不仅可识别革兰氏阴性细菌壁成分脂多糖,还能识别诸多内源性分子如热休克蛋白70、高迁移率族蛋白1等而活化。鉴于热休克蛋白70在器官IRI过程中可能发挥保护性作用[13],而高迁移率族蛋白1是一种晚期炎症因子[11,14],因此寻找IRI过程中的早期激活TLR4的内源性配体,从TLR4信号通路的源头早期控制炎症反应,对于预防肾脏IRI具有重要意义。
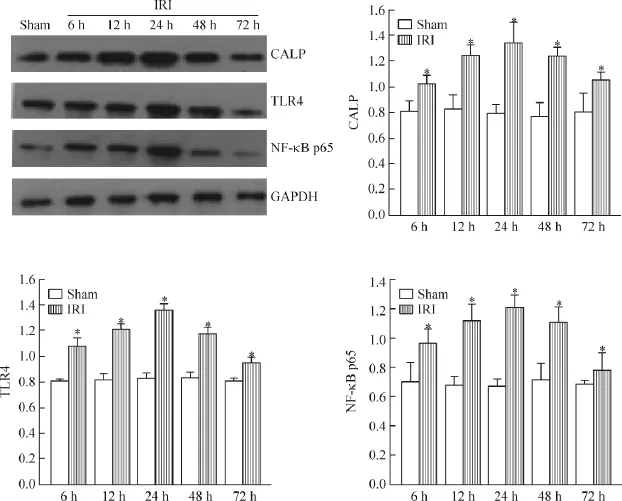
Figure 4.The protein expression of CALP,TLR4 and NF-κB p65 in the renal tissues of the rats detected by Western blot.Mean± SD.n=3.*P<0.05 vs sham group.图4 Western blott检测各组大鼠肾组织CALP、TLR4和NF-κB p65蛋白的表达
S100A8和S100A9是S100蛋白家族成员,是能够结合钙离子的胞质分子,在体内两者可通过钙离子连接起来形成异二聚体CALP(S100A8/S100A9),表达在中性粒细胞、单核细胞和早期分化的巨噬细胞等细胞表面[9,15-16]。在生理状态下,CALP具有参与细胞骨架建立、调节钙离子稳态等功能,不具备促炎活性[9,15]。在炎症、肿瘤等病理状态下,由于细胞坏死或吞噬细胞激活,CALP可释放到细胞外而作为DAMP激活免疫效应细胞,参与到中性粒细胞的招募、炎性因子及黏附分子的诱导生成等病理生理过程[17-18]。
临床上CALP作为炎症标志物常用来协助诊断和监测类风湿性关节炎[19]、炎症性肠病[20]等炎症相关性疾病,而其在肾脏病中的研究尚少。近年Heller等[21]发现,肾性AKI患者尿液CALP水平是肾前性患者的60.7倍,而Seibert等[22]的报道进一步证实上述结果,肾性AKI患者尿液CALP水平较肾前性患者显著升高,尿液CALP水平可作为鉴别肾前性和肾性AKI的一个诊断标志物,其敏感性和特异性高于中性粒细胞明胶酶相关脂质运载蛋白。CALP既然与AKI密切相关,那么深入研究CALP在肾脏IRI中的作用及其机制,对早期预测和防范AKI危险事件的发生有着重要意义和实用价值。CALP是否参与或通过什么信号通路介导肾脏IRI的发生与病理生理过程?CALP在IRI中的肾脏组织的表达及分布情况如何?目前鲜有文献报道。
本实验结果显示,在IRI组大鼠血清CALP含量于再灌注6 h即显著升高,且随着再灌注时间的延长呈进行性升高,并与血清TNF-α和IL-6含量升高相一致,而肾组织中CALP、TLR4及NF-κB p65表达明显增强,CALP表达与TLR4和NF-κB p65表达水平相平行,且各蛋白表达的高峰时间与血清TNF-α和IL-6水平一致,均于再灌注24 h达到高峰,之后逐渐减弱,变化趋势也与肾功能和肾脏病理改变相吻合。结果提示在肾IRI的早期,CALP对肾脏IRI的发生发展起重要作用,而且很可能作为危险相关分子模式,通过激活膜受体TLR4介导细胞内炎症信号的转导,促进NF-κB p65的表达及炎性因子的释放,加重缺血后的再灌注损伤。Vogl等[9]在实验性脓毒症休克小鼠模型中也证实,CALP可作为TLR4的内源性配体,通过识别并与TLR4结合而激活下游炎症信号通路,加剧小鼠的死亡。
虽然肾脏IRI的机制非常复杂,有多种信号通路交互影响及多种细胞因子共同作用,但本实验初步揭示,通过激活膜受体TLR4介导细胞内炎症信号转导是CALP蛋白参与炎症反应的一个重要途径。抑制CALP介导的信号转导,有望为早期防治AKI提供新靶点。
[1] Menke J,Sollinger D,Schamberger B,et al.The effect of ischemia/reperfusion on the kidney graft[J].Curr Opin Organ Transplant,2014,19(4):395-400.
[2] Bonventre JV,Yang L.Cellular pathophysiology of ischemic acute kidney injury[J].J Clin Invest,2011,121 (11):4210-4221.
[3] Eltzschig HK,Eckle T.Ischemia and reperfusion:from mechanism to translation[J].Nat Med,2011,17(11): 1391-1401.
[4] Furuichi K,Wada T,Kaneko S,et al.Roles of chemokines in renal ischemia/reperfusion injury[J].Front Biosci,2008,13:4021-4028.
[5] Gluba A,Banach M,Hannam S,et al.The role of Tolllike receptors in renal diseases[J].Nat Rev Nephrol,2010,6(4):224-235.
[6] Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.
[7] Vallés PG,Lorenzo AG,Bocanegra V,et al.Acute kidney injury:what part do toll-like receptors play?[J].Int J Nephrol Renovasc Dis,2014,7:241-251.
[8] Mudaliar H,Pollock C,Panchapakesan U.Role of Tolllike receptors in diabetic nephropathy[J].Clin Sci (Lond),2014,126(10):685-694.
[9] Vogl T,Tenbrock K,Ludwig S,et al.Mrp8 and Mrp14 are endogenous activators of Toll-like receptor 4,promoting lethal,endotoxin-induced shock[J].Nat Med,2007,13(9):1042-1049.
[10]Loser K,Vogl T,Voskort M,et al.The Toll-like receptor 4 ligands Mrp8 and Mrp14 are crucial in the development of autoreactive CD8+T cells[J].Nat Med,2010,16 (6):713-717.
[11]Yu M,Wang H,Ding A,et al.HMGB1 signals through Toll-like receptor(TLR)4 and TLR2[J].Shock,2006,26(2):174-179.
[12]Eleftheriadis T,Pissas G,Liakopoulos V,et al.Toll-like receptors and their role in renal pathologies[J].Inflamm Allergy Drug Targets,2012,11(6):464-477.
[13]Zeng Z,Kim JY,Ma H,et al.Anti-inflammatory effects of the 70 kDa heat shock protein in experimental stroke [J].J Cereb Blood Flow Metab,2008,28(1):53-63.
[14]唐道林,康 睿,肖献忠,等.晚期炎症介质HMGB1的生理作用[J].中国病理生理杂志,2005,21(7):1426-1430.
[15]Gebhardt C,Németh J,Angel P,et al.S100A8 and S100A9 in inflammation and cancer[J].Biochem Pharmacol,2006,72(11):1622-1631.
[16]Pepper RJ,Hamour S,Chavele KM,et al.Leukocyte and serum S100A8/S100A9 expression reflects disease activity in ANCA-associated vasculitis and glomerulonephritis[J].Kidney Int,2013,83(6):1150-1158.
[17]Ryckman C,Vandal K,Rouleau P,et al.Proinflammatory activities of S100:proteins S100A8,S100A9,and S100A8/A9 induce neutrophil chemotaxis and adhesion [J].J Immunol,2003,170(6):3233-3242.
[18]Ehrchen JM,Sunderkotter C,Foell D,et al.The endogenous Toll-like receptor 4 agonist S100A8/S100A9(calprotectin)as innate amplifier of infection,autoimmunity,and cancer[J].J Leukoc Biol,2009,86(3):557-566.
[19]Abildtrup M,Kingsley GH,Scott DL.Calprotectin as a biomarker for rheumatoid arthritis:a systematic review [J].J Rheumatol,2015,42(5):760-770.
[20]Mosli MH,Zou G,Garg SK,et al.C-reactive protein,fecal calprotectin,and stool lactoferrin for detection of endoscopic activity in symptomatic inflammatory bowel disease patients:a systematic review and meta-analysis[J].Am J Gastroenterol,2015,110(6):802-820.
[21]Heller F,Frischmann S,Grunbaum M,et al.Urinary calprotectin and the distinction between prerenal and intrinsic acute kidney injury[J].Clin J Am Soc Nephrol,2011,6 (10):2347-2355.
[22]Seibert FS,Pagonas N,Arndt R,et al.Calprotectin and neutrophil gelatinase-associated lipocalin in the differentiation of pre-renal and intrinsic acute kidney injury[J].Acta Physiol,2013,207(4):700-708.
(责任编辑:卢 萍,罗 森)
Expression of calprotectin in rats with renal ischemia-reperfusion injury
CHEN Ping-zhen1,ZHU Ye1,ZHANG Hui-tao1,XU Xiao-chang1,ZHENG Jing1,JIA Ning1,LIN Yu-jing2,LI Ling-ling3,ZHANG Hua1
(1Department of Nephrology,2Department of Pathology,3Centre of Laboratory,The Fifth Affiliated Hospital of Sun Yat-sen University,Zhuhai 519000,China.E-mail:zh3196@126.com)
AIM:To investigate the expression of calprotectin(CALP)in the rats with renal ischemia-reperfusion injury(IRI).METHODS:Male Sprague-Dawley rats were randomly divided into sham operation and IRI group(n= 25 in each group).Blood samples and the kidneys were obtained at 6 h,12 h,24 h,48 h and 72 h after reperfusion.The pathological changes of the kidneys were observed.The serum concentrations of blood urea nitrogen(BUN)and serum creatinine(SCr)were measured.The serum levels of CALP,tumor necrosis factor-α(TNF-α)and interleukin-6(IL-6) were detected by ELISA,and the expression of CALP,Toll-like receptor 4(TLR4)and NF-κB p65 in the renal tissues were determined by the methods of immunohistochemistry and Western blot.RESULTS:Different serial ischemia changes were observed in the renal tissues,mainly in the renal tubular epithelial cells and the mesenchyma,with the infiltration of inflammatory cells.The serum levels of BUN,SCr,CALP,TNF-α and IL-6 in IRI group were markedly increased as compared with sham group(P<0.05).The protein expression of CALP,TLR4 and NF-κB p65 in the renal tubular epithelial cells in IRI group was greatly enhanced in comparison with that in sham group(P<0.05).CONCLUSION:The serum concentrations of CALP,TNF-α and IL-6,and the protein expression levels of CALP,TLR4 and NF-κB p65 in the renal tissue are significantly increased in the rats with IRI,suggesting that calprotectin plays an important role in the inflammation in rats with IRI.
Kidney;Ischemia-reperfusion injury;Calprotectin;Toll-like receptor 4
R363.2+1
A
10.3969/j.issn.1000-4718.2016.07.027
1000-4718(2016)07-1317-06
2016-02-02
2016-03-16
广东省自然科学基金资助项目(No.S2013010016698);珠海市医学科研基金资助项目(No.201504)
△Tel:0756-2528189;E-mail:zh3196@126.com

