SREBP-2沉默抑制衣霉素诱导的软骨细胞内质网应激
谢 静, 史栋梁, 郭会卿
(河南省中医院风湿骨病科,河南郑州450002)
SREBP-2沉默抑制衣霉素诱导的软骨细胞内质网应激
谢 静, 史栋梁, 郭会卿△
(河南省中医院风湿骨病科,河南郑州450002)
目的:探究固醇调节元件结合蛋白2(SREBP-2)对衣霉素诱导的软骨细胞内质网应激(ERS)的影响。方法:分离人正常软骨细胞和骨关节炎(OA)软骨细胞培养,衣霉素和SREBP-2 siRNA分别处理正常软骨细胞。24 h后,实时荧光定量PCR检测对微小RNA-185(miR-185)表达的影响,流式细胞术检测对细胞凋亡的影响,Western blot法检测对SREBP-2、CHOP、p-eIF2α和ATF4等ERS相关蛋白,Bcl-2、Bax和caspase-3等凋亡相关蛋白水平的影响;caspase-3活性试剂盒检测对细胞caspase-3活性的影响。结果:与对照组相比,OA组和衣霉素组SREBP-2表达增加,miR-185表达降低(P<0.05)。SREBP-2 siRNA转染可明显阻断衣霉素引起的miR-185降低(P<0.05)。miR-185过表达能够下调SREBP-2蛋白水平(P<0.05)。与对照组相比,OA组和衣霉素组CHOP、peIF2α和ATF4的蛋白水平明显上调,Bcl-2表达下调,Bax和caspase-3表达增加(P<0.05);SREBP-2沉默处理则显著逆转上述蛋白表达(P<0.05)。细胞凋亡率与上述细胞凋亡相关蛋白的变化趋势一致(P<0.05)。与衣霉素组相比,SREBP-2 siRNA转染明显下调caspase-3活性,miR-185抑制则明显逆转上述作用(P<0.05)。结论: SREBP-2沉默可通过上调miR-185抑制衣霉素诱导的软骨细胞ERS和细胞凋亡。
固醇调节元件结合蛋白2;衣霉素;内质网应激;软骨细胞;微小RNA-185
骨关节炎(osteoarthritis,OA)是一种常见的以关节软骨退行性病变和继发性骨质增生为特征,并伴随关节周围滑膜炎症的慢性关节疾病。研究表明,软骨细胞凋亡为软骨退变的主要诱因和分子生物学基础。其中,氧化损伤、炎症损伤、免疫功能失衡等病理机制在该病发生发展过程中扮演着重要角色。内质网应激(endoplasmic reticulum stress,ERS)是由各种刺激引起的亚细胞器病理状态,因内质网腔内错误折叠蛋白积聚而产生的一种适应性反应。文献显示,衣霉素(tunicamycin,Tuni)处理的软骨细胞可作为研究OA疾病发展的细胞模型[1],衣霉素通过引起ERS导致软骨细胞凋亡[2]。因此,可通过阻断ERS,减少软骨细胞凋亡,进而降低OA患者的软骨缺失,最终防治OA发生与发展。
最新研究表明,OA可能是一种代谢类疾病[3]。固醇调节元件结合蛋白(sterol regulatory elementbinding proteins,SREBPs)是调节脂类代谢的转录因子,在胆固醇稳态平衡中发挥关键作用[2]。有报道SREBP-2与OA病理过程相关[4]。因此,本实验旨在探究SREBP-2对衣霉素诱导的软骨细胞ERS和细胞凋亡的影响以及相关机制。
材料和方法
1 材料与试剂
衣霉素(Sigma);Lipofectamine 2000、胰酶(Invitrogen);胎牛血清(fetal bovine serum,FBS)、DMEM/F12培养基(Gibco);微小 RNA-185(micro-RNA-185,miR-185)荧光定量PCR检测试剂盒(Gene Copia);BCA蛋白定量分析试剂盒(Thermo);6孔板(Corning);ECL、caspase-3活性检测试剂盒、HRP标记的山羊抗鼠II抗和山羊抗兔II抗(碧云天生物技术研究所);anti-miR-185 mimics和scrambled mimics(锐博生物公司);靶向人SREBP-2 siRNA、scrambled siRNA以及兔多抗Bcl-2、Bax、β-actin、ATF4和CHOP (Santa Cruz);兔多抗caspase-3(Upstate);兔单抗peIF2α(CST);0.2%Ⅱ型胶原酶(Millipore);其它试剂均为国产分析纯。
2 方法
2.1 软骨细胞的分离、培养和传代 正常软骨细胞和OA软骨细胞分别来自河南中医学院第二附属医院创伤截肢患者和OA行膝关节置换术患者,此过程均得到河南中医学院伦理委员会批准和患者完全知情同意。术中无菌条件下削取足量关节面软骨,移至无血清DMEM/F12培养基,冰上保存。去除多余组织,切成小颗粒,PBS洗涤后,加入0.25%胰蛋白酶液,37℃摇床中放置30 min。弃酶液,PBS洗3次。加入0.2%Ⅱ型胶原酶溶液,37℃摇床中放置4 h。120目筛网过滤,收集悬液。1 000 r/min离心7 min,PBS洗3次后,用含10%FBS的完全培养基重悬,在37℃、5%CO2条件下培养,隔天换液,保持培养条件稳定。
2.2 细胞分组处理及转染 将培养软骨细胞分为OA软骨细胞组、正常软骨细胞组、衣霉素组、SREBP-2 siRNA组和衣霉素+SREBP-2 siRNA组。将软骨细胞按每孔4×105接种6孔板,按照Lipofectamine 2000说明书,分别将 50 nmol/L SREBP-2 siRNA、scrambled siRNA、anti-miR-185 mimics和 scrambled mimics转染正常软骨细胞。48 h后,进行实验处理。各组细胞用相应处理的培养基孵育时间一致。无水乙醇配制衣霉素储液,实验前用含0.5%FBS培养基稀释至0.5 mg/L。
2.3 实时荧光定量PCR(RT-qPCR)检测细胞miR-185的表达 将软骨细胞或者转染后软骨细胞按每孔4×105个接种6孔板,过夜后无血清处理。12 h后,向各组分别加相应处理的培养液。miR-185表达的检测严格按microRNA检测试剂盒说明书进行。
2.4 流式细胞术检测细胞凋亡 将软骨细胞或者转染后软骨细胞按每孔4×105个的密度接种6孔板,过夜后无血清处理。12 h后,向各组分别加相应处理的培养液。作用24 h后收集细胞,预冷PBS洗涤,加入预冷75%乙醇,4℃固定4 h以上。离心弃上清,PBS洗涤后,加入500 μL binding buffer悬浮细胞。加入5 μL Annexin V-EGFP混匀后,再加入5 μL PI,混匀。室温、避光、反应5~15 min。1 h内,上机流式细胞仪检测分析。
2.5 Western blot检测细胞相关蛋白表达 将软骨细胞或者转染后软骨细胞按每孔4×105接种6孔板,过夜后无血清处理。12 h后,向各组分别加相应处理的培养液。作用24 h后收集细胞,加RIPA裂解液,提取细胞全蛋白。经BCA定量、上样、SDSPAGE分离、转膜、封闭、I抗孵育、II抗孵育和ECL显影等步骤,检测各组细胞相关蛋白表达。
2.6 Caspase-3活性的检测 获取细胞裂解液,置于冰上,按试剂盒说明进行操作,使用酶标仪在405 nm处测定caspase-3的活性。
3 统计学处理
实验数据采用SPSS 13.0软件进行统计学分析,计量资料用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析,各组均数间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1 SREBP-2和miR-185在软骨细胞中的表达
通过酶两步消化法成功获得原代人正常软骨细胞和OA软骨细胞。与正常软骨细胞对照组相比,OA组和衣霉素组SREBP-2蛋白表达显著增加,miR-185水平显著降低(P<0.05),见图1。
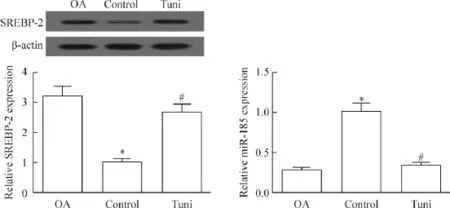
Figure 1.The expression of SREBP-2 and miR-185 in the normal chondrocytes and OA chondrocytes.Tuni:tunicamycin.Mean±SD.n=4.*P<0.05 vs OA group;#P<0.05 vs control group.图1 SREBP-2和miR-185在正常软骨细胞和OA软骨细胞中的表达
2 衣霉素处理下SREBP-2和miR-185表达相互调节
SREBP-2 siRNA转染正常软骨细胞可显著降低SREBP-2蛋白表达,上调miR-185水平(P<0.05)。与正常软骨细胞对照组相比,OA组和衣霉素组miR-185水平降低,SREBP-2蛋白水平增加,SREBP-2 siRNA转染则明显上调miR-185水平(P<0.05),miR-185过表达则下调衣霉素诱导的SREBP-2蛋白水平(P<0.05)。可见,衣霉素处理下,SREBP-2和miR-185表达相互影响,相互调节,见图2。
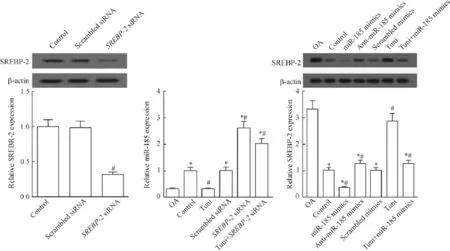
Figure 2.SREBP-2 and miR-185 expression interacted with each other in the normal chondrocytes with tunicamycin(Tuni)treatment.Mean±SD.n=4.*P<0.05 vs OA group;#P<0.05 vs control group.图2 衣霉素处理下正常软骨细胞SREBP-2和miR-185表达相互影响
3 SREBP-2沉默抑制衣霉素诱导的ERS
Western blot结果显示,与正常软骨细胞对照组相比,OA组和衣霉素组CHOP、p-eIF2α和ATF4蛋白表达显著增加,SREBP-2沉默则作用相反。而且SREBP-2沉默显著下调衣霉素诱导的ERS相关蛋白表达(P<0.05),见图3。
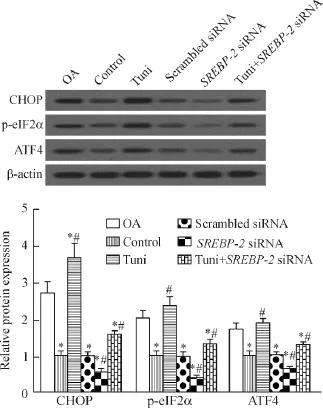
Figure 3.The effects of tunicamycin(Tuni)and SREBP-2 silencing on ERS in the normal chondrocytes.Mean±SD.n=4.*P<0.05 vs OA group;#P<0.05 vs control group.图3 衣霉素和SREBP-2沉默处理对正常软骨细胞ERS的影响
4 SREBP-2沉默抑制衣霉素诱导的细胞凋亡
Western blot结果显示,与正常软骨细胞对照组相比,OA组和衣霉素组Bax和caspase-3蛋白表达显著升高,Bcl-2蛋白表达显著减少(P<0.05); SREBP-2沉默组则作用相反。而且SREBP-2沉默处理可显著抑制衣霉素引起的细胞凋亡(P<0.05)。流式细胞术结果显示,细胞凋亡率与上述细胞凋亡相关蛋白表达趋势一致(P<0.05),见图4。
5 抑制miR-185表达可阻断SREBP-2沉默引起的软骨细胞caspase-3活性降低
与正常软骨细胞对照组相比,OA组和衣霉素组细胞相对caspase-3活性明显升高。而SREBP-2 si RNA转染明显下调衣霉素引起的细胞相对caspase-3活性升高,miR-185抑制则阻断SREBP-2沉默引起的软骨细胞caspase-3活性降低(P<0.05),见图5。
讨论
OA是一种衰老性疾病,是老年人关节疼痛和致残的主要原因。该病最早最主要的病理变化是由关节软骨起始,影响包括软骨下骨、滑膜、关节囊、肌腱韧带及周围肌肉组织在内的整个关节结构,导致关节软骨全部脱失,最终关节畸形和功能丧失。若OA患者能早期确诊并进行干预,可避免关节结构和功能进一步恶化,降低中晚期OA发生率和致残率。因此,寻找新的OA分子标记将有助于OA的早期诊断、治疗和发病机制的研究。
软骨细胞是关节软骨中惟一细胞类型,在维持正常软骨代谢中具有关键作用。软骨细胞凋亡引起的细胞数目减少是OA最主要的病理表现之一,进而导致OA发生。细胞凋亡主要通过死亡受体途径、线粒体途径、内质网途径等3种信号通路发生。适度ERS具有细胞保护作用,过高和持久的ERS则可通过诱导ERS相关蛋白表达和激活相关信号通路,导致细胞凋亡。研究发现,ERS引起的软骨细胞凋亡促进关节软骨退化[2]。SREBP-2在OA软骨细胞中高表达,与OA病理过程密切相关[4]。miR-185在多种癌组织中低表达[5],miR-185下调可作为人软骨肉瘤诊断和预后的潜在生物标记[6],而且miR-185可抑制衣霉素诱导的ERS[7]。本研究表明,与人正常软骨细胞相比,OA对照组和衣霉素组SREBP-2表达增加,miR-185降低;SREBP-2沉默可显著上调衣霉素引起的miR-185降低。
SREBPs是与固醇调节元件DNA序列结合的转录因子,能激活胆固醇代谢和生物合成基因[8],促进低密度脂蛋白摄取[9]。研究发现,SREBP-2通过与Smad3相互作用,参与调控关节软骨主要结构成分的形成[10]。ERS可诱导SREBP-2激活和细胞凋亡,引发肾脏近曲小管细胞损伤[11]。此外,miR-185具有心肌保护作用,能抑制ERS诱导的心肌细胞凋亡[7]。文献进一步表明,miR-185可通过调控肝细胞中SREBP-2及相关联基因的表达和活性,维持胆固醇稳态,且SREBP-2的调节作用依赖于miR-185表达,SREBP-1c能通过胆固醇反应反馈回路调节miR-185表达[9]。miR-185能通过下调 SREBP-1和SREBP-2及其靶基因表达,调控前列腺癌细胞中脂肪生成和胆固醇产生,引发caspase依赖性的细胞凋亡,抑制肿瘤进程[12]。本研究亦发现,OA组和衣霉素处理组软骨细胞CHOP、p-eIF2α和ATF4上调,Bcl-2表达下调,Bax和caspase-3表达明显增加,miR-185水平下调;SREBP-2沉默则显著抑制衣霉素引起的ERS升高和凋亡增加,并上调miR-185水平。而且,miR-185过表达下调衣霉素引起的SREBP-2增加,miR-185抑制则阻断SREBP-2沉默引起的软骨细胞 caspase-3活性降低。可见,SREBP-2和miR-185之间相互影响,相互调节,在衣霉素诱导的软骨细胞ERS和细胞凋亡过程中共同发挥着重要作用。

Figure 4.The effects of tunicamycin(Tuni)and SREBP-2 silencing on the apoptosis of the normal chondrocytes.Mean±SD.n=4.*P<0.05 vs OA group;#P<0.05 vs control group.图4 衣霉素和SREBP-2沉默处理对正常软骨细胞细胞凋亡的影响
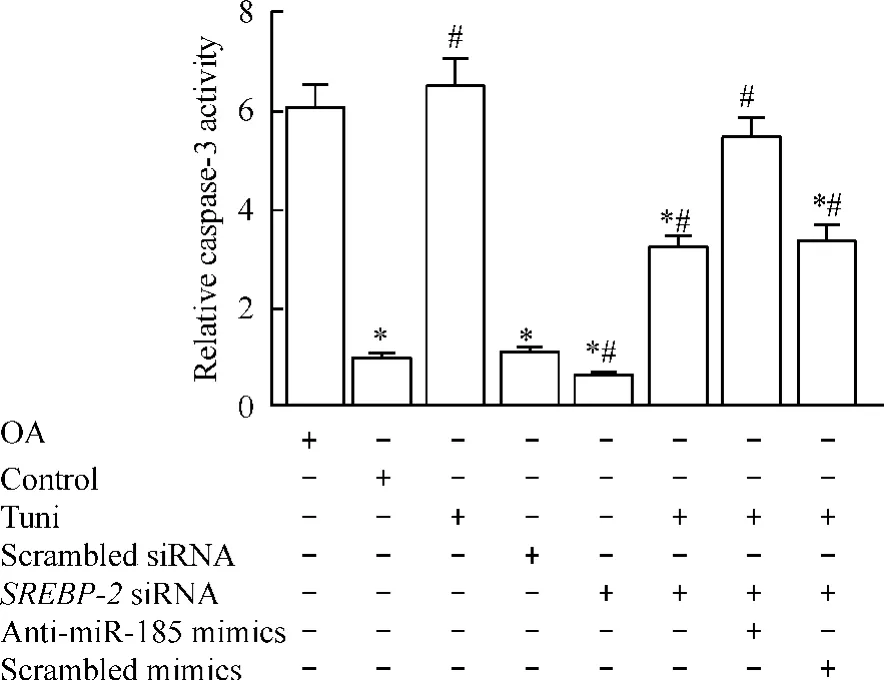
Figure 5.The effects of tunicamycin(Tuni),SREBP-2 silencing and miR-185 inhibition on caspase-3 activity in the normal chondrocytes.Mean±SD.n=4.*P<0.05 vs OA group;#P<0.05 vs control group.图5 衣霉素、SREBP-2沉默和miR-185抑制处理对正常软骨细胞caspase-3活性的影响
综上所述,本实验初步探究发现SREBP-2沉默可通过上调miR-185抑制衣霉素诱导的软骨细胞内质网应激和细胞凋亡。但是SREBP-2沉默在软骨细胞凋亡中的作用以及调控OA进程的分子机制仍需进一步研究。SREBP-2有望成为针对OA疾病的分子作用靶点,亦为其它衰老相关性疾病的预防和治疗提供新思路。
[1] Liu F,Weng X,Lin P,et al.Duhuo Jisheng decoction inhibits endoplasmic reticulum stress in chondrocytes induced by tunicamycin through the downregulation of miR-34a[J].Int J Mol Med,2015,36(5):1311-1318.
[2] Uehara Y,Hirose J,Yamabe S,et al.Endoplasmic reticulum stress-induced apoptosis contributes to articular cartilage degeneration via C/EBP homologous protein[J].Osteoarthritis Cartilage,2014,22(7):1007-1017.
[3] Katz JD,Agrawal S,Velasquez M.Getting to the heart of the matter:osteoarthritis takes its place as part of the metabolic syndrome[J].Curr Opin Rheumatol,2010,22 (5):512-519.
[4] Kostopoulou F,Gkretsi V,Malizos KN,et al.Central role of SREBP-2 in the pathogenesis of osteoarthritis[J].PLoS One,2012,7(5):e35753.
[5] Wang R,Tian S,Wang HB,et al.MiR-185 is involved in human breast carcinogenesis by targeting Vegfa[J].FEBS Lett,2014,588(23):4438-4447.
[6] Goudarzi PK,Taheriazam A,Asghari S,et al.Downregulation of miR-185 and upregulation of miR-218 expression may be potential diagnostic and prognostic biomarkers of human chondrosarcoma[J].Tumour Biol,2016,37(5):5775-5779.
[7] Kim JO,Kwon EJ,Song DW,et al.miR-185 inhibits endoplasmic reticulum stress-induced apoptosis by targeting Na+/H+exchanger-1 in the heart[J].BMB Rep,2016,49(4):208-213.
[8] Horton JD,Goldstein JL,Brown MS.SREBPs:activators of the complete program of cholesterol and fatty acid synthesis in the liver[J].J Clin Invest,2002,109(9): 1125-1131.
[9] Yang M,Liu W,Pellicane C,et al.Identification of miR-185 as a regulator of de novo cholesterol biosynthesis and low density lipoprotein uptake[J].J Lipid Res,2014,55(2):226-238.
[10]Grimsby S,Jaensson H,Dubrovska A,et al.Proteomicsbased identification of proteins interacting with Smad3: SREBP-2 forms a complex with Smad3 and inhibits its transcriptional activity[J].FEBS Lett,2004,577(1-2):93-100.
[11]Lhotak S,Sood S,Brimble E,et al.ER stress contributes to renal proximal tubule injury by increasing SREBP-2-mediated lipid accumulation and apoptotic cell death [J].Am J Physiol Renal Physiol,2012,303(2):F266-F278.
[12]Li X,Chen YT,Josson S,et al.MicroRNA-185 and 342 inhibit tumorigenicity and induce apoptosis through blockade of the SREBP metabolic pathway in prostate cancer cells[J].PLoS One,2013,8(8):e70987.
(责任编辑:陈妙玲,罗 森)
Effect of SREBP-2 silencing on tunicamycin-induced endoplasmic reticulum stress in chondrocytes
XIE Jing,SHI Dong-liang,GUO Hui-qing
(Department of Rheumatism Bone Disease,Henan Province Hospital of Traditional Chinese Medicine,Zhengzhou 450002,China.E-mail:qujining@yeah.net)
AIM:To explore the effect of sterol regulatory element-binding protein 2(SREBP-2)on tunicamycin-induced endoplasmic reticulum stress(ERS)in chondrocytes.METHODS:After isolation of human normal chondrocytes and osteoarthritis(OA)chondrocytes,the normal cells were cultured and treated with tunicamycin and SREBP-2 siRNA.After 24 h treatment,fluorescent quantitative RT-PCR(RT-qPCR)was applied to quantify microRNA-185(miR-185)levels.The cell apoptotic rate was determined by flow cytometry.The expression of SREBP-2 and ERS-related proteins,C/EBP homologous protein(CHOP),phosphorylated eukaryotic initiation factor-2 α(p-eIF2α)and activating transcription factor 4(ATF4),and the expression of apoptosis-related proteins,Bcl-2,Bax and caspase-3,were determined by Western blot.The caspase-3 activity kit was used to determine the caspase-3 activity.RESULTS:Compared with human normal chondrocytes,both SREBP-2 up-regulation and miR-185 down-regulation were observed in OA chondrocytes (P<0.05).SREBP-2 siRNA transfection enhanced tunicamycin-inhibited miR-185 level(P<0.05).miR-185 overexpression reduced tunicamycin-induced SREBP-2 expression(P<0.05).OA control group and tunicamycin treatment group consistently resulted in ERS and cell apoptosis with concomitant enhancement of CHOP,p-eIF2α and ATF4 proteins,increases in Bax and caspase-3 proteins,and reduction of Bcl-2(P<0.05).However,SREBP-2 silencing significantly reversed these effects(P<0.05).The apoptotic rates were consistent with the expression tendency of apoptosis-related proteins(P<0.05).SREBP-2 siRNA transfection markedly down-regulated tunicamycin-induced caspase-3 activity,which was notably blocked by miR-185 inhibition(P<0.05).CONCLUSION:SREBP-2 silencing may inhibit tunicamycin-induced ERS and cell apoptosis via up-regulating miR-185 expression.
Sterol regulatory element-binding protein 2;Tunicamycin;Endoplasmic reticulum stress;Chondrocytes;MicroRNA-185
R684.3;R363
A
10.3969/j.issn.1000-4718.2016.07.022
1000-4718(2016)07-1291-06
2016-01-28
2016-05-10
△Tel:0371-60979803;E-mail:qujining@yeah.net
——疾病防治的新靶标

