SAHA对发育期大鼠惊厥后海马TLR4/MYD88信号通路及神经元凋亡的影响
胡擎鹏, 黄湘壹
(南华大学附属第二医院1儿科,2功能检查科,湖南衡阳421001)
SAHA对发育期大鼠惊厥后海马TLR4/MYD88信号通路及神经元凋亡的影响
胡擎鹏1, 黄湘壹2△
(南华大学附属第二医院1儿科,2功能检查科,湖南衡阳421001)
目的:探讨组蛋白去乙酰化酶抑制剂伏立诺他(即辛二酰苯胺异羟肟酸,SAHA)在惊厥性脑损伤发病中的作用及机制。方法:32只雄性SD大鼠随机分为control组、戊四唑(pentylenetetrazole,PTZ)组、PTZ+10 mg/kg SAHA组及PTZ+50 mg/kg SAHA组,通过腹腔注射PTZ制作发育期大鼠惊厥模型,SAHA于PTZ诱导惊厥前2 h腹腔注射给药。本实验中PTZ造模成功率约85%,注射后约30 min到1 h后出现惊厥发作,评估惊厥发作的等级。惊厥后24 h处死大鼠,RT-qPCR及Western blot检测海马组织TLR4、MYD88、NF-κB P65和IL-1β mRNA及相应蛋白的表达;HE染色观察脑组织病理变化;TUNEL染色检测大鼠海马神经元凋亡。结果:(1)PTZ组均达到Ⅳ~V级惊厥发作,而SAHA预处理能减轻惊厥发作的等级;(2)PTZ组大鼠海马组织中TLR4、MYD88、NF-κB P65和IL-1β mRNA及相应蛋白的表达均较对照组显著增高(P<0.05),而SAHA预处理能抑制mRNA和相应蛋白表达水平的增高;(3)HE染色可见PTZ组明显的细胞水肿及神经元凋亡,伴有较多的炎症细胞浸润,而SAHA预处理能减轻细胞水肿及神经元凋亡,同时减少炎症细胞浸润;(4)大鼠海马组织中的神经元凋亡数PTZ组较对照组显著增加(P<0.05),而SAHA预处理能抑制海马神经元的凋亡;(5)相对于10 mg/kg SAHA治疗组,50 mg/kg SAHA治疗作用更明显(P<0.05)。结论:组蛋白去乙酰化酶抑制剂SAHA能抑制惊厥后TLR4/MYD88炎症信号通路和海马神经元的凋亡,从而减少炎症反应及惊厥性脑损伤。
组蛋白去乙酰化酶抑制剂;伏立诺他;惊厥;海马
惊厥是婴幼儿时期常见的中枢神经系统疾病,能导致发育期不同程度脑损伤,其在儿童时期的发生率较一般人群高5~10倍,尤以1岁以内小儿的惊厥发病率最高,发生率约占全体儿童的4%~6%,其中20%表现为反复惊厥发作或惊厥持续状态(status convulsion,SC)。Toll样受体4(Toll-like receptor 4,TLR4)是TLRs家族中的一员,在脑组织中主要表达于海马的小胶质细胞,其激活信号传导有2个通路,髓样分化因子88(myeloid differentiation factor 88,MYD88)依赖性信号通路和非MYD88依赖性信号通路[1]。研究报道TLR4/MYD88与炎症、缺血缺氧、创伤和兴奋性中毒等引起的脑损伤有密切关系[2],但在惊厥模型中TLR4/MYD88信号通路的作用国内外还很少报道。伏立诺他(vorinostat;即辛二酰苯胺异羟肟酸,suberoylanilide hydroxamic acid,SAHA)为当下研究得最多、最深入的一类异羟肟酸组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)[3],在Kyoko Takahashi等[4]报道的肠内皮细胞及LPS诱导的炎症动物模型中,HDACi可以通过调控染色质组蛋白乙酰化水平,减少TLR4及NF-κB p65基因的转录,从而抑制TLR4/MYD88信号通路,减少炎症因子的生成,SAHA在惊厥性脑损伤病理过程中是否存在同样的作用有待进一步研究。本实验组在前期的研究中,通过发育期大鼠惊厥模型的建立,观察了惊厥后大鼠海马区甘氨酸受体α1、α2亚单位和caspase-1、IL-18的表达变化,本实验旨在通过类似模型,进一步观察惊厥后大鼠海马组织TLR4、MYD88、NF-κB p65和IL-1β的mRNA及其相应蛋白的表达变化及神经元细胞凋亡的变化,探讨SAHA在抑制大鼠发育期惊厥性脑损伤发病机制中的作用。
材料和方法
1 实验动物及分组
20 日龄健康雄性SD大鼠32只(南华大学实验动物中心提供),所有动物随机分为control组、PTZ组、PTZ+SAHA低剂量(10 mg/kg)组和PTZ+SAHA高剂量(50 mg/kg)组,每组8只。
2 主要仪器与试剂
PTZ和 SAHA(Sigma);TLR4、MYD88、NF-κB p65和IL-1β抗体(Abcam);ECL化学发光剂(Santa Cruz);cDNA逆转录及RT-qPCR试剂盒(Promega); Trizol试剂(Gibco-BRL);TUNEL凋亡试剂盒(武汉博士德生物有限公司)。实时定量PCR仪(Roche)
3 主要方法
3.1 大鼠惊厥模型的建立 通过腹腔注射PTZ(80 mg/kg)复制大鼠惊厥动物模型[5],惊厥发作级别参考Racine分级标准[6];对照组仅注射生理盐水。低剂量(10 mg/kg)和高低剂量(50 mg/kg)SAHA于PTZ注射前2 h腹腔给药。惊厥后24 h处死大鼠,留取海马组织标本,部分用4%多聚甲醛固定,做病理切片及TUNEL免疫组化染色,其余部分迅速保存于-80℃,用于Western blot及RT-qPCR检测。
3.2 HE染色 将组织切片在60℃恒温箱中烘烤30 min,然后置于松节油中浸泡30 min脱蜡,置于不同浓度梯度乙醇(从高到低)中脱去松节油,用蒸馏水洗5 min除去乙醇并水化。苏木精染色切片15 min,细胞核被染成紫兰色,自来水冲洗2 min。将组织切片置于0.5%盐酸乙醇中30 s分化,自来水冲洗20 min。伊红染液染色30 s,细胞质染成粉红色,自来水冲洗30 s去浮色。切片经浓度梯度乙醇脱水(从低到高),二甲苯浸泡透明,随后用中性树胶封片。在光学显微镜下观察HE染色下脑组织病理变化。
3.3 TUNEL染色检测神经元凋亡 海马组织经4% 多聚甲醛固定、石蜡包埋、切片(厚度约3 μm)、脱蜡水化。标本片加0.01 mol/L TBS洗2 min 3次,按每张切片取TdT和DIG-dUTP各1 μL,加入18 μL标记缓冲液中,混匀。甩去切片上多余液体后加标记液20 μL,然后置样品于湿盒中,37℃反应2 h。用0.01 mol/L TBS清洗后加封闭液50 μL,室温30 min,后加入生物素化抗地高辛抗体,置样品于湿盒中,37℃反应30 min。加入1∶100稀释的SABC,37℃反应30 min,随后DAB显色及苏木素复染。光镜下对每张切片随机选取面积相同的5个高倍视野(×400),肉眼计数每个高倍视野TUNEL染色阳性细胞数,然后取平均值。结果判定:细胞核中有棕黄色颗粒者为阳性细胞。
3.4 Western blot检测TLR4、MYD88、NF-κB P65和IL-1β的蛋白表达量 取-80℃保存的海马组织,匀浆后加适量RIPA裂解液及PMSF蛋白酶抑制剂,4℃、12 000 r/min离心10 min,取上清,BCA法测定蛋白浓度。每个标本取30 μg蛋白样本经10%SDSPAGE凝胶电泳,此后在低温下将目的蛋白用电湿转法转移至PVDF膜上(PVDF膜在使用前用无水甲醇浸泡5 min),5% 脱脂牛奶在37℃下封闭1 h,然后分别加TLR4(1∶1 000)、MYD88(1∶2 000)、NF-κB P65(1∶2 000)及IL-1β(1∶500)抗体,4℃孵育过夜。PBST清洗3次后用辣根过氧化物酶标记的兔II抗(1∶5 000)在室温下孵育2 h,再次用PBST清洗3次后加入化学发光底物ECL显色1 min,用Image QuantTMLAS 4000成像系统扫描分析蛋白条带。
3.5 RT-qPCR方法检测TLR4、MYD88、NF-κB P65 和IL-1β的mRNA表达量 采用TRIzol试剂盒进行海马组织总RNA提取,用GoScriptTM逆转录试剂盒合成cDNA第1链,用GoTaq qPCR Master Mix试剂盒在实时定量PCR仪上进行DNA扩增,步骤均按说明说进行。RT-qPCR引物见表1,RT-qPCR循环扩增条件如下:95℃ 45 s,55~58℃ 45 s,72℃ 1 min,30个循环;循环结束后4℃冷却。
4 统计学处理
所有数据均采用SPSS 17.0统计学软件进行分析,数据均采用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),两两比较使用Bonferroni检验,以P<0.05为差异有统计学意义。
结果
1 惊厥发作等级计数及分级评分
本实验予PTZ 80 mg/kg复制惊厥模型及予不同剂量SAHA干预治疗,观察不同组惊厥发作级别。惊厥等级评分SAHA高、低剂量干预组显著低于PTZ 组(P<0.05),且PTZ+SAHA高剂量(50 mg/kg)组显著低于PTZ+SAHA低剂量(10 mg/kg)组(P<0.05),见表2。
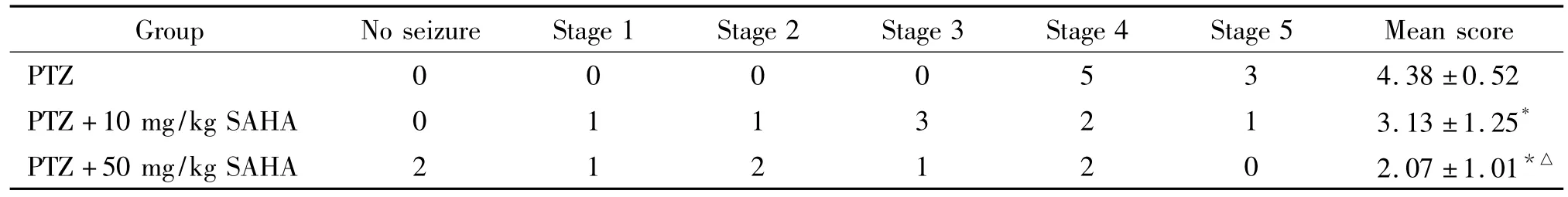
表2 大鼠惊厥发作等级计数及评分Table 2.The rats in different seizure stages were counted and mean seizure score was analyzed
2 HE染色观察脑组织病理学改变
发育期大鼠惊厥后24 h,HE染色后光镜下观察脑组织病理学改变;正常对照组海马神经元结构清楚,细胞核大而圆,染色均匀,呈淡蓝色,细胞壁完整,未见神经元变性,水肿及坏死;PTZ组出现神经元体积增大,细胞水肿明显,核溶解、碎裂,核固缩深染,细胞形态不完整,可见大量神经元凋亡及细胞碎片,伴有较多的炎症细胞浸润;PTZ+10 mg/kg SAHA组仍可见较多的神经元凋亡及细胞碎片,但细胞水肿较前有所减轻;PTZ+50 mg/kg SAHA组与PTZ组比较细胞水肿明显减轻,细胞体积及形态大部分正常,仅有少许的神经元凋亡及细胞碎片,同时炎症细胞浸润较前减少,见图1。
3 SAHA抑制PTZ诱导的海马神经元凋亡
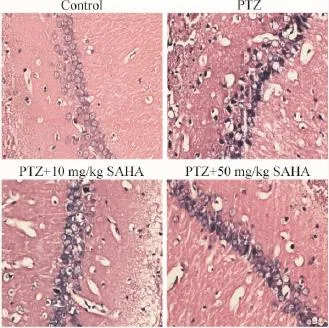
Figure 1.The pathological changes of the brain tissues in hippocampal CA1 region after seizure observed with HE staining(×400).图1 HE染色观察脑组织病理学改变
TUNEL染色测定发育期大鼠惊厥后24 h海马组织神经元凋亡的数量见图2,TUNEL染色阳性可见细胞核中有棕黄色或棕色着染,并伴有核膜裂解,染色质浓缩和边缘化等现象;正常细胞核染色呈蓝色。PTZ组在海马CA1区有大量的TUNEL染色阳性细胞,与对照组相比神经元凋亡数量显著增加(P<0.05);SAHA高剂量或低剂量均能显著抑制PTZ诱导的海马神经元的凋亡(P<0.05),其中以高剂量组的抑制更明显(P<0.05)。
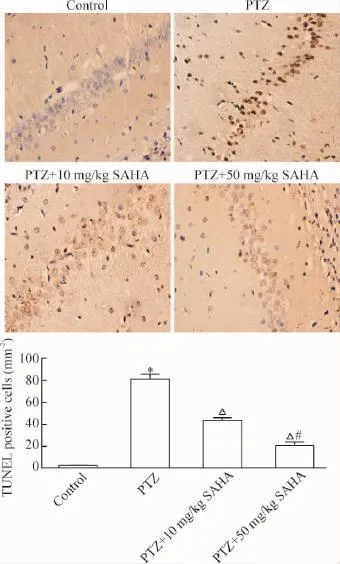
Figure 2.Seizure-induced neuronal apoptosis in hippocampal CA1 region detected by TUNEL staining(×400).Mean±SD.n=5.*P<0.05 vs control group;△P<0.05 vs PTZ group;#P<0.05 vs PTZ+10 mg/ kg SAHA group.图2 TUNEL染色检测大鼠海马CA1区凋亡的神经元数目
4 SAHA减少TLR4、MYD88、NF-κB P65和IL-1β的mRNA水平
RT-qPCR结果显示PTZ组TLR4、MYD88、NF-κB和IL-1β mRNA水平较对照组显著增高(P<0.05),低剂量SAHA预处理对TLR4及P65的mRNA有显著的抑制作用(P<0.05),其余组抑制作用不明显;予50 mg/kg SAHA干预治疗可以显著抑制PTZ诱导的信号通路各组的mRNA水平(P<0.05);其中TLR4、MYD88和IL-1β的表达量在50 mg/kg SAHA治疗组显著低于10 mg/kg SAHA治疗组(P<0.05),见图3。
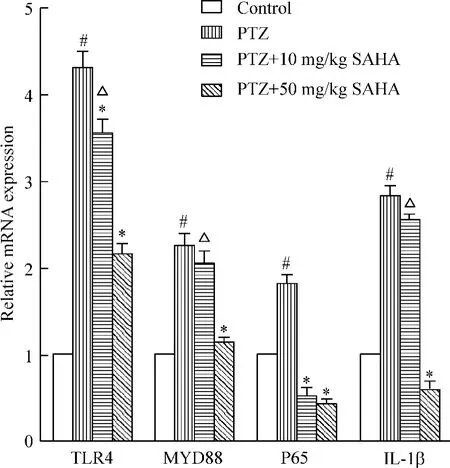
Figure 3.The effects of SAHA on the mRNA expression of TLR4,MYD88,NF-κB P65 and IL-1β in rat hippocampal region.Mean±SD.n=8.*P<0.05 vs PTZ group;#P<0.05 vs control group;△P<0.05 vs PTZ+50 mg/kg SAHA group.图3 SAHA对大鼠海马区TLR4、MYD88、NF-κB P65和IL-1β mRNA表达的影响
5 SAHA减少TLR4、MYD88、NF-κB P65和IL-1β的蛋白水平
Western blot结果显示,PTZ组 TLR4、MYD88、NF-κB P65和IL-1β蛋白水平较对照组显著增高(P<0.05),予 10 mg/kg SAHA干预治疗除了对TLR4蛋白增高有显著的抑制作用(P<0.05),其余组抑制作用不明显;予50 mg/kg SAHA干预治疗可以显著抑制PTZ诱导的信号通路各组蛋白水平增高(P<0.05);其中TLR4、MYD88、NF-κB P65和IL-1β蛋白表达量在50 mg/kg SAHA治疗组均显著低于10 mg/kg SAHA治疗组(P<0.05),见图4。
讨论
国内已建立新生鼠吸入三氟乙醚致惊厥模型,对惊厥后胶质细胞的变化、炎症因子和凋亡蛋白的表达、突触可塑性的改变进行过研究,证实了这些病理变化对发育中脑功能以及惊厥的作用机制具有重要价值。为进一步探讨惊厥的发病机制和寻求惊厥性脑损伤的治疗途径,我们选择了神经元的凋亡和 TLR4/MYD88信号通路作为研究对象。PTZ诱导的惊厥与大量谷氨酸的释放有关,且这个模型造成的惊厥活动和脑损伤类似于人类颞叶癫痫模型[7],与临床研究更为接近,PTZ制作的发育鼠及成年鼠的惊厥模型在国内外都已经被反复证实可靠、重复性好。国内外关于发育期惊厥发作的动物模型少有报道,既往仅有三氟乙醚吸入[8]、七氟乙醚吸入[9]、Jensen等制作的梯度缺氧[10]及PTZ药物注射的动物模型,但前三者为气体药物,难以掌控动物的惊厥程度,且操作较复杂,故在本实验中我们选择了相对更为简便、可行的PTZ模型。
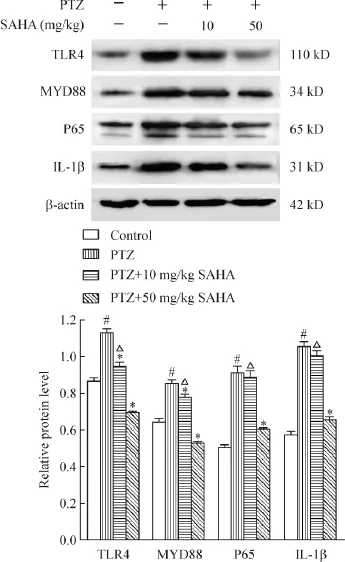
Figure 4.The effects of SAHA on the protein expression of TLR4,MYD88,NF-κB P65 and IL-1β in rat hippocampal region.Mean±SD.n=8.*P<0.05 vs PTZ group;#P<0.05 vs control group;△P<0.05 vs PTZ+50 mg/kg SAHA group.图4 SAHA对大鼠海马区TLR4、MYD88、NF-κB P65和IL-1β蛋白表达的影响
在惊厥性脑损伤发生过程中,神经元坏死和细胞凋亡是脑损伤的基本形式。神经元凋亡可能与海马CA1区存在大量的谷氨酸受体[11]、钙超载、氧自由基、炎性反应等多种因素有关。在本实验中,HE染色可见PTZ诱导的惊厥导致了大鼠海马CA1区出现神经元体积增大,细胞水肿明显,可见大量神经元凋亡及细胞碎片,伴有较多的炎症细胞浸润;TUNEL染色检测到PTZ组神经元的凋亡较对照组显著增多,提示惊厥后神经元损伤具有典型凋亡特征,因而进一步证实了神经元的凋亡参与了惊厥性脑损伤的病理过程,这与既往的研究报道一致[12]。
TLR4是Toll样受体家族中的一员,在脑组织中主要表达于海马的小胶质细胞,可参与炎症介质的释放和神经元细胞的凋亡。MYD88是TLR4重要的衔接蛋白,可以导致下游因子NF-κB P65的活化和炎症介质的产生,并且可诱导细胞凋亡酶caspase-3的激活而最终导致脑损伤的形成[13]。NF-κB是中枢神经系统内重要的核蛋白,是TLR4介导的MYD88依赖性信号通路的一种关键成分,当细胞受到外界因素,如感染、炎症等刺激后,NF-κB进入细胞核,结合于特异性DNA位点,通过诱导基因的转录从而增加IL-1β、TNF-α、IL-6等炎症介质的分泌[14]。白细胞介素IL-1β是由多种细胞产生并可作用于多种细胞的一类细胞因子。IL-1β在传递信息,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化及在炎症反应中起重要作用。大量研究发现各种途径诱发的惊厥模型大鼠脑组织IL-1β、IL-6和TNF-α的表达增加,且均与惊厥性脑损伤的发生有关[15]。在本实验中RT-qPCR和Western blot测定了惊厥后TLR4、MYD88、NF-κB p65及IL-1β mRNA和蛋白的含量,发现惊厥后PTZ组各指标的含量较对照组显著增加,证实了TLR4/MYD88信号通路参与了惊厥性脑损伤的病理过程。
SAHA是一类异羟肟酸HDACi,可提高染色质特定区域组蛋白乙酰化,从而调控基因表达,诱导细胞凋亡及分化[16]。目前关于HDACi在神经系统疾病的研究主要集中在缺血性脑卒中、多发性硬化、亨廷顿氏舞蹈症等[17],很少有关于HDACi在惊厥方面的报道。在本研究中,PTZ诱导的惊厥导致了TLR4/MYD88信号通路mRNA和蛋白显著增加及神经元的凋亡,而SAHA预处理对TLR4/MYD88信号通路及神经元的凋亡有抑制作用,表明SAHA可以通过抑制炎症介质和神经元的凋亡而发挥脑保护作用。SAHA抑制TLR4/MYD88信号通路,保护脑损伤可能的机制如下:(1)SAHA通过抑制组蛋白去乙酰化,降低TLR4/MYD88信号通路基因的表达,进而减少下游因子 IL-1β、IL-6、TNF-α的合成[18];(2) SAHA诱导高乙酰化反应,通过增加抗炎症因子IL-4、IL-10和TGF-β的表达,从而起到脑损伤的保护作用;(3)在单核细胞和/或巨噬细胞中,SAHA使热休克蛋白90乙酰化,造成其与IL-1受体相关激酶1 (IL-1 receptor-associated kinase 1,IRAK1)失联,使IRAK1降解,从而间接抑制 TLR4/MYD88信号通路[19]。也有报道指出,SAHA可以促进炎症介质如IL-1β、IL-6的生成,这可能是与激活了NF-κB依赖性信号通路有关[20],在Stammler等[21]研究中发现,在人类和小鼠树突状细胞和小鼠巨噬细胞中,HDAC1如SAHA能促进炎症因子IL-1β的成熟与分泌,这种促进作用完全不依赖于传统的炎症通路的激活,而主要是通过caspase-8依赖的信号转导机制从而促进IL-1β等炎症介质的合成。在本实验中,SAHA能抑制TLR4/MYD88信号通路及炎症介质的产生,这与既往的大多数研究保持一致。同时从实验结果可以发现,SAHA在剂量为50 mg/kg比10 mg/kg对神经元的凋亡和TLR4/MYD88炎症信号通路的抑制作用更明显,说明SAHA对损伤脑组织的保护作用与剂量有关。
[1] Larochelle A,Bellavance MA,Rivest S.Role of adaptor protein MyD88 in TLR-mediated preconditioning and neuroprotection after acute excitotoxicity[J].Brain Behav Immun,2015,46:221-231.
[2] Ferreira MJ,Lima C,Lopes-Ferreira M.Anti-inflammatory effect of Natterins,the major toxins from the Thalassophryne nattereri fish venom is dependent on TLR4/ MyD88/PI3K signaling pathway[J].Toxicon,2014,87: 54-67.
[3] Duncan HF,Smith AJ,Fleming GJ,et al.Transcriptional profiling of suberoylanilide hydroxamic acid(SAHA)regulated genes in mineralizing dental pulp cells at early and late time points[J].Genom Data,2015,5:391-393.
[4] Takahashi K,Sugi Y,Hosono A,et al.Epigenetic regulation of TLR4 gene expression in intestinal epithelial cells for the maintenance of intestinal homeostasis[J].J Immunol,2009,183(10):6522-6529.
[5] Ozsoy S,Aydin D,Ekici F.Effects of modafinil on pentylenetetrazol-induced convulsive epilepsy[J].Bratisl Lek Listy,2015,116(3):162-166.
[6] Groot LJ,Gosens N,Vles JS,et al.Inter-and intraobserver agreement of seizure behavior scoring in the amygdala kindled rat[J].Epilepsy Behav,2015,42:10-13.
[7] Choopankareh S,Vafaee F,Shafei MN,et al.Effects of melatonin and theanine administration on pentylenetetrazole-induced seizures and brain tissue oxidative damage in ovariectomized rats[J].Turk J Med Sci,2015,45 (4):842-849.
[8] Garau C,Miralles A,García-Sevilla JA.Chronic treatment with selective I2-imidazoline receptor ligands decreases the content of pro-apoptotic markers in rat brain[J].J Psychopharmacol,2013,27(2):123-134.
[9] Wang XS,Chen YY,Shang XF,et al.Idazoxan attenuates spinal cordinjury by enhanced astrocytic activation and reduced microglial activationin rat experimental autoimmune encephalomyelitis[J].Brain Res,2009,1253: 198-209.
[10]Li F,Zhang ZX,Liu YF,et al.2-BFI ameliorates EAE-induced mouse spinal cord damage:effective therapeutic time window and possible mechanisms[J].Brain Res,2012,1483:13-19.
[11]Goudarzi E,Elahdadi Salmani M,Lashkarbolouki T,et al.Hippocampal orexin receptors inactivation reduces PTZ induced seizures of male rats[J].Pharmacol Biochem Behav,2015,130:77-83.
[12]Saha L,Chakrabarti A,Kumari S,et al.Antiapoptotic and neuroprotective role of Curcumin in Pentylenetetrazole (PTZ)induced kindling model in rat[J].Indian J Exp Biol,54(2):133-141.
[13]Wang X,Stridh L,Li W,et al.Lipopolysaccharide sensitizes neonatal hypoxic-ischemic brain injury in a MyD88-dependent manner[J].J Immunol,2009,183(11): 7471-7477.
[14]Ding Y,Yang H,Xiang W,et al.CD200R1 agonist attenuates LPS-induced inflammatory response in human renal proximal tubular epithelial cells by regulating TLR4-MyD88-TAK1-mediated NF-κB and MAPK pathway[J].Biochem Biophys Res Commun,2015,460(2):287-294.
[15]Kaur H,Patro I,Tikoo K,et al.Curcumin attenuates inflammatory response and cognitive deficits in experimental model of chronic epilepsy[J].Neurochem Int,2015,89: 40-50.
[16]Sewal AS,Patzke H,Perez EJ,et al.Experience modulates the effects of histone deacetylase inhibitors on gene and protein expression in the hippocampus:impaired plasticity in aging[J].J Neurosci,2015,35(33):11729-11742.
[17]Faraco G,Pancani T,Formentini L,et al.Pharmacological inhibition of histone deacetylases by suberoylanilide hydroxamic acid specifically alters gene expression and reduces ischemic injury in the mouse brain[J].Mol Pharmacol,2006,70(6):1876-1884.
[18]Wang D,Zhao M,Chen G,et al.The histone deacetylase inhibitor vorinostat prevents TNFα-induced necroptosis by regulating multiple signaling pathways[J].Apoptosis,2013,18(11):1348-1362.
[19]Chong W,Li Y,Liu B,et al.Histone deacetylase inhibitor suberoylanilide hydroxamic acid attenuates Toll-like receptor 4 signaling in lipopolysaccharide-stimulated mouse macrophages[J].J Surg Res,2012,178(2):851-859.
[20]van den Bosch T,Boichenko A,Leus NG,et al.The histone acetyltransferase p300 inhibitor C646 reduces pro-inflammatory gene expression and inhibits histone deacetylases[J].Biochem Pharmacol,2016,102:130-140.
[21]Stammler D,Eigenbrod T,Menz S,et al.Inhibition of histone deacetylases permits lipopolysaccharide-mediated secretion of bioactive IL-1β via a caspase-1-independent mechanism[J].J Immunol,2015,195(11):5421-5431.
(责任编辑:陈妙玲,罗 森)
Effects of SAHA on hippocampal TLR4/MYD88 signaling and neuronal apoptosis after seizure in developing rats
HU Qing-peng1,HUANG Xiang-yi2
(1Department of Pediatrics,2Department of Function Examination,The Second Affiliated Hospital,University of South China,Hengyang 421001,China.E-mail:yanguowuhen0011@sina.com)
AIM:To investigate the effect of vorinostat(suberoylanilide hydroxamic acid,SAHA),a histone deacetylase inhibitor,on seizure-induced brain damage in developing rats and its mechanism.METHODS:Male Sprague-Dawley rats(n=32)were randomly divided into control group,pentylenetetrazole(PTZ)group,PTZ+10 mg/kg SAHA group and PTZ+50 mg/kg SAHA group.Intraperitoneal injection of PTZ was used to induce rat seizure.SAHA was injected intraperitoneally 2 h before PTZ injection.The rats in different seizure stages were counted and mean seizure score was analyzed at 30~60 min after PTZ injection.Hippocampal tissues were sampled at 24 h after seizures.The expression of TLR4,MYD88,NF-κB P65 and IL-1β at mRNA and protein levels was detected by RT-qPCR and Western blot,respectively.The pathological changes of the brain tissues were observed by HE staining.The apoptotic neurons were observed by TUNEL staining.RESULTS:The mRNA and protein levels of TLR4,MYD88,NF-κB P65 and IL-1β,the apoptosis of neurons,the inflammation reaction and mean seizure score significantly increased after PTZ treatment(P<0.05),and these effects were attenuated by treatment with SAHA.Compared with PTZ+10 mg/kg SAHA group,PTZ+50 mg/kg SAHA group showed more significant protective effect against seizure-induced brain damage.CONCLUSION:Histone deacetylase inhibitor SAHA suppresses seizure-induced TLR4/MYD88 signaling and reduces apoptosis of neurons,suggesting a protective effect against brain damage associated with seizure in developing rats.
Histone deacetylase inhibitor;Vorinostat;Seizure;Hippocampus
R741.02;R363
A
10.3969/j.issn.1000-4718.2016.07.009
1000-4718(2016)07-1208-06
2016-01-11
2016-04-18
△Tel:15886473686;E-mail:yanguowuhen0011@sina.com

