慢性间歇性低氧对幼鼠脑区AMPK通路的影响*
梁冬施, 陈利亚, 洪芳芳, 林 晶, 温正旺, 李秀翠, 蔡晓红△
(温州医科大学附属第二医院育英儿童医院1儿童急诊科,2儿童呼吸科,3儿童感染科,4儿童神经科,浙江温州325000)
慢性间歇性低氧对幼鼠脑区AMPK通路的影响*
梁冬施1, 陈利亚2, 洪芳芳2, 林 晶2, 温正旺3, 李秀翠4, 蔡晓红2△
(温州医科大学附属第二医院育英儿童医院1儿童急诊科,2儿童呼吸科,3儿童感染科,4儿童神经科,浙江温州325000)
目的:探讨慢性间歇性低氧对幼鼠脑区腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)通路的影响。方法:第一部分:将3~4周龄的SD幼鼠随机分为4组(n=8):2周空气模拟对照(2AC)组、2周慢性间歇低氧(2IH)组、4周空气模拟对照(4AC)组和4周慢性间歇低氧(4IH)组。第二部分:将3~4周龄的SD幼鼠随机分为2组(n=8):4周慢性间歇性低氧组(4IH)和4周慢性间歇性低氧用药组(4IHI)。造模结束后行八臂迷宫测试,TUNEL法检测细胞凋亡,RT-qPCR法了解腺苷A2a受体的mRNA表达,Western blot法测定AMPK及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的磷酸化水平。结果:与对照组相比,2IH组和4IH组的参考记忆错误(RME)、工作记忆错误(WME)和总错误(TE)次数明显增加,差异有统计学显著性(P<0.01);4IH与2IH组比较,各项错误次数亦明显增加(P<0.01)。4IHI组比4IH组RME、WME和TE次数减少,差异有统计学显著性(P<0.01)。与对照组相比,2IH组和4IH组海马和前额皮层区的神经元凋亡增多,以4IH组凋亡明显(P<0.05);4IHI组凋亡较4IH组减少(P<0.05)。2IH组和4IH组海马和前额皮层区腺苷受体A2a的mRNA和AMPK磷酸化蛋白的水平升高,mTOR磷酸化蛋白的水平下降,4IH组较2IH组改变明显(P<0.05)。4IHI组较4IH组海马和前额皮层区的AMPK磷酸化蛋白水平下降,mTOR磷酸化蛋白水平升高(P<0.05)。结论:慢性间歇性低氧诱导神经元凋亡,从而引起幼鼠学习记忆障碍,呈时间依赖性。慢性间歇性低氧上调腺苷A2a受体,激活海马和前额皮层区AMPK,抑制mTOR的活性,诱导神经元凋亡,进而影响幼鼠学习记忆能力。
慢性间歇性低氧;腺苷A2a受体;腺苷酸活化蛋白激酶;哺乳动物雷帕霉素靶蛋白;海马;前额皮层
慢性间歇性低氧是阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)的病理生理过程,类似缺氧-再灌注过程,对身体各器官均有损害作用,特别对神经元,可造成OSAHS儿童认知功能下降[1]。目前国内外研究表明,OSAHS对神经元的损伤主要包括各种氧化应激途径、凋亡途径引起神经元凋亡。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是能量调控家族中的关键蛋白,在神经系统中有广泛的分布,与神经细胞的存亡密切相关。在神经细胞缺血、低氧时,AMP/ ATP比值改变[2],产生大量细胞因子及相关代谢产物,包括如腺苷、促炎症、免疫因子,其中腺苷作用较显著。腺苷通过腺苷受体可诱导多条途径活化[3-4],特别是腺苷受体A2a诱导的AMPK途径目前较为受关注。AMPK被激活,转化为磷酸化 AMPK(p-AMPK),通过 AMPK-哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)途径控制着细胞凋亡和生长[5-6]。在小鼠脑缺血再灌注模型中,神经元缺血后AMPK含量明显增高,同时脑梗死面积增大[7]。在体外应用AMPK激动剂后人神经母细胞瘤细胞出现凋亡,提示AMPK可调控神经系统细胞凋亡发生。而腺苷受体-AMPK-mTOR通路是生存、凋亡调节重要途径,特别在神经元。因此本研究通过建立慢性间歇性低氧幼鼠模型,观察幼鼠神级行为及相关功能区细胞凋亡情况,采用RT-qPCR了解前额皮层区和海马区腺苷A2a受体的mRNA表达情况及Western blot法检测相应脑区p-AMPK和pmTOR蛋白水平的改变,初步探讨慢性间歇性低氧对幼鼠前额皮层区和海马区损害机制。
材料和方法
1 实验动物
SPF级雄性SD幼鼠48只,体重100~120克,由温州医学院实验动物中心提供。第一部分:按随机数字表法分为4组(n=8):2周空气模拟对照组(2AC)、2周慢性间歇低氧组(2IH)、4周空气模拟对照组(4AC)和4周慢性间歇低氧组(4IH)。第二部分:按随机数字表法分为2组(n=8):4周慢性间歇低氧组(4IH)和4周给药组(4IHI)。4IHI组每天进入舱体前0.5 h,予腹腔注射AMPK抑制剂compound C 11.2 mg/kg。
2 OSAHS模型的建立
参照文献[8]建立OSAHS模型,舱体60 cm×22 cm×16 cm,连接氮气管道、氧气管道(或空气压缩泵)并由气体流量控制阀控制。氧舱侧壁各有4个单向进气、排气阀;舱壁各有4个单向进气、出气阀。舱体内有CO2吸附剂,保证CO2浓度<0.01%。舱内压力始终保持常压,温度维持在22~24℃,湿度在40%~50%范围。O2浓度、CO2浓度、温度、湿度均可被测量,实时显示。90 s为1个循环,通氮气(0.3 kP)30 s,停30 s;通氧气(25 L/min)12 s,停18 s;氧浓度上升并维持在(21.0±0.5)%约30 s。低氧时舱内氧浓度波动在(10.0±1.5)%,复氧时舱内氧浓度波动在(21.0±0.5)%,见图1。并行模型验证,即造模2 h后,在慢性间歇性低氧1个周期内的5个时点,取幼鼠动脉血行动脉血气分析,检测氧分压(oxygen partial pressure,PO2)及氧饱和度(oxygen saturation,SO2)[8]。验证造模后,4组实验动物放入对应实验舱内,舱外用黑色布遮盖模拟黑夜时间,每天7.5 h,出舱后日光灯照射模拟白天时间,造模时间分别为2周及4周。
3 实验方法
3.1 八臂迷宫实验 实验中保持温度22~24℃、湿度40%~50%,12 h光照,自由饮水,限制进食。将幼鼠置于迷宫中适应2 d,每次放2只,使其自由活动和摄取饲饵15 min,每日1次。适应后进行每日1次的训练,每次训练时,8臂中只有4臂放置饵料(分别为1、2、4和7号臂)。训练时幼鼠放在迷宫中央区,中央区四周用门关住,15 s后门开放,幼鼠可选择进入任意一臂摄饵,待吃掉所有臂上饵料或时间超过10 min视为训练结束。总错误(total error,TE)次数:大鼠进入有饵的臂且摄取饵为1次正确选择,否则为错误选择;工作记忆错误(working memory error,WME)次数:重复进入已吃过食物臂的次数;参考记忆错误(reference memory error,RME)次数:进入不放饵臂的次数;总时间(total time,TT):完成1次训练的时间。
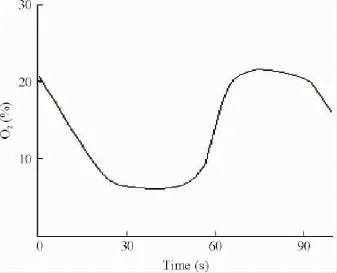
Figure 1.The changes of oxygen concentration in chronic intermittent hypoxia chamber.图1 慢性间歇性低氧氧舱内一个循环氧浓度变化图
3.2 取材 实验结束后,随机取幼鼠每组6只,予10%水合氯醛麻醉,行心脏灌注,并迅速断头,取左、右海马及前额叶皮层,放入冻存管,置液氮保存。随机取每组幼鼠2只,心脏灌注多聚甲醛,迅速断头取脑,取海马及皮层。
3.3 TUNEL实验 将组织进行多聚甲醛固定、脱水、透明、浸蜡、包埋、切片后按TUNEL检测试剂说明书步骤操作,随机计算6个不同高倍视野(×400)下凋亡细胞数,计算凋亡指数(apoptoic index,AI): AI(%)=凋亡细胞数/计数细胞总数×100%。其中4IH组及4IHI组予DAB复染,观察凋亡情况。
3.4 RT-qPCR法测定幼鼠海马和前额叶皮层区腺苷A2a受体的mRNA表达 按照TRIzol提取试剂说明书抽提RNA,并测定RNA浓度,按RNA逆转录试剂盒(Fermentas公司)说明书进行逆转录,按实时荧光定量PCR操作要求在96孔中加入引物(由上海基康生物工程有限公司合成,序列见表1)、SYBR Green I、模板、水总体积为20 μL,混匀后在Roche LightCycler 480中进行实时定量PCR分析,实验结束,用LightCycler 480 15.0软件处理实验结果。
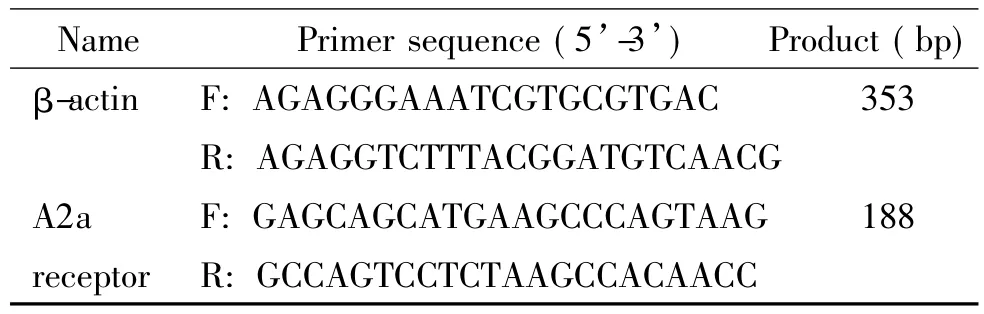
表1 引物序列Table 1.The sequence of the primers for RT-qPCR
3.5 Western blot法检测海马及前额叶皮层组织中p-AMPK和p-mTOR蛋白含量 蛋白裂解液提取蛋白,采用BCA试剂盒(Pierce)进行蛋白浓度测定,按分子大小加入10%(或5%)分离胶、5%(或4%)浓缩胶制胶,电泳、转膜、封闭、孵育,孵育采用 I抗孵育18~24 h(AMPK和mTOR浓度均为1∶1 000),4℃孵育过夜,加II抗(1∶5 000),2 h后加化学发光检测试剂(试剂A∶试剂B=1∶1)反应5 min,曝光。采用Gel-Pro凝胶分析软件分析。蛋白相对表达水平=目的蛋白条带累积吸光度(IA)/内参照条带IA。
4 统计学分析
计量资料数据呈正态分布采用均数±标准差(mean±SD)表示,方差齐单因素两组间比较采用t检验;方差齐单因素两组以上比较采用单因素方差分析;方差齐组间比较采用SNK-q检验,方差不齐则采用Tamhane’s T2检验。非正态分布数据用中位数表示,两组间比较用两独立样本Mann-Whitney U检验,多组间比较用Kruskal-Wallis H检验。所有数据用SPSS 17.0统计软件处理分析,以P<0.05为差异有统计学意义。
结果
1 模型验证
慢性间歇性低氧组动脉血气分析结果显示,最低PO2为(43±4)mmHg,最低SO2为(76±3)%,慢性间歇性低氧周期内PO2与SO2变化明显;对照组动脉血气分析结果显示,PO2和SO2分别为(96±1) mmHg和(97±4)%,取血时点与慢性间歇性低氧组相同,各时点动脉血气差异不明显,见图2。
2 八臂迷宫测试行为学检测结果
与2AC组和4AC组相比,2IH组和4IH组的RME、WME和TE次数明显增加,差异有统计学显著性(P<0.01)。4IH组各项错误次数亦比2IH组明显增加(P<0.01),见表2。与4IH组比,4IHI组错误数明显减少(P<0.01),见表3。
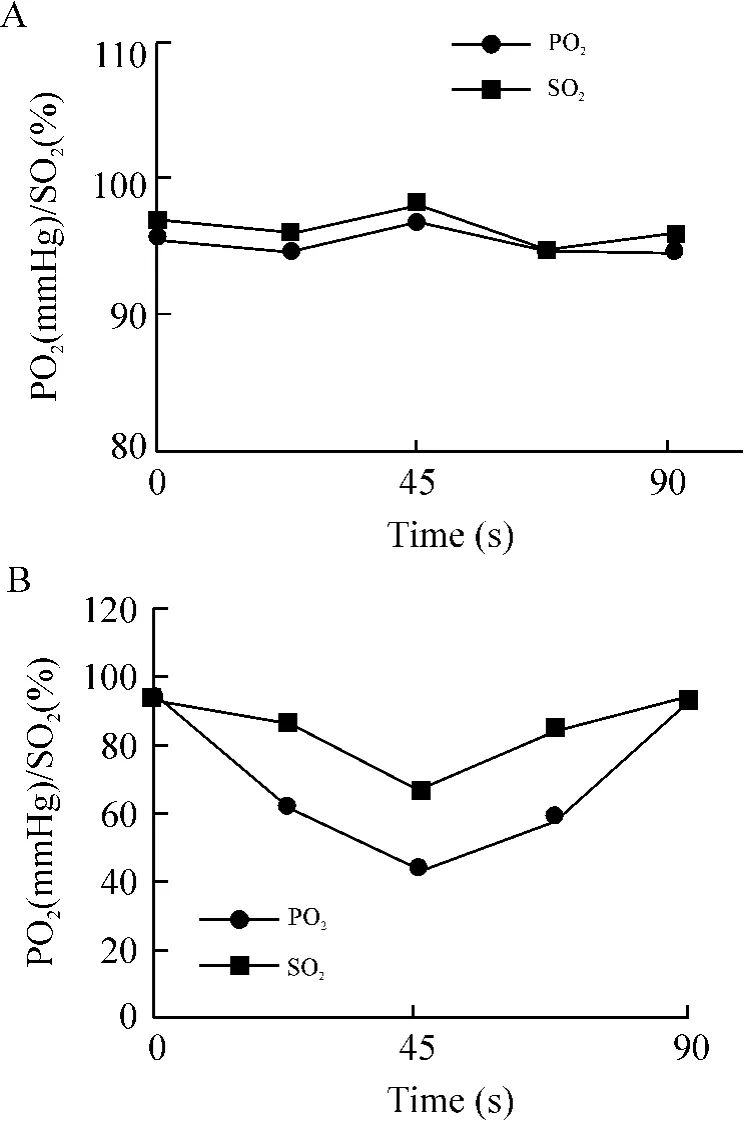
Figure 2.The effect of chronic intermittent hypoxia on the changes of PO2and SO2in the arterial blood of the rats.Mean±SD.n=5.A:simulated air control group;B: chronic intermittent hypoxia group.图2 慢性间歇性低氧对动脉血PO2和SO2的影响

表2 各组幼鼠RME、WME和TE的比较Table 2.The changes of RME,WME and TE in the young rats with different treatments(Mean±SD.n=8)
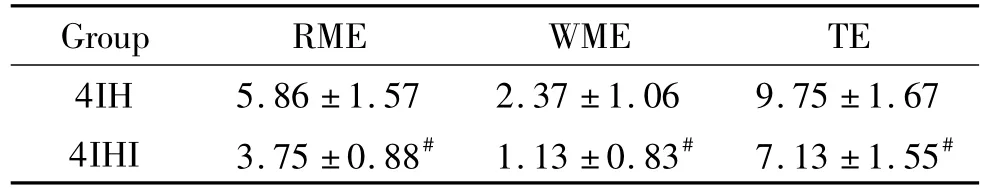
表3 AMPK抑制剂对幼鼠RME、WME和TE的影响Table 3.The changes of RME,WME and TE in the young rats with different treatments between 4IH group and 4IHI group(Mean±SD.n=8)
3 神经元凋亡结果
分别与2AC组和4AC组相比,2IH组和4IH组的海马和前额皮层区神经元凋亡增多,差异有统计学显著性(P<0.05);与2IH组比,4IH组海马和前额皮层区神经元凋亡增多,差异有统计学显著性(P<0.01);2AC组与4AC组比较,海马和前额皮层神经元凋亡指数的差异无统计学显著性,见图3、表4。与4IH组比,4IHI组海马和前额皮层区细胞凋亡减少,差异有统计学显著性(P<0.05),见图3、表5。

Figure 3.The TUNEL staining in hippocampus and prefrontal cortex.图3 海马和皮层TUNEL荧光染色
4 RT-PCR检测幼鼠脑区腺苷A2a受体mRNA的表达
与对照组相比,2IH组和4IH组海马和前额皮层区腺苷A2a受体的mRNA表达升高,4IH组较2IH组升高更明显,差异均有统计学显著性(P<0.05);2AC组与4AC组比较,海马和前额皮层区腺苷A2a的mRNA表达差异无统计学显著性(P>0.05),见表4。
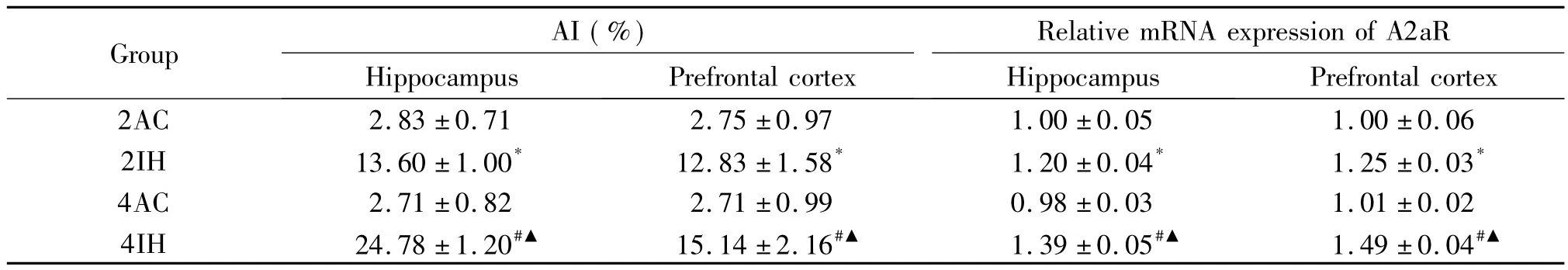
表4 幼鼠海马及前额皮层的神经元凋亡指数和腺苷A2a受体mRNA表达量的比较Table 4.The apoptotic index(AI)and relative mRNA expression of adenosine A2a receptor(A2aR)in the hippocampal and forehead cortical tissues in the young rats(Mean±SD.n=2~3)

表5 AMPK抑制剂对幼鼠神经元调亡的影响Table 5.The apoptotic index(AI)in the hippocampal and forehead cortical tissues in the young rats between 4IH and 4IHI groups(%.Mean±SD.n=3)
5 Western blot法检测幼鼠脑区p-AMPK和 pmTOR的蛋白水平
与对照组比,2IH和4IH组海马和前额皮层区的p-AMPK蛋白含量增加,4IH组较2IH组增加明显,差异有统计学显著性(P<0.05),见图4、表6;与对照组相比,2IH组和4IH组海马和前额皮层区的pmTOR蛋白含量下降,4IH组较2IH组下降更明显,差异有统计学显著性(P<0.05);海马和前额皮层区的p-AMPK和p-mTOR的蛋白含量在2AC组和4AC组之间的差异无统计学显著性(P>0.05);与4IH组比,4IHI组海马和前额皮层区的p-AMPK蛋白含量下降,p-mTOR蛋白含量升高,差异有统计学显著性(P<0.05),见图4、表7。
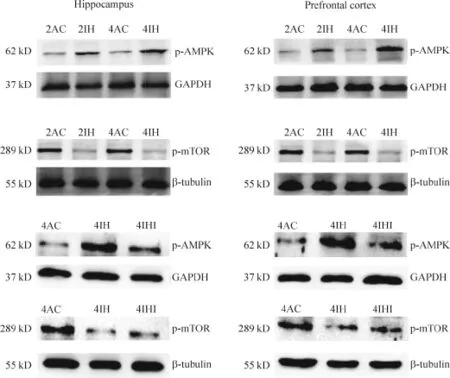
Figure 4.The protein levels of p-AMPK and p-mTOR in the hippocampal and forehead cortical among groups.图4 各组间海马和前额皮层区p-AMPK和p-mTOR蛋白的含量
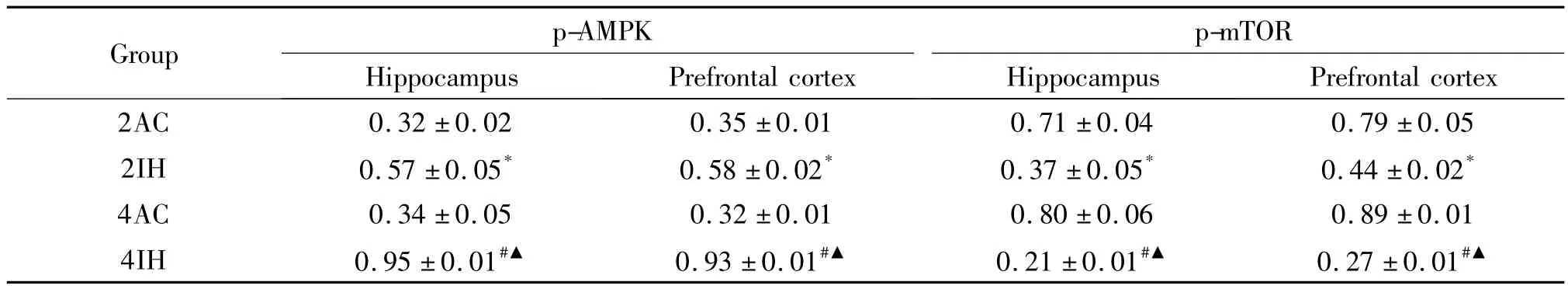
表6 SD幼鼠脑区p-AMPK和p-mTOR蛋白水平的比较Table 6.The protein levels of p-AMPK and p-mTOR in the hippocampal and forehead cortical tissues in the young rats(Mean±SD.n=3)
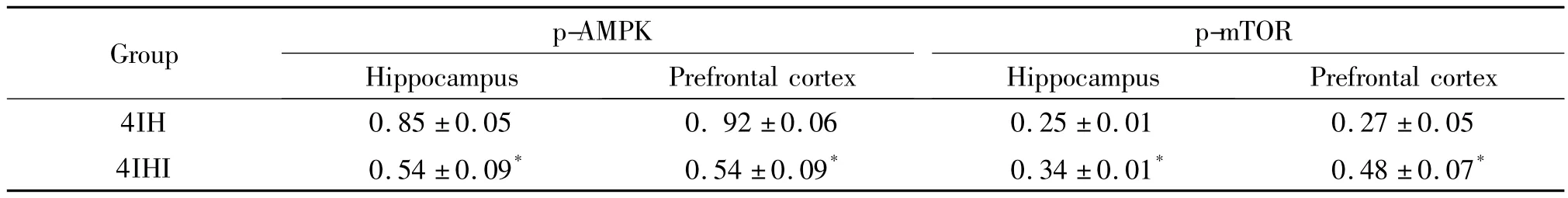
表7 AMPK抑制剂对幼鼠神经元p-AMPK及p-mTOR的影响Table 7.The protein levels of p-AMPK and p-mTOR in the hippocampal and forehead cortical tissues in the young rats between 4IHI and 4IHI groups(Mean±SD.n=3)
讨论
睡眠呼吸暂停综合征在成人和儿童都是较常见的一种临床病症,儿童发病率在1%~3%之间,成人发病率在2%~4%之间[9]。OSAHS的主要致病机制为反复的低氧-复氧循环过程,本模型中可见最低PO2为(43±4)mmHg,最低SO2为(76±3)%,复氧后可见氧分压及氧饱和度可上升至95%以上,并随90s的周期波动。与OSAHS患者的血液内氧分压及氧饱和度变化一致。我们前期实验[8]验证了慢性间歇性低氧可模拟OSAHS的病理生理变化。目前认为OSAHS可累及多个系统,如内分泌、心血管、神经系统。在OSAHS患儿神经系统症状最为突出,主要表现为认知功能障碍。O’Brien曾对35例OSAHS儿童进行研究,发现OSAHS儿童存在注意力不集中、执行能力下降、语言能力下降、学习能力下降[10],而经过手术或正压通气治疗后的儿童夜间血氧饱和度下降程度减小,神经系统症状改善,说明OSAHS夜间低氧对儿童大脑产生损伤。OSAHS夜间低氧模式即慢性间歇性低氧,更多的临床资料[11]及实验模型研究[12]证实,慢性间歇性低氧导致脑结构、功能、生理发生改变[13]。本实验研究结果显示慢性间歇性低氧组幼鼠的八臂迷宫实验错误率增加,提示不同程度出现认知功能异常。
慢性间歇低氧造成的脑损伤主要表现为神经元细胞的凋亡,诱发细胞凋亡的确切机制目前尚未完全明确,近20年来研究发现,腺苷也参与启动细胞凋亡信号。腺苷在体内分解迅速,可与腺苷受体(腺苷A1、A2a或A2b受体)结合产生各种相关代谢反应,而腺苷A2a受体则是其参与凋亡的重要途径。目前证实的是可以通过使用腺苷 A2a受体拮抗剂[14]和腺苷A2a受体基因敲除[15]的方法来减少脑损伤和神经元凋亡,A2a受体激活PKA途径可导致神经元损伤。AMPK为PKA重要的下游蛋白,有研究表明运动神经元中腺苷A2a受体可通过激活PKA途径,抑制AMPK的活性[16],导致人抗原R(HuR)异常分布,从而引起神经元退行性改变。但本实验结果提示腺苷A2a受体的表达升高,并没有抑制AMPK的活性,反而AMPK活性蛋白增多,这可能与慢性间歇性低氧导致的改变相关。
AMPK是能量调控家族中的关键蛋白,在脑组织低氧等应激改变都可影响AMPK的表达[17],腺苷A2a受体的激活可显著增加AMPK磷酸化,增加其活性[18]。AMPK处于代谢的中心位置,同时可通过AMPK-mTOR途径决定细胞代谢发展状态。但缺氧后脑组织中活化或磷酸化的AMPK作用仍存在争议。研究显示在组织缺血时,激活AMPK可起保护作用,AMPK通过改变细胞内AMP水平减少组织凋亡;体外实验显示,应用少量 AMPK激动剂激活AMPK,可减少海马神经元及胶质细胞凋亡,避免低血糖应激、谷氨酸毒性、神经酰胺等对海马及胶质细胞的损害[19]。但研究得出相反的结论,脑组织缺血、缺氧后过度激活AMPK活性,造成细胞毒性作用,致细胞凋亡[20]。在人神经母细胞瘤SH-SY5Y细胞中,予AMPK激动剂后,发现成纤维细胞凋亡[21],同样的结果显示,在脑皮层组织中激活AMPK,皮层神经元发生凋亡[22]。我们研究发现慢性间歇性低氧2IH组和4IH组较对照组海马、前额皮层区p-AMPK表达增高,4IH组表达增加更为明显;同时2IH组和4IH组较对照组脑区凋亡细胞增多,4IH组较2IH组增加更为明显。这说明慢性间歇性低氧后,AMPK激活,致慢性间歇性低氧神经元发生凋亡,影响认知功能。而予AMPK抑制剂后,4IHI组脑区细胞凋亡减少,八臂迷宫试验错误率下降。
mTOR是AMPK重要的下游途径,是保守的丝氨酸/苏氨酸蛋白激酶,与AMPK共同调节细胞增殖、凋亡。当周围环境不利于生长如缺氧、糖含量降低等,通过mTOR调节,合成代谢减少、分解代谢增加[23]。在缺氧条件下,AMPK激活,mTOR活性抑制,蛋白的合成下降,并通过各种途径转换信号,比如转录更多的低氧诱导因子、4E-BP1,S6K和S6脱磷酸化作用等,从而适应低氧环境。最新研究表明低氧通过mTOR途径损伤海马神经干细胞,从而影响幼鼠海马神经干细胞的增殖发育,进而影响幼鼠认知[24]。我们研究表明2IH组、4IH组较对照组海马、皮层区AMPK表达升高,mTOR磷酸化蛋白水平减低,4IH组下降更为明显;说明AMPK升高,mTOR下降,最终导致神经元凋亡,并且导致认知功能下降。而予AMPK抑制剂后AMPK表达下降,p-mTOR水平升高,八臂迷宫错误率下降。
本研究只初步观察了慢性间歇性低氧对幼鼠脑区腺苷A2a受体、AMPK、mTOR mRNA及p-AMPK、p-mTOR蛋白水平的影响及给予AMPK抑制剂后p-AMPK、p-mTOR蛋白水平的变化,说明慢性间歇性低氧可致海马、皮层区细胞凋亡,通过腺苷A2a受体活化,激活AMPK活性、抑制mTOR活性,我们初步推测腺苷A2a受体-AMPK-mTOR通路激活参与慢性间歇性低氧凋亡过程,进而影响学习记忆过程。
[1] Halbower AC,Degaonkar M,Barker PB,et al.Childhood obstructive sleep apnea associates with neuropsychological deficits and neuronal brain injury[J].PLoS Med,2006,3(8):e301.
[2] Ramamurthy S,Ronnett GV.Developing a head for energy sensing:AMP-activated protein kinase as a multifunctional metabolic sensor in the brain[J].J Physiol,2006,574 (Pt 1):85-93.
[3] Day YJ,Huang L,Mcduffie MJ,et al.Renal protection from ischemia mediated by A2Aadenosine receptors on bone marrow-derived cells[J].J Clin Invest,2003,112 (6):883-891.
[4] Yu L,Huang Z,Mariani J,et al.Selective inactivation or reconstitution of adenosine A2Areceptors in bone marrow cells reveals their significant contribution to the development of ischemic brain injury[J].Nat Med,2004,10 (10):1081-1087.
[5] An HK,Kim KS,Lee JW,et al.Mimulone-induced autophagy through p53-mediated AMPK/mTOR pathway increases caspase-mediated apoptotic cell death in A549 human lung cancer cells[J].PLoS One,2014,9(12): e114607.
[6] Inoki K,Zhu T,Guan KL.TSC2 mediates cellular energy response to control cell growth and survival[J].Cell,2003,115(5):577-590.
[7] Mccullough LD,Zeng Z,Li H,et al.Pharmacological inhibition of AMP-activated protein kinase provides neuroprotection in stroke[J].J Biol Chem,2005,280(21): 20493-20502.
[8] 李秀翠,蔡晓红,温正旺,等.间歇性低氧动物模型的建立及验证[J].医学研究杂志,2012,41(7):57-61.
[9] Sardó O,Pérez-Yarza EG,Aldasoro A,et al.Obstructive sleep apnea-hypopnea syndrome in children is not associated with obesity[J].Arch Bronconeumol,2006,42(11): 583-587.
[10]O'Brien LM,Mervis CB,Holbrook CR,et al.Neurobehavioral implications of habitual snoring in children[J].Pediatrics,2004,114(1):44-49.
[11]Engleman H,Joffe D.Neuropsychological function in obstructive sleep apnoea[J].Sleep Med Rev,1999,3(1): 59-78.
[12]Gozal D,Row BW,Kheirandish L,et al.Increased susceptibility to intermittent hypoxia in aging rats:changes in proteasomal activity,neuronal apoptosis and spatial function[J].J Neurochem,2003,86(6):1545-1552.
[13]Shan X,Chi L,Ke Y,et al.Manganese superoxide dismutase protects mouse cortical neurons from chronic intermittent hypoxia-mediated oxidative damage[J].Neurobiol Dis,2007,28(2):206-215.
[14]Melani A,Gianfriddo M,Vannucchi MG,et al.The selective A2Areceptor antagonist SCH 58261 protects from neurological deficit,brain damage and activation of p38 MAPK in rat focal cerebral ischemia[J].Brain Res,2006,1073-1074(1):470-480.
[15]Chen JF,Huang Z,Ma J,et al.A2Aadenosine receptor deficiency attenuates brain injury induced by transient focal ischemia in mice[J].J Neurosci,1999,19(21):9192-9200.
[16]Liu YJ,Lee LM,Lai HL,et al.Aberrant activation of AMP-activated protein kinase contributes to the abnormal distribution of HuR in amyotrophic lateral sclerosis[J].FEBS Lett,2015,589(4):432-439.
[17]Li J,Mccullough LD.Effects of AMP-activated protein kinase in cerebral ischemia[J].J Cereb Blood Flow Metab,2010,30(3):480-492.
[18]Godoy V,Banales JM,Medina JF,et al.Functional crosstalk between the adenosine transporter CNT3 and purinergic receptors in the biliary epithelia[J].J Hepatol,2014,61(6):1337-1343.
[19]Culmsee C,Monnig J,Kemp BE,et al.AMP-activated protein kinase is highly expressed in neurons in the developing rat brain and promotes neuronal survival following glucose deprivation[J].J Mol Neurosci,2001,17(1): 45-58.
[20]Jung JE,Lee J,Ha J,et al.5-Aminoimidazole-4-carboxamide-ribonucleoside enhancesoxidative stress-induced apoptosis through activation of nuclear factor-κB in mouse Neuro 2a neuroblastoma cells[J].Neurosci Lett,2004,354(3):197-200.
[21] Garcia-Gil M,Pesi R,Perna S,et al.5’-aminoimidazole-4-carboxamide riboside induces apoptosis in human neuroblastoma cells[J].Neuroscience,2003,117(4): 811-820.
[22]Nakatsu Y,Kotake Y,Hino A,et al.Activation of AMP-activated protein kinase by tributyltin induces neuronal cell death[J].Toxicol Appl Pharmacol,2008,230(3):358-363.
[23]Wullschleger S,Loewith R,Hall MN.TOR signaling in growth and metabolism[J].Cell,2006,124(3):471-484.
[24]Raman L,Kong X,Kernie SG.Pharmacological inhibition of the mTOR pathway impairs hippocampal development in mice[J].Neurosci Lett,2013,541(9):9-14.
(责任编辑:林白霜,罗 森)
Effect of chronic intermittent hypoxia on AMPK pathway in young rats
LIANG Dong-shi1,CHEN Li-ya2,HONG Fang-fang2,LIN Jing2,WEN Zheng-wang3,LI Xiu-cui4,CAI Xiao-hong2
(1Department of Emergency,2Department of Pneumology,3Department of Infectious Diseases,4Department of Neurology,The Second Affiliated Hospital&Yuying Children’s Hospital,Wenzhou Medical University,Wenzhou 325000,China.E-mail:caixh839@sina.com)
AIM:To investigate the effect of chronic intermittent hypoxia on AMP-activated protein kinase (AMPK)pathway in the brain of young rats.METHODS:Part one:SD mice(3~4 weeks old)were randomly divided into 4 groups(n=8):simulated air control group for 2 weeks(2AC),chronic intermittent hypoxia group for 2 weeks (2IH),simulated air control group for 4 weeks(4AC)and chronic intermittent hypoxia group for 4 weeks(4IH).Part two:SD mice(3~4 weeks old)were randomly divided into 2 groups(n=8):chronic intermittent hypoxia group for 4 weeks(4IH)and chronic intermittent hypoxia group treated with AMPK inhibitor for 4 weeks(4IHI).After modeling,the eight-arm maze test was performed.TUNEL method was used to detect the neuronal apoptosis in the hippocampal and prefrontal cortical tissues.The mRNA expression of adenosine A2a receptor was examined by RT-qPCR,and the protein levels of phosphorylated AMPK(p-AMPK)and mammalian target of rapamycin(p-mTOR)were determined by Western blot.RESULTS:Compared with control group,the numbers of reference memory error(RME),working memory error(WME) and total error(TE)in 2IH group and 4IH group significantly increased(P<0.01).Compared with 2IH group,the numbers of errors in 4IH group also increased significantly(P<0.01).Compared with 4IH group,the values in 4IHI group significantly decreased.Compared with control group,the neuronal apoptosis of hippocampus and prefrontal cortex in 2IH group and 4IH group increased,and that in 4IH group was more evident(P<0.05).In 4IHI group,the neuronal apoptosis decreased.The mRNA expression of adenosine A2a receptor in the hippocampal and cortical tissues in 2IH group and 4IH group was higher than that in control group.The protein level of p-AMPK was higher,and p-mTOR was lower in 2IH group and 4IH group,and those in 4IH group were more evident(P<0.05).Compared with 4IH group,the protein level of p-AMPK was lower,and p-mTOR was higher in 4IHI group.CONCLUSION:Chronic intermittent hypoxia induces neuronal apoptosis,resulting in impairment of learning and memory in a time-dependent manner by upregulating adenosine A2a receptor,activating AMPK activity,and inhibiting mTOR phosphorylation in rats.
Chronic intermittent hypoxia;Adenosine A2a receptor;AMP-activated protein kinase;Mammalian target of rapamycin;Hippocampus;Prefrontal cortex
R714.253;R363.2
A
10.3969/j.issn.1000-4718.2016.07.008
1000-4718(2016)07-1200-08
2015-06-15
2016-06-03
浙江省自然科学基金资助项目(No.Y2110277);浙江省科技厅公益性技术应用研究计划资助项目(No.2013C33174);温州市科学技术局科技合作项目(No.H20130001);浙江省医药卫生科技计划(No.2014ZDA014);国家卫计委国家重点临床专科开放课题(No.20130201)
△Tel:0577-88002125;E-mail:caixh839@sina.com

