芦柑皮中柠檬苦素提取工艺优化
谢三都 福建师范大学闽南科技学院
芦柑皮中柠檬苦素提取工艺优化
谢三都 福建师范大学闽南科技学院
以永春芦柑的果皮为原料,研究了超声波辅助溶剂法提取芦柑皮中的柠檬苦素。结果表明,超声波辅助溶剂法提取芦柑皮中柠檬苦素的最优工艺条件为:70%乙醇溶液、料液比1∶30(g∶ml),40℃恒温水浴20min,所得芦柑皮柠檬苦素提取率为11.29mg/g。
芦柑皮;柠檬苦素;提取工艺
芦柑(Citrus madurensisLour)又名乳柑、真柑、柑果,为芸香科柑橘属(Citrus reticulata Blanco)宽皮橘类植物[1]。芦柑除用于鲜食外,少部分用于制作果汁[2]、果酒[3]、果醋[4]、果酱[5]等,受季节、运输、贮藏及加工[6]等条件影响,每年均有大量鲜果腐烂丢弃[1],芦柑产业面临增产不增收的窘境。目前,从芦柑果皮中提取果胶[7,8]、精油[9]、黄酮类化合物[10]、多糖[11]、柠檬苦素类似物[12]等成为提高芦柑综合加工利用的途径。
柠檬苦素(Limonoids)是一类高度氧化的四环三萜类化合物,是引起柑橘类果汁苦味的主要物质[13]之一,具有抑制HIV[14]、抗氧化[15,16]、抗炎[17]、抑菌[18]、抗肿瘤[19,20]等作用,有致昆虫拒食活性和不育的生理活性[21],主要存在于芸香科和楝科植物体内[22],广泛地分布于柑橘属类中。研究发现,从柑橘皮、蜜柚皮和柚皮中可提取获得柠檬苦素[23-25],高一勇[12]等报道了芦柑皮中含有柠檬苦素。到目前为止,却鲜见有采用超声波辅助溶剂法从芦柑皮中提取柠檬苦素的研究性报道。
本文通过研究溶剂类型、溶剂浓度、料液比、超声波时间、提取温度对柠檬苦素提取率的影响,获得超声波辅助溶剂法提取芦柑皮中柠檬苦素的最佳提取工艺条件。有利于减少芦柑皮的资源浪费及为芦柑产业的发展提供一条新的加工途径,在一定程度上刺激芦柑产业的进一步发展。
1 材料与方法
1.1 材料
原料:永春芦柑果皮,2015年11月采购于南安洪濑新华都超市。
试剂:柠檬苦素标准品:成都曼斯特生物科技有限公司,色谱纯;对-二甲氨基苯甲醛:成都市科龙化工试剂厂,乙醇、浓硫酸、三氯化铁、乙醚、氯仿、丙酮、甲醇、石油醚,以上试剂均为分析纯。
1.2 仪器与设备
HS6150D超声波仪器:天津恒奥科技发展有限公司;SHZ-DⅢ型予华牌循环水真空泵:巩义市予华仪器有限责任公司;RE-5203旋转蒸发仪:上海亚荣生化仪器厂;BT-124S电子天平:北京赛多利斯仪器系统有限公司;DHG-9245A鼓风干燥箱:上海一恒科技有限公司;WFJ720型可见分光光度计:上海尤尼柯仪器有限公司;远红外快速恒温干燥箱:上海跃进医疗器械厂;HWS-250恒温恒湿箱:上海精宏实验设备有限公司。
1.3 试验方法
1.3.1 芦柑皮柠檬苦素提取工艺流程
新鲜芦柑皮→在50℃下烘48h、粉碎,过60目筛→加溶剂→超声波处理→过滤除渣→旋转蒸馏浓缩(40℃,60rpm)→芦柑皮柠檬苦素。
1.3.2 芦柑皮柠檬苦素提取率的测定方法
芦柑皮柠檬苦素提取率参照李彪[26]等关于柠檬苦素提取率测定方法,建立标准曲线回归方程:
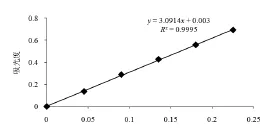
图1 柠檬苦素质量浓度(mg/mL)
由图1可知,标准曲线的回归方程为:

式中:y为柠檬苦素标准溶液在500nm波长处测定的吸光度;x为柠檬苦素标准溶液浓度(mg/ml),柠檬苦素质量浓度在0~0.25mg/ml范围内线性关系良好。
按以下公式计算芦柑皮中柠檬苦素的提取率:
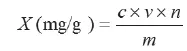
式中:X为柠檬苦素提取率,mg/g;c为提取液中柠檬苦素的质量浓度,mg/ml;v为提取液中柠檬苦素溶液体积,ml;n为稀释倍数;m为样品质量,g。
1.3.3 单因素实验
1.3.3.1 溶剂类型对柠檬苦素提取率的影响
准确称量5份1.00g脱脂且干燥至恒重的芦柑皮粉于三角瓶中,各加入20ml乙醚、氯仿、丙酮、甲醇和乙醇,于50℃下超声波提取20min后,过滤,真空浓缩后用30%乙醇定容,显色,在500nm波长下测定吸光值,计算柠檬苦素提取率。
1.3.3.2 溶剂浓度对柠檬苦素提取率的影响
准确称量5份1.00g脱脂且干燥至恒重的芦柑皮粉于三角瓶中,各加入50%、60%、70%、80%、90%乙醇20ml,于50℃下超声波提取20min后,过滤,真空浓缩后用30%乙醇定容,显色,在500nm波长下测定吸光值,计算柠檬苦素提取率。
1.3.3.3 料液比对柠檬苦素提取率的影响
准确称量5份1.00g脱脂且干燥至恒重的芦柑皮粉于三角瓶中,各加入70%乙醇调至料液比为1∶10g/ml、1∶20g/ml、1∶30g/ml、1∶40g/ml、1∶50g/ml,于50℃下超声波提取20min后,过滤,真空浓缩后用30%乙醇定容,显色,在500nm波长下测定吸光值,计算柠檬苦素提取率。
1.3.3.4 超声波处理时间对柠檬苦素提取率的影响
准确称量5份1.00g脱脂且干燥至恒重的芦柑皮粉于三角瓶中,各自加入70%乙醇20ml,于50℃下超声波提取10、20、30、40、50min后,过滤,真空浓缩后用30%乙醇定容,显色,在500nm波长下测定吸光值,计算柠檬苦素提取率。
1.3.3.5提取温度对柠檬苦素提取率的影响
准确称量5份1.00g脱脂且干燥至恒重的芦柑皮粉于三角瓶中,各自加入70%乙醇20ml,于30、40、50、60、70℃下超声波提取20min后,过滤,真空浓缩后用30%乙醇定容,显色,在500nm波长下测定吸光值,计算柠檬苦素提取率。
1.3.4 正交试验
在单因素实验基础上,选择乙醇浓度、料液比、超声时间、超声温度四个主要影响因素,按照五因素四水平(见表1)的正交试验优化芦柑皮中提取柠檬苦素的工艺参数。获取最优提取条件进行提取,然后在500nm波长下测定吸光值,计算柠檬苦素提取率。
示踪剂通常情况选取与工作介质互溶的NaCl或KCl[6],本次模拟采用NaCl作为示踪剂,其相关属性如表1所示。
1.3.5 数据处理
采用DPS2.0数据处理软件对正交试验结果进行极差分析和方差分析。
2 结果与分析
2.1 溶剂类型对柠檬苦素提取率的影响
由图2可知,不同溶剂对柠檬苦素提取率有不同的影响,相比之下乙醇的提取率最高,为6.47mg/g。因此,选择乙醇为实验的最佳提取剂。
2.2 乙醇浓度对柠檬苦素提取率的影响
由图3可知,乙醇浓度在60%~70%之间,柠檬苦素的提取率随乙醇浓度增加而增加。随后再增加乙醇浓度,柠檬苦素的提取率随之下降。在乙醇含量为70%时,提取率已达到最大,再增加乙醇浓度时,提取率会受到一定的影响,当乙醇为70%时柠檬苦素达到10.12mg/g;而乙醇浓度增大至80%时,提取率下降至8.35mg/g。因此本试验把乙醇浓度定为70%。
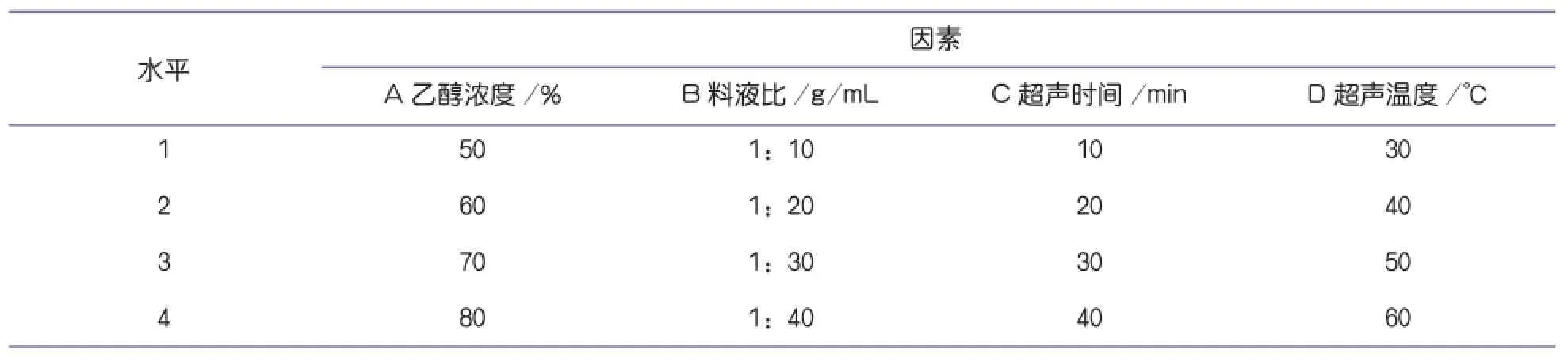
表1 试验因素和水平表

图2 不同溶剂类型对柠檬苦素提取率的影响
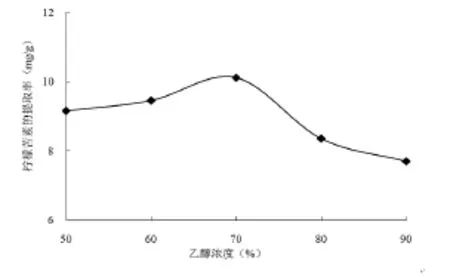
图3 不同溶剂浓度对柠檬苦素提取率的影响
2.3 料液比对柠檬苦素提取率的影响
2.4 超声波处理时间对柠檬苦素提取率的影响
由图5可知提取时间小于20min时,柠檬苦素的提取率随着时间的延长而升高,当时间为20min时最大,达到10.99mg/g,当超过20min时,柠檬苦素的提取率随之下降,当时间为30min时,提取率下降到10.09mg。因此,选择的较佳提取时间为20min。

图4 不同料液比对柠檬苦素提取率的影响
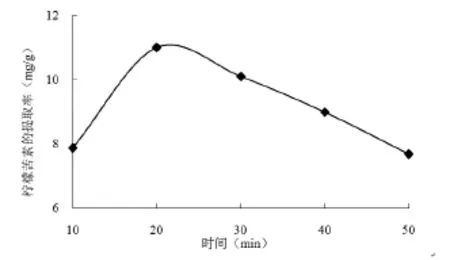
图5 不同超声波处理时间对柠檬苦素提取率的影响
2.5 超声波温度对柠檬苦素提取率的影响
从图6可知,柠檬苦素的提取率先增加后减少。提取温度在40~50℃时,柠檬苦素提取率随温度升高而增加,当温度为50℃时柠檬苦素的提取率最大,达到10.55mg/g,超过50℃时,柠檬苦素的提取率随温度升高不断下降,在温度为60℃时,提取率下降到8.44mg/g。因此,选择的较佳提取温度为50℃。
根据正交试验结果,比较各列的极差结果R值,可以发现在试验所设定的因素中,超声时间对柠檬苦素提取率的影响最大,其次才是乙醇浓度和料液比。通过对K值的比较,可知A3、B3、C2、D2为最优水平。
由表3可以看出,在所选取的三个因素中,对柠檬苦素提取率影响的主次顺序为:C>B>A>D,即时间>料液比>乙醇浓度>温度,这与表2中极差分析的结果相一致。进一步的统计分析和显著性检验结果表明,因素C影响极显著,因素A、B、D显著。根据正交试验得出的最优结果为:A3B3C2D2。
取A3B3C2D2最优水平做验证试验,结果与正交试验结果相一致,说明超声波提取柠檬苦素的最佳工艺条件即为在料液比1︰30条件下,40℃水浴浸提20min,所得柠檬苦素提取率为11.29mg/g。
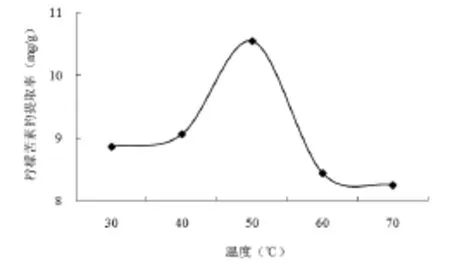
图6 不同提取温度对柠檬苦素提取率的影响
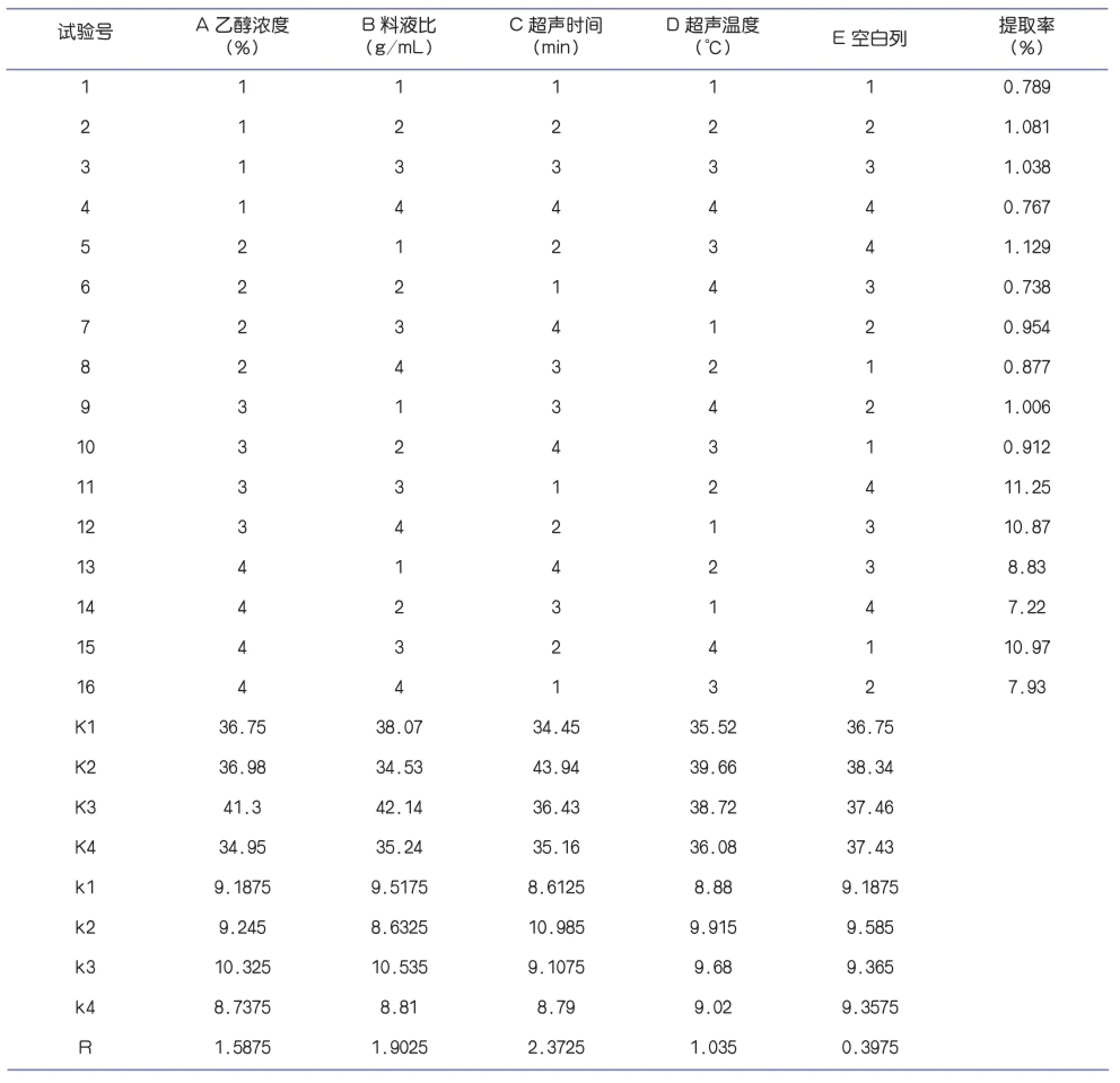
表2 正交试验的结果及分析
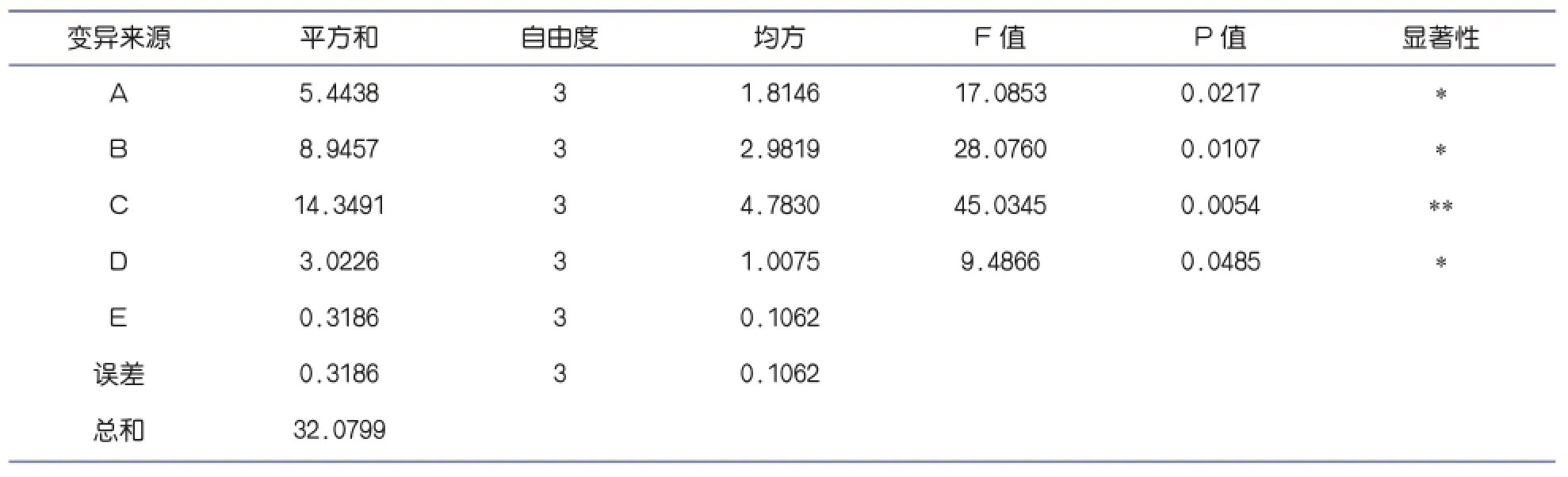
表3 正交试验的方差分析表
3 结论
通过单因素试验和正交试验对比溶剂浓度、料液比、超声波处理时间、提取温度对柠檬苦素提取率的影响。其中,超声时间是影响柠檬苦素提取率的主要因素,其次是提取时间和乙醇浓度,提取温度对柠檬苦素提取率的影响相对较小,在柠檬苦素的提取过程中超声波对柠檬苦素提取率的提高起到了辅助作用。所得超声波辅助溶剂法提取芦柑皮中柠檬苦素的最优组合条件为70%乙醇溶液、料液比1∶30(g∶ml),40℃恒温水浴20min,所得芦柑皮柠檬苦素提取率为11.29mg/g。
[1] 陈忠宗.永春芦柑浓缩汁生产工艺的研究[J].福建轻纺,2006(11):75-78.
[2] 高彦祥,陈静,吴伟莉,等.吸附树脂在柑桔汁脱苦中的应用[J].饮料工业,2005,8(3):1-5.
[3] 陈丽娇,陈清西,吕峰.芦柑酒脱苦技术研究[J].福州大学学报:自然科学版,2002,30(增刊):727-729.
[4] 颜文凤.芦柑果醋饮料的研制[J].江苏调味副食品,2003,20(5):14-16.
[5] 薛彩娟,黄枚,林清强.永春芦柑果酱生产工艺研究[J].农产品加工☒学刊,2011(6):81-83.
[6] 夏辉,田呈瑞.柑桔果汁中苦味物质的去除方法[J].现在生物医学进展,2006,6(6):50-52.
[7] 李宏睿,邹立强,韩雅惠,等.芦柑皮果胶提取工艺的研究[J].保鲜与加工,2011,11(1):32-35.
[8] 吴环.芦柑皮中果胶提取研究[J].安徽农业科学,2012,40(7):3982-3983,3991.
[9] 高余朵,李保国.超临界CO2萃取芦柑精油的研究[J].分离与提取,2004,20(6):22-24.
[10] 焦士蓉,王玲,林玲.芦柑皮黄酮类物质的微波辅助提取及其抗氧化活性研究[J].西华大学学报:自然科学版,2007,26(4):36-38,82.
[11] 王丽艳,荆瑞勇,阮洪生,等.芦柑皮中水溶性多糖提取条件的研究[J].食品科学,2009,30(6):117-119.
[12] 高一勇,詹忠根,陆旋,等.椪柑中柠檬苦素开发与产业化应用[J].现代商业,2009,(6).
[13] 全晓艳,刘新宇,谢士娟,等.超临界二氧化碳萃取柠檬籽中柠檬苦素化合物的工艺研究[J].安微农业科学,2013,41(10):4623-4625.
[14] Liminoidsstrongly inhibit HIV protease activity [N].Health&Medicine week,2004-02-09.
[15] 施英,徐玉娟,陈卫东,等.桔核中柠檬苦素类物质最佳提取条件的探讨及清除DPPH活性的研究[J].食品与机械,2006,22(6):74-76.
[16] 刘英.四季柚果实主要功能成分分析及抗抗氧化作用的研究[D].杭州:浙江大学,2007:79-83.
[17] 施英,徐玉娟,吴娱明,等.橘核中柠檬苦素类物质消炎镇痛作用的研究[J].天然产物研究与开发,2007,19:456-458.
[18] 罗水忠,潘利华,何建军,等.柑橘籽中柠檬苦素的提取与抑菌性研究[J].农产品加工☒学刊,2006,(10):104-106.
[19] 唐莉莉,曾祥斌,田庆国,等.柠檬苦素类化合物对人乳腺癌细胞(MCF27)的生长抑制及细胞周期动力学的影响[J].无锡轻工大学学报,2001,20(2):205-207.
[20] B Torto,A Hassanal.A limonoid from turraca floribunda [J].Phytochemistry,1996,42(4):1235-1237.
[21] Michael D.Bentley,Mohammed S.Rajab,Michael J.Mendel,et al.Limonoid modelinsectantifeedants[J].J.Agric.Food Chem.,1990,38(6):1400-1403.
[22] 王贱荣,董美玲,郭跃伟.芸香科柠檬苦素类化合物及其生物活性研究进展[J].国际药学研究杂志,2009,36(5):1-2.
[23] 张丽杰,赵天涛,全学军,等.柑橘皮渣抑菌成分提取工艺研究[J].食品研究与开发,2009,30(2):23-25.
[24] 彭腾,李鸿翔,文焕松,等.蜜橘皮中柠檬苦素总类似物促胃肠动力实验研究[J].药理,2010,22(5):32-37.
[25] 李彪,施蕊,熊智,等.柚皮柠檬苦素的提取及其杀虫活性研究[N].中国农学通报,2012,28(01):284-288.
谢三都(1984),男,讲师,硕士,研究方向:植物天然产物的研究与应用。
——营养
——去皮

