双膦酸盐抗肾移植术后骨质丢失有效性及安全性的Meta分析
白云金,王晓明,杨玉帛,韩 平,王 佳,魏 强,唐 寅
(四川大学华西医院泌尿外科, 四川成都 610041)
双膦酸盐抗肾移植术后骨质丢失有效性及安全性的Meta分析
白云金,王晓明,杨玉帛,韩平,王佳,魏强,唐寅
(四川大学华西医院泌尿外科, 四川成都610041)
目的系统评价双膦酸盐抗肾移植术后骨质丢失的有效性及安全性。方法计算机检索Medline、Cochrane Library、Embase、CNKI、CBM、VIP和万方数据库,全面收集有关双膦酸盐抗肾移植术后骨质丢失的随机对照试验。检索时限均从建库至2016年1月。由2位研究者独立筛选文献、提取资料和评价纳入研究质量后,采用RevMan 5.2软件进行Meta分析。结果纳入21篇随机对照研究,共计1 225例患者。Meta分析结果显示:在对照组基础上加用双膦酸盐明显提高患者脊柱[MD=4.69, 95%CI(2.79~6.59),P<0.000 1]和股骨颈[MD=4.15, 95%CI(1.97~6.33),P=0.000 2]骨密度(BMD)变化百分比;双膦酸盐组明显提高患者脊柱骨质密度变化绝对值[MD=0.05, 95%CI(0.04~0.05),P<0.0001],但并未提高股骨颈BMD变化绝对值[MD=0.02, 95%CI(0.00~0.04),P=0.06]。两组患者骨折及不良反应发生率比较差异无统计学意义。结论双膦酸盐可降低肾移植受者早期脊柱骨质丢失且不增加不良反应发生率。
肾移植;骨质丢失;双膦酸盐;Meta分析
DOI:10.3969/j.issn.1009-8291.2016.07.004
骨密度(bone mineral density, BMD)异常是肾移植受者术后常见并发症之一,发生率高达76%[1]。骨质丢失速度最快常发生在术后半年至1年,第1年内BMD降低约10%[2]。移植受者骨质丢失主要原因包括移植前已存在肾性骨营养不良,移植后免疫抑制剂的影响,移植肾功能减退对骨代谢的影响等因素[3]。双膦酸盐可减少破骨细胞数量并抑制其活力,常用来预防骨质丢失和治疗骨质疏松。但对肾移植受者预防和治疗骨质丢失作用尚不明确。本文收集关于双膦酸盐预防和治疗肾移植受者术后骨质丢失的随机对照试验(randomized controlled trial, RCT),利用Meta分析提高检验效能,以期更科学地评价其有效性及安全性。
1 资料与方法
1.1检索策略计算机检索Medline、Cochrane Library、Embase、CNKI、CBM、VIP和万方数据库中自建库以来到2016年1月有关双膦酸盐预防和治疗肾移植受者术后骨质丢失的RCT。英文检索词包括:“renal transplantation”、 “kidney transplantation”、“bisphosphonates” 或 the generic names of multifarious bisphosphonates。中文检索词包括:肾移植、双膦酸盐。
1.2纳入标准研究需满足以下标准:①研究类型:已发表RCT;②研究对象:仅接受肾移植者,患者年龄≥18岁,接受免疫抑制治疗者可纳入研究;③干预措施:对照组接受安慰剂或不治疗或予以钙剂/维生素D及其类似物,双膦酸盐组在对照组基础上加用双膦酸盐;④结局指标:BMD变化百分比,BMD变化绝对值,骨折事件以及治疗相关不良反应。
1.3文献筛选与资料提取由2位研究者独立进行资料提取,如遇分歧,讨论解决或征求第3位研究者意见解决。提取资料包括:①文献题目、作者、发表时间;②研究对象的基本特征;③各组患者的基线、干预措施和结局指标;④各研究的方法学详细信息,以便对偏倚风险及研究质量进行评估。
1.4文献质量评价质量评价主要根据Cochrane系统评价手册推荐的RCT评价标准进行评估,主要评价内容包括:①随机分组的方法;②是否分配隐藏;③有无采用盲法;④结果数据的完整性;⑤有无选择性报告偏倚;⑥有无其他偏倚。若评估为“lower risk”表示为偏倚低风险,评估为“high risk”表示为偏倚高风险,“unclear risk”表示文献未提供足够的信息进行偏倚评估。
1.5统计学方法采用RevMan5.2软件进行数据分析,计数资料采用比值比(odds risk,OR)作为效应量,计量资料采用均数差(mean difference,MD)为效应量,均给出95%可信区间(confidence interval,CI)。异质性分析采用2检验,如无统计学异质性,采用固定效应模型分析;如存在异质性,则分析异质性来源,并根据可能导致异质性的因素进行亚组分析,若无明显临床异质性,采用随机效应模型进行Meta分析,否则采用描述性分析。必要时采用敏感性分析检验结果的稳定性。以P<0.05为差异有统计学意义。
2 结 果
2.1检索结果按照检索策略在中文数据库和外文数据库进行初步筛选,获得相关文献共264篇;然后通过阅读文献标题、摘要及全文进一步筛选,最终纳入21篇已发表的RCT[1-21],共25个对照研究,1 225例患者,其中双膦酸盐组580例,对照组645例。双膦酸盐包括帕米磷酸二钠[1, 4, 8, 15, 19-20],阿伦膦酸钠盐[2, 6, 7, 11-14, 17],利塞膦酸盐[5, 16, 18],伊班膦酸钠[3, 9],氯膦酸盐[21]和唑来膦酸盐[10]。其中,19[1-4, 6-7, 9-21]篇研究中报告患者每日服用钙剂,15[1, 3-7, 11-20]篇研究中患者服用维生素D或类似物,18[1, 3-13, 16-21]篇研究报告患者应用免疫抑制剂。所有研究试验组与对照组患者基线一致。
2.2质量评价纳入的21篇RCT中,9篇[3-7, 18-21]研究具体描述了随机产生方法,8篇[3-6, 12, 18, 19, 21]研究正确使用分配隐藏和盲法,其余仅提及随机分配,未描述随机序号产生方法、分配隐藏和盲法的实施。最终,仅2篇[3, 5]研究存在低风险偏倚,仅1项[5]研究采用意向性分析。
2.3骨密度变化百分比9篇研究评价双膦酸盐治疗后脊柱BMD变化百分比。对纳入的研究进行异质性检验发现异质性明显(P<0.001,I2=99%),未找到明确引起异质性原因,因此采用随机效应模型合并数据。结果显示相对于对照组,双膦酸盐组明显提高患者脊柱BMD变化百分比,两组间差异具有统计学意义[MD=4.69, 95%CI(2.79~6.59),P<0.000 1](图1A)。5篇研究评价双膦酸盐治疗后股骨颈BMD变化百分比,异质性检验发现这些研究异质性明显(P<0.001,I2=86%),敏感性分析未找到明确引起异质性原因,因此采用随机效应模型合并数据。结果显示相对于对照组,双膦酸盐组明显提高患者股骨颈BMD变化百分比,两组间差异具有统计学意义[MD=4.15, 95%CI(1.97~6.33),P=0.000 2] (图1B)。依照对照组采用不同治疗方案进行亚组分析,结果详见表1。
2.4骨密度变化绝对值15篇研究评价双膦酸盐治疗后脊柱BMD变化绝对值。Meta分析结果显示相对于对照组,双膦酸盐组明显提高患者脊柱骨质密度变化绝对值,两组间差异具有统计学意义[MD=0.05, 95%CI(0.04~0.05),P<0.000 1;I2=0%](图2A)。10篇研究评价双膦酸盐治疗后股骨颈BMD变化绝对值。Meta分析结果显示两组患者股骨颈BMD变化绝对值间差异无有统计学意义[MD=0.02, 95%CI(0.00~0.04),P=0.06;I2=0%](图2B)。亚组分析结果详见表1。
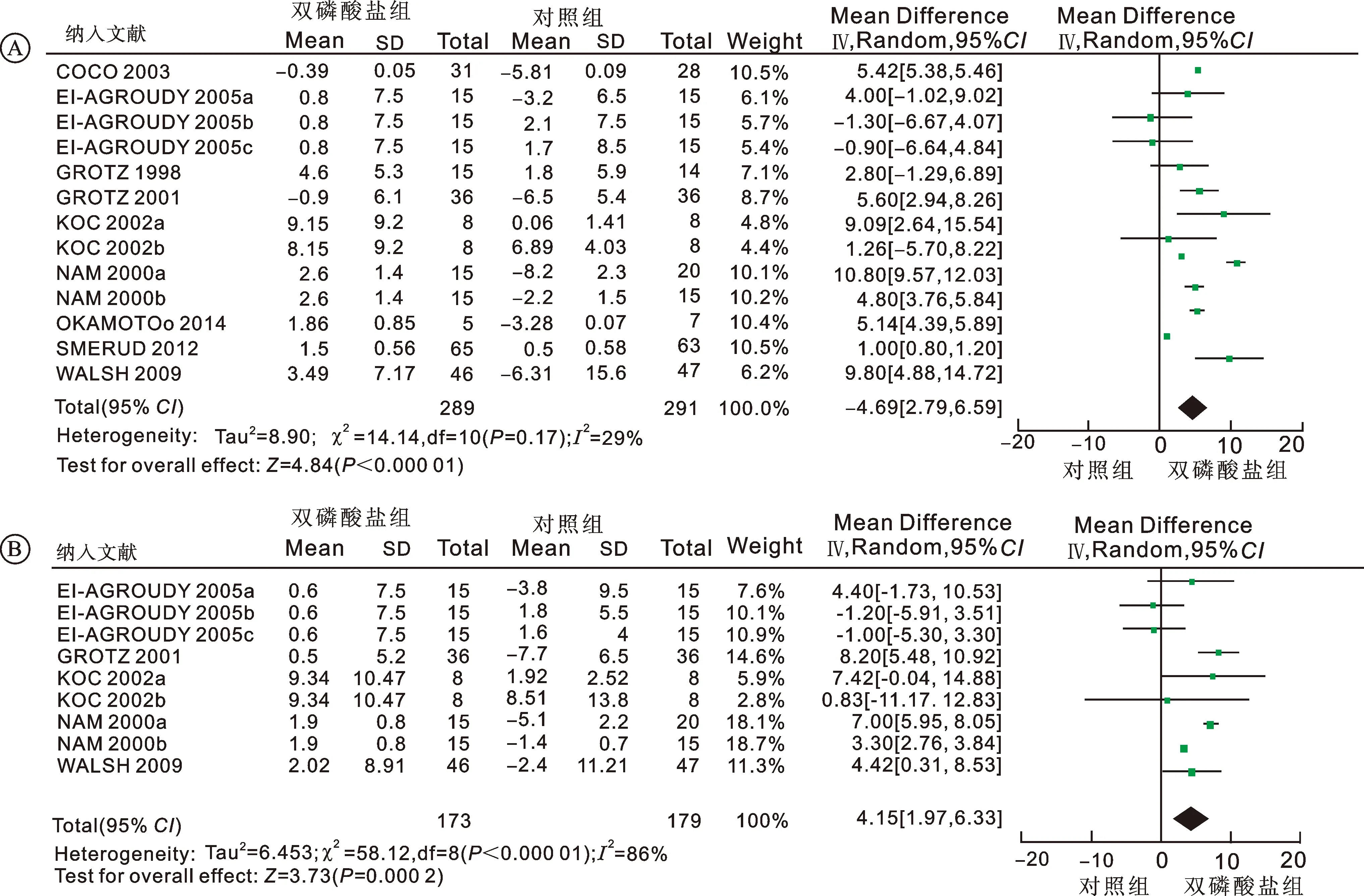
图1骨密度变化百分比的Meta分析
A:脊柱;B:股骨颈。
表1双膦酸盐组与钙剂单用或联合维生素D对骨质密度影响亚组分析

指标/部位对照组用药研究篇数MD(95%CI)P值异质性I2(%)P值BMD变化百分比 脊柱钙剂47.14(3.01~11.26)0.000787<0.0001 脊柱钙剂+维生素D58.61(4.61~12.62)<0.000196<0.0001 股骨颈钙剂37.16(6.19~8.13)<0.000100.72 股骨颈钙剂+维生素D23.30(2.76~3.83)<0.000100.69BMD变化绝对值 脊柱钙剂30.04(0.00~0.08)0.0700.83 脊柱钙剂+维生素D90.05(0.04~0.05)<0.000100.48 股骨颈钙剂30.02(-0.01~0.06)0.2280.36 股骨颈钙剂+维生素D40.04(-0.02~0.09)0.2000.42
注:双膦酸盐组均在对照组基础上加用双膦酸盐治疗。
2.5骨折发生情况9篇研究比较两组患者研究期间发生脊柱骨折情况,Meta分析结果显示双膦酸盐组和对照组患者脊柱骨折发生率分别为3.49%、7.04%,两组间差异无统计学意义[OR=0.67, 95%CI(0.33~1.35),P=0.26;I2=0%](图3A);4篇研究比较两组患者研究期间发生非脊柱骨折情况,Meta分析结果显示双膦酸盐组和对照组患者非脊柱骨折发生率分别为2.78%、6.15%,两组间差异无统计学意义[OR=0.47, 95%CI(0.15~1.47),P=0.20;I2=0%] (图3B)。
2.6不良反应9篇研究比较两组患者不良反应发生情况。对纳入研究进行异质性检验,结果显示研究间存在同质性(P=0.10,I2=41%),故采用固定效应模型进行Meta分析。结果显示双膦酸盐组和对照组患者治疗相关不良反应发生率分别为25.85%、26.80%,两组间差异无统计学意义[OR=0.85, 95%CI(0.53~1.34),P=0.47] (图4A)。3篇研究比较两组患者胃肠道不良反应发生情况,Meta分析结果显示双膦酸盐组和对照组患者胃肠道不良反发生率分别为4.95%、10.20%,两组间差异无统计学意义[OR=0.46, 95%CI(0.15~1.41),P=0.18;I2=24%](图4B)。

图2骨密度变化绝对值的Meta分析
A:脊柱;B:股骨颈。

图3 骨折发生率对比的Meta分析
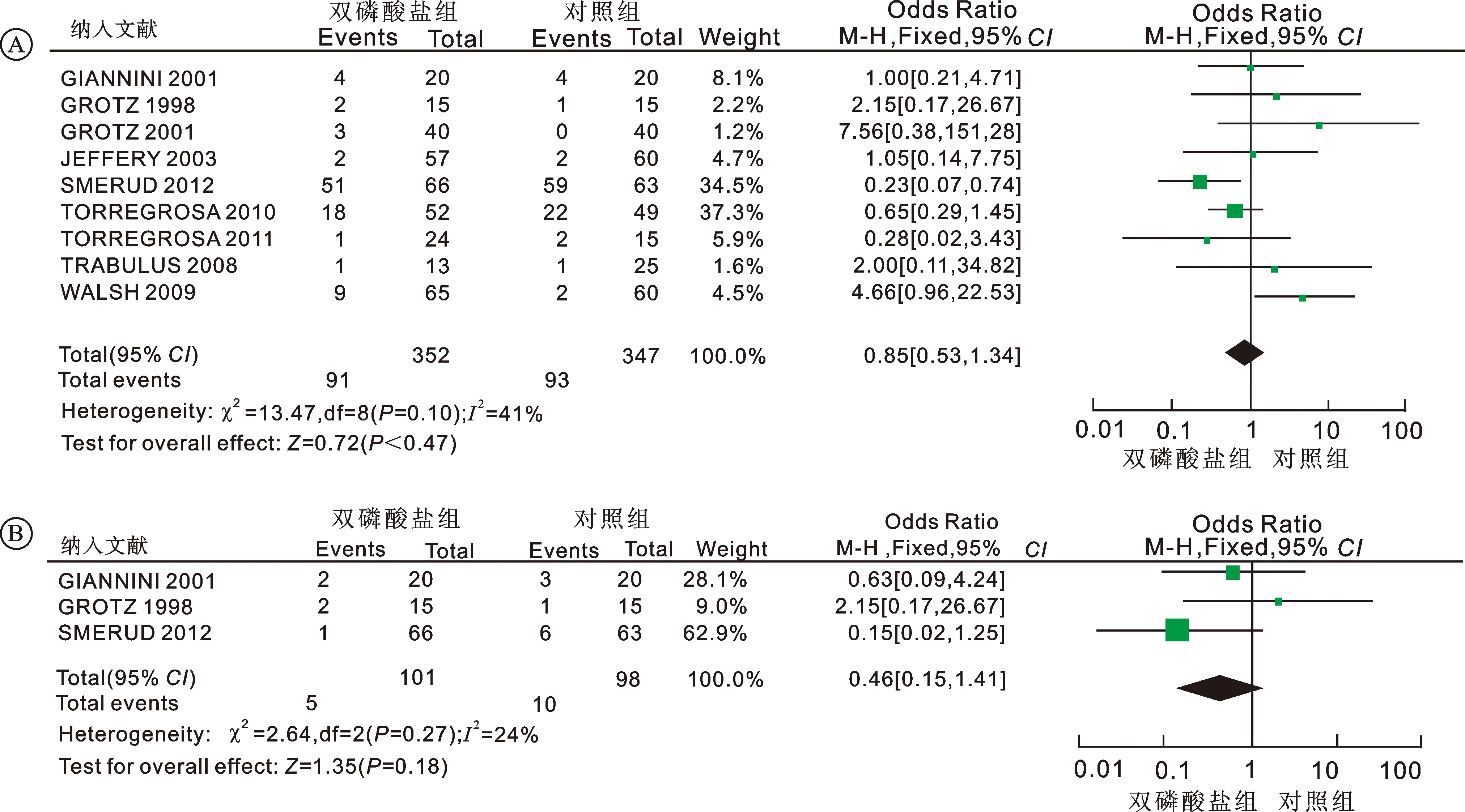
图4 不良反应对比的Meta分析
2.7对肾功影响13篇研究比较两组患者治疗后肾功能的情况。Meta分析结果显示双膦酸盐组和对照组患者治疗后12月血清肌酐水平无明显差异[MD=-0.01, 95%CI(-0.11~0.08),P=0.80;I2=29%](图5A)。治疗后6月肾小球滤过率(glomerular filtration rate, GFR)两组间亦无明显差异。[MD=2.49, 95%CI(-7.63~12.61),P=0.63;I2=47%](图5B)。

图5治疗后肾功能比较的Meta分析
A:12月肌酐;B:6月GFR。
3 讨 论
肾移植是终末期肾衰的最佳治疗手段。然而,肾移植相关并发症不容忽视,其中移植后骨病发病率高达76%,其特征表现为骨质丢失和易骨折,严重影响肾移植受者的生活质量,甚至降低患者的生存[22]。因此,对肾移植骨病高危患者应尽早在肾移植手术后制定出预防和治疗骨质丢失的方案。
肾移植术后第1年骨质丢失最快,即使后期降低类固醇药物剂量亦会导致BMD以一定速度丢失并持续较长时间。近期,国内研究指出肾移植受者骨质疏松的危险因素包括年龄>50岁、父母有髋骨骨折史以及应用大剂量激素[23]。欧洲实践指南推荐对于骨质丢失高危肾移植者,如无明显禁忌证可予以补充钙剂、维生素D,还可给予双膦酸盐预防骨质丢失[24]。双膦酸盐是针对移植后骨质丢失的主要药物,它主要是抑制破骨细胞的骨吸收作用。本研究通过Meta分析证实双膦酸盐单用或联合钙剂/维生素D均可减少脊柱骨质丢失,效果优于钙剂单用或联合维生素D,但并未降低股骨颈骨质丢失。其原因可能在于皮质骨和松质骨对双膦酸盐反应具有异质性。双膦酸盐可能对皮质骨破骨细胞短期无明显作用[25]。
肾移植术后不同时期骨质丢失的程度不同。尽管肾移植患者存在长期影响其BMD的危险因素,包括糖尿病、继发甲状旁腺功能亢进、低磷血症以及营养不良等。但随着免疫抑制剂方案的改善和肾移植受者后期类固醇使用剂量的减少,明显改善了肾移植受者长期骨质的保留。目前大量研究证实对于长期存活的肾移植患者,其BMD长期处于稳定甚至得到改善[26-27]。有研究表明,在移植术后无任何治疗的情况下,1~2年间患者脊柱BMD增加2.2%,股骨颈BMD增加3.3%[28],这与糖皮质激素剂量减低有关。因此,目前双膦酸盐主要用于肾移植受者早期预防或治疗骨质丢失。
早期预防或治疗肾移植受者骨质丢失最佳双膦酸盐制剂应是具有明显效果、不良反应小且患者依从性好的药物。该研究纳入所有研究并未报道任何药物相关严重不良反应,而且Meta分析结果显示双膦酸盐并不会增加相关不良反应。值得注意的是,虽然双膦酸盐能改善肾移植患者的BMD,但有可能会导致骨组织学异常、增加无动力性骨病发生的风险。因此,临床医生应该考虑到肾移植后骨病的复杂性和异质性,慎重选择治疗方案。Meta分析还发现双膦酸盐对肾移植受者骨折发生率无明显影响。虽然肾移植受者骨折发生率是健康人群的近4倍,在术后3年骨折发生率高于透析患者30%[29],但肾移植患者骨折受诸多因素影响[30],目前没有足够证据显示BMD可作为肾移植受者预测骨折发生风险的标志。
本研究纳入的研究中共13篇评价了双膦酸盐预防或治疗肾移植术后早期骨质丢失对移植肾功能的影响,所有研究均得出同一结论,认为小剂量双膦酸盐使用后与对照组患者肾功能比较并无明显差别。该结论亦得到我们荟萃分析证实。因此,我们可以认为小剂量双膦酸盐预防或治疗肾移植术后早期骨质丢失并不会影响移植肾功能,但关于双膦酸盐是否存在药物种类、剂量效应差异仍需后期研究评价。
本研究虽仅纳入RCT,但仍存在以下不足:①部分研究样本量小,随机化、分配隐藏及盲法不明确,可能在方法学上有一定局限性;②虽研究证实帕米磷酸二钠和阿伦膦酸钠盐预防肾移植术后早期骨质丢失效果相当[32],但本研究纳入各研究中使用的双膦酸盐的种类、剂量差异较大,因此,可能影响研究结果的评估;③各项研究随访时间存在差异,可能产生较大异质性,降低了评价力度。因此,解释本研究结论时仍需考虑上述不足。
综上所述,当前证据表明双膦酸盐可降低肾移植受者早期脊柱骨质丢失,且不增加不良反应发生率。但鉴于本研究存在的不足,仍需多中心大样本RCT进一步完善双膦酸盐对肾移植受者骨质丢失的预防或治疗作用的评价。
[1] 张强, 曹凯, 胡小鹏, 等. 肾移植受者骨密度异常调查及相关因素分析[J]. 中华医学杂志, 2015,95(26):2062-2065.
[2] BRANDENBURG VM WR, KETTELER M. The fate of bone after renal transplantation[J]. J Nephrol, 2004, 17(2):190-204.
[3] DOUNOUSI E, LEIVADITIS K, ELEFTHERIADIS T, et al. Osteoporosis after renal transplantation[J]. Int Urol Nephrol, 2015,47(3):503-511.
[4] SHAHIDI S, ASHRAFI F, MOHAMMADI M, et al. Low-dose pamidronate for treatment of early bone loss following kidney transplantation:a randomized controlled trial[J]. Iran J Kidney Dis, 2015, 9(1):50-55.
[5] OKAMOTO M YS, YOSHIMOTO W, SHIGEMATSU T. Alendronate as an effective treatment for bone loss and vascular calcification in kidney transplant recipients[J]. J Transplant, 2014, 2014:1-6.
[6] SMERUD KT, DOLGOS S, OLSEN IC, et al. A 1-year randomized, double-blind, placebo-controlled study of intravenous ibandronate on bone loss following renal transplantation[J]. Am J Transplant, 2012, 12(12):3316-3325.
[7] COCO M, GLICKLICH D, FAUGERE MC, et al. Prevention of bone loss in renal transplant recipients:a prospective, randomized trial of intravenous pamidronate[J]. J Am Soc Nephrol, 2003, 14(10):2669-2676.
[8] COCO M, PULLMAN J, COHEN HW, et al. Effect of risedronate on bone in renal transplant recipients[J]. J Am Soc Nephrol, 2012, 23(8):1426-1437.
[9] EL-AGROUDY AE, EL-HUSSEINI AA, EL-SAYED M, et al. A prospective randomized study for prevention of postrenal transplantation bone loss[J]. Kidney Int, 2005, 67(5):2039-2045.
[10] GIANNINI S, D′ANGELO A, CARRARO G, et al. Alendronate prevents further bone loss in renal transplant recipients[J]. J Bone Miner Res, 2001,16(11):2111-2117.
[11] FAN SLS, KUMAR S, CUNNINGHAM J. Long-term effects on bone mineral density of pamidronate given at the time of renal transplantation[J]. Kidney Int, 2003, 63(6):2275-2279.
[12] GROTZ W, NAGEL C, POESCHEL D, et al. Effect of ibandronate on bone loss and renal function after kidney transplantation[J]. J Am Soc Nephrol, 2001,12(7):1530-1537.
[13] HAAS M, LEKO-MOHR Z, ROSCHGER P, et al. Zoledronic acid to prevent bone loss in the first 6 months after renal transplantation[J]. Kidney Int, 2003, 63(3):1130-1136.
[14] JEFFERY JR, LESLIE WD, KARPINSKI ME, et al. Prevalence and treatment of decreased bone density in renal transplant recipients:a randomized prospective trial of calcitriol versus alendronate[J]. Transplantation, 2003, 76(10):1498-1502.
[15] KOC M, TUGLULAR S, ARIKAN H, et al. Alendronate increases bone mineral density in long-term renal transplant recipients[J]. Transpl Proc, 2002, 34(6):2111-2113.
[16] LAN G, PENG L, XIE X, et al. Alendronate is effective to treat bone loss in renal transplantation recipients[J]. Transpl Proc, 2008, 40(10):3496-3498.
[17] NAYAK B, GULERIA S, VARMA M, et al. Effect of bisphosphonates on bone mineral density after renal transplantation as assessed by bone mineral densitometry[J]. Transpl Proc, 2007, 39(3):750-752.
[18] NAM JH, MOON JI, CHUNG SS, et al. Pamidronate and calcitriol trial for the prevention of early bone loss after renal transplantation[J]. Transpl Proc, 2000, 32(7):1876.
[19] TORREGROSA JV, FUSTER D, PEDROSO S, et al. Weekly risedronate in kidney transplant patients with osteopenia[J]. Transpl Int, 2007, 20(8):708-711.
[20] TRABULUS S, ALTIPARMAK MR, APAYDIN S, et al. Treatment of renal transplant recipients with low bone mineral density:a randomized prospective trial of alendronate, alfacalcidol, and alendronate combined with alfacalcidol[J]. Transplant Proc, 2008, 40(1):160-166.
[21] TORREGROSA JV, FUSTER D, GENTIL MA, et al. Open-label trial:effect of weekly risedronate immediately after transplantation in kidney recipients[J]. Transplantation, 2010, 89(12):1476-1481.
[22] WALSH SB, ALTMANN P, PATTISON J, et al. Effect of pamidronate on bone loss after kidney transplantation:a randomized trial[J]. Am J Kidney Dis, 2009, 53(5):856-865.
[23] TORREGROSA JV, FUSTER D, MONEGAL A, et al. Efficacy of low doses of pamidronate in osteopenic patients administered in the early post-renal transplant[J]. Osteoporos Int, 2011, 22(1):281-287.
[24] GROTZ WH, RUMP LC, NIESSEN A, et al. Treatment of osteopenia and osteoporosis after kidney transplantation[J]. Transplantation, 1998, 66(8):1004-1008.
[25] ABBOTT KC, OGLESBY RJ, HYPOLITE IO, et al. Hospitalizations for fractures after renal transplantation in the United States[J]. Ann Epidemiol, 2001, 11(7):450-457.
[26] EEGoR T. European best practice guidelines for renal transplantation. Section IV:longterm management of the transplant recipient[J]. Nephrol Dial Transpl, 2002,17 (Suppl 4):1-67.
[27] CHAPPARD D, PETITJEAN M, ALEXANDRE C, et al. Cortical osteoclasts are less sensitive to etidronate than trabecular osteoclasts[J]. J Bone Miner Res, 1991, 6(7):673-680.
[28] NAYLOR KL, GARG AX, HODSMAN AB, et al. Long-term changes in bone mineral density in kidney transplant recipients[J]. Transplantation, 2014, 98(12):1279-1285.
[29] TILLMANN FP SM, JGER M, KRAUSPE R, et al. Ibandronate in stable renal transplant recipients with low bone mineral density on long-term follow-up[J]. Int Urol Nephrol,2015 [Epub ahead of print].
[30] FALKIEWICZ K, BORATYNSKA M, ZMONARSKI SC, et al. Evolution of bone disease at 2 years after transplantation:a single-center study[J]. Transp Proc, 2009, 41(8):3063-3066.
[31] PERRIN P, CAILLARD S, JAVIER RM, et al. Persistent hyperparathyroidism is a major risk factor for fractures in the five years after kidney transplantation[J]. Am J Transpl, 2013, 13(10):2653-2663.
[32] OMIDVAR B, GHORBANI A, SHAHBAZIAN H, et al. Comparison of alendronate and pamidronate on bone loss in kidney transplant patients for the first 6 months of transplantation[J]. Iran J Kidney Dis, 2011,5(6):420-424.
(编辑何宏灵)
Efficacy and safety of bisphosphonates for low bone mineral density after kidney transplantation:a Meta-analysis
BAI Yun-jin,Wang Xiao-ming, YANG Yu-bo, HAN Ping, WANG Jia, WEI Qiang, TANG Yin
(Department of Urology,West China Hospital, Sichuan University, Chengdu 610041, China)
ObjectiveTo evaluate the efficacy and safety of bisphosphonates for low bone mineral density (BMD) after kidney transplantation. MethodsData bases including MEDLINE, Cochrane Library, Embase, CNKI, CBM, VIP, and Wan Fang Database were searched to collect randomized controlled trials (RCTs) published since the establishment of database till Jan. 2016 that compared bisphosphonate in the treatment of low bone mineral density after kidney transplantation. Two reviewers independently screened the studies according to exclusion and inclusion criteria, extracted data, and assessed the methodological quality. Then, aMeta-analysis was performed using RevMan 5.2 software. ResultsA total of 21 RCTs with 1 225 patients were eligible. The results ofMeta-analysis showed that, compared with the control group, those who received bisphosphonates had a significant increase in percent change in BMD at the lumbar spine [MD=4.69, 95%CI(2.79~6.59),P<0.0001] and the femoral neck [MD=4.15, 95%CI(1.97~6.33),P=0.000 2]. Bisphosphonates resulted in a significant improvement in absolute change in BMD at the lumbar spine [MD=0.05, 95%CI(0.04~0.05),P<0.000 1], but a non-significant improvement absolute change in BMD at the femoral neck [MD=0.02, 95%CI(0.00~0.04),P=0.06]. No significant differences were found in fractures and adverse events. ConclusionBisphosphonates appear to have a beneficial effect on BMD at the lumbar spine and do not significantly increase adverse events in recipients.
kidney transplantation; low bone mineral density; bisphosphonates; meta-analysis
2016-02-17
2016-03-28
国家自然科学基金(No.81270841);四川省科技厅科技支撑计划(No.2013SZ0034)
韩平,教授,博士生导师. E-mail:hanping@scu.edu.cn
白云金(1989-),男(汉族),博士在读.研究方向:泌尿外科.
E-mail:baiyunjin@163.com
R69
A

