二维应变成像定量评价慢性中重度主动脉瓣返流左室功能异常
权欣,李慧,郭继鸿,朱天刚,吴伟春,江勇,朱振辉,王浩
·论著·
二维应变成像定量评价慢性中重度主动脉瓣返流左室功能异常
权欣1,李慧1,郭继鸿2,朱天刚2,吴伟春1,江勇1,朱振辉1,王浩1
目的 应用二维应变成像定量评价射血分数正常的慢性中重度主动脉瓣返流左室心肌做功是否受累。方法 入选2013年10月至2016年3月,阜外医院及北京大学人民医院共入组51例慢性主动脉瓣中重度返流患者,并将入选对象分为有症状(27例)和无症状(24例)两组。根据美国超声心动图学会相关指南,二维灰阶及彩色多普勒模式下获取心尖部及左室短轴切面及相应血流频谱,脱机分析左室内径、左室射血分数(LVEF)、主动脉瓣返流参数及左室二维总体应变。结果 基线状态下,两组患者的左室内径及主动脉相关径线测量参数之间无统计学差异(P>0.05);而两组之间的左室舒张末期容积指数及射血分数之间存在统计学差异(P<0.05)。有症状组比无症状组左室纵向、径向及周向应变明显减低(P<0.05)。对无症状患者的随访中,其中14例出现外科手术适应证(患者出现症状或左室射血分数低于50%)。将无症状组进一步分为手术组及非手术组,手术组的左室纵向应变及周向应变减低(P <0.05)。结论 即使左室射血分数代偿在正常范围内,中重度主动脉瓣返流的无症状患者,左室各方向应变减低提示左室功能存在亚临床异常。
二维应变;超声心动图;主动脉瓣返流;左室内径;左室射血分数
随着主动脉瓣返流(AR)程度加重,左室容量负荷增加,左室相应扩大,最终导致左室收缩功能减低。主动脉瓣返流达到重度或左室收缩功能明显减低(左室射血分数≤50%),才作为外科手术干预的Ⅰ类适应证[1]。由于前负荷储备不足,而后负荷增加过度,患者尚未出现症状左室功能已经受累[2]。上述情况下,患者发生心力衰竭并伴有左室功能不全等症状时,心肌已经发生纤维化等不可逆改变[3],即使采取外科手术,亦会影响手术效果。因此,在患者出现症状之前,有效、准确评价亚临床阶段的左室功能异常,指导临床决策,及时采取外科手术干预,从而改善患者预后。业已证实,二维应变成像,不受到心脏负荷干扰及成像角度限制,可准确、定量评价左室功能[4,5]。因此,本研究力图应用二维应变成像,对无症状且左室射血分数(LVEF)大于50%的中重度AR患者,定量评价并判断左室心肌做功是否受累。
1 资料与方法
1.1研究对象 自2013年10月至2016年3月,在阜外医院及北京大学人民医院共入组51例慢性主动脉瓣中重度或重度返流的患者并随访。中重度主动脉瓣返流诊断标准参照2003美国超声心动图学会自体瓣膜返流指南[6]。入选标准:①中度以上AR;②LVEF>50%。排除标准:①急性AR;②合并轻中度以上其它瓣膜病变的患者;③LVEF <50%;④合并严重肾功能不全、糖尿病者;⑤既往行心脏外科手术者。其中,男性共40例,女性11例。根据有无呼吸困难、心绞痛等相关症状,将入选对象分为两组,分别为有症状组(27例)和无症状组(24例)。所有入选对象均为窦性心律。检查前,向所有患者告知检查内容,患者及家属知情、同意并签字。
1.2仪器与方法
1.2.1仪器设备 应用Philips IE33(Philips Medical Systems,Eindhoven,Netherlands)或GE vivid E9 (GE Healthcare,Horten,Norway)彩色多普勒超声诊断仪,探头频率1.5/3.6 MHz,扫查深度15~18 cm,帧频60~100 帧/s。
1.2.2图像获取和分析 获取患者基线状态下超声心动图图像。患者采取左侧卧位,依照美国超声心动图学会指南,记录二维灰阶、彩色血流多普勒、彩色组织多普勒模式下胸骨旁长轴切面、左室短轴、心尖四腔切面、心尖两腔切面及心尖长轴切面,记录主动脉瓣血流频谱[6]。每个切面存储5个周期,用于脱机后处理分析。采用Simpson法,计算LVEF及左室舒张末期容积指数(LVEDVI)。测量左室舒张末期内径(LVIDd)、收缩末期内径(LVIDs)、主动脉瓣环、窦部及升主动脉内径、主动脉瓣返流束宽度/左室流出道宽度比值(AR/LVOT)、主动脉瓣返流压力降半时间(PHT)。分别于心尖及左室短轴切面脱机定量分析左室总体纵向应变(LV-LS)、左室径向(LV-RS)和周向应变(LV-CS)。所有图像采集及分析,均由具有3年以上心脏超声诊断经验的主治医师完成。
对无症状组的患者进行随访监测,依据患者是否进行外科手术,进一步将无症状组患者分为手术组(14例)及非手术组(10例),并对两个亚组的基线超声心动图定量参数进行比较分析。
1.3统计学分析 应用IBM SPSS 22.0统计软件进行分析。符合正态分布的计量资料用均值±标准差表示。两组间差异的显著性检验采用独立样本t检验。计数资料采用例数表示,采用χ2检验。P <0.05为差异具有统计学意义。
2 结果
2.1患者基本临床信息 共入组51例患者,基线状态下,有症状组与无症状组之间年龄、心率、血压水平无明显差异(P>0.05)(表1)。
2.2超声心动图参数 有症状组与无症状组患者间LVIDd、LVIDs水平无统计学差异(P>0.05),但是有症状组LVEDVI平均水平大于无症状组(P<0.05),两组患者LVEF均在正常范围内,但是有症状组平均水平略低于无症状组(P<0.05)。主动脉结构相关参数,包括主动脉瓣环内径、主动脉窦部及升主动脉内径,两组之间差异无统计学意义(P>0.05)。但两组间AR/LVOT比值、PHT存在显著差异(P<0.05)(表2)。两组应变参数比较,有症状组三个方向的总体应变绝对值均明显低于无症状组(P <0.01)。
2.3无症状组亚组分析 对无症状组患者进行随访,随访时间2~31个月。无症状组患者中14例出现新发症状或左室收缩功能减低等手术指征并行外科手术。进一步将无症状组分为手术组(14例)和非手术组两组(10例),并将两亚组基线状态下左室应变参数进行比较分析,手术组较非手术组的LV-LS(13.6±2.0% vs. 16.5±2.2%,P <0.01)及LV-CS绝对值(14.9±2.1% vs. 17.9± 2.6%,P>0.01)进一步减低,LV-RS略减低但无统计学差异(34.5±5.8% vs. 36.5±3.2%,P>0.05)。

表1 研究对象基本临床信息比较
表2 基线状态两组超声心动图参数比较(±s)
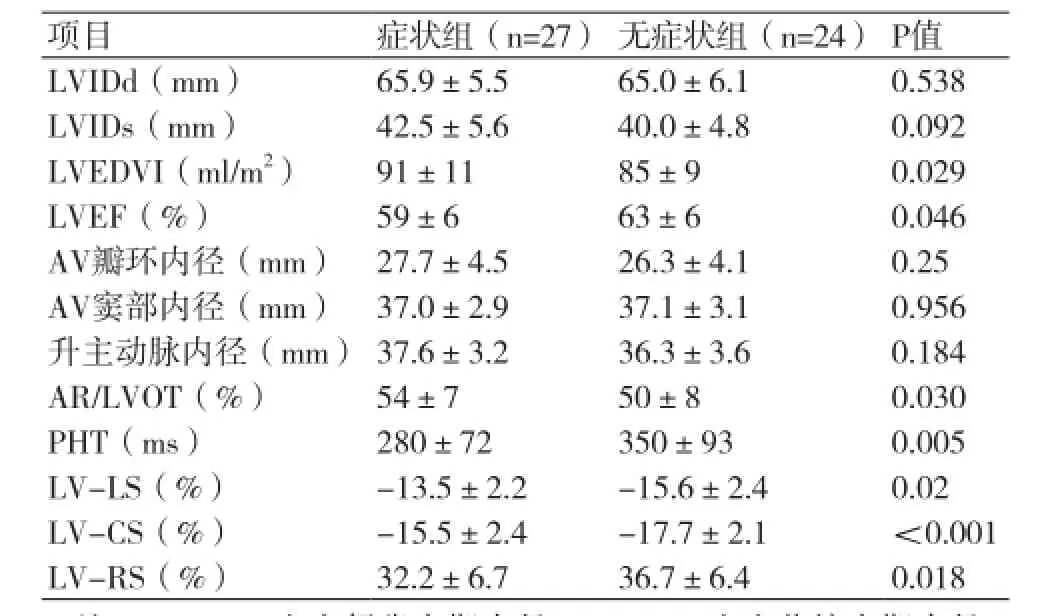
表2 基线状态两组超声心动图参数比较(±s)
注:LVIDd:左室舒张末期内径;LVIDs:左室收缩末期内径,LVEDVI:左室舒张末期容积指数,LVEF:左室射血分数;AR/ LVOT:主动脉瓣返流束宽度与左室流出道宽度比值;PHT:主动脉瓣返流压力降半时间。LV-LS:左室总体纵向应变;LV-CS:左室总体周向应变;LV-RS:左室总体径向应变
项目症状组(n=27)无症状组(n=24)P值LVIDd(mm)65.9±5.565.0±6.10.538 LVIDs(mm)42.5±5.640.0±4.80.092 LVEDVI(ml/m2)91±1185±90.029 LVEF(%)59±663±60.046 AV瓣环内径(mm)27.7±4.526.3±4.10.25 AV窦部内径(mm)37.0±2.937.1±3.10.956升主动脉内径(mm)37.6±3.236.3±3.60.184 AR/LVOT(%)54±750±80.030 PHT(ms)280±72350±930.005 LV-LS(%)-13.5±2.2-15.6±2.40.02 LV-CS(%)-15.5±2.4-17.7±2.1<0.001 LV-RS(%)32.2±6.736.7±6.40.018
3 讨论
慢性中重度AR,由于左室对前后负荷增加的代偿,患者可以在数月甚至数年无明显症状,其10年生存率69%,无主要心血管事件生存率37%[7]。当左室容量及压力负荷增加超过代偿极限时,后负荷不匹配及有限的前负荷代偿能力导致左心功能受损,出现呼吸困难,劳力性心绞痛等临床症状[8]。经胸超声心动图作为一种无创性检查手段,在AR患者的初诊及随访监测中,可以评估主动脉瓣、瓣环、窦部及升主动脉解剖结构和功能异常,而且能够评价长期容量负荷过重对左室形态功能的影响。二维应变成像定量评价心肌功能,无明显负荷依赖性,其可靠性及可重复性已经被以往研究证实[9,10]。
本研究结果主要包括以下几个方面:①症状组和无症状组LVEF均代偿在正常范围内,但是症状组的LVEF低于无症状组(P<0.05);②症状组的AR程度重于无症状组(P<0.05);③LVEF正常的慢性中重度AR患者,其左室心肌机械做功减低,无症组LV-LS、LV-CS及LV-RS绝对值高于有症状组(P<0.05);④部分无症状组患者随着病情进展出现手术指征,手术组LVLS、LV-CS绝对值相对非手术组患者减低(P <0.01)。
尽管两组的LVEF均大于50%,但是症状组的LVEF明显低于无症状组。多因素回归分析,重度AR死亡的预测因子包括年龄、基线状态左室收缩末径(>50 mm)和静息状态LVEF(<50%)[1]。国内学者对192例LVEF正常且左室明显扩张(LVIDd>70 mm)的重度AR患者进行回顾分析,ROC曲线分析显示LVEF<55% 和LVIDd≥81 mm是预测术后死亡的临界值。与LVEF≥55%组相比,50%<LVEF<55%组术后5年存活率减低(87.4% vs. 97.3%,P=0.023);LVIDd≥81 mm组术后5年存活率(85.6%)低于70 mm<LVIDd<81 mm组存活率(98.2%)(P= 0.027)[11]。
众所周知,左室壁由三层心肌纤维构成,二维应变成像通过测量局部及整体的心肌形变,定量评估不同走形的心肌做功。本研究中,症状组的纵向、周向及径向心肌应变相对无症状组均明显减低,提示由于AR所致的左室容量负荷过重,导致左室几何形态发生改变,影响不同走形的心肌功能。Ewe等[12]得到了与本研究相似的结果。另一项研究结果提示,单纯心尖四腔切面测量的左室总体纵向应变减低是重度AR患者死亡风险的独立预测因子(危险比1.313,95% 可信区间:1.010~1.706,P<0.05)[13]。严重AR病变对心脏机械做功的影响,在青少年患者见相似的结果。一组对于中重度AR青少年(年龄≤16岁)患者二维应变研究结果提示,AR进展者左室纵向应变绝对值明显减低 [(-17.8±3.9)% vs.(-22.7±2.7)%,P=0.001],纵向应变绝对值小于19.5%是预测AR进展的独立预测因子[14]。Iida等[15]研究发现重度AR患者内层心肌做功减低,外层心肌做功代偿性增强,是重度AR的LVEF仍旧维持正常的机制之一。严重AR患者所致的左室结构及功能的改变,通过外科手术干预去除致病因素,纠正过重的前、后负荷,患者的左室形态学发生逆重构,左室收缩及舒张末期内径明显减小,适应代偿机制而增厚的室壁在术后变薄[16],同时左室收缩功能提高,LVEF较术前改善[(58±6)% vs. (62±7)%,P=0.018],左室径向应变较术前明显增加[(27.8±12.5)% vs. (37.7±14.6)% ,P<0.0001][17]二维应变成像能够定量评价LVEF代偿期的中重度AR患者左室功能,左室纵向、周向及径向应变不同程度减低,发现亚临床阶段左室机械功能异常,作为中重度AR早期危险分层的筛查手段之一,协助决定LVEF正常的重度AR患者的手术时机,从而改善预后。
[1] Nishimura RA,Otto CM,Bonow RO,et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. J Thorac Cardiovasc Surg,2014,148(1): e1-e132.
[2] Bonow RO,Lakatos E,Maron BJ,et al. Serial long-term assessment of the natural history of asymptomatic patients with chronic aortic regurgitation and normal left ventricular systolic function[J]. Circulation,1991,84(4):1625-35.
[3] Azevedo CF,Nigri M,Higuchi ML,et al. Prognostic significance of myocardial fibrosis quantification by histopathology and magnetic resonance imaging in patients with severe aortic valve disease[J]. J Am Coll Cardiol,2010,56(4):278-87.
[4] Gorgulu S,Norgaz T,Nurkalem Z,et al. Comparison of left ventricular contractility in pressure and volume overload: a strain rate study in the clinical model of aortic stenosis and regurgitation[J]. Echocardiography,2010, 27(7): 798-802.
[5] Korinek J,Wang J,Sengupta PP,et al. Two-dimensional strain--a Doppler-independent ultrasound method for quantitation of regional deformation: validation in vitro and in vivo[J]. J Am Soc Echocardiogr,2005,18:1247-53.
[6] Zoghbi WA,Enriquez-Sarano M,Foster E,et al. 2003. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography[J]. J Am Soc Echocardiogr, 16(7):777-802.
[7] Detaint D,Messika-Zeitoun D,Maalouf J,et al. Quantitative echocardiographic determinants of clinical outcome in asymptomatic patients with aortic regurgitation: a prospective study[J]. JACC Cardiovasc Imaging, 2008,1(1):1-11.
[8] Ricci DR. Afterload mismatch and preload reserve in chronic aorticregurgitation[J]. Circulation, 1982,66(4):826-34.
[9] Aurich M,Keller M,Greiner S,et al. Left ventricular mechanics assessed by two-dimensional echocardiography and cardiac magnetic resonance imaging: comparison of high-resolution speckle tracking and feature tracking[J]. Eur Heart J Cardiovasc Imaging,2016. Epub ahead of print. [10] Leischik R,Dworrak B,Hensel K. Intraobserver and interobserver reproducibility for radial, circumferential and longitudinal strain echocardiography[J]. Open Cardiovasc Med J,2014,8:102-9.
[11] Wang Y,Shi J,Li F,et al. Aortic valve replacement for severe aortic regurgitation in asymptomatic patients with normal ejection fraction and severe left ventricular dilatation[J]. Interact Cardiovasc Thorac Surg, 2016,22(4):425-30.
[12] Ewe SH,Haeck ML,Ng AC,et al. Detection of subtle left ventricular systolic dysfunction in patients with significant aortic regurgitation and preserved left ventricular ejection fraction: speckle tracking echocardiographic analysis[J]. Eur Heart J Cardiovasc Imaging,2015,16(9):992-9.
[13] Park SH,Yang YA,Kim KY,et al. Left Ventricular Strain as Predictor of Chronic Aortic Regurgitation[J]. J Cardiovasc Ultrasound,2015,23(2):78-85.
[14] Di Salvo G,Rea A,Mormile A,et al. Usefulness of bidimensional strain imaging for predicting outcome in asymptomatic patients aged </= 16 years with isolated moderate to severe aortic regurgitation[J]. Am J Cardiol,2012,110(7):1051-5.
[15] Iida N,Seo Y,Ishizu T,et al. Transmural compensation of myocardial deformation to preserve left ventricular ejection performance in chronic aortic regurgitation[J]. J Am Soc Echocardiogr,2012,25(6):620-8.
[16] Gunay D,Ozen Y,Cekmecelioglu D,et al. Effect of ejection fraction on left ventricular remodeling in aortic insufficiency[J]. Asian Cardiovasc Thorac Ann, 2016,24(4):332-6.
[17] Kaneko A,Tanaka H,Onishi T,et al. Subendocardial dysfunction in patients with chronic severe aortic regurgitation and preserved ejection fraction detected with speckle-tracking strain imaging and transmural myocardial strain profile[J]. Eur Heart J Cardiovasc Imaging,2013,14(4):339-46.
本文编辑:田国祥
The role of two dimensional strain imaging in the assessment of subclinical ventricular dysfunction in severe aortic regurgitation patients
QUAN Xin*, LI Hui, GUO Ji-hong, ZHU Tian-gang, WU Wei-chun, JIANG Yong, ZHU Zhen-hui, WANG Hao. *Department of Ultrasonography, Fu Wai Hospital, Chinese Academy of Medical Sciences, Beijing, 100037, China.
WANG Hao; Email: fwwangh@163.com
Objective To study left ventricular myocardial performance in moderate to severe aortic regurgitation (AR) patients with preserved left ventricular ejection fraction (LVEF) using two dimensional strain imaging. Methods From 2013 October to 2016 March, fifty-one AR individuals with preserved LVEF were enrolled into this study, divided into 2 groups: symptom (n=27) and asymptom (n=24) groups. Echocardiographic parameters including left ventricular end-diastolic (LVIDd) and end-systolic diameters (LVIDs), left ventricular end-diastolic volume index (LVEDVI), LVEF, AR width/left ventricular outflow (LVOT) width ratio, pressure-half time (PHT)of AR, left ventricle global longitudinal, circumferential and radial strain derived from two-dimensional strain imaging were obtained. Results Differences were observed in LVEDVI and LVEF between 2 groups(P<0.05). AR width/LVOT width ratio and PHT were worse in symptom group than asymptom group (P<0.05). Longitudinal,circumferential and radial strain were significantly lower in symptom group than asymptom group(P<0.01). Conclusion Two-dimensional strain can detect subclinical left ventricular dysfunction in severe AR patients with preserved LVEF. Three orthogonal directions strains were all involved.
Two-dimensional Strain; Echocardiography; Aortic Regurgitation; Left ventricular diameter; Left ventricular ejection
R540.45
A
1674-4055(2016)06-0756-04
1100037 北京,中国医学科学院阜外医院超声科;2100044 北京,北京大学人民医院心脏中心
王浩,E-mail:fwwangh@163.com
10.3969/j.issn.1674-4055.2016.06.34

