丹参多酚盐对动脉内膜增生的影响及其机制研究
王书青,邱明科,代玉鑫,潘畅,汪洋,欧敬民
丹参多酚盐对动脉内膜增生的影响及其机制研究
王书青1,邱明科1,代玉鑫1,潘畅1,汪洋1,欧敬民1
目的 观察丹参多酚盐对大鼠颈动脉内膜损伤后血管增生的影响,并探讨其机制。方法 将18 只SD大鼠随机分为假手术组、手术组、丹参多酚盐组,每组6只,颈动脉内膜损伤术后14 d分别检测各组大鼠血清中白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、转化生长因子-β (TGF-β)水平,并取颈动脉切片作病理形态学观察内膜增生情况,测量血管新生内膜厚度(IT)、中膜厚度(MT)并计算IT/MT值,RT-PCR和Western Blot分别测定各组管壁 LOX-1mRNA和蛋白的表达变化。结果 大鼠颈动脉内膜损伤后14 d可见血管内膜增生,管腔狭窄;与假手术组比较,手术组管壁LOX-1mRNA和蛋白的表达升高,差异具有统计学意义(P均<0.05),血清中促炎因子IL-6、TNF-α水平上升,抗炎因子IL-10、TGF-β水平下降,差异具有统计学意义(P均<0.05);与手术组比较,丹参多酚盐组内膜增生显著减低,血清IL-6、TNF-α水平下降,IL-10、TGF-β水平升高,差异具有统计学意义(P均<0.05),管壁LOX-1 mRNA和蛋白表达水平明显降低,差异具有统计学意义(P均<0.05);丹参多酚盐组与假手术组比较,大鼠颈动脉IT、MT和IT/MT,血清中IL-6、IL-10、TNF-α和TGF-β水平,管壁LOX-1mRNA和蛋白表达水平,差异不具有统计学意义(P均>0.05)。结论 丹参多酚盐能有效抑制大鼠颈动脉内膜损伤后内膜的增生,抑制炎症反应,其机制可能与下调增生内膜LOX-1表达有关。
丹参多酚盐;内膜增生;炎症因子;LOX-1
动脉硬化是一组以血管管腔狭窄为主的退行性变和增生性病变疾病的总称,主要病理变化为动脉管壁增厚、变硬,失去弹性[1]。自上世纪60年代以来,经皮腔内血管成形术(PTA)由于其安全性在临床上得到了广泛的应用,成为治疗动脉狭窄性疾病的重要手段之一,但管腔术后再狭窄导致的远期疗效不甚满意。丹参多酚酸盐是从丹参中提取的以丹参乙酸镁为主要成分的化合物,具有抗炎[2]、抗氧化应激[3]、免疫调节[4]等多重明显心血管保护作用。近年来研究发现,丹参多酚盐能通过多种途径保护血管内皮细胞改善血管功能[5]。有关丹参多酚盐能否抑制因血管内膜损伤引起的血管增生相关研究较少,且相关机制未见文献报道。因此本研究拟通过缺血再灌注损伤建立颈动脉内膜增生的动物模型,再予以丹参多酚盐干预,探讨丹参多酚盐对内膜增生的影响及其作用机制。
1 材料和方法
1.1主要实验材料 健康同龄雄性SD大鼠,购自上海斯莱克实验动物有限责任公司;羊抗鼠LOX-1抗体,购自美国Abcam公司;大鼠白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、肿瘤坏死因子-β (TGF-β)检测试剂盒,购自北京四正柏生物公司;丹参多酚盐,购自上海绿谷制药公司;其他试剂均为国产分析纯。
1.2实验方法
1.2.1动物分组及造模 18只健康雄性SD大鼠,平均(200±30)g,随机分为假手术组、手术组和丹参多酚盐组,每组均6只。所有动物普通饲养2周后,用10%水化氯醛腹腔注射麻醉,尾静脉注射肝素100 U/kg。颈部脱毛后用75%酒精消毒。取颈部正中切口,切口长3 cm。在气管旁寻找到左颈总动脉。手术组用眼科镊钝性分离血管2 cm左右,用3号线结扎阻断近心端的血流,远心端在颈内外动脉分叉处3号线结扎,夹闭血流30 min后松开丝线后逐层缝合皮下组织与皮肤。假手术组除不给予丝线结扎外,余操作步骤与手术组相同。丹参多酚盐组自术前3 d至术后14 d腹腔注射丹参多酚盐,剂量为5 mg/(kg·d),手术过程同手术组。各组SD大鼠术前、术后每日喂食普通饲料,自由饮水。
1.2.2取材及标本制备 术后14 d处死大鼠,常规分离血清和取病变明显的颈总动脉约2.0 cm,置于-70℃冰箱中保存备用。
1.2.3光镜下观察血管形态学变化 多聚甲醛液固定的标本,梯度酒精逐步脱水,常规石蜡包埋、切片,切片厚度为 5 μm,HE染色,在光镜下观察其病理学改变并拍照,用图像分析系统测微尺测量内膜厚度(IT)、中膜厚度(MT)并计算IT/MT值。
1.2.4血清中IL-6、IL-10、TNF-α、TGF-β含量的测定 血清中IL-6、IL-10、TNF-α、TGF-β含量的测定,严格按ELISA试剂盒说明书进行定量测定。
1.2.5大鼠颈动脉LOX-1 mRNA的测定 取血管组织约100 mg迅速剪碎加1 ml Trizol试剂,置于组织匀浆器中匀浆,抽提总RNA,采用紫外分光光度计测定其浓度和纯度。依据Takara公司反转录试剂盒将提取的RNA反转录为cDNA,置于ABI Prism7900 PCR仪进行扩增反应,反应体系为25 μl。目标基因和内参基因引物均由上海生工生物技术有限公司合成。LOX-1上游序列:5'-CCTCACCTGGAAGCTAA ACG-3',下游序列:5'-CCTGCTCTTTGGATTTCTCG-3'。内参β-actin上游序列: 5′-GGTGCTGAGTATGTCG TGGA-3',下游序列:5′-CTTCTGAGTGGCA GTGATGG-3′。反应条件为预变性95℃ 600 s,变性95℃ 15 s,退火60℃ 60 s,延伸72℃ 90 s,最后延伸600 s 40个循环,计算相对表达量。
1.2.6大鼠颈动脉LOX-1蛋白表达的检测 取血管组织约50 mg加入RIPA裂解液(含PMSF)提取总蛋白,采用BCA法进行蛋白质定量。取各组总蛋白30 μg进行SDS-PAGE电泳,转膜,以5% BSA封闭1 h,加入一抗于4℃孵育过夜。再加入1:5000倍稀释的二抗,37℃孵育1 h,PBS洗涤,显影,定影。 将胶片进行扫描或拍照,用凝胶图象处理系统分析目标带的分子量和净光密度值。
1.2.7数据统计和分析 所有实验数据用均数±标准差表示,SPSS 17.0统计软件被用来做所有的统计学分析。三组均数比较采用方差分析,组间比较采用LSD-t检验。对于所有的统计分析,P <0.05为差异有统计学意义。
2 结果
2.1血管壁病理形态学观察 HE染色的结果显示,动脉内膜缺血灌注损伤2周后,手术组大鼠颈总动脉有明显的内膜增生,管腔不均一狭窄,内膜平滑肌细胞增生,中膜可见增厚(图1B);假手术组大鼠颈总动脉内膜可见单层内皮细胞,动脉弹力层结构清楚(图1A);丹参多酚盐组血管内膜增生不明显,可见多层内膜细胞(图1C)。
2.2动脉管壁的增生的情况 与假手术组比较,手术组IT、MT和IT/MT明显增大,差异具有统计学意义(P<0.01);与手术组比较,丹参多酚盐组IT、MT和IT/MT明显减低,差异具有统计学意义(P<0.05);丹参多酚盐组与假手术组比较,IT、MT和IT/MT差异无统计学意义(P <0.05)(表1)。
2.3大鼠血清中IL-6、IL-10、TNF-α、TGF-β水平的测定 ELISA法检测结果显示:与假手术组比较,手术组大鼠血清中促炎因子IL-6和TNF-α水平增高,抗炎因子IL-10和TGF-β水平降低,差异具有统计学意义(P均<0.05);与手术组比较,丹参多酚盐组大鼠血清中促炎因子IL-6和TNF-α水平增高,抗炎因子IL-10和TGF-β水平减低,差异具有统计学意义(P均<0.05);与假手术组比较,丹参多酚盐组大鼠血清中炎症因子IL-6、IL-10、TNF-α和TGF-β水平差异无统计学意义(P均>0.05),(图2)。
2.4大鼠颈动脉LOX-1 mRNA的表达 RT-PCR检测结果显示:与假手术组比较,手术组颈动脉组织LOX-1 mRNA表达增高,差异具有统计学意义(P<0.05);与手术组比较,丹参多酚盐组颈动脉组织LOX-1 mRNA的表达降低,差异有统计学意义(P<0.05)(图3)。
2.5大鼠颈动脉LOX-1蛋白的表达 Western Bolt测定结果显示:与假手术组比较,手术组LOX-1蛋白的表达变化增高,差异具有统计学意义(P <0.01);与手术组比较,丹参多酚盐组LOX-1蛋白的表达变化降低,差异具有统计学意义(P <0.05),与假手术组比较,丹参多酚盐组大鼠管壁组织LOX-1蛋白的表达水平差异无统计学意义(P>0.05)(图4)。
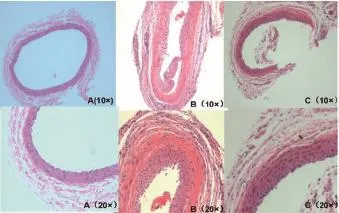
图1 大鼠颈动脉内膜损伤后14 d颈动脉切片光镜观察结果(A:假手术组;B:手术组;C:丹参多酚盐组;HE染色;×10/×20)

表1 动脉内膜损伤后血管内膜增生的影响
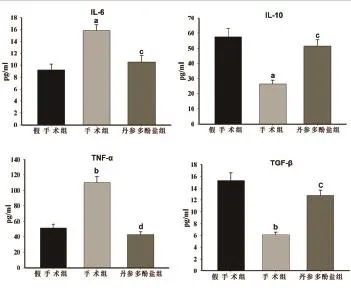
图2 大鼠血清中IL-6、IL-10、TNF-α、TGF-β水平的测定(与假手术组比较,bP<0.01;与手术组比较,cP<0.05,dP<0.01)
3 讨论
动脉硬化是一组以血管管腔狭窄为主的退行性变和增生性病变疾病的总称。由于生活水平的提高,生活方式及食物结构的变化,使本病的发生率逐年增高。动脉粥样硬化(AS)是动脉硬化疾病中常见的类型,也是并发严重心血管意外主要病因之一[6,7]。其中,下肢动脉硬化闭塞症(ASO)已成为导致患者肢体残疾的重要病因之一。自上世纪60年代以来, PTA由于其创伤小、恢复快等优势在临床上得到了广泛的应用,成为治疗动脉狭窄性疾病的重要手段之一。经皮冠状动脉腔内血管成形术(PTCA)包括球囊扩张术和血管内支架置入术,短期疗效显著,能迅速开通血管,改善组织或器官的缺血状况。但远期疗效不甚满意,术后再狭窄率高达20%~35%[8]。据研究报道,腘动脉支架置入术后1年再狭窄率高达20%~60%[9,10]。血管的弹性回缩、血管负性重塑及内膜过度增生是公认的三大术后再狭窄的原因[11,12],但确切的机制尚不明确。其中内膜增生占到了PTA术后再狭窄的40%左右[13]。
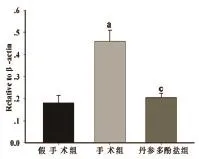
图3 大鼠颈动脉LOX-1 mRNA的表达(与假手术组相比,aP<0.05;与手术组相比,cP<0.05)

图4 大鼠颈动脉LOX-1 蛋白的表达(与假手术组相比,bP<0.01;与手术组相比,cP<0.05)
上世纪九十年代学者Ross[14]首先提出AS的免疫炎症学说后,该学说被逐渐证实,使得该学说在AS发病中的机制受到人们越来越多的关注。既往研究提示,慢性炎症反应贯穿AS的整个过程,众多炎性介质参与其中,形成复杂的调节网络。炎性介质诱导的炎症反应在PTA术后血管再狭窄的发生发展过程中起到重要作用。促炎因子 (如IL-6、IL-1、TNF-α等)与抗炎因子(如IL-4、IL-10、TGF-β)相互作用,通过改变体内物质代谢、能量代谢和细胞(包括免疫细胞和VSMCs等)的生物学特性等,造成了血管壁结构紊乱,最终决定了AS和PTA术后再狭窄的发生、发展和转归。本实验中,手术组大鼠血清促炎因子IL-6和TNF-α水平增高,抗炎因子IL-10和TGF-β水平减低,且内膜增生明显,进一步证实免疫炎症参与AS的过程。
LOX-1是一种新型ox-LDL受体,属于C类血凝素家族,与已知的ox-LDL受体,包括A类和B类清道夫受体以及CD68都没有同源性[15]。LOX-1除介导ox-LDL作用外,LOX-1还可以诱导ROS生成,经过一系列的级联反应使Fas/Bcl-2失衡,最终导致内皮细胞损伤、平滑肌细胞迁移及增殖[16,17],引起管腔狭窄。本实验发现在颈动脉内膜损伤组管壁LOX-1的表达显著增高,提示LOX-1 与AS具有一定相关性。既往研究显示,一些与致动脉硬化有关的因素刺激TNF-α、佛波醇酯、AT-Ⅱ、血流切应力等都可引起内皮细胞LOX-1表达增强[18];减少LOX-1 的表达能起到抗血栓抗AS 的作用[19],亦提示LOX-1在动脉粥样硬化病理变化过程中起着关键的作用。
丹参多酚酸盐是从丹参中提取的以丹参乙酸镁为主要成分的化合物,是中药丹参主要活性成分。近年基础研究显示,其在动脉硬化、减轻心脏缺血再灌注损伤、降低心脏耗氧量、抑制血小板聚集和防治血栓形成等方面具有明显的作用,临床上也已广泛应用于冠心病的治疗[20]。吴兰等研究表明,丹参多酚酸盐对Cu2+诱导的氧化修饰有较强的抑制作用,提示其对防治动脉粥样硬化有重要意义[21]。Huang等研究表明,丹参多酚酸盐能诱导新生血管内膜细胞凋亡,而凋亡对细胞的数量起稳定作用,从而可以防止血管内膜的增厚,预防再狭窄[22]。丹参多酚酸盐作用机制涉及自由基清除、降低细胞内胆固醇及其酯的合成、提高内皮细胞抗氧化酶的活力以及抑制某些细胞因子的分泌等[3]。我们研究结果显示,丹参多酚盐能有限抑制手术组大鼠颈动脉内膜的增生,降低血清中促炎因子的浓度,增加抗炎因子,同时下调管壁LOX-1的表达。
综上所述,丹参多酚盐通过增加机体抗炎因子,而降低促炎因子的浓度,并降低增生动脉LOX-1的表达,提示丹参多酚盐抗AS作用可能与下调LOX-1表达有关,此将有助于推进以丹参多酚酸盐为代表的中药防治AS提供新的思路与理论支持。但丹参多酚盐如何通过LOX-1抗AS细胞内信号传导机制尚未清楚,有待于进一步研究。
[1] 陈杰,李甘地,主编. 病理学[M]. 第2版.北京:人民卫生出版社,2013:181-2.
[2] Zhang Q,Chang Z,Yang J,et al. Antiatherogenic property of triterpenoidsenriched extract from the aerial parts of Salvia miltiorrhiza[J]. Phytother Res,2008,22(8):1040-5.
[3] 王明伟,张殿福,唐建金,等. 丹参多酚酸盐对猪急性心肌梗死后心肌细胞凋亡和心功能的影响[J]. 中西医结合学报,2009,7(2):140-4.
[4] 宋少华,郭闻渊,傅志仁,等. 丹参多酚酸盐负性调节小鼠骨髓来源树突状细胞成熟及其部分免疫功能[J]. 第二军医大学学报,2009,30(12):1333-7.
[5] Kim SH,Kim SH,Choi M,et al. Natural therapeuticmagnesium lithospermate B potently protects the endotheliumfrom hyperglycaemiainduced dysfunction[J]. CardiovascRes,2010,87(4):713-22.
[6] Hansson GK,Robertson AK,Soderberg-Naucler C. Inflammation and atheroselerosis[J]. Annu Rev Pathol,2006,1:297-329.
[7] Dalai A,Land C,Russell D. Atherosclcrosis and cerebral infarction[J]. Tidsskr Nor Laegeforen,2007,127(7):892-6.
[8] Mary Beth DeYoung,David A. Dichek.Gene Therapy for Restenosis Are We Ready?[J].Circ Res,1998,82(3):306-13.
[9] Schillinger M,Sabeti S,Loewe C,et al. Balloon angioplasty versus implantation ofnitinol stents in the superficial femoral artery[J].N Engl J Med,2006,354(18):1879-88.
[10] Razzouk L,Aggarwal S,Gorgani F,et al. In-stent restenosis in the superficial femoral artery[J].Ann Vasc Surg,2013,27(4):510-24.
[11] Rabbat MG,Bavry AA,Bhatt DL,et al. Understanding and minimizing late thrombosis of drug-during stents[J]. Cleve Clin J Med,2007,74(2):129-36.
[12] Moses JW,Leon MB,Popma JJ,et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery[J]. N Engl J Med,2003,349(14):1315-23.
[13] Kandzari DE,Leon MB,Popma JJ,et al. Comparison of zotarolimuseluting and sirolimus-eluting stents in patients with native coronary artery disease:a randomized controlled trial[J]. J Am Coll Cardiol,2006,48:2440-7.
[14] Ross R. Atherosclerosis-an inflammtory disease[J]. N Engl JMed,1999,340(2):115-26.
[15] 王宁,孙荣国,夏茏,吕以杰. Lox-1经ox-LDL介导致动脉粥样硬化机制的研究进展[J]. 中国老年学杂志,2012,32(18):4108-10.
[16] Tanigawa H,Miura S,Zhang B,et al. Low-density lipoprotein oxidized to various degrees activates ERK1/2 through Lox-1[J]. Atherosclerosis,2006,188(2):245-9.
[17] Chen J,Li D,Schaefer R,et al. Cross-talk between dyslipidemia and renin-angiotensin system and the role of LOX-1 andMAPK in atherogenesis studieswith the combined use of rosuvastatinand candesartan[J]. Atherosclerosis,2006,184(2): 295-302.
[18] 张磊,朱建华,黄元伟,等. 血管紧张素II对巨噬细胞(THP-1细胞)凝集素样氧化低密度脂蛋白受体表达的影响[J]. 中国病理生理杂志,2003,19(2):230-4.
[19] Jozefa D,Andrzej K,Zbigniew G. Nuclearfactor kappa-light-chainenhancer of activated B cells(NFκB):a new potential therapeutic target inatherosclerosis[J]. Pharmacol Rep,2010,62(5):778-83.
[20] 谈世进,郭慧峰,陆燕. 丹参多酚酸盐对老年不稳定型心绞痛患者内皮功能的影响[J]. 实用老年医学,2009,23(2):87-9.
[21] 吴兰,陈瑗. 丹酚酸B对Cu2+介导的LDL氧化修饰的抑制作用. 中国老年学杂志,1996,16(4):239-42.
[22] Huang YS,Zhang JT. Antioxidative effect of three water soluble components isolated from Salvia miltiorrhiza in vitro[J]. Yao Xue Xue Bao,1992,27(2):96-100.
本文编辑:李杨,田国祥
The mechanism and effect of salvianolate on the proliferation of vascular intima
WANG Shu-qing*, QIU Ming-ke, DAI Yu-xin, PAN Chang, WANG Yang, OU Jing-min. *Xinhua Hospital Affiliated to Shanghai Jiaotong University School of Medicine,Shanghai 200092
OU Jing-min; E-mail: jingminou@163.com
Objective To observe the effect of salvianolate on the proliferation of vascular intima and study mechanism behind. Methods 18 SD rats were randomly divided into sham operation group, operation group,salvianolate group. After operation for 14 days, IL-6, IL-10, TNF-α and TGF-β levels were measured in serums, and pathological morphology of carotid artery sections were observed, including the intimal hyperplasia,intimal thickness (IT), Medium thickness (MT) and calculate IT/MT value. RT-PCR and Western Blot were used to measure the expression of LOX-1 mRNA and proteins in vascular. Results Intimal hyperplasia and vascular luminal stenosis were observed at 14 days in the rat carotid artery after vascular intimal injury. Compared with sham operation group, the expression of LOX-1 mRNA and proteins in operation group were increased in vascular walls (P<0.05). IL-6, TNF-α levels in serum were increased, while IL-10, TGF-β levels were decreased (P<0.05). Compared with the operation group, the intimal hyperplasia was significantly decreased in the salvianolate group, as well as serum IL-6 and TNF-α levels. However, IL-10 and TGF-β levels were increased (P<0.05), and LOX-1 mRNA and proteins expression level significantly were decreased (P<0.05). There was no statistic difference between salvianolate group and sham operation group in above items (P>0.05). Conclusion Salvianolate can effectively inhibit the intimal hyperplasia and inflammatory response after carotid artery injury, it may be related to the downregulation of the expression of LOX-1 in intimal hyperplasia.
Salvianolate; Intimal hyperplasia; Inflammatory factor; LOX-1
R543.5
A
1674-4055(2016)06-0749-04
1200092 上海,上海交通大学医学院附属新华医院
欧敬民,E-mail:jingminou@163.com
10.3969/j.issn.1674-4055.2016.06.32

