利培酮抑制3T3-L1前脂肪细胞的分化
张高丽,张 弋,于海川,张新雅
(1.河南省周口市中心血站 466000;2.四川成都军区总医院,成都 610083;3.新乡医学院医学检验学院,河南新乡 453003)
利培酮抑制3T3-L1前脂肪细胞的分化
张高丽1,张弋2,于海川3,张新雅3
(1.河南省周口市中心血站466000;2.四川成都军区总医院,成都 610083;3.新乡医学院医学检验学院,河南新乡 453003)
目的研究利培酮对3T3-L1前脂肪细胞分化的影响。方法采用经典的激素鸡尾酒法诱导3T3-L1前脂肪细胞分化为成熟的脂肪细胞,油红O染色观察。向诱导培养基中加入利培酮研究其对3T3-L1前脂肪细胞分化的影响。结果用激素鸡尾酒法成功地将3T3-L1前脂肪细胞诱导为成熟的脂肪细胞。0.1、1、10 μmol/L的利培酮均能够抑制3T3-L1前脂肪细胞的分化。结论利培酮能够抑制3T3-L1前脂肪细胞的分化。
利培酮;3T3-L1细胞;分化
利培酮属于第2代抗精神病药物,也是目前临床上治疗精神分裂症的一线药物。长期使用该药物,会导致体质量增加、糖尿病、高血脂等不良反应。随着肥胖发生率的逐年增加,代谢综合征已成为一个全球性的流行病,严重威胁人类健康,尤其是在发展中国家其发病率呈逐年升高趋势。本研究利用3T3-L1前脂肪细胞诱导为成熟的脂肪细胞的方法,加入利培酮药物后,从细胞水平分析该药物对脂肪细胞分化的影响。
1 材料与方法
1.1主要试剂3T3-L1前脂肪细胞由新乡医学院医学检验学院中心实验室提供;油红O染液(Oil red染液) 购自广州威佳科技有限公司;DMEM培养基购自Gibco公司;胎牛血清购自Hyclone公司;胰岛素(Insulin)购自Blotopped公司;地塞米松(Dex)购自Blotopped公司;3-异丁基-1-甲基黄嘌呤(IBMX)购自Sigma公司;利培酮购自Blotopped公司;二甲基亚砜(DMSO)由新乡医学院医学检验学院中心实验室保存。
1.2方法
1.2.1细胞培养及处理3T3-L1前脂肪细胞用含10%的胎牛血清、Hyclone DMEM培养基,在37 ℃、5%CO2培养箱中培养,每2~3天传代1次,细胞贴壁生长,生长良好。
1.2.2细胞诱导分化采用经典的激素鸡尾酒方法诱导3T3-L1前脂肪细胞为成熟的脂肪细胞。具体步骤如下:3T3-L1前脂肪细胞生长至完全融合后2 d(即诱导分化0 d),加诱导分化培养基Ⅰ(含59 mL的10%FBS+600 μL IBMX+200 μL Insulin+60 μL Dex+140 μL DMEM补齐到60 mL),2 d后换成诱导分化培养基Ⅱ(含59 mL的10%FBS+200 μL Insulin+800 μL DMEM补齐到60 mL),继续培养2 d,随后换成10%DMEM培养基,2 d换液一次,继续培养4~6 d(即诱导分化8~10 d),倒置显微镜下,观察3T3-L1细胞诱导前后的细胞形态。
1.2.3油红O染色后抽提脂滴半定量测定脂滴油红O染色后,脂滴半定量的方法检测定量脂滴中携带油红O的多少。检测步骤如下:先用PBS洗2次,随后用4%的多聚甲醛固定15 min;用PBS洗2次,用油红O染色,室温密闭染色20 min;染色完成后分别用PBS和60%异丙醇洗涤1次;然后往中皿加入含4%SDS的60%异丙醇4 mL,室温20 min(期间可缓慢摇晃,有助于加速油红O溶解于异丙醇),镜下观察细胞内油红O是否抽提完全;最后将抽提的油红O转移至新的离心管,选择510 nm处用分光光度计读取吸光度值。
1.2.4药物干预细胞诱导分化诱导分化步骤如同上述经典的激素鸡尾酒方法,不同的是在加入诱导分化培养基Ⅰ和Ⅱ时,分别加入0.1、1、10 μmol/L利培酮药,同时设置空白组和DMSO组。
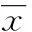
2 结 果
2.13T3-L1细胞诱导前后的形态观察在倒置显微镜下(20×)观察,3T3-L1前脂肪细胞呈梭形,纤维状贴壁生长。诱导分化第4天,细胞出现融合逐渐变圆,成功诱导分化后的3T3-L1细胞,胞内有空泡,形成“戒环”样结构。见图1。
2.2油红O染色后抽提脂滴半定量测定脂滴半定量结果显示,诱导分化成熟的3T3-L1细胞脂滴数吸光度(OD)值为(0.449±0.003),3T3-L1前脂肪细胞脂滴数OD值(1.356±0.090),两者比较,诱导分化成熟的3T3-L1细胞脂滴数增多较明显,差异有统计学意义(P<0.05)。

注:a为3T3-L1前脂肪细胞;b为3T3-L1诱导分化第4天;c为成熟的脂肪细胞。
图13T3-L1细胞的诱导分化
2.3药物干预细胞的诱导分化 选用0.1、1、10 μmol/L浓度的利培酮药物对3T3-L1前脂肪细胞诱导分化的干预进行分析。结果显示,诱导分化的第5天,各组之间整体比较差异有统计学意义(P<0.05),DMSO组细胞中的脂滴数比空白组明显减少(P<0.01),0.1 μmol/L药物组、1 μmol/L药物组、10 μmol/L药物组细胞中的脂滴比DMSO组明显减少(P<0.01)。见图2、3。

注:a为空白组;b为DMSO组;c为0.1 μmol/L药物组;d为1 μmol/L药物组;e为10 μmol/L药物组。
图2利培酮组油红O染色(20×)

注:与空白组比较,*P<0.01。
图3利培酮药对3T3-L1前脂肪细胞诱导分化的影响
3 讨 论
3T3-L1前脂肪细胞来源于小鼠胚胎成纤维细胞,能够分化为成熟的脂肪细胞。脂肪细胞分化是指细胞内没有脂滴的前脂肪细胞定向分化为细胞内充满脂滴的脂肪细胞的过程[1]。本研究中3T3-L1前脂肪细胞在诱导分化过程中,细胞停止有丝分裂、形状逐渐变大变圆,成“戒环”样结构。诱导前后细胞形态的变化与文献[2-4]报道一致。
第2代抗精神病药物通过多种途径导致患者体质量增加,加重了胰岛素抵抗,最终导致糖代谢、脂代谢异常。有研究报道,服用10周利培酮的患者体质量至少增加4 kg左右,常伴有高三酰甘油和糖尿病[5-6]。有报道称,脂肪组织是非典型抗精神病药物引发此类不良反应的一个靶点[7]。本实验研究非典型抗精神病药物利培酮对3T3-L1前脂肪细胞分化的影响,结果表明,0.1 μmol/L组、1 μmol/L组、10 μmol/L组利培酮均抑制了3T3-L1前脂肪细胞的分化,且组与组之间的抑制作用有明显差异。
肥胖是应用抗精神病药物后常见的不良反应,而肥胖可使机体体内产生一系列复杂的变化,导致机体内游离脂肪酸增多,肥大的脂肪细胞会分泌低水平的肿瘤坏死因子(TNF)-α以刺激前脂肪细胞和内皮细胞分泌人单核细胞趋化蛋白-1,从而使巨噬细胞聚集到脂肪组织周围,引发较低水平的慢性炎性反应,导致胰岛素抵抗[8-9]。另外,游离脂肪酸也可以通过激活丝氨酸激酶来阻断胰岛素的信号传导,引起胰岛素抵抗;TNF-α可通过促使胰岛素受体底物发生丝氨酸磷酸化和络氨酸去磷酸化来阻断胰岛素受体的信号传导,从而导致胰岛素抵抗的发生[10]。因此,非典型抗精神病药物引起的胰岛素抵抗日益被起研究者的重视,随着分子生物学基础研究及临床研究的发展,将进一步阐明相关的机制,有利于减少对使用此类药物患者出现糖脂代谢疾病的可能。
[1]郭秀玲,徐民岗,张秀丽,等.小鼠3T3-L1前脂肪细胞培养与诱导分化方法的建立[J].中国药物与临床,2013,13(12):1542-1544.
[2]聂绪强,杨建文,史海霞,等.IR-3T3-L1脂肪胰岛素抵抗细胞的建立[J].南方医科大学学报,2015,35(1):103-108.
[3]Noh JR,Kim YH,Hwang JH,et al.Scoparone inhibits adipocyte differentiation through down-regulation of peroxisome proliferators-activated receptor γ in 3T3-L1 preadipocytes[J].Food Chem,2013,141(2):723-730.
[4]Kim WK,Kang NE,Kim MH,et al.Peanut sprout ethanol extract inhibits the adipocyte proliferation,differentiation,and matrix metalloproteinases activities in mouse fibroblast 3T3-L1 preadipocytes[J].Nutr Res Pract,2013,7(3):160-165.
[5]Hu Y,Kutscher E,Davies GE.Berberine inhibits SREBP-1-related clozapine and risperidone induced adipogenesis in 3T3-L1cells[J].Phytother Res,2010,24(12):1831-1838.
[6]王克明,季益富.影响精神分裂症患者平均住院日的因素分析[J].疾病控制杂志,2001,5(4):324-326.
[7]Sertié AL,Suzuki AM,Sertié RA,et al.Effects of antipsychotics with different weight gain liabilities on human in vitro models of adipose tissue differentiation and metabolism[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(8):1884-1890.
[8]Hertle E,Stehouwer CD,van Greevenbroek MM.The complement system in human cardiometabolic disease[J].Mol Immunol,2014,61(2):135-148.[9]Sertie AL,Suzuki AM,Sertie RA,et al.Effects of antipsychotics with different Weight gain liabilities on human in vitro models of adipose tissue differentiation And metabolism[J].Prog Neuropsychophamacol Biol Psychiatry,2011,35(8):1884-1890.
[10]Capurso C,Capurso A.From excess adiposity to insulin resistance:the role of freefatty acids[J].Vascul Pharmacol,2012,57(2):91-97.
Risperidone inhibits 3T3-L1 pre-adipocytes differentiation
ZHANG Gaoli1,ZHANG Yi2,YU Haichuan3,ZHANG Xinya3
(1.ZhoukouMunicipalCentralBloodStation,Zhoukou,Henan466000,China;2.GeneralHospitalofChengduMilitaryRegion,Chengdu,Sichuan610083,China;3.SchoolofLaboratoryMedicine,XinxiangMedicalUniversity,Xinxiang,Henan453003,China)
ObjectiveTo investigate the influence of risperidone on differentiation of 3T3-L1 pre-adipocytes.Methods3T3-L1 pre-adipocytes were induced to differentiate into mature adipocytes by adopting the classic hormone cocktail method and observed by the oil red O staining.Meanwhile,the inducing medium was added with risperidone for studying its influence on 3T3-L1 pre-adipocytes differentiation.Results3T3-L1 pre-adipocytes were successfully differentiated into the mature adipocytes,0.1,1,10 μmol/L risperidone all could inhibit the differentiation of 3T3-L1 pre-adipocytes.ConclusionRisperidone can inhibit the differentiation of 3T3-L1 pre-adipocytes.
risperidone;3T3-L1 cell;differentiation
2015-12-09修回日期:2016-05-04)
张高丽,女,主管检验技师,研究方向是生物化学与分子生物学。
10.3969/j.issn.1673-4130.2016.15.021
A
1673-4130(2016)15-2108-02
·论著·

