苍耳子水提取液对小鼠肝毒性“量-时-毒”关系研究
汪永忠,洪燕,李钰馨,,韩燕全
(1.安徽中医药大学第一附属医院国家中医药管理局中药制剂三级实验室,安徽合肥230031;2.安徽中医药大学,安徽合肥230012)
苍耳子水提取液对小鼠肝毒性“量-时-毒”关系研究
汪永忠1,洪燕2,李钰馨1,2,韩燕全1
(1.安徽中医药大学第一附属医院国家中医药管理局中药制剂三级实验室,安徽合肥230031;2.安徽中医药大学,安徽合肥230012)
●“实验”虽然是现代科学研究常用的方法,然在我国却自古有之。古代学者王冲说“等类众多,行事比肩,略举较著,以定实验也”,颜之推说“昔在江南,不信有千人帐,及来河北,不信有二万斛船,皆实验也”,大凡此义均与现代科学意义上的experiment相通。照此,传统中医药学并非只是经验之学,而更充满实验的思想和方法。实验中医药学,将现代实验科学的方法和传统中医药学的实验方法融合起来,开拓现代实验生物学、医学和药物科学的新领域。
目的:考察苍耳子水提物单次给予对小鼠肝毒性的“量-时-毒”关系。方法:将小鼠按不同时间点和不同剂量分组,观察小鼠急性肝毒性反应,检测血清谷氨酸氨基转移酶(ALT)、谷草氨酸氨基转移酶(AST)水平,计算肝体比值,光学显微镜下观察肝组织病理形态变化。结果:“时-毒”关系研究表明:制备4.0 g/mL苍耳子水提液,取小鼠按不同时间点分组,按101.14 g/kg剂量小鼠灌胃给药一次,分别于给药后各时间点取血,小鼠血清ALT,AST均在给药1 h后明显升高,给药后8 h达到高峰,24 h后恢复近正常值;肝体比值增大,肝组织病理损伤严重;“量-毒”关系研究表明:小鼠单次灌胃给药不同剂量(101.14 g/kg、83.312 g/kg、66.650 g/kg、53.320 g/kg、42.656 g/kg、空白组同体积蒸馏水)。苍耳子水提液对肝组织产生明显损伤,随剂量增大,血清ALT,AST值显著升高。肝体比值增大,肝组织病理损伤严重。结论:小鼠单次灌胃给药苍耳子水提取液可造成明显急性肝损伤,并呈现一定“量-时-毒”关系。
苍耳子水提液;肝毒性;时毒;量毒
中药苍耳子为菊科植物苍耳(Xanthium sibirium Patr.)的干燥成熟带总苞的果实,收载于历版《中华人民共和国药典》,味辛、苦,性温,有毒,归肺经。苍耳子水提取物临床应用于治疗鼻窦炎和头痛,也用于治疗中耳炎、过敏性鼻炎和臭鼻症等[1-2]。课题组前期研究表明苍耳子水提物对于小鼠具有抗炎和镇痛等药理作用,但苍耳子属传统记载的确有疗效的有毒中药,临床有因长期、过量、反复使用或者炮制不当或者未经炮制使用而导致中毒,甚至屡有死亡的报道。研究表明,苍耳子的使用不当容易导致不同器官的损害,尤其是肝脏,以及轻微程度的心肌和肾脏损伤。大鼠在给药4 w后,血清中丙氨酸氨基转氨酶、天冬氨酸氨基转氨酶和碱性磷酸酶显著增加[3-4]。苍耳子中苍术苷与羧基苍术苷等水溶性苷类成分可影响脂肪酸及氨基酸代谢从而产生肝脏毒性[5]。
苍耳子作为临床常用中药,其化学成分和药理作用已经得到广泛的研究,但对于苍耳子的毒性作用研究较少,为进一步明确苍耳子水提物的肝脏毒性特点及其“时间窗”和“剂量窗”,本实验对苍耳子药材的水提组分给小鼠单次灌胃所致急性肝毒性的“量-时-毒”关系进行了研究,以期为该中药临床合理安全用药提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物昆明种小鼠,18~22 g,适龄,健康,雌雄各半,共240只,购于安徽医科大学实验动物中心。
1.1.2 实验药物苍耳子药材购于合肥深南中药饮片有限公司,批号:120909。经安徽中医药大学彭华胜教授鉴定为菊科植物苍耳的成熟带总苞的果实。取苍耳子药材600 g,适当粉碎后加水煎煮,第1次为10倍量水,煎煮1.5 h,收集滤液;第2次加入8倍量水,煎煮1 h,收集滤液;合并2次滤液,加热浓缩至浓度为4 g/m L,冷冻保存,备用。
1.1.3 试剂与仪器谷丙氨酸氨基转移酶(ALT/ GPT)试剂盒,批号:C009-2;谷草氨酸氨基转移酶(AST/GOT)试剂盒,批号:C010-2,上述试剂均由南京建成生物科技有限公司提供。Thermo Scientific Multiscan GO 1510全波长酶标仪,美国赛默飞世尔科技有限公司;BS2005电子天平,德国Sartorius公司;KDC-16H高速离心机,科大创新股份有限公司中佳分公司。
1.2 实验方法
课题组前期研究表明,苍耳子小鼠灌胃给药的LD50为329.92 g/kg,95%可信区间为303.42~ 359.06 g/kg,设定“时-毒”关系研究给药剂量为101.14 g/kg;“量-毒”关系研究各给药剂量组分别为101.140 g/kg、83.312 g/kg、66.650 g/kg、53.32 g/kg、42.656 g/kg,空白对照组给予等体积蒸馏水灌胃,均按25mL/kg体积灌胃。
1.2.1 苍耳子水提物相同剂量单次给药对小鼠肝毒性“时-毒”关系研究取小鼠,随机分为12组,按处理时间点依次为0 h(正常对照组)、20min、40 min、1 h、2 h、3 h、4 h、8 h、12 h、24 h、48 h、72 h组。正常对照组小鼠蒸馏水灌胃,其余各组按101.14 g/kg生药浓度灌胃。于相应时间点称量小鼠体质量,摘眼球取血,3 000 rpm离心10min。采用所购买试剂盒,按照试剂盒说明书,以生化分析仪测定血清ALT、AST水平。取肝脏称重,计算脏器系数;另取一部分肝组织,常规HE染色,光学显微镜下观察其组织形态学变化。
1.2.2 苍耳子水提物相同剂量单次给药对小鼠肝毒性“量-毒”关系研究取小鼠,随机分为6组,按剂量分别为101.140 g/kg、83.312 g/kg、66.650 g/kg、53.320 g/kg、42.656 g/kg及正常对照组。给药8 h后,按1.2.1项下方法测量血清ALT、AST水平,计算脏器系数;另取一部分肝组织,光学显微镜下观察其组织形态学变化。
2 结果
2.1 苍耳子水提物相同剂量单次给药对小鼠肝毒性“时-毒”关系
2.1.1 苍耳子水提物对小鼠血清ALT、AST活力的影响空白对照组(0 h)小鼠血清ALT、AST水平均在正常范围内;给药后20min~48 h,药物组小鼠血清ALT、AST值均有不同程度升高,与对照组比较差异有统计学意义(P<0.05),结果见表1、图1。
表1 苍耳子水提物对小鼠肝毒性“时-毒”关系血清ALT和AST的影响(±s)

表1 苍耳子水提物对小鼠肝毒性“时-毒”关系血清ALT和AST的影响(±s)
注:与0 h比较,1)P<0.05
时间n ALT(IU/L)AST(IU/L)0 h 10 35.67±1.27 49.73±1.02 20min 10 38.59±1.181)55.53±1.521)40 min 10 40.71±1.291)75.90±1.361)1 h 10 51.30±1.431)85.56±1.481)2 h 10 55.15±1.401)91.02±1.001)3 h 10 58.86±1.231)92.47±2.981)4 h 10 68.23±1.691)99.93±1.691)8 h 10 84.77±1.001)114.43±1.561)12 h 10 48.00±1.961)86.20±1.571)24 h 10 43.32±1.171)77.15±1.301)48 h 10 35.33±1.40 54.14±0.951)72 h 10 35.35±1.38 48.63±1.06
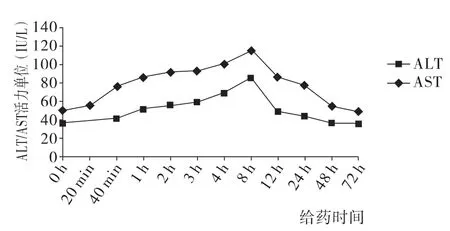
图1 苍耳子水提物对小鼠肝毒性“时-毒”ALT和AST变化曲线
2.1.2 对小鼠肝脏指数的影响给药8 h后小鼠即可出现肝脏明显肿大,肝指数升高,其中8~24 h肝脏指数升高最为明显(P<0.01),结果见表2。
表2 苍耳子水提物对小鼠肝毒性“时-毒”关系肝脏指数的影响(±s)
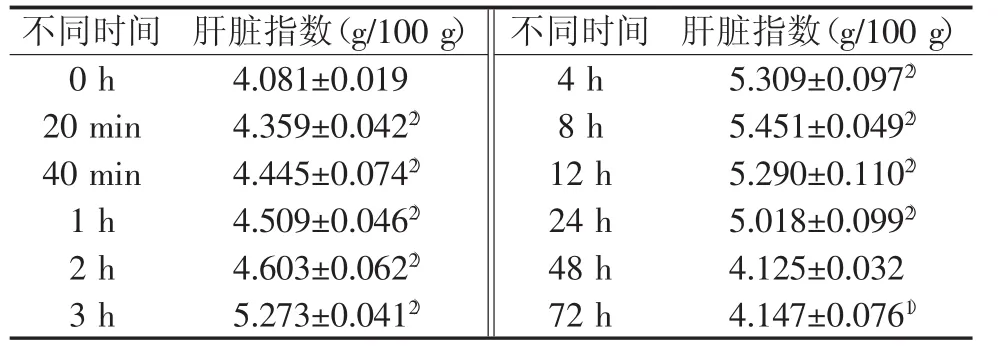
表2 苍耳子水提物对小鼠肝毒性“时-毒”关系肝脏指数的影响(±s)
注:与0 h比较,1)P<0.05,2)P<0.01
不同时间肝脏指数(g/100 g)不同时间肝脏指数(g/100 g)0 h 4.081±0.019 4 h 5.309±0.0972)20min 4.359±0.0422)8 h 5.451±0.0492)40min 4.445±0.0742)12 h 5.290±0.1102)1 h 4.509±0.0462)24 h 5.018±0.0992)2 h 4.603±0.0622)48 h 4.125±0.032 3 h 5.273±0.0412)72 h 4.147±0.0761)
2.1.3 对小鼠肝组织形态的影响光镜下观察,正常对照组肝小叶结构清晰完好,肝细胞未见明显变性、坏死;给药20min后,可见肝小叶结构尚正常,肝细胞水肿、变性,大部分细胞固缩深染,出现气球样变、嗜酸性变与脂肪变,与正常对照组比较差异明显。结果见图2。
2.2 苍耳子水提物相同剂量单次给药对小鼠肝毒性“量-毒”关系
2.2.1 苍耳子水提物对小鼠血清ALT、AST活力的影响正常对照组(0 h)小鼠血清ALT、AST水平均在正常范围内,药物组小鼠血清ALT、AST值均有不同程度升高,与正常照组相比,5个剂量组的小鼠血清ALT、AST值均不同程度的升高(P<0.01)。结果见表3、图3。
2.2.2 对小鼠肝脏指数的影响苍耳子水提物各剂量组肝脏指数均显著性升高,与正常对照组比较差异有统计学意义(P<0.01),结果见表4。
表3 苍耳子水提物对小鼠肝毒性“量-毒”关系血清ALT和AST的影响(±s)
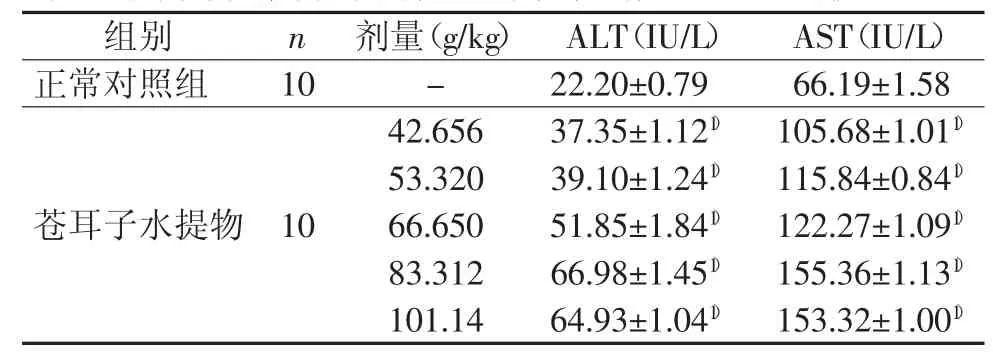
表3 苍耳子水提物对小鼠肝毒性“量-毒”关系血清ALT和AST的影响(±s)
注:与正常对照组比较,1)P<0.01
组别n剂量(g/kg)ALT(IU/L)AST(IU/L)正常对照组10-22.20±0.79 66.19±1.58 42.656 37.35±1.121)105.68±1.011)53.320 39.10±1.241)115.84±0.841)66.650 51.85±1.841)122.27±1.091)83.312 66.98±1.451)155.36±1.131)101.14 64.93±1.041)153.32±1.001)苍耳子水提物10
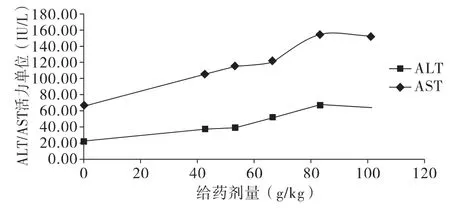
图3 苍耳子水提物对小鼠肝毒性“量-毒”ALT和AST变化曲线
表4 苍耳子水提物对小鼠肝毒性“量-毒”关系肝脏指数的影响(±s)
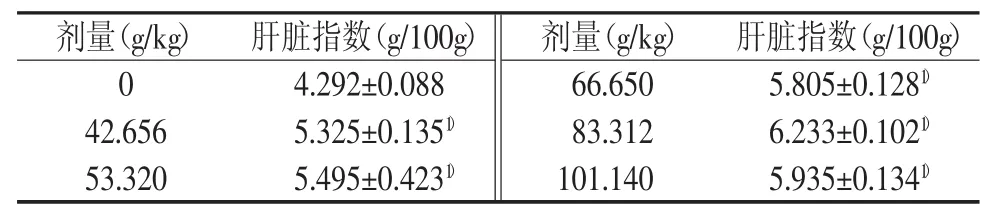
表4 苍耳子水提物对小鼠肝毒性“量-毒”关系肝脏指数的影响(±s)
注:与正常对照组比较,1)P<0.01
剂量(g/kg)肝脏指数(g/100g)剂量(g/kg)肝脏指数(g/100g)0 4.292±0.088 66.650 5.805±0.1281)42.656 5.325±0.1351)83.312 6.233±0.1021)53.320 5.495±0.4231)101.140 5.935±0.1341)
2.2.3 对小鼠肝组织形态的影响给药8 h后,观察小鼠肝细胞形态,可见肝小叶结构尚正常,肝细胞明显肿大,出现气球样变与脂肪变,部分灶状坏死或点状坏死,与正常对照组比较差异明显。结果见图4。
3 讨论
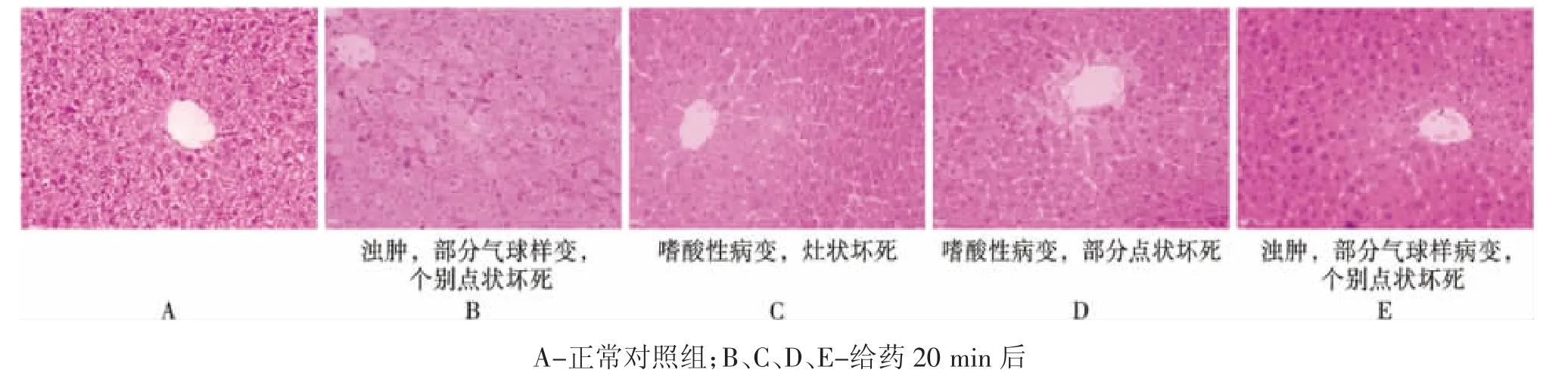
图2 苍耳子水提液小鼠肝毒性“时-毒”关系研究病理照片(HE染色,10×20)
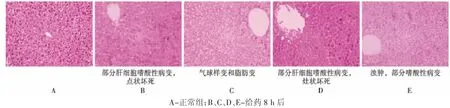
图4 苍耳子水提液小鼠肝毒性“量-毒”关系研究病理照片(HE染色,10×20)
苍耳子为历代治疗鼻渊及头痛的要药,在治疗鼻病的常用方剂中占有重要的地位,但文献载明有“小毒”,属有毒中药范畴。苍耳子引起的毒性反应表现为多器官、多靶点、多系统。部分学者认为苍耳子的毒性物质常损害肝、心、肾等内脏实质细胞,出现黄疽、心律不齐、蛋白尿,尤以损害肝脏为甚[6]。临床均使用苍耳子或炒苍耳子的水煎提取物用于治疗鼻科疾病,而现代医学研究表明,苍耳子中的毒性成分主要为水溶性苷类苍术苷与羧基苍术苷[7]。因此,为了减少临床不良反应,更安全合理地使用苍耳子,了解其口服毒性特点及机制,对其进行毒性机制研究指导临床应用具有重要意义。
本实验对苍耳子水提物单次给药致小鼠急性肝毒性“量-时-毒”关系进行了观察与评价。研究结果发现,苍耳子水提物对小鼠肝脏具有毒性作用。苍耳子水提物致小鼠肝毒性“时-毒”关系研究显示,小鼠单次灌胃101.14 g/kg苍耳子水提物后,血清ALT、AST值随时间不同肝损伤程度不同,给药20min后血清ALT、AST水平升高,毒性高峰出现在给药后8 h,毒性持续时间24 h。肝组织病理形态学检查显示,苍耳子水提液在给药后8 h对肝组织产生明显损伤。这表明,单次给予较高剂量的苍耳子水提液可造成小鼠急性肝损伤,具体表现为血清ALT、AST值升高或肝组织病理形态学的改变,且毒性出现早、持续时间长。苍耳子水提物致小鼠肝毒性“量-毒”关系研究显示,小鼠灌胃给药8 h后,不同剂量组小鼠肝体比值和血清ALT、AST值都明显升高,
本文对苍耳子水提液单次给药对小鼠肝毒性的“量-时-毒”关系进行了初步研究,为中药苍耳子体内肝毒性安全性评价体系的建立提供了研究思路与技术支撑。通过本文明确了苍耳子水提液单次给药致小鼠体内肝毒性的毒性剂量范围和肝毒性依赖时间变化的规律,为临床长期大量使用苍耳子水提制剂过程中毒副作用的监测提供了参考,对于中药临床安全合理用药具有重要意义。
[1]Hsu F L,Chen Y C,Cheng JT.Caffeic acid as active principle from the fruit of Xanthium strumarium to lower plasma glucose in diabetic rats[J].Planta Medica,2000(66):228-230.
[2]Hsu H Y,Chen Y P,Sheu S J,et al.Orientalmateriamedica a concise guide[M].Taipei:Modern DrugWeekly of Taiwan,1985:277.
[3]Kellerman T S,Coetzer JAW,Naude TW.Plant poisonings andmycotoxicoses of livestock in Southern Africa[M].Cape Town:Oxford University Press,1988.
[4]Wu B,Cao M,Liu SM,et al.Experiment study on hepatotoxicity induced by thewater extractof cocklebur fruit in rats[J].Adverse Drug Reactions Journal,2010,12(6),381-386.
[5]Xue LM,Zhang Q Y,Han P,et al.Hepatotoxic constituents and toxicologicalmechanism of Xanthium strumarium L.fruits[J].JEthnopharmacol,2014,152(2):272-282.
[6]曲莉颖,权锦花,孙彤,等.105例苍耳子不良反应文献分析[J].辽宁中医药大学学报,2015,17(2):127-129.
[7]Nikles S,Heuberger H,Hilsdorf E,etal.Influence of processing on the contentof toxic carboxyatractyloside and atractyloside and themicrobiological status of xanthium sibiricum fruits(Canger zi)[J].Planta Med,2015,81(12/13):1 213-1 220.
(编辑:翟春涛)
Study on"dose-time-toxicity"relationship on hepatotoxicity caused by water extract of Xanthium in m ice
Wang Yongzhong1,Hong Yan2,Li Yuxin1,2,Han Yanquan1
(1.Grade 3 Laboratory of Traditional Chinese Medicine Preparation,State Administration of Traditional Chinese Medicines,The First Affiliated Hospital,Anhui University of Traditional Chinese Medicine,Hefei Anhui230031;2.Anhui University of Traditional Chinese Medicine,Hefei Anhui230031)
Objective:To study the"dose-time-toxicity"relationship of hepatotoxicity in mice caused by single dosage water extract of Xanthium.Method:Mice were packeted according to different time and dose points,to observe the hepatotoxicity ofmice,detect the ALT、AST in serum,calculate liver index,and observe the histopathology of liver tissue. Result:The"time-toxicity"relationship showed that:administrated the 101.14 g/kgwater extractof Xanthium tomice,take the blood samples at different time after administration,ALT and AST were increased after 1 hour,peaked at 8 hour and turned back to normal level at 24 hour;liver index increased and histopathological examination showed serious injury of liver tissue.The"dosage-toxicity"relationship showed that:the dosage ranger ofwater extract of Xanthium cause injury is 101.14 g/kg、83.312 g/kg、66.650 g/kg、53.320 g/kg、42.656 g/kg,the ALT and AST increased significantly as the dosage increased.Live index also increased,live tissue histopathology serious injurywas observed.Conclusion:The acute liver injury can be caused by single dosewaterextractofXanthium tomice,and thereare certain"time-dosage-toxicity"relationship.
water extract of xanthium;hepatotoxicity;time-toxicity;dosage-toxicity
R285
A
1671-0258(2016)06-0001-04
国家中医药管理局中药炮制技术传承基地项目
汪永忠,硕士,主任药师,E-mail:wyzhmail@163.com
韩燕全,副主任药师,E-mail:hyquan2003@163.com

