细胞培养中的三维支架
王建政朱玉霞
综述与讲座
细胞培养中的三维支架
王建政1,2朱玉霞2,3
三维细胞培养所创建的3D生长环境,能够最大程度地模拟体内情形,使细胞呈现出空间立体生长的模式,形成类似体内细胞的组织结构,并发挥其功能。因此,三维培养已广泛用于组织工程、药物筛选和基础生命科学等研究领域。本文就3D培养产生的背景、3D培养的应用和3D培养支架应该具备的特性等内容进行了综合评述与回顾。
组织工程;二维培养;三维培养;三维培养支架
2 三维细胞培养的用途
如今,关于细胞3D培养的研究已变得更加至关重要和富有成效[3],已广泛用于以下三种用途的研究:
2.1 组织工程
组织、器官的丧失以及功能障碍已成为人类健康所面临的主要危害之一,也是人类疾病和死亡的最主要原因。近年来临床上采用的自体、同种异体或异种组织器官进行移植修复的手段常因供源不足、造成供体受损及免疫排斥等问题而难以满足需求[4]。组织工程的兴起和发展,为解决这一难题提供了新的方法和手段。体外细胞三维培养一方面能够为细胞提供与其组织来源相似或相同的生长微环境,另一方面可望在体外构建与各类组织、器官相应的细胞三维生长类似物或等同物。因而,细胞三维培养技术大大促进了组织工程研究工作的发展[5]。
2.2 药物筛选
在筛选新药的疗效分析和毒理实验方面,利用三维培养获得的与二维单层培养完全不同的结果,引起了药物学家的极大兴趣[1,2]。与传统二维培养模式相比,三维培养系统是可透见的。三维培养肿瘤模型可以观测到类似人体内环境中肿瘤细胞长期生长、增生、分化、成熟和运动的全过程,医疗人员能够在施药过程中随时观察和追踪肿瘤细胞的生长、分化、浸润、迁移或凋亡等特性。因此,体外三维肿瘤生物模型在肿瘤疫苗研发和肿瘤治疗等方面具有广阔的应用前景。
2.3 基础生命科学研究
体外培养的多细胞聚集体生物模型具有与体内细胞相似的生物学特性和基因表达,所形成的3D组织培养结构具有和体内生命组织相似的生长状态和生物学特性。因此体外细胞3D培养在研究细胞内和细胞间信号转导(Signaltransduction)、细胞与细胞外基质(ExtracellularMatrixc,ECM)的相互作用、细胞的分化与调控、细胞的衰老和调亡等基础生命科学研究中起着越来越重要的作用[6-8]。
3 三维支架在细胞三维培养中的作用
组织工程的核心是建立由细胞和生物材料构成的三维空间复合体,其研究主要集中在生物可降解支架材料、种子细胞、体外培养条件等方面,其中理想的三维支架构建是组织工程化人工器官研究成功的前提条件[9]。组织工程支架材料提供一个有利于细胞黏附、增殖及分化的三维支架式外环境,起着替代细胞外基质的作用,是细胞间信号传导的媒介,同时也为细胞提供结合位点,诱发生物反应,诱导细胞的正常生长和基因的正常表达。此外,组织工程支架材料可以为细胞提供生存空间,促进细胞生长所需的营养物质、氧气和其它生物活性物质的渗透扩散和运输,使细胞及时获得足够的营养物质,并进行气体交换和排泄细胞代谢物,同时使细胞按预制形态在三维支架上生长。
4 三维支架材料的来源
按照材料来源的不同,三维支架材料可分为天然支架材料、人工合成支架材料两大类:
4.1 天然材料
天然支架材料是指自然界生长或形成的材料,这些材料生物相容性好,具有细胞识别信号[10],利于细胞粘附、增殖和分化。常见的天然材料有:
胶原(Collagen)[11]:胶原是哺乳动物体内主要的结构蛋白,由多种糖蛋白分子组成,占机体总蛋白的30%,它具有多方面的生物活性,是细胞外基质的重要成分。胶原蛋白来源丰富、结构复杂、类型多,可分为可分为 I型、Ⅱ型、Ⅲ型等,生物体中约85%的胶原蛋白为I型胶原蛋白。胶原本身所包含的细胞黏附信号肽序列(RGD)可以引导细胞对支架材料的特异性识别,已成为目前组织工程学研究中最常用的天然生物材料。胶原蛋白及相关制品已在止血、促进伤口愈合、创面敷料、骨移植替代材料、组织再生诱导物方面得到广泛的应用。
纤维蛋白(Fibrin)[12]:纤维蛋白作为天然细胞外基质成分,有较好的介导细胞间信号传导的性能,是最早使用的医学材料之一,也是应用较多的生物材料,具有良好的生物相容性。另外,纤维蛋白凝胶可塑性强,而且其本身就是一种营养物质,这在体内组织液通过渗透作用给细胞提供滋养以前是至关重要的。纤维蛋白基生物材料与无机骨陶瓷,如HA或 -TCP复合,不仅可以改善复合基质的生物力学特性,而且可以提供组织再生的生物活性。
甲壳素[13,14]:亦称甲壳质、几丁质,是自然界中仅次于纤维素的天然多糖,广泛存在于昆虫、甲壳类动物外壳及真菌细胞壁中[13]。甲壳素及其衍生物是一种低等动植物的组成部分,是少见的带正电荷的聚合物。由于它具有无毒性、无刺激性、可降解性能良好等特点,在人工皮肤、骨组织修复工程和手术缝线等方面有广泛应用。
透明质酸(Hyaluronicacid,HA)[15]:又名玻璃酸(Hyaluronan),是由两个双糖单位 D-葡萄糖醛酸及 N-乙酰葡糖胺组成的大型多糖类,广泛分布在动物和人体组织的细胞外基质中,在眼玻璃体、房水和脐带中含量较高。透明质酸是一种天然的高分子直链多糖,带有负电荷。商品透明质酸一般为其钠盐,即透明质酸钠(Sodium Hyaluronate),简称HA。它的水溶液为粘弹性流体,在动物体内起着保护及润滑细胞,调节细胞在基质上的移动,稳定和保护胶原网状结构免于机械性破坏等功能。由于HA大分子很容易降解,近年来作为一种可吸收的高分子医用材料,已成功地运用于眼科手术、关节病治疗和组织修复等领域。
蚕丝(Silk)[16]:蚕丝作为天然高分子材料,具备良好的力学性能,同时在生物相容性方面又优于传统的人工合成可降解高分子材料。蚕丝具有良好的表面活性和组织相容性,以丝素为原料编织的手术缝合线,在体内没有抗源性,几乎不形成血栓,在临床上早已得到应用[17,18]。蚕丝已是天然成品生物材料,可避免其它天然材料需进一步加工的缺点。蚕丝还被制成微粒作为血管栓塞剂在临床广泛应用。
明胶(Gelatin):胶原由于其动物源性而拥有抗原性,明胶是由动物胶原部分水解得到的蛋白质,化学本质是由胶原的三螺旋肽链水解成的单螺旋肽链[19]。相比之下,胶原的水解产物-明胶由于热变性而消除了抗原性。此外,明胶含有大量的亲水性基团,交联后的明胶海绵能促进上皮化组织生成,因而是理想的组织工程用生物材料。最近,明胶基生物材料已经被应用于人造皮肤、骨移植和组织工程用支架等诸多方面[20]。但明胶本身所具有的高亲水性和脆性限制了其在组织工程领域中的应用。为了解决这些问题,人们做了大量的尝试以改善明胶的性能,包括通过物理改性和化学交联的方式来改善明胶多孔支架材料的性能[19]。
4.2 人工合成材料
人工合成支架材料包括人工高分子材料和人工合成无机材料两类。
人工高分子材料指以石油、煤、天然气及农副产品等为原料经人工合成获得的高分子聚合物材料,目前应用较多的人工合成可降解高分子材料主要是聚乳酸(PLA)、聚羟基乙酸(PGA,即聚乙醇酸)以及它们之间的各种共聚物。
以聚乳酸[21]为例,利用谷物或有机物淀粉原料发酵可以生产乳酸,多个乳酸分子在一起,-OH与别的分子的-COOH脱水缩合得到一种线形分子-聚乳酸(PLA)。聚乳酸也称为聚丙交酯,属于聚酯家族。与天然的细胞外基质如胶原等相比,PLA材料不仅有良好的机械性能,而且具有丰富的加工手段,可采用包括盐析法、气体发泡法、乳液冻干法、相分离法、静电纺丝法等一系列方法制备具有合适体型结构的组织工程支架[22]。聚乳酸由于其良好的生物降解性、生物相容性和可加工性,已广泛应用到组织工程支架制备中[22]。以聚乳酸为代表的聚酯类生物降解材料是目前组织工程研究中最常用的细胞生长支架材料之一。PLA的降解分为两个阶段,第一阶段是它的酯基团逐步水解成为乳酸和其它小分子,然后这些小分子被环境中的微生物所分解[22]。
不过,以聚乳酸为代表的人工合成的高分子材料缺乏细胞识别信号,不具备生物活性,材料界面与细胞之间不能引发生物特异反应,但可引起无菌性炎症[23]。
人工合成无机材料是指一些医用碳素材料、生物玻璃、生物陶瓷、医用不锈钢、钛基合金、钴基合金等无机材料。生物陶瓷材料,如羟基磷灰石、磷酸三钙、生物活性玻璃、磷酸钙骨水泥、云母等,这类材料无毒,亲水性、细胞亲和性较好,生物相容性好,常用作骨组织工程的支架材料,但降解速度慢,一些材料吸收过慢,甚至不吸收,脆性大[9]。
5 理想的三维支架应该具备的特征
细胞与支架的附着作用对细胞的活性和组织工程器官的再生起着至关重要的作用[24],不同工程组织、工程器官的体外构建对生物支架材料的理化和生物活性的要求各不相同,合适的材料形状、细胞相容性、空隙率、渗透性能、表面特性和机械性能,是支架材料所必须具备的性能[25]。理想的组织工程支架应具备以下条件:
①较高的孔隙率和比表面积-以适于细胞的黏附和生长,细胞间的信号传导,养分传送,以及降解产物和新陈代谢产物的排出。细胞的贴附生长有利于其增殖,而非贴附生长形成的细胞团则有利于其行使组织特异性功能[25]。
多孔支架材料的孔形结构影响着细胞黏附和迁移,并决定着细胞向材料内部生长的速率和能够生长的深度[26]。巨大的支架比表面积有利于细胞的黏附和生长,而支架的比表面积依赖于孔隙率和孔径的大小[25]。因此,三维支架材料上的组织再生依赖于支架材料的孔径和孔隙率[27]。支架巨大的孔隙率有利于容纳足够的细胞量,并有利于细胞营养物质和代谢物的传质和扩散[25],而平均孔径的大小又影响着细胞的表型特征[28]。孔径的大小一般应在所培养的细胞直径的2.5倍以上[29],但不同尺寸和种类的细胞在不同的支架材料上,对上述条件的要求也各不相同[25]。比如,新生血管化组织细胞需要的孔径为5 m;成纤维细胞需要5~15 m;肝实质细胞需要20 m;成年哺乳动物皮肤细胞需要20~125 m;非成熟骨组织细胞需要40~100 m;成熟骨组织细胞需要100~350 m;移植细胞的纤维血管组织快速生成则需要500 m 以上的支架孔径[25]。在多孔氮化硅支架上,内皮细胞倾向于贴附孔径<80 m的支架,而成纤维细胞倾向于贴附孔径>90 m的支架[30]。在PLLA支架上,血管平滑肌细胞倾向于贴附孔径为63~150 m的支架,而成纤维细胞倾向于贴附孔径为38~150 m的支架[31]。此外,由于一些细胞需要周围支持细胞的存在,所以这些细胞结构就需要比细胞尺度大得多的支架孔径[32]。综合已有的研究结果表明,对于支架材料的孔径尺寸,不同的细胞类型有不同的反应[33],不同的组织细胞需要不同孔径的支架材料[34]。一些磷酸钙骨组织工程支架材料的孔隙率和孔径如表1[25]。
另外,支架材料孔隙的连通性也至关重要[29]。即便是孔隙率很高,但如果孔隙间的连通性不好的话,细胞生长过程中的有关传质就会受到抑制,同时会造成细胞聚集[36]。有研究表明,直径>200 m的细胞团,如果没有血管供应,就会进入失活或坏死状态[37]。孔型和孔的扭曲度也对细胞生长有影响[38]。
②良好的生物相容性-在生物体内不会引起炎症或致畸反应。
③适当的生物可降解性-在细胞生长繁殖的同时支架材料同步降解。
④一定的生物稳定性、机械强度、柔韧性和可加工性。
⑤作为细胞、生长因子和基因的生物载体,并能控制生长因子的释放。同时,支架材料还必须具备与活性添加剂的良好相容性。比如,骨移植过程中需要添加磷酸钙和骨生成素蛋白等[25]。
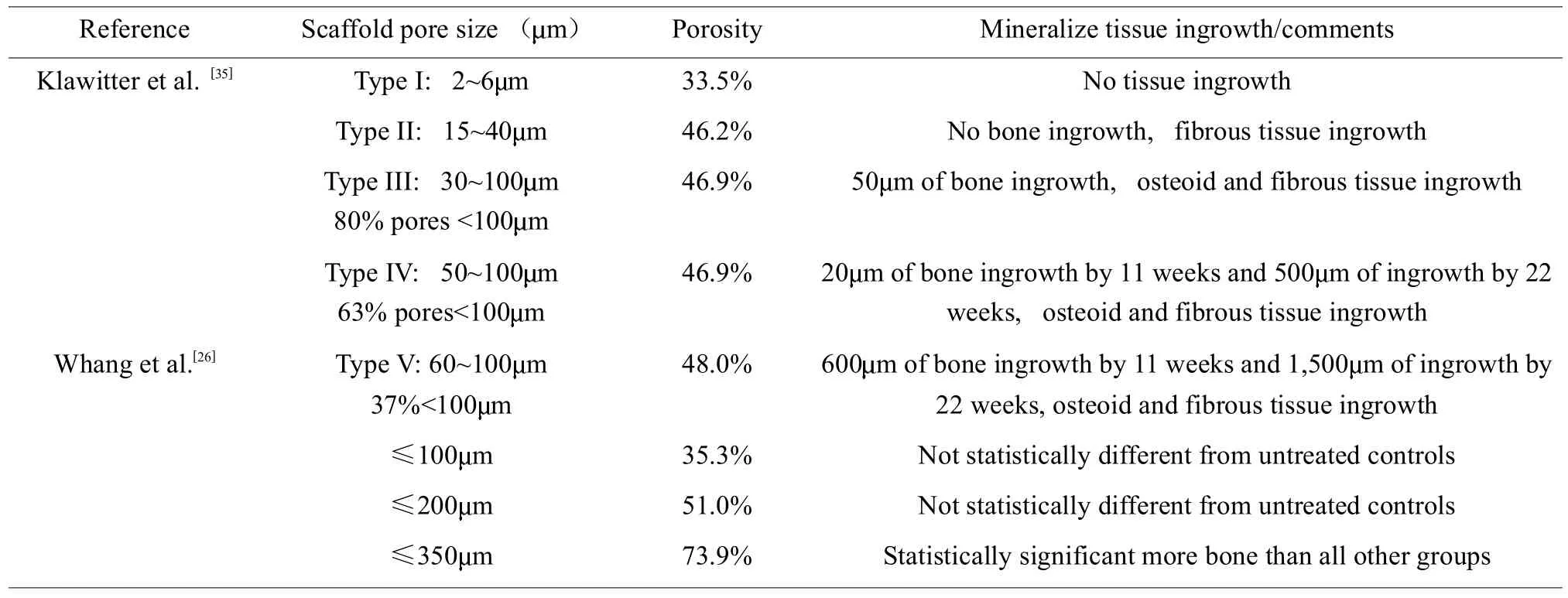
表1 骨组织工程中支架孔径的优化
关于支架尺寸变化的问题,Green等人发现,与细胞可以比拟的尺度变化可以影响到细胞的生长和增殖[39]:2~5 m的节结瘤表面有助于细胞增殖,10 m的节结瘤表面则抑制细胞的增殖。细胞对表面特征宽度的变化的分辨率为1~3 m,对表面特征深度的变化的分辨率为0.5~1 m[40]。已有的研究表明,细胞在光滑和亲水性的材料表面更容易增殖和迁移,并分泌更多的细胞外基质[41]。
6 三维支架的拓扑结构
根据拓扑学结构,用于生物医学领域的3D支架可以分为蜂窝状(A lveolitoid)和纤维状(Fibroid)两大类[42]:6.1蜂窝状
蜂窝状多孔支架(图1)是指整个3D支架的基本骨架连结成一个蜂窝状的整体[43]。传统的蜂窝状多孔支架制备方法主要包括[44-47]:添加致孔剂法、气体发泡法、粒子沥滤法、溶胶-凝胶法、盐析致孔法、有机泡沫浸渍法、冷冻干燥法等。其中,冷冻干燥技术是一种制造蜂窝状支架的简便技术,在支架制备领域应用最为广泛[48]。
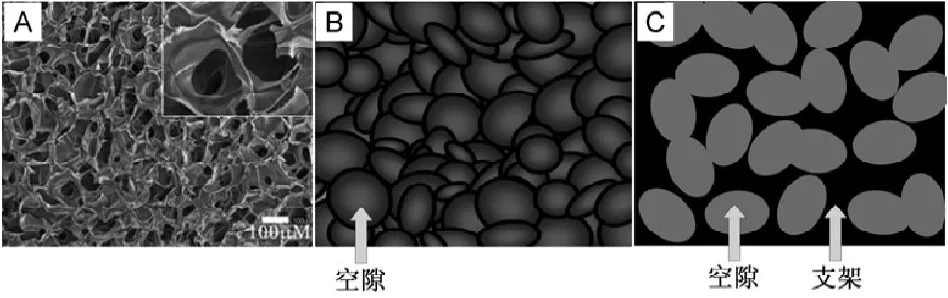
图1 蜂窝状多孔支架。A壳聚糖/海藻酸钠复合多孔支架(图片来源:Li等,2005);B蜂窝状支架内的空腔示意图(如肥皂泡状);C蜂窝状支架截面上的空腔示意图
6.2 纤维状
纤维状支架(图2)是指整个3D支架结构由互不相连的纤维组合而成,即整个3D支架中间的空腔连结成一个连通的整体[49]。利用纺织技术可将直径10~15 m的纤维制成织物或无纺物,其孔隙率高达97%,比表面积高达0.05 m-1,是组织工程研究中最早采用的细胞外基质替代物之一,目前已成功地用于软骨等多种组织工程领域。
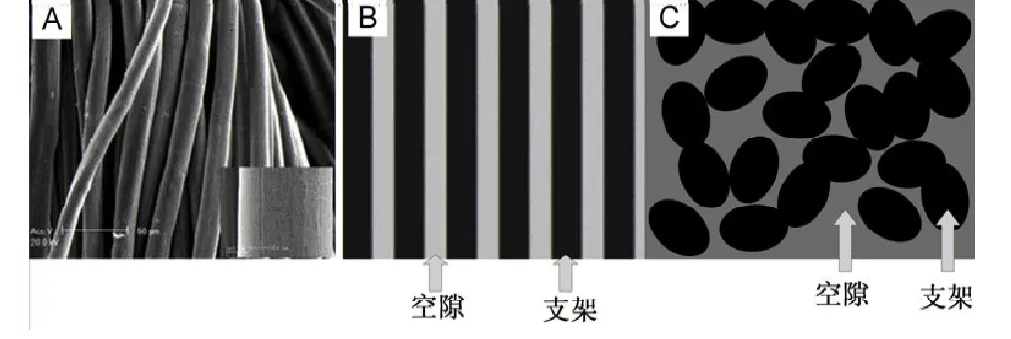
图2 纤维状多孔支架。A壳聚糖纤维(图片来源:Yang等,2007);B纤维状支架内的空腔示意图;C纤维状支架横截面上的空腔示意图
7 结论
二维细胞培养的局限性,催生了对细胞3D培养的研究。理想的三维细胞培养支架的构建,是组织工程化3D细胞培养成功的前提条件。深入了解3D细胞支架的材料来源,并使支架具备合适的物理、化学及生物学特征,是开展细胞3D支架制备研究的必由之路。
[1] 滕伟,郭志坤.细胞三维培养的研究进展[J].医学综述,2008,12: 1767-1770.
[2] 胡康洪,姚颖.三维细胞培养技术的研究与应用[J].医学分子生物学杂志,2008,5:185-188.
[3] Marlow R,Dontu G.Modeling the breast cancer bonemetastatic niche in complex three-dimensional cocultures[J].Methods Mol Biol.2015,1293:213-20..
[4] Zhong L,Gou J,Deng N,Shen H,He T,Zhang BQ.Three-dimensionalCo-culture of hepatic progenitor cellsandmesenchymalstemcells in vitro and in vivo[J].M icrosc ResTech,2015,78(8):688-696.
[5] Langer R,Vacanti J.Tissue engineering[J].Science,1993,260: 920-926.
[6] Adissu H,Asem E,Lelièvre S.Three-dimensional cell culture to modelepithelia in the female reproductive system[J].Reprod Sci, 2007,14:11-19.
[7] Hehlgans S,Lange I,Eke I,etal.3D cell culturesof human head and neck squamous cellcarcinoma cellsare radiosensitized by the focaladhesion kinase inhibitor TAE226[J].RadiotherOncol,2009, 92:371-378.
[8] Fernandes T,Kwon S,Bale S,etal.Three-dimensionalcellculture m icroarray for high-throughput studies of stem cell fate[J].BiotechnolBioeng,2010,1,12.
[9] 黄明华,陈庆华,刘美红,等.组织工程支架材料研究进展及发展趋势[J].材料导报,2006,20:365-368.
[10]任杰,张乃文.具有细胞识别信号的组织工程支架材料的研究[J].材料导报,2004,18:61-64.
[11]NistorMT,VasileC,Chiriac AP.Hybrid collagen-based hydrogels w ith embeddedmontmorillonitenanoparticles[J].MaterSciEng C Mater BiolAppl,2015,53,212-221.
[12]BanihashemiM,Mohkam M,SafariA,etal.Optimization of Three DimensionalCulturing of the HepG2Cell Line in Fibrin Scaffold [J].HepatMon,2015,15(3):22731.
[13]冯庆玲,李晓明.甲壳素纤维增强骨组织工程框架材料.会议论文2005,第二届全国生物复合材料学术研讨会.
[14]Zhao L,Wu Y,Chen S.Preparation and characterization of crosslinked carboxymethyl chitin porousmembrane scaffold for biomedicalapplications[J].Carbohydr Polym,2015,126:150-155.
[15]BornesTD,JomhaNM,Mulet-SierraA,etal.Hypoxic cultureofbone marrow-derivedmesenchymalstromalstem cellsdifferentially enhancesin vitro chondrogenesisw ithin cell-seeded collagenandhyaluronic acid porousscaffolds[J].Stem CellRes Ther,2015,6(1):84.
[16]Oliveira BHG,Barud HS,CavicchioliM,et al.Preparation and characterization of a bacterial cellulose/silk fibroin sponge scaffold for tissue regeneration[J].CarbohydrPolym,2015,128:41-51.
[17]吴海涛,钟翠平,顾云娣.蚕丝在软骨细胞立体培养中的应用[J].中国修复重建外科杂志,2000,14:301-304.
[18]She Z,Jin C,Huang Z,etal.Silk fibroin/chitosan scaffold:preparation,characterization,and culturew ith HepG2 cell[J].JMater SciMaterMed,2008,19:3545-3553.
[19]李欢.明胶、胶原的静电纺丝研究进展[J].明胶科学与技术,2007,27:1-9.
[20]Sio M,WeiT,Ta J.Genipin-crosslinked gelatin scaffolds for articular cartilage tissue engineeringw ith a novel crosslinkingmethod[J].Mater SciEng C,2008,23:36-43.
[21]LlorensE,Calderon S,delValle LJ,etal.Polybiguanide(PHMB)loaded in PLA scaffolds displaying high hydrophobic,biocompatibility and antibacterialproperties[J].Mater SciEng CMater Biol Appl,2015,50:74-84.
[22]李孝红,袁明龙,熊成东.聚乳酸及其共聚物的合成和在生物医学上的应用[J].高分子通报,1999,1:24-32.
[23]黄明华,陈庆华,刘美红,等.组织工程支架材料研究进展及发展趋势[J].材料导报,2006,20:365-368.
[24]Assoian R,Zhu X.Cellanchorageand the cytoskeleton aspartners in grow th factor dependent cell cycle progression[J].Curr Opin Cell Biol,1997,9(1):93-98.
[25]Yang S,Leong K,Du Z,etal.Thedesign ofscaffolds foruse in tissue engineering.Part I.Traditional factors[J].Tissue Eng,2001,7 (6):679-689.
[26]WakeM,Patrick JC,M ikosA.Poremorphology effectson the fibrovascular tissue grow th in porous polymer substrates[J].Cell Transplant,1994,3(4):339-343.
[27]Cima L,Vacanti J,Vacanti C,et al.Tissue engineering by cell transplantation using degradable polymersubstrates[J].JBiomech Eng,1991,113(2):143-151.
[28]Nehrer S,Breinan H,Ramappa A,etal.Matrix collagen type and pore size influence behavior of seeded canine chondrocytes[J]. Biomaterials,1997,18(11):769-776.
[29]BonfieldW.Designing porous scaffolds for tissue engineering[J]. Philos TransactA,2006,364(1838):227-232.
[30]O'Brien FJ,Harley BA,Yannas IV,etal.Theeffectof poresizeon cell adhesion in collagen-GAG scaffolds[J].Biomaterials,2005, 26:433-441.
[31]Zeltinger J,Sherwood J,Graham D,etal.Effectof pore size and void fraction on cellular adhesion,proliferation,and matrix deposition[J].Tissue Eng,2001,7(5):557-572.
[32]ClaaseM,GrijpmaD,MendesS,etal.Porous PEOT/PBT scaffolds for bone tissue engineering:preparation,characterization,and in vitro bonemarrow cell culturing[J].JBiomed Mater Res,2003, 64A(2):291-300.
[33]Tsuruga E,Takita H,Itoh H,etal.Poresizeofporoushydroxyapatite as the cell-substratum controls BMP-induced osteogenesis[J]. JBiochem,1996,2:317-324.
[34]Lowery JL,Datta Nh,RutledgeGC.Effectof fiber diameter,pore sizeand seedingmethod on grow th ofhuman dermal fibroblasts in electrospun poly(3-caprolactone)fibrousmats[J].Biomaterials, 2010,31:491-504.
[35]Klaw itter JJ,HulbertSF.Application ofporous ceramics for theattachmentof load bearing internalorthopedic applications[J].JBiomed MaterRes Symp,1971,2:161-229.
[36]Mooney D,Baldw in D,Suh N,etal.Novel approach to fabricate porous sponges of poly(D,L-lactic-co-glycolic acid)w ithout the useoforganic solvents[J].Biomaterials,1996,17(14):1417-1422.
[37]Colton C.Implantable biohybrid artificial organs[J].Cell Transplant,1995,4(4):415-436.
[38]Cima LG,Cima M J.Tissue regenerationmatrices by solid freeform fabrication techniques[J].US patent,5,518,680.
[39]Green A,Jansen J,Ven dWJ,etal.Fibroblast response tom icrotextured siliconesurfaces:textureorientation intooroutof thesurface[J].JBiomed MaterRes,1994,28:647-653.
[40]Recum A,Shannon C,Cannon C,etal.Surface roughness,porosity,and texture asmodifiers of cellular adhesion[J].Tissue Eng, 1996,2(4):241-253.
[41]Flemm ing R,Murphy C,AbramsG,etal.Effectsofsyntheticm icroand nano-structured surfaces on cell behavior[J].Biomaterials, 1999,20(6):573-588.
[42]Wang J,Huang X,Xiao J,etal.Spray-spinning:A novelmethod formaking alginate/chitosan fibrous scaffold[J].JMater Sci:MaterM,2010,21:497-506.
[43]Seo S,Kim I,ChoiY,etal.Enhanced liver functionsofhepatocytes cocultured w ith NIH3T3 in the alginate/galactosylated chitosan scaffold[J].Biomaterials,2006,27:1487-1495.
[44]费小深,颜永年,熊卓.骨组织工程支架的制造[J].材料导报,2002,16:63-68.
[45]Harris L,Kim B-S,Mooney D.Open porebiodegradablematrices formed w ith gas foam ing[J].J Biomed Mater Res,1998,42: 396-402.
[46]赵瑾,袁晓燕,姚康德.组织工程多孔支架制备技术进展[J].化工进展,2002,21:644-648.
[47]李祥,王成寿.快速成形技术制造组织工程支架研究进展[J].生物工程学报,2008,24:1321-1326.
[48]Madihally S,Matthew H.Porous chitosan scaffolds for tissue engineering[J].Biomaterials,1999,20:1133-1142.
[49]Shao X,Hunter C.Developing an alginate/chitosan hybrid fiber scaffold forannulus fibrosuscells[J].JBiomed MaterResA,2007, 82:701-710.
Three-dim ensionalscaffold in the cultivation of cells
Wang Jianzheng 1,2,Zhu Yuxia2,3.1BiomaterialEngneering Group of Dalian Instituteof Chem icalPhysics,Chinese Academy of Sciences,Dalian Liaoning,116023;2Group of Material Engineering,State Key Laboratory of Bio-fuel Technology forVehicle,Nanyang Henan,473000;3Testing CenterofHenan Tianguan Group Co.,Ltd,Nanyang Henan, 473000,China
The three-dimensional(3D)grow thenvironmentcreated by 3D cellculture can simulate the in vivoenvironment to the greatest extent,and the cells showed a spatial grow th pattern forming organizational structure similar to cells in vivo.Therefore,three-dimensional culture hasbeenw idely used in the research fields such as tissue engineering,drug selection and basic life science.This papermakesa comprehensive review on thebackground of 3D cultivation,the application of 3D culture and the required characteristics of 3D culture scaffolds.
Tissue engineering;2D culture;3D culture;3D culture scaffold
R318
B
1 三维细胞培养的概念
1中国科学院大连化学物理研究所生物医学材料工程组,辽宁大连116023;2车用生物燃料技术国家重点实验室工程材料研究室,河南南阳473000;3河南天冠企业集团试验中心,河南南阳473000模拟体内环境,使细胞呈空间立体生长,并形成类似体内组织的结构,以发挥其功能。因此,三维培养的细胞在基因表达及细胞功能等方面与体内生长的细胞相接近,而与单层培养的细胞有明显差异。此外,三维细胞培养具有直观性及条件可控制性等特点,可以把体外单层细胞培养体系与组织器官及生物体的整体研究联系起来,填补了体内-体外实验之间的鸿沟[1,2]。
10.3969/j.issn.1672-5972.2016.01.019
swgk2015-05-00109
自从德国胚胎学家Wilhelm Roux于1885年从鸡胚中分离细胞并建立体外细胞单层培养(Single-layer cell culture)以来,体外细胞二维培养(Two-dimensionalcellculture)便蓬勃发展起来[1,2]。但是生物医学研究人员越来越意识到了二维细胞培养的局限性。细胞体外培养中最重要的是细胞需要维持其在体内增殖时所具有的性状,但二维培养的细胞会逐渐丧失其原有性状,对其研究的结果与体内试验结果经常不一致。由于体内动物实验耗时长,操作繁琐,试验的中间过程难以完整呈现,因此如何填补单层细胞培养和体内动物实验之间的鸿沟,一直是生命科学家思索的问题。
随着组织工程的兴起,三维细胞培养技术应运而生。不同于传统的二维单层细胞培养模式,三维细胞培养是指将三维支架材料与细胞在体外进行共培养,使细胞在支架上生长、分化和迁移,并形成具有一定组织特异性的三维复合结构[1,2]。三维细胞培养所创建的生长环境,能够最大程度地

