放射性125I粒子植入联合紫杉醇治疗非小细胞肺癌的随访研究*
李 妮,邓泽虎,田福华
(重庆市九龙坡区人民医院肿瘤科 400051)
放射性125I粒子植入联合紫杉醇治疗非小细胞肺癌的随访研究*
李妮,邓泽虎,田福华△
(重庆市九龙坡区人民医院肿瘤科400051)
目的评价放射性125I粒子植入联合紫杉醇(PTX)化疗治疗老年非小细胞肺癌的疗效和安全性。方法回顾性分析2013年6月至2014年8月该院收治的35例非小细胞肺癌患者的临床资料,其中12例仅接受肺肿瘤放射性125I粒子植入治疗(A组),10例接受放射性125I粒子植入治疗后再行PTX联合顺铂(TP方案)化疗(B组),13例仅接受TP方案化疗(C组)。以接受化疗21 d为1个评价周期,每1个周期评价不良反应,每2个周期评价疗效。结果35例患者随访6个月,均可评价不良反应,34例可评价近期疗效。A组未出现明显不良反应,B组、C组的主要不良反应为骨髓抑制和消化道反应,差异均无统计学意义(P>0.05)。化疗4个周期后,A组和B组的有效率分别为66.7%、80.0%,临床获益率分别为83.3%、90.0%,均高于C组的23.1%和53.8%,差异均有统计学意义(P<0.05)。结论放射性125I粒子植入治疗与PTX联合放射性125I粒子植入治疗老年早期非小细胞肺癌,均较单纯PTX化疗的有效率、临床获益率高,且安全、微创、不良反应轻,可有效提高患者的生活质量。
非小细胞肺癌;125I粒子;紫杉醇;顺铂
据文献报道,肺癌的发病率和病死率呈上升趋势,尤其在发展中国家已成为肿瘤患者死亡的主要原因[1]。到2030年,预计全世界将会有800余万人因吸烟相关疾病而死亡,肺癌正是其中之一[2]。来自美国的一项研究表明,近年来青少年吸烟率上升达2倍之多,中年和老年人群的肺癌发病率也在不断上升[3]。有针对中国人群的横断面研究发现,与1996年相比,2002年中国人群总吸烟率有一定程度的降低,但是15~24岁的青少年人群吸烟率却在上升[4]。我国肺癌的病死率近年来增加了约1.5倍,是增长最快的恶性肿瘤。除吸烟、人口老龄化等因素外,医学水平的进步、职业暴露、严重的环境污染等因素作用,最终使肺癌发病率呈增长趋势,病死率的增长极大地威胁着人们的生存质量,而肺癌中约80%为非小细胞肺癌[5]。由于老年人肺功能、肝脏储备能力和肾脏清除功能减退,骨髓造血功能减弱,加上可能同时合并多种慢性病等因素,致使老年肿瘤患者治疗的过程中容易出现复杂多样的临床状况,此外治疗的耐受性差,至今还没有针对老年肺癌的标准治疗方案。因此,对老年肺癌的治疗已成为肿瘤相关研究领域的重要课题[6],目的在于延长生存期的同时兼顾生活质量的提高。本研究回顾性分析放射性125I粒子植入及联合紫杉醇(paclitaxel,PTX)化疗治疗老年非小细胞肺癌的疗效和不良反应,为非小细胞肺癌的临床治疗提供参考依据。
1 资料与方法
1.1一般资料2013年6月至2014年8月本科室收治的非小细胞肺癌患者35例,男20例,女15例;年龄68~85岁,平均(74.0±3.4)岁;其中腺癌22例,鳞癌13例;根据治疗方法将所有患者分为A、B、C 3组,分别为12、10、13例。纳入的所有患者均符合以下标准:(1)患者均在CT引导下经皮穿刺并活检,病理证实为非小细胞肺癌,且为初诊初治,TNM分期为Ⅰ~ⅢA期;(2)预计患者生存期大于或等于3个月,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分小于或等于2分;(3)不接受表皮生长因子受体(epidermal growth factor receptor,EGFR)基因检测;(4)不接受手术治疗及传统放射治疗。3组性别、年龄、肿瘤分型等一般资料比较,差异均无统计学意义(P>0.05)。见表1。

表1 3组一般资料比较
1.2方法
1.2.1治疗方法A组治疗方案:患者按照肺癌的位置,取仰卧位、俯卧位或侧卧位,通过CT扫描病变部位,以确定穿刺点和进针的角度和深度。然后按照早已通过三维治疗计划系统制订的粒子植入路径穿刺至肿瘤内,再次通过CT扫描,确定穿刺针的位置已进入肿瘤。随后通过粒子植入枪将放射性粒子植入体内,每间隔0.5~1.5 cm植入1粒放射性粒子,植入粒子的部位直到肿瘤的外表0.5~1.0 cm处。当植入完成后进行CT扫描,以确认有无冷区,同时观察出血情况、粒子移位、气胸等并发症。如果粒子植入密度过于稀少,应立即补充,直到符合预定的计划为止。术后3 d常规使用抗菌药物,对疼痛、气胸、血胸等并发症进行对症处理。B组治疗方案:同A组方案进行粒子植入治疗,植入术后1周行PTX联合顺铂(cisplatin,DDP)方案(TP方案)化疗,PTX 135~175 mg/m2静脉滴注3 h,第1天同时行抗过敏预处理,DDP 60 mg/m2静脉滴注,第2~3天或第2~4天配合止吐及水化,21 d为1个周期。C组方案:TP方案化疗,PTX 135~175 mg/m2静脉滴注3h,第1天同时行抗过敏预处理,DDP 60 mg/m2静脉滴注,第2~3天或第2~4天配合止吐及水化,21 d为1个周期。根据血常规、肝肾功能及不良反应等情况随时调整化疗药物剂量,并积极对症处理。患者化疗周期限定为6个周期以内,期间出现病情进展或严重不良反应时停止化疗。纳入的所有患者在临床治疗过程中,均仅进行了4个周期的化疗。
1.2.2评价标准(1)近期疗效的评价参照实体肿瘤的疗效评价标准:完全缓解(complete response,CR),即肿瘤全部消失并维持4周以上;部分缓解(partial response,PR),即肿瘤体积消退50%以上并维持4周以上;疾病稳定(stable disease,SD),即肿瘤增大不足25%,减少不足50%,至少维持4周以上;进展(progressive disease,PD),即经CT扫描发现原病灶增大超过25%或有新的病灶出现,新出现胸腔积液、腹水,且癌细胞阳性,也评定为PD。以CR+PR计算有效率(response rate,RR),以CR+PR+SD计算临床获益率(clinical benefit rate,DCR)。(2)不良反应的评价参照世界卫生组织发布的白细胞毒性、血小板毒性、消化道毒性标准进行评级。(3)生活质量(quality of life,QOL)评价以一般状况评分(performance status,PS)表达,以卡氏功能状态量表(KPS)评分为结果判定依据。与治疗前比较,治疗后的KPS评分如果提高大于或等于10分判为改善,KPS评分提高小于10分判为稳定,KPS评分降低大于或等于10分判为恶化。
1.3统计学处理采用SPSS17.0统计软件进行数据分析,计数资料以例数或百分率表示,计算总有效率及临床获益率的95%置信区间(CI),组间比较采用χ2检验或Fisher精确检验方法,以P<0.05为差异有统计学意义。
2 结 果
2.13组近期疗效比较A组12例患者全部按照计划顺利完成粒子植入,术后4个月随访,5例获CR、3例PR、2例SD、2例PD;B组10例全部按照计划顺利完成粒子植入后接受4个周期化疗,5例获CR、3例PR、1例SD、1例PD;C组13例均完成4个周期化疗,1例获CR、2例PR、4例SD,6例PD。术后4个月,A组、B组、C组的RR分别为66.7%、80.0%、23.1%,DCR分别为83.3%、90.0%、53.8%。术后2个月及术后4个月,A组与B组的RR及DCR比较,差异均无统计学意义(P>0.05);而A组、B组与C组比较,差异均有统计学意义(P<0.05)。见表2、3。
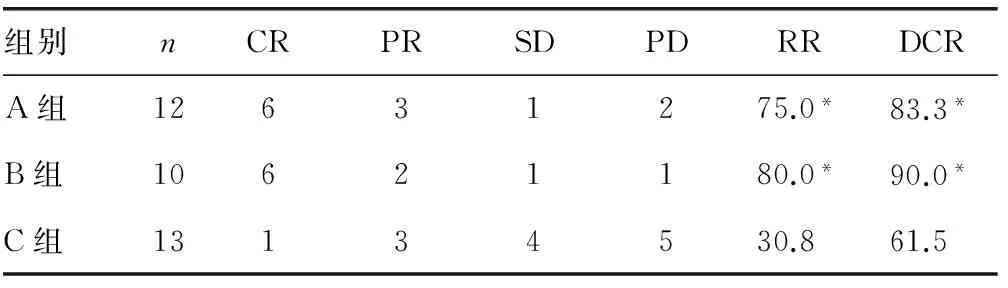
表2 术后2个月3组化疗2个周期后的疗效比较[n(%)]
*:P<0.05,与C组比较。
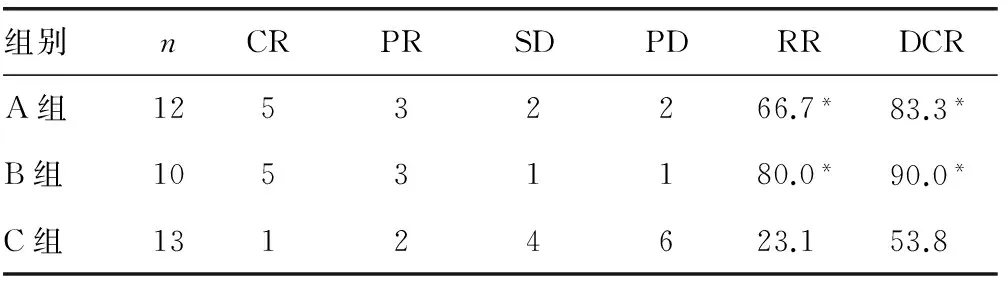
表3 术后4个月3组化疗4个周期后的疗效比较[n(%)]
*:P<0.05,与C组比较。
2.23组不良反应发生率比较35例患者均可评价不良反应。A组12例患者随访6个月,无发热、出血、感染、血象下降、肝肾功能异常,也无植入区域皮肤破溃、窦道形成、器官功能损伤、放射性皮炎、粒子移位等并发症;1例出现少量气胸(肺压缩10%~20%),吸氧治疗后3 d消失;1例出现少量咯血,止血、止咳治疗2 d后症状消失。B组、C组患者中性粒细胞减少、脱发、消化道反应(恶性呕吐)的发生率高于A组,差异有统计学意义(P<0.05)。C组患者消化道反应的发生率稍高于B组(38.50%vs. 30.00%),但差异无统计学意义(P>0.05)。3组患者均未出现肝功能损伤与过敏反应。其余不良反应的发生率,见表4。
2.33组QOL比较根据KPS评分结果,A组治疗后QOL改善10例(83.3%)、稳定l例(8.3%)、恶化1例(8.3%);B组治疗后QOL改善6例(60.0%)、稳定2例(20.0%)、恶化2例(20.0%);C组治疗后QOL改善4例(30.8%)、稳定4例(30.8%)、恶化5例(38.5%)。A组KPS评分优于B组,但差异无统计学意义(P>0.05)。A组KPS评分优于C组,差异有统计学意义(P=0.030 1)。B组KPS评分优于C组,差异无统计学意义(P>0.05)。

表4 3组不良反应发生率比较
*:P<0.05,与A组比较。
3 讨 论
本研究通过对行放射性125I粒子植入治疗、放射性125I粒子植入联合TP方案化疗、TP方案常规化疗的3组患者临床及随访资料进行比较,结果表明,放射性125I粒子植入治疗和联合TP方案化疗的RR和DCR均明显高于常规化疗。提示放射性125I粒子植入治疗与TAX联合放射性125I粒子植入治疗老年非小细胞肺癌,均比单纯TAX联合顺铂化疗的RR和DCR高、不良反应低,可以有效改善患者的QOL,安全性高,值得临床推广应用。
在老年非小细胞肺癌的各种治疗手段中,放疗、化疗是重要的治疗手段,其中被临床广泛应用的是放疗与化疗的综合应用。近年来研究报道显示,采用放射性粒子的临床治疗方案是一种既有效又安全的肿瘤治疗方法。放射性125I粒子是目前临床唯一采用的放射性粒子,其光子能量为27 keV,半衰期为59.6 d[7]。放射性125I粒子应用的最大优势是安全性好,其临床应用不需要特别防护。125I粒子的作用机制为粒子通过电子捕获而衰减,粒子在组织间衰减后,持续释放特征为27.4~31.5 keV的X射线和35.5 keV的γ射线[8]。其中,γ射线具有可以使DNA单链或双链断裂的直接电离作用;X射线则通过间接电离作用而产生氧自由基,可以使肿瘤细胞凋亡,并且可有效抑制肿瘤细胞的增殖。持续低剂量的放射治疗可以增加肿瘤对射线的敏感性,并且能抑制肿瘤细胞的有丝分裂,从而有效杀伤肿瘤细胞[9]。谈瑞生等[10]研究显示,在CT引导下的放射性125I粒子植入作为恶性肿瘤的临床治疗手段,其操作简便、不良反应少、并发症轻,能明显提高患者的QOL。
化疗仍然是非小细胞肺癌的一项重要治疗手段。以顺铂为基础的双药联合化疗方案,可以减轻行为状态良好患者的临床症状,延长生存时间。临床随机对照试验和Meta分析结果表明,全身化疗的疗效明显优于单纯支持治疗,以铂类为基础联合第3代化疗药物的双药联合方案,已成为目前治疗晚期非小细胞肺癌的一线治疗标准方案[11]。与含铂方案相比,非铂类双药联合方案对治疗的RR和生存期改善效果较差,但其不良反应相对较小[12]。国外有多中心随机对照临床试验结果表明,长春瑞滨、TAX和吉西他滨分别与顺铂联合治疗晚期非小细胞肺癌的疗效近似,其RR为30.0%~44.4%,中位生存期为11~17个月,1年生存率为35.0%~61.0%[13-15]。
TAX作为一种活性高的广谱抗肿瘤药,能促进微管蛋白聚合,抑制微管解聚,通过阻滞细胞G2期和M期抑制肿瘤细胞生长。DDP为铂金属络合物,抗癌谱广,骨髓抑制轻,联合用药对多种肿瘤有较好的疗效。有研究报道,以DDP为基础的临床化疗方案能明显提高患者的生存时间,与最佳支持治疗相比,可以增加1.5~2个月的中位生存时间和约10%的1年生存率[16]。陈宝玉等[17]回顾性比较分析TP方案和吉西他滨联合DDP方案(GP方案)治疗70例晚期非小细胞肺癌患者的疗效,结果显示两组RR比较差异无统计学意义(40.0%vs. 42.8%,P>0.05);此外,两组1年生存率比较,差别亦无统计学意义(37.1%vs.34.2%,P>0.05)。Lilenbaum等[18]的随机对照临床试验表明,70岁以上患者的生存情况与低年龄患者相似,生存率及生存质量比较,差异均无统计学意义(P>0.05)。一项针对高龄晚期非小细胞肺癌患者的SWOG0027和LUN6联合化疗研究结果表明,80岁以上的晚期非小细胞肺癌患者具有良好的化疗耐受性,其RR为53%[19]。因此,临床上对一般状态好的患者,应推荐应用铂类为主的联合化疗方案,对于一般状态差的患者,可给予温和的单药化疗[20]。有研究显示,放射性125I粒子植入治疗肺癌,患者治疗后6个月的RR达81.2%~100.0%[21-23]。其中,治疗组患者2、4个月的RR均在90%以上,表明放射性125I粒子对肺癌具有良好的近期治疗效果。
本研究也存在一些不足之处。由于本研究入组病例较少,随访时间较短,所得出的结果存在一定的局限性。因此,仍需扩大样本量进行分层研究,以得出更科学的研究结果,指导临床实践。此外,通过本研究分析,笔者总结了影响各组疗效的可能因素:肿瘤体积是放射性125I粒子植入治疗的影响因素之一。如果肿瘤较大,则需要植入较多的放射性125I粒子,这就会增加穿刺次数。由于容易受到胸廓骨骼的阻挡,放射剂量会受到限制而产生射线剂量不足的现象,必然导致肿瘤坏死不彻底或者继续生长。其次,由于穿刺次数增加,也会导致气胸和咯血等并发症的增加。另外,肿瘤的进展程度、纵隔淋巴结转移与否、患者的基础疾病情况、术者的穿刺水平,以及粒子从生产到植入肿瘤存储的时间等因素同样会影响疗效。2013年12月20日在中国医学论坛报社主办的“放射性粒子植入治疗圆桌会”上,多学科专家指出粒子植入的基础条件是肿瘤直径小于或等于7 cm,肺部粒子植入穿刺所致少量气胸多数不需要处理,待气体自行吸收,少数需穿刺抽气或引流。咯血时应采取患侧卧位,保持健侧肺气道通畅,避免窒息,并深吸氧气,尽量将血完全咳出。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71-96.
[2]Navada S,Lai P,Schwartz AG,et al.Temporal trends in small cell lung cancer: analysis of the National Surveillance,Epidemiology,and End-Results(SEER) database[J].J Clin Oncol,2006,24(18S):384S.
[3]Yang P,Visbal A,Ebbert J,et al.O-058 characteristics of lung cancer patients who were diagnosed younger than 50 or older than 80 years of age[J].Lung Cancer,2005,49(Suppl 2):S22-23.
[4]杨功焕,马杰民,刘娜,等.中国人群2002年吸烟和被动吸烟的现状调查[J].中华流行病学杂志,2005,25(2):5-11.
[5]顾勤花,沈琦斌,李冬,等.非小细胞肺癌化疗的研究进展[J].中国医药,2013,8(12):1811-1812.
[6]张明云,张菁华,李兴德,等.老年肺癌流行病学及临床治疗现状[J].现代肿瘤医学,2010,18(12):2505-2507.
[7] Yoshioka Y.Current status and perspectives of brachytherapy for prostate cancer[J].Int J Clin Onco1,2009,14(1):31-36.
[8]陈文,周运锋.CT导向下125I组织间植入治疗恶性肿瘤的应用进展[J].西部医学,2010,22(6):1126-1127.
[9]Pickett B,Pouliot J.The effect of the radial function on I-125 seeds used for permanent prostate implantationE[J].Med Dosim,2004,29(3):204-209.
[10]谈瑞生,朱永强,施富强,等.CT引导下125I放射性粒子植入治疗恶性肿瘤19例分析[J].重庆医学,2014,43(1):106-109.
[11]Stewart L.Chemotherapy in non--small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials.Non-small Cell Lung Cancer Collaborative Group[J].BMJ,1995,311(7010):899-909.
[12]Rajeswarana A,Trojanb A,Burnand B,et al.Efficacy and side effects of cisplatin- and carboplmin- based doublet chemotherapeutic regimens versus non-platinum-based doublet chemothapeutic regimens as first line tretment of metastatic non-small cell lung carcinoma: asystematic review of randomized controlled trials[J].Lung Cancer,2008,59(1):1-11.
[13]Le Chevalier T,Brisgand D,Pujol JL,et al.Results of a randomized study comparing combination of navelbine-cisplatin to combination of vindesine-cisplatin and to navelbine alone in 612 patients with inoperable non-small cell lung cancer[J].Bull Cancer,1996,83(5):385-394.
[14]Chen CH,Chang WC,Lin MC,et al.Phase II study of paclitaxel (Genaxol) and cisplatin combination in treating Chinese patients with advanced non-small cell lung cancer (NSCLC)[J].Lung Cancer,2002,38(1):91-96.
[15]Bretti S,Manzin E,Loddo C,et al.Gemcitabine plus cisplatin in the treatment of patients with advanced non-small cell lung cancer: a phase II study[J].Anticancer Res,2003,22(5):3039-3043.
[16] Rinaldi M,Cauchi C,Gridelli C.First line chemotherapy in advanced or metastatic NSCLC[J].Ann Onc,2006,17(Suppl5):S64-67.
[17]陈宝玉,房振羽,刘德干,等.紫杉醇联合顺铂与吉西他滨联合顺铂治疗晚期非小细胞肺癌疗效对比研究[J].中国实用医药,2013,8(9):5-6.
[18]Lilenbaum RC,Herndon JE,List MA,et al.Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer: the cancer and leukemia group B (study 9730)[J].J Clin Oncol,2005,23(1):190-196.
[19]Hesketh PJ,Lilenbaum RC,Chansky K,et al.Chemotherapy in patients > or = 80 with advanced non-small cell lung cancer: combined results from SWOG 0027 and LUN 6[J].J Thorac Oncol,2007,2(6):494-498.
[20]吴坚文,李丹,曾波航,等.高龄对老年性晚期非小细胞肺癌化疗效果的影响[J].广东医学,2011,32(17):2282-2284.
[21]何德荣,梁待宁,李瑞忠,等.125I放射性粒子植入治疗中晚期肺癌32例近期疗效[J].中国医学文摘(内科学),2005,26(6):762-763.
[22]庞晨光,马春峰,范海伟,等.碘125放射性粒子植入治疗非小细胞肺癌30例疗效分析[J].医药与保健,2014,14(11):32-32.
[23]张义栋,杨睿,姜睿.58例CT引导下碘-125粒子植入治疗非小细胞肺癌的临床研究[J].家庭心理医生,2014,10(1):69.
Follow-up study of radioactive125I seed implantation combined with paclitaxel in treatment of non-small cell lung cancer*
LiNi,DengZehu,TianFuhua△
(DepartmentofOncology,JiulongpoDistrictPeople′sHospital,Chongqing400051,China)
ObjectiveTo evaluate the efficacy and safety of radioactive125I seed implantation combined with paclitaxel (PTX) for treating senile non-small cell lung cancer(NSCLC).MethodsThe clinical data in 35 patients with NSCLC in our hospital from June 2013 to August 2014 were retrospectively analyzed,including 12 cases receiving the lung tumor radioactive125I seed implantation therapy(group A),10 cases treated with PTX combined with cisplatin (TP scheme) after receiving radioactive125I seed implantation therapy(group B) and 13 cases only conducted TP scheme(group C).The 21 d chemotherapy was a evaluation cycle.The adverse reactions were evaluated after 1 cycle and the curative efficacy was evaluated after 2 cycles.ResultsThirty-five cases were followed up for 6 months.The adverse reactions could be evaluated in all the cases.The short-term efficacy could be evaluated in 34 cases.The group A had no obvious adverse reactions,the main adverse reactions in the group B and C were bone marrow suppression and digestive tract reactions without statistically significant differences(P>0.05).The effective rates after 4 cycles of chemotherapy in the group A and B were 66.7% and 80.0%,the clinical benefit rates were 83.3% and 90.0% respectively,which were higher than 23.1% and 53.8% in the group C respectively,the differences were statistically significant(P<0.05).ConclusionRadioactive125I seed implantation therapy and PTX combined with radioactive125I seed implantation for treating senile early NSCLC are superior to the simple PTX chemotherapy,which have high effective rate and benefit rate,safety,mini-invasion and mild adverse reactions,and can increase the patient′s living quality.
non-small cell lung cancer;125I radioactive seed;paclitaxel;cisplatin
重庆市卫生计生委医学科研项目(2015XMSB000352)。作者简介:李妮(1979-),主治医师,本科,主要从事恶性肿瘤的化疗、靶向治疗、射频治疗及放射性粒子植入治疗临床研究。△
,E-mail:2638860139@qq.com。
R734.2
A
1671-8348(2016)21-2929-04
2016-01-19
2016-04-06)
论著·临床研究doi:10.3969/j.issn.1671-8348.2016.21.015

