高迁移率族蛋白B1及其糖基化终产物受体在系统性红斑狼疮患者中的变化及其临床意义*
潘舒月,朱 勇#,刘 怡,青玉凤,张梦云,蒲梦君,周京国△
(1.成都市第五人民医院风湿免疫科 611130;2.川北医学院附属医院风湿免疫科,四川南充 637000)
高迁移率族蛋白B1及其糖基化终产物受体在系统性红斑狼疮患者中的变化及其临床意义*
潘舒月1,朱勇1#,刘怡1,青玉凤2,张梦云2,蒲梦君2,周京国2△
(1.成都市第五人民医院风湿免疫科611130;2.川北医学院附属医院风湿免疫科,四川南充 637000)
目的探讨高迁移率族蛋白B1(HMGB1)及其糖基化终产物受体(RAGE)在系统性红斑狼疮(SLE)发病中可能的作用。方法采用酶联免疫吸附试验(ELISA)检测52例SLE女性患者(SLE组)及40例体检健康女性(HC组)血浆HMGB1水平;同时采用实时荧光定量PCR(RT-qPCR)检测外周血单核细胞(PBMCs)HMGB1及RAGE mRNA表达水平;并分析SLE患者血浆HMGB1及PBMCs HMGB1、RAGE mRNA水平与临床指标的相关性。结果SLE组患者血浆HMGB1及PBMCs HMGB1 mRNA水平高于HC组,差异均有统计学意义(P<0.01);而PBMCs RAGE mRNA水平比较,差异无统计学意义(P>0.05);Spearman相关性分析显示,SLE患者血浆HMGB1水平与抗核抗体滴度、SLE活动性指数(SLEDAI)评分均呈正相关(P<0.05),与其他临床和实验室指标无明显相关性(P>0.05);HMGB1 mRNA表达水平与RAGE mRNA表达水平、SLEDAI评分均呈正相关(P<0.01,P<0.05),与其他临床和实验室指标无明显相关性(P>0.05)。结论血浆HMGB1及PBMCs HMGB1 mRNA在SLE患者的异常表达提示其可能在SLE的发生、发展中发挥作用,可能参与了SLE的免疫炎症调节。
系统性红斑狼疮;高迁移率族蛋白B1;糖基化终产物受体;炎症
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种可累及全身多系统多器官的自身免疫性结缔组织病,好发于中青年女性,以免疫性炎症为突出表现,常与遗传、性激素、免疫功能紊乱及外界环境等因素有关,发病机制复杂[1-2]。近年来研究发现,高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)是一种重要的炎性介质,在一定条件下可释放至胞外参与机体炎性反应[3]。研究发现其在类风湿性关节炎、干燥综合征、肿瘤等疾病中发挥着重要作用[4-6]。HMGB1在SLE中的作用机制研究,目前国内外尚无统一认识,HMGB1是如何参与SLE的炎症发生过程,HMGB1介导的信号通路是否在其中发挥了重要作用,尚需要更进一步的研究。因此,本课题组对HMGB1及其重要受体糖基化终产物受体(receptor for advanced glycation end products,RAGE)在SLE患者中的变化进行研究,现报道如下。
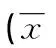
表1 两组一般资料比较±s)
-:无数据。
1 资料与方法
1.1一般资料收集川北医学院附属医院风湿免疫科2012年1~12月门诊或住院的活动期SLE女性患者52例纳入SLE组,年龄18~69岁,平均(37±12)岁;病程1个月至10年,平均(5±3)年。均采用美国SLE活动性指数(SLEDAI)[7]进行评分,分级标准:0~4分,基本无活动;5~9分,轻度活动;10~14分,中度活动;≥15分,重度活动;轻、中、重度活动均纳入。同时收集川北医学院附属医院40例女性体检健康者作为健康对照(healthy control,HC)组,年龄22~62岁,平均(38±15)岁,均无实验室指标异常,均排除其他自身免疫性疾病、感染性疾病及肿瘤疾病。研究程序符合川北医学院附属医院制订的伦理学标准并得到该伦理委员会的批准,且所有受试者均知情同意。
1.2方法
1.2.1常规实验室指标测定实验室常规指标测定均在川北医学院附属医院检验科完成,血细胞分析采用美国Beckman公司生产的LH750血细胞分析仪,血生化仪分析采用美国Beckman公司生产的DxC800全自动生化仪;包括血细胞计数、红细胞沉降率(ESR)、C反应蛋白、肝功能、肾功能、抗核抗体谱等。
1.2.2血浆HMGB1水平测定采集所有研究对象清晨空腹(8 h以上)外周静脉血5 mL(肝素钠抗凝),3 000 r/min离心10 min分离血浆,-20 ℃保存标本。人HMGB1酶联免疫吸附试验(ELISA)试剂盒购自USCN生命科学公司。操作步骤按照说明书:在已包被HMGB1抗体的酶标板上,每孔加入已稀释样品血浆100 μL或100 μL标准品,37 ℃孵育2 h,弃去液体,甩干后加入检测溶液A 100 μL,37 ℃孵育1 h,洗涤液洗板3次,加检测溶液B 100 μL,37 ℃孵育30 min,洗涤液洗板5次,加3,3′,5,5′-四甲基联苯胺(TMB)底物90 μL,37 ℃避光孵育15~25 min,加终止液50 μL,立即在酶标仪上以450 nm为测量波长测定其吸光度(A)值。每个标本均做复孔,取其平均值。根据标准品A值及浓度做标准曲线,得到待测血浆的HMGB1水平。
1.2.3外周血单核细胞(peripheral blood mononuclear cells,PBMCs)总RNA的提取及cDNA的合成人淋巴细胞分离液(天津灏洋生物公司)分离52例SLE患者及年龄与之匹配的40例HC的PBMCs,采用Trizol试剂(美国Invitrogen公司)一步提取PBMCs总RNA,紫外分光光度仪测定A260/A280(1.8~2.0者采用)。取6 μL总RNA,3 μL随机引物,3 μL反录酶ReverTra Ace,5×RT-增强添加剂(RT-Enhancer)1.5 μL,5×RT缓冲液12 μL,三磷酸脱氧核苷酸(dNTP)混合物6 μL,Super-R1 1.5 μL,去RNA酶水(RNase-free H2O)24 μL至总反应体积60 μL,于42 ℃反应60 min,反转录为cDNA,冻存于-80 ℃备用。
1.2.4HMGB1、RAGE及内对照β-肌动蛋白(β-actin)mRNA表达检测采用实时荧光定量PCR(real time quantitative PCR,RT-qPCR)进行检测,用于扩增的引物均由上海生工生物工程公司合成,HMGB1序列:上游引物5′-TTA CAG AGC GGA GAG AGT GAG G-3′,下游引物5′-TGA CAT TTT GCC TCT CGG CT -3′;RAGE序列:上游引物5′-GGC TGG TGT TCC CAA TAA-3′;下游引物5′-CAC AGA TAC TCC CTT CTC ATT-3′;β-actin:上游引物5′-GAG CTA CGA GCT GCC TGA CG-3′;下游引物5′-GTA GTT TCG TGG ATG CCA CAG-3′。HMGB1 PCR产物长度为193 bp,RAGE PCR产物长度为118 bp,β-actin PCR产物长度为120 bp。试剂盒为RT-qPCR试剂盒(成都博瑞克公司),荧光染料试剂盒(Power SYBR Green PCR Master Mix,美国ABI公司),严格遵循说明书,采用20 μL反应体系:包括10 μL Power SYBR Green PCR Master Mix,各0.5 μL 10 pmol/L上下游引物,2 μL cDNA,7 μL双蒸水。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,进行40个循环。每份标本均作复孔,复孔间的Ct值差异控制在0.5以内。所有扩增均在7900 Real-Time PCR仪(美国ABI公司)上进行。以目的基因的Ct值减去内参的Ct值为△Ct,2-△Ct值表示目的基因mRNA表达水平的高低。
2 结 果
2.1两组一般资料比较两组红细胞(RBC)计数、尿酸(UA)、三酰甘油(TG)水平比较,差异均有统计学意义(P<0.05);而年龄、白细胞(WBC)计数及肌酐(Crea)水平比较,差异均无统计学意义(P>0.05)。见表1。
2.2两组血浆HMGB1及PBMCs HMGB1、RAGE mRNA水平比较SLE组患者血浆HMGB1水平与PBMCs HMGB1 mRNA表达水平均高于HC组,差异均有统计学意义(P<0.01); 而两组PBMCs RAGE mRNA表达水平比较,差异无统计学意义(P>0.05),见表2。SLE组52例患者中,36例有肾脏损伤,16例无肾脏损伤,有、无肾脏损伤的SLE患者血浆HMGB1及PBMCs HMGB1、RAGE mRNA表达水平比较,差异均无统计学意义(P>0.05),见表3。
2.3SLE患者血浆HMGB1及PBMCs HMGB1、RAGE mRNA水平与临床指标的相关性SLE患者血浆HMGB1浓度与抗核抗体滴度、SLEDAI评分呈正相关(P均<0.05),与其他临床和实验指标之间无明显相关性(均P>0.05),见表4。
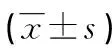
表2 两组血浆HMGB1及PBMCs HMGB1、RAGE mRNA水平比较
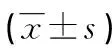
表3 有、无肾脏损伤的SLE患者血浆HMGB1及PBMCsHMGB1、RAGE mRNA水平比较

表4 SLE患者血浆HMGB1、PBMCs HMGB1及RAGEmRNA水平与临床指标的相关性(n=52)
LY:淋巴细胞,TC:总胆固醇;Alb:清蛋白;GLOB:球蛋白;GLU:葡萄糖;ANA:抗核抗体;C3:补体3;C4:补体4;-:无数据。
3 讨 论
SLE是多种自身抗体介导的自身免疫炎性疾病,多种炎性因子及其信号通路参与了SLE疾病的发生、发展过程。HMGB1还是一种核内非组蛋白,参与DNA的组成,其在进化过程中高度保守[8]。近年来发现,HMGB1还是一种新型的强大致炎细胞因子,可通过体内坏死细胞的被动分泌或者受一定刺激的单核细胞等细胞的主动分泌使其在细胞外参与机体的免疫炎性反应[9];HMGB1可以促进多种炎性因子的释放,包括肿瘤坏死因子-α(TNF-α),白细胞介素(IL)-1、IL-6、IL-8等的释放[10]。HMGB1与RAGE、Toll样受体(TRL)2、TRL4、TRL9等受体结合后,形成炎症信号通路的上游部分,活化核因子-κB(NF-κB)等下游信号分子,参与机体的免疫炎性反应过程[11-12];其中RAGE是HMGB1众多受体中较为重要的受体,与HMGB1有很高的亲和力,二者结合后形成炎症信号通路参与机体炎性反应,在多种疾病的发病机制中发挥作用。
本课题组研究发现,SLE组患者血浆HMGB1水平明显高于HC组(P<0.01),且相关性分析发现血浆HMGB1与抗核抗体呈正相关,提示HMGB1可能参与了SLE的免疫炎性反应过程,其有望成为判断SLE炎性反应的一项新指标。通过RT-qPCR本课题发现,SLE组患者PBMCs HMGB1 mRNA表达水平明显高于HC组(P<0.01)。而SLE组患者PBMCs RAGE mRNA表达水平高于HC组,但差异无统计学意义(P>0.05),造成该结果原因可能是:(1)样本量不足,加大样本量有可能得到不同的结果;(2)HMGB1参与SLE的炎性反应过程可能不是重点通过HMGB1-RAGE结合后形成的信号通路发挥作用,而是借助于其他炎症信号通路参与SLE的发病机制。Lutterloh等[12]研究发现,HMGB1诱导巨噬细胞和中性粒细胞NF-κB的活化可通过TLR2和TLR4受体与HMGB1结合后形成的炎症信号通路;Tian等[10]与Urbonaviciute等[13]发现,在SLE发病机制中,HMGB1-DNA免疫复合物起着重要作用,而该复合物的产生主要依赖TRL如TRL2、TRL4、TRL9等。此外,文献[14-17]研究发现,HMGB1通过与TRL、RAGE受体结合后参与系统性红斑狼疮肾炎的发病。本次研究发现系统性红斑狼疮肾炎患者血浆HMGB1及PBMCs HMGB1、RAGE mRNA水平与无肾脏损伤患者比较,差异均无统计学意义(P>0.05),可能是由于样本量不足导致,加大样本量可能会得到不同结果,但笔者更倾向于在系统性红斑狼疮肾炎的发病过程中,HMGB1参与其发病过程更多是通过与TRL等HMGB1相关受体结合后,参与系统性红斑狼疮肾炎的免疫炎性反应过程。通过以上研究笔者推断在SLE的发病过程中,HMGB1可能更多的是与TRL结合形成炎症信号通路,活化下游信号通路分子,参与机体的免疫炎性反应过程,RAGE在HMGB1参与SLE发病过程中可能起次要作用或者不起作用,该推论有待做进一步证实。
综上所述,活动期SLE患者血浆HMGB1及PBMCs HMGB1 mRNA的异常高表达提示,HMGB1可能参与了SLE的炎性免疫反应过程。然而HMGB1如何介导SLE的发病,是单独参与或是HMGB1与其受体结合后形成免疫炎症信号通路参与SLE的发生与发展,还有待后期从蛋白质水平及HMGB1其他相关受体方面做进一步的深入研究,以明确SLE的发病机制,为SLE的治疗提供新方向。
[1]D′cruz DP,Khamashta MA,Hughes GR.Systemic lupus erythematosus[J].Lancet,2007,369(9561):17-23.
[2]Abdulahad DA,Westra J,Bijzet JA,et al.High mobility group box 1(HMGB1) and anti-HMGB1 antibodies and their relation to disease characteristics in systemic lupus erythematosus[J].Arthritis Res Ther,2011,13(3):R71.
[3]Andersson U,Tracey KJ.HMGB1 is a therapeutic target for sterile inflammation and infection[J].Annu Rev Immunol,2011(29):139-162.
[4]Ek M,Popovic K,Harris HE,et al.Increased extracellular levels of the novel proinflammatory cytokine high mobility group box chromosomal protein 1 in minor salivary glands of patients with Sjögren′s syndrome[J].Arthritis Rheum,2006,54(7):2289-2294.
[5]Urbonaviciute V,Fürnrohr BG,Weber C,et al.Factors masking HMGB1 in human serum and plasma[J].J Leukoc Biol,2007,81(1):67-74.
[6]李焱,蒋勇,史立群,等.HMGB1和VEGF-C/D在结肠癌组织中的表达及与淋巴结转移之间的关系[J].第三军医大学学报,2006,28(11):1237-1239.
[7]Bombardier C,Gladman DD,Urowitz MB,et al.Derivation of the SLEDAI.A disease activity index for lupus patients.The Committee on Prognosis Studies in SLE[J].Arthritis Rheum,1992,35(6):630-640.
[8]Müller S,Ronfani L,Bianchi ME.Regulated expression and subcellular localization of HMGB1,a chromatin protein with a cytokine function[J].J Intern Med,2004,255(3):332-343.
[9]Scaffidi P,Misteli T,Bianchi ME.Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J].Nature,2002,418(6894):191-195.
[10]Tian J,Avalos AM,Mao SY,et al.Toll-like receptor 9-dependent activation by DNA-containing immune complexes is mediated by HMGB1 and RAGE[J].Nat Immunol,2007,8(5):487-496.
[11]Palumbo R,Galvez BG,Pusterla T,et al.Cells migrating to sites of tissue damage in response to the danger signal HMGB1 require NF-kappa B activation[J].J Cell Biol,2007,179(1):33-40.
[12]Lutterloh EC,Opal SM,Pittman DD,et al.Inhibition of the RAGE products increases survival in experimental models of severe sepsis and systemic infection[J].Crit Care,2007,11(6):R122.
[13]Urbonaviciute V,Fürnrohr BG,Meister S,et al.Induction of inflammatory and immune responses by HMGB1-nucleosome complexes: implications for the pathogenesis of SLE[J].J Exp Med,2008,205(13):3007-3018.
[14]刘淑霞,郭惠芳,张玉军,等.高迁移率族蛋白及其TOLL样受体4在系统性红斑狼疮肾脏损害中的作用[J].中国免疫学杂志,2008,24(10):948-951.
[15]刘淑霞,郝军,郭惠芳,等.HMGB1/TLR/NF-κB在狼疮性肾炎小鼠肾组织中的表达及意义[J].中国免疫学杂志,2009,25(5):450-453.
[16]Huttunen HJ,Fages C,Rauvala H.Receptor for advanced glycation end products (RAGE)-mediated neurite outgrowth and activation of NF-kappa B require the cytoplasmic domain of the receptor but different downstream signaling pathways[J].J Biol Chem,1999,274(28):19919-19924.
[17]易华.HMGB1及其配体RAGE在狼疮肾炎中的表达和相关性研究[D].长沙:中南大学,2011.
Change and clinical significance of high mobility group protein B1 and its advanced glycation end product receptor in patients with systemic lupus erythematosus*
PanShuyue1,ZhuYong1#,LiuYi1,QingYufeng2,ZhangMengyun2,PuMengjun2,ZhouJingguo2△
(1.DepartmentofRheumatology,ChengduMunicipalFifthPeople′sHospital,Chengdu,Sichuan611130,China;2.DepartmentofRheumatology,AffiliatedHospitaltoNorthSichuanMedicalCollege,Nanchong,Sichuan637000,China)
ObjectiveTo investigate the possible role of high mobility group box 1 protein (HMGB1) and its advanced glycation end products receptor (RAGE) in the pathogenesis of systemic lupus erythematosus (SLE).MethodsThe enzyme-linked immunosorbent assay (ELISA) was used to determine the level of plasma HMGB1 in 52 cases of SLE (SLE group) and 40 healthy females undergoing physical examination (HC group),at the same time real time quantitative polymerase chain reaction (RT-qPCR) was employed to detect the expression of HMGB1 and RAGE mRNA in peripheral blood mononuclear cells(PBMCs).The correlation between plasma HMGB1,PBMCs HMGB1 and RAGE mRNA levels with clinical indicators was analyzed.ResultsThe levels of plasma HMGB1,PBMCs HMGB1 mRNA in the SLE group were significantly higher than those in the HC group,the differences were statistically significant(P<0.05),while the level of PBMCs RAGE mRNA had no statistical difference(P>0.05);the Spearman correlation analysis showed that the level of plasma HMGB1 was positively correlated with antinuclear antibodies titers and SLEDAI score in the SLE patients(P<0.01),while had no obvious correlation with the other clinical and laboratory indicators(P>0.05); the HMGB1 mRNA expression level was positively correlated with the RAGE mRNA expression level and SLEDAI scores(P<0.01,P<0.05),and had no obvious correlation with other clinical and laboratory indicators(P>0.05).ConclusionThe abnormal expression of plasma HMGB1 and PBMCs HMGB1 mRNA in SLE patients prompts that which might be involved in the occurrence and development of SLE,might participate in the immune and inflammatory regulation of SLE.
systemic lupus erythematosus;high mobility group box 1 protein;receptor for advanced glycation end products;inflammation
四川省省属高校科研创新团队资助项目(14TD0021)。#共同第一作者。作者简介:潘舒月(1988-),住院医师,硕士,主要从事风湿免疫学研究;朱勇(1968-),副主任医师,本科,主要从事风湿免疫学研究。△
,E-mail:jgzhou@nsmc.edu.cn。。
R392.32
A
1671-8348(2016)21-2922-04
2016-01-11
2016-03-29)
论著·临床研究doi:10.3969/j.issn.1671-8348.2016.21.013

