miR-21对人喉鳞癌细胞Hep2迁移侵袭能力的影响
刘永军,管艳飞,常 顺
(云南省第一人民医院:1.耳鼻喉科;2.神经外科,昆明 650032)
miR-21对人喉鳞癌细胞Hep2迁移侵袭能力的影响
刘永军1,管艳飞1,常顺2△
(云南省第一人民医院:1.耳鼻喉科;2.神经外科,昆明 650032)
目的探讨微小RNA-21(miR-21)对人喉鳞癌细胞Hep2迁移、侵袭能力的影响。方法用脂质体LipofectamineTM2000将miR-21抑制剂和miR-21 NC转入人喉鳞癌细胞Hep2中,48 h后,运用四甲基偶氮唑蓝(MTT)比色法检测细胞活力,划痕实验检测细胞迁移能力,Transwell小室法检测细胞侵袭能力,蛋白质印迹法检测人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)/磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)的激活情况,以及基质金属蛋白酶(MMP)2、MMP9与伴有kazal域的富含半胱氨酸的逆转诱导蛋白(RECK)的表达。结果与miR-21 NC比较,miR-21 抑制剂能明显降低Hep2细胞活力[(0.688±0.043)vs.(0.375±0.012)],抑制细胞迁移能力[(6.57±0.02)μmvs.(20.49±2.18)μm]及细胞侵袭能力[(100.7±10.2)vs.(46.8±4.3)],差异均有统计学意义(P<0.01);同时miR-21 抑制剂能明显下调PI3K、MMP2及MMP9的表达(P<0.01),降低Akt的磷酸化水平(P<0.01),并上调PTEN及RECK的表达(P<0.01)。结论miR-21 抑制剂能明显抑制人喉鳞癌细胞Hep2的迁移、侵袭能力,可能与PTEN/PI3K/Akt信号通路有关。
微小RNA-21;人喉鳞癌Hep2细胞;迁移;侵袭
喉鳞癌是我国常见的头颈部恶性肿瘤,占头颈部肿瘤的14%左右,其中喉鳞状细胞癌是其主要病理类型,占90%以上。喉鳞癌的主要治疗方式为手术治疗,辅以化疗和放射治疗,但对中晚期患者预后及5年生存率效果欠佳,主要原因是恶性肿瘤的侵袭转移,并最终导致患者死亡[1-2]。而且喉鳞癌的发病机制尚未清楚,吸烟、饮酒、病毒感染、空气污染及癌基因的激活与抑癌基因的失活都可能是其病因[1]。微小RNA(microRNA,miRNA)是目前新发现的一类癌基因或抑癌基因,并与肿瘤的发生、发展密切相关,在肿瘤的增殖、凋亡、侵袭转移中起重要作用[3]。已证实微小RNA-21(microRNA-21,miR-21)是唯一一个在已检测的恶性肿瘤中均表达上调的miRNA,在肿瘤中发挥着癌基因作用[4-5]。此外,通过miRNA芯片技术也证实48对喉鳞状细胞癌标本中包括miR-21在内的4个miRNA表达水平上调[6]。同时也发现喉鳞状细胞癌患者血清miR-21表达水平明显过高,并与淋巴结转移密切相关,且可作为喉鳞状细胞癌标记物及预后的独立因子[7]。充分说明miR-21在喉鳞癌中过表达,并与喉鳞癌的发生、发展密切相关。因此,探讨miR-21在喉鳞癌发生、发展过程中的作用,具有重要的理论意义。所以,本研究拟通过下调人喉鳞癌细胞Hep2中miR-21的表达,探讨其对Hep2细胞迁移、侵袭能力的影响及具体机制,从而为喉鳞癌的早期诊断及预后判断提供新思路。
1 材料与方法
1.1细胞株来源人喉鳞癌细胞Hep2购自中国科学院细胞库(目录号:TCHu21)。
1.2仪器与试剂四甲基偶氮唑盐(MTT,美国Gibco公司),miR-21抑制剂和miR-21 NC(上海吉玛制药技术有限公司);张力蛋白同源的基因(PTEN),磷脂酰肌醇3激酶(PI3K),蛋白激酶B(Akt),伴有kazal域的富含半胱氨酸的逆转诱导蛋白(RECK),基质金属蛋白酶(MMP)2,MMP9(美国Epitomics公司);胎牛血清,达氏修正依氏培养基(DMEM,美国Hyclone公司);三磷酸甘油醛脱氢酶(GADPH,碧云天生物技术有限公司)。迷你双垂直电泳仪,迷你转印电泳仪(北京六一仪器厂);ChemiDocTM XRS凝胶成像系统(美国Bio-Rad公司),TS100倒置显微镜(日本Nikon公司)。
1.3方法
1.3.1MTT比色法检测Hep2细胞活力将人喉鳞癌细胞Hep2接种于96孔板,当细胞汇合度达到50%时,用LipofectamineTM2000分别转染miR-21 抑制剂和miR-21 NC。48 h后,加入5 mg/mL MTT 20 μL,继续培养4 h后吸弃培养液,每孔加入二甲基亚砜(DMSO)150 μL,震荡使结晶物充分溶解,于酶标仪560 nm处测吸光度值(A值),以A值表示细胞相对活力。
1.3.2划痕实验将人喉鳞癌细胞Hep2接种于6孔板,当细胞汇合度达到50%时,用移液器枪头沿培养板底部呈“一”字型划痕单层细胞,用磷酸盐缓冲液(PBS)洗涤被刮下的细胞,更换培养基后,用LipofectamineTM2000分别转染miR-21 抑制剂和miR-21 NC。48 h后,倒置显微镜下观察Hep2细胞向划痕区域的迁移距离并拍照。
1.3.3Transwell侵袭实验将基质胶(matrigel)均匀平铺于Transwell小室的微膜(8 μm)上,制成凝胶备用。将人喉鳞癌细胞Hep2接种于6孔板,当细胞汇合度达到50%时,用LipofectamineTM2000分别转染miR-21 抑制剂和miR-21 NC。48 h后,将细胞消化加入Transwell上室,下室用含5%胎牛血清的DMEM培养基,继续培养24 h,取出Transwell小室,洗涤,多聚甲醛固定,结晶紫染色,被染色的细胞质呈紫色,倒置光学显微镜下计数5个视野穿膜细胞个数,计算平均每个视野的细胞数,即表示细胞的侵袭能力。每组实验重复3次。
1.3.4蛋白质印迹法(Western blotting)将人喉鳞癌细胞Hep2接种于6孔板,当细胞汇合度达到50%时,用LipofectamineTM2000分别转染miR-21 抑制剂和miR-21 NC。48 h后消化收集细胞,加入放射免疫沉淀分析(RIPA)裂解液,每隔10 min置于涡旋仪中震荡30 s,40 min后4 ℃ 10 000 r/min离心10 min,小心吸取上清液,即可获得总蛋白。根据二喹啉甲酸(BCA)试剂盒对蛋白浓度进行测定。蛋白上样,进行十二烷基硫酸钠(SDS)凝胶电泳,后湿法转膜。将膜浸入一抗溶液孵育,4 ℃过夜;漂洗后,浸入二抗溶液中室温孵育1~2 h。将膜取出漂洗,在膜上滴加电化学发光(ECL)曝光液,在凝胶成像系统中曝光。用Quantity One软件对各抗体条带灰度值进行统计。
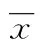
2 结 果
2.1miR-21 抑制剂对人喉鳞癌Hep2细胞活力的影响Hep2细胞转染miR-21 抑制剂和miR-21 NC 48 h后,经MTT比色法发现,细胞转染miR-21 抑制剂其A值(0.375±0.012)低于转染miR-21 NC的(0.688±0.043),差异有统计学意义(P<0.01),表明miR-21 抑制剂能明显抑制Hep2细胞活力。
2.2miR-21 抑制剂对人喉鳞癌Hep2细胞迁移侵袭能力的影响与miR-21 NC比较,miR-21 抑制剂能明显抑制人喉鳞癌Hep2细胞的迁移、侵袭能力,差异均有统计学意义(P<0.01)。见图1、2及表1。
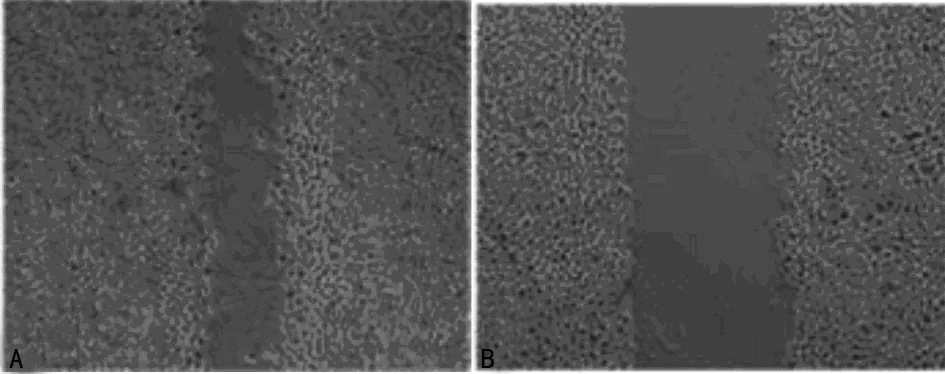
A:miR-21 NC;B:miR-21 抑制剂。
图1miR-21 抑制剂对人喉鳞癌Hep2细胞迁移能力的影响(×100)

A:miR-21 NC;B:miR-21 抑制剂。
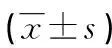
图2 miR-21 抑制剂对人喉鳞癌Hep2细胞侵袭能力的影响(结晶紫染色,×200)
*:P<0.01,与miR-21 NC比较。
2.3miR-21 抑制剂对人喉鳞癌Hep2细胞中MMPs及RECK蛋白表达的影响与miR-21 NC比较,miR-21 抑制剂能明显下调人喉鳞癌Hep2细胞中MMP2、MMP9的表达,上调RECK的表达,差异均有统计学意义(P<0.01)。见图3、表2。
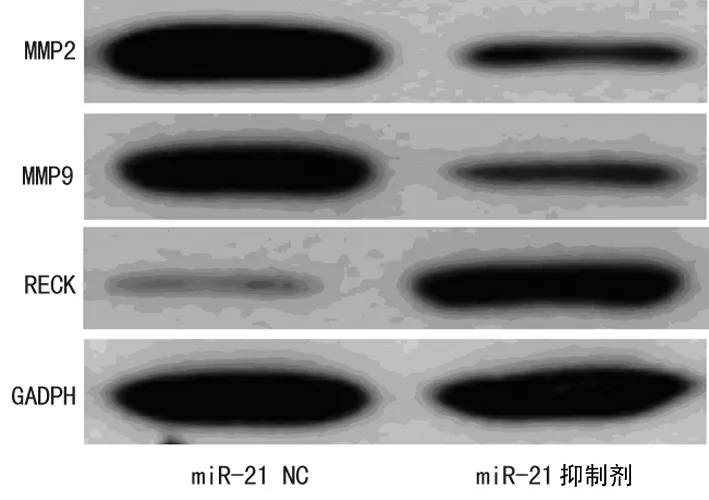
图3 miR-21 抑制剂对人喉鳞癌Hep2细胞中MMPs及RECK蛋白表达的影响

组别MMP2/GADPHMMP9/GADPHRECK/GADPHmiR-21NC1.089±0.0840.997±0.0780.283±0.010miR-21抑制剂0.342±0.020*0.305±0.026*0.975±0.064*
*:P<0.01,与miR-21 NC比较。
2.4miR-21 抑制剂对人喉鳞癌Hep2细胞中PTEN/Akt信号通路的影响与miR-21 NC比较,miR-21 抑制剂能明显下调人喉鳞癌Hep2细胞中PI3K的表达及Akt磷酸化水平,上调PTEN的表达,差异均有统计学意义(P<0.01)。见图4、表3。

图4 miR-21 抑制剂对人喉鳞癌Hep2细胞中PTEN/Akt信号通路的影响

组别PTEN/GADPHPI3K/GADPHp-Akt/AktmiR-21NC0.287±0.0110.502±0.0461.007±0.104miR-21抑制剂1.009±0.097*0.133±0.012*0.169±0.020*
*:P<0.01,与miR-21 NC比较。
3 讨 论
miRNAs是一类进化上高度保守的内源性非编码小分子RNA,它能够结合于靶基因mRNA的3′-UTR区域,阻遏靶基因的翻译,从而抑制靶基因表达。miR-21是2001年在非脊椎动物和脊椎动物中发现的第一个miRNA,随后在小鼠的神经元细胞及Hela细胞中也分别检测到,其具有较强的组织特异性,与多种实体肿瘤的发生、发展密切相关,在喉鳞癌中也表达异常,并呈上调趋势。如Kalfert等[5]对51例头颈部鳞状细胞癌组织(23例咽癌、24例喉癌、4例鼻咽癌)及正常鳞上皮组织进行实时荧光定量PCR(RT-PCR)分析,结果发现miR-21在所有癌组织中表达水平都明显上调。Cao等[6]进一步通过miRNA芯片也证实48对喉鳞状细胞癌标本中包括miR-21在内的4个miRNA表达水平上调。Wang等[7]检测52例喉鳞状细胞癌患者及52例声带息肉患者血清中miR-21的表达,发现喉鳞状细胞癌患者血清miR-21表达水平明显过高,并与淋巴结转移密切相关,其可作为喉鳞状细胞癌标记物及预后的独立因子。此外,Liu等[8]也证实喉鳞癌中miR-21过表达,且高表达的miR-21与临床分期、病理分化及淋巴结转移密切相关,说明miR-21在喉鳞癌细胞中起致癌miRNA的作用,并与喉癌淋巴结转移密切相关。因此,本研究在此基础上探讨miR-21对人喉鳞癌细胞Hep2迁移、侵袭的作用。
Reis等[9]证实RECK是miR-21的下游靶基因,miR-21能靶向下调RECK,且RECK的低表达导致了MMP9的高表达,从而促进胰腺癌细胞的侵袭。左文娜[10]证实RECK在喉癌组织中低表达,并与喉癌的发生、发展、分化及淋巴结转移密切相关。RECK是一种新型的MMPs抑制剂,可在转录后水平明显抑制多种MMPs的表达,从而抑制肿瘤的侵袭转移及血管生成。MMPs是降解细胞外基质的最重要的蛋白水解酶,其中MMP2不仅可以降解细胞外基质中的明胶Ⅳ型胶原等,还可以通过新生毛细血管促进肿瘤的侵袭及转移。MMP9是MMPs中相对分子质量最大的酶,能够降解细胞外基质和基底膜,从而增加细胞的运动能力,促进肿瘤的扩散和转移。吴春芳等[11]证实,MMP2在喉癌组织中的阳性率明显高于癌旁组织,并与分化程度及临床分期密切相关。刘玉东等[12]证实MMP9在喉癌组织中的阳性率明显高于癌旁组织,并与肿瘤的发生、发展密切相关。因此,上调RECK表达,下调MMP2及MMP9的表达,能在一定程度上抑制细胞外基质破坏,抵抗肿瘤细胞侵袭。本研究结果恰好证实了miR-21 抑制剂可以明显地上调RECK的表达,下调MMP2及MMP9的表达,从而抑制Hep2细胞的侵袭、迁移能力。
肿瘤的侵袭、转移等生物学行为与多种信号通路有关,PTEN/PI3K/Akt就是其中的一种。已证实PTEN是miR-21的下游靶基因,PTEN在在众多肿瘤中表达缺失或突变。PTEN在喉鳞癌中低表达,并与肿瘤分期、肿瘤范围及淋巴结转移密切相关,且miR-21与PTEN呈负相关[8]。PTEN能将三磷酸磷脂酰肌醇(PIP3)去磷酸化为二磷酸脂酰肌醇(PIP2),从而负调控PI3K/Akt信号通路,负调节细胞生长、凋亡、迁移侵袭等生物学行为。PI3K/Akt信号通路与多种人类肿瘤的发生、发展密切相关,能通过下游多种靶蛋白表达,从而参与调控肿瘤细胞的生长、凋亡、周期调控,血管生成,侵袭转移等过程。已报道,PI3K/Akt在喉鳞癌中异常激活[13]。孙吉春等[14]证实,miR-21 抑制剂能明显抑制PTEN/PI3K/Akt信号通路,从而抑制胰腺癌细胞的侵袭转移。miR-21 抑制剂能明显抑制人舌鳞状细胞癌的增殖及侵袭能力[15]。本研究结果也表明,miR-21 抑制剂能明显上调PTEN表达水平,下调PI3K表达水平及Akt磷酸化水平。从而说明,miR-21能通过PTEN/PI3K/Akt信号通路影响喉鳞癌Hep2细胞的迁移、侵袭能力。
综上所述,miR-21 抑制剂能明显抑制人喉鳞癌细胞Hep2的迁移、侵袭能力,可能与上调RECK表达,下调MMPs表达,以及PTEN/PI3K/Akt信号通路失活有关。
[1]骆文龙.喉癌治疗的进展和相关问题[J].重庆医学,2007,36(12):1119-1120.
[2]Zhang W,Liu Y,Wang CW.S100A4 promotes squamous cell laryngeal cancer Hep-2 cell invasion via NF-kB/MMP-9 signal[J].Eur Rev Med Pharmacol Sci,2014,18(9):1361-1367.
[3]张经波,汪荣泉.mir-21的转录调控及在肿瘤中的作用研究进展[J].重庆医学,2012,41(31):3336-3337.
[4]Volinia S,Calin GA,Liu CG,et al.A microRNA expression signature of human solid tumors defines cancer gene targets[J].Proc Natl Acad Sci U S A,2006,103(7):2257-2261.
[5]Kalfert D,Pesta M,Kulda V,et al.MicroRNA profile in site-specific head and neck squamous cell cancer[J].Anticancer Res,2015,35(4):2455-2463.
[6]Cao PY,Zhou L,Zhang J,et al.Comprehensive expression profiling of microRNAs in laryngeal squamous cell carcinoma[J].Head Neck,2013,35(5):720-728.
[7]WangJT,ZhouYD,LuJ,etal.Combined
detection of serum exosomal miR-21 and HOTAIR as diagnostic and prognostic biomarkers for laryngeal squamous cell carcinoma[J].Med Oncol,2014,31(9):148.
[8]Liu J,Lei DP,Jin T,et al.Altered expression of miR-21 and PTEN in human laryngeal and hypopharyngeal squamous cell carcinomas[J].Asian Pac J Cancer Prev,2011,12(10):2653-2657.
[9]Reis ST,Pontes-Junior J,Antunes AA,et al.miR-21 may acts as an oncomir by targeting RECK,a matrix metalloproteinase regulator,in prostate cancer[J].BMC Urol,2012(12):14.
[10]左文娜.回复引导半胱氨酸丰富蛋白Kazal基元、基质金属蛋白酶-14、内皮抑素及血管内皮生长因子在喉癌中的表达及相关性研究[J].中国现代医学杂志,2015,25(23):71-75.
[11]吴春芳,李海洲,李富.喉癌组织中Survivin、MMP-2的表达、临床意义及相关性研究[J].中国当代医药,2015,25(1):8-11.
[12]刘玉东,冯帅,甄娟,等.S100A4与MMP-9在喉鳞癌中的表达和相关性研究[J].中国肿瘤临床,2011,38(24):1547-1550.
[13]杨大志,姬长友.PI3K、p-Akt蛋白在喉鳞癌中的表达及临床意义[J].第三军医大学学报,2007,29(10):935-937.
[14]孙吉春,黄飞舟,聂晚频,等.MiR-21通过PTEN/PI3K/AKT信号通路抑制胰腺癌细胞系生长侵袭能力的体外研究[J].中国现代医学杂志,2015,25(12):39-44.
[15]Wang Y,Zhu Y,Lv P,et al.The role of miR-21 in proliferation and invasion capacity of human tongue squamous cell carcinoma in vitro[J].Int J Clin Exp Pathol,2015,8(5):4555-4563.
Effect of miR-21 on migration and invasion ability in human laryngeal squamous carcinoma cell Hep2
LiuYongjun1,GuanYanfei1,ChangShun2△
(1.DepartmentofEarNoseThroat;2.DepartmentofNeurosurgery,YunnanProvincialFirstPeople′sHospital,Kunming,Yunnan650032,China)
ObjectiveTo explore the effect of microRNA-21(miR-21) on the migration and invasion ability in human laryngeal squamous carcinoma cell Hep2.MethodsThe MTT method was used to detect the viability of Hep2 cells at 48 h after miR-21 inhibitor and miR-21 NC transferring into Hep2 cells by LipofectamineTM2000.The cell migration ability was detected by using the scratch test.The cell invasion ability was detected by using the Transwell method.The activation of phosphatase and tensin homologue deleted on chromosome 10 (PTEN)/ phosphatidylinositol 3 kinase (PI3K) / protein kinase B(Akt) signal pathway and the expression of matrix metalloproteinase 2 (MMP2),MMP9,reversion inducing cysteine rich protein with kazal motif (RECK) was detected by using the Western blotting.ResultsCompared with miR-21 NC,miR-21 inhibitor could significantly reduce the Hep2 cell viability[(0.688±0.043)vs.(0.375±0.012)],inhibited the migration ability[(6.57±0.02)μmvs.(20.49±2.18) μm] and invasion ability[(100.7±10.2)vs.(46.8±4.3)],and the differences were statistically significant(P<0.01),meanwhile miR-21 inhibitor could down-regulate the expression of PI3K,MMP2 and MMP9(P<0.01),and reduced the phosphorylation level of Akt (P<0.01),up-regulated the expression of PTEN and RECK (P<0.01).ConclusionmiR-21 inhibitor can significantly suppress the migration and invasion ability of Hep2,which may be related with the PTEN/PI3K/Akt signal pathway.
microRNA-21;human laryngeal squamous carcinoma cell Hep2;migration;invasion
刘永军(1983-),住院医师,硕士,主要从事耳鼻喉头颈外科相关研究。△
,E-mail:stone1983712@163.com。
R739.65
A
1671-8348(2016)21-2906-03
2016-01-08
2016-03-26)
论著·基础研究doi:10.3969/j.issn.1671-8348.2016.21.008

