抗癌液联合FOLFOX方案治疗大肠癌的临床研究
刘全林 郭孝然 巩跃生
抗癌液联合FOLFOX方案治疗大肠癌的临床研究
刘全林郭孝然巩跃生
河南中医学院附属肛肠病医院大肠外科(郑州 450004)
摘要:目的观察抗癌液联合FOLFOX方案治疗大肠癌的近期疗效、不良反应和生存期。方法将84例大肠癌患者根据治疗方法分为A组和B组,A组52例服用FOLFOX方案加口服抗癌液治疗,B组32例服用FOLFOX方案治疗,6周期后评价疗效,不良反应每周评价一次,随访观察疾病进展时间,总生存期。结果A组近期客观有效率RR ( CR+PR ) 56.3%,B组37.5%,P<0.05;中位疾病进展时间(TTP)为26周,P<0.05;中位生存期(OS )3年( P<0.05 )、5年( P<0.01 ),不良反应(P<0. 05),均有统计学差异。结论抗癌液具有消积止痛、清热利湿、抑瘤减毒作用。
关键词:抗癌液;大肠癌;FOLFOX方案;OS;TTP
大肠癌是结直肠黏膜和腺体发生的恶性肿瘤,是结肠癌、直肠癌和肛管癌的总称。大肠癌的发病部位以直肠约占50%,乙状结肠约占20%,盲肠约占16%,横结肠和降结肠约占6%,其他为同时多原发癌约占8%。大肠癌的发生是极其复杂的,是多个因素和多个步骤以及多个途径交互作用于结直肠干细胞,经诱导、促进及演进癌细胞等多阶段导致的结果。目前认为大肠癌的发生机制主要是肠道干细胞发生突变引起的[1]。
大肠癌的治疗以外科手术为主,如不易进行根治性切除也要考虑姑息性切除,根据具体情况制定个体化治疗方案。中医药的优势是整体观念和辨证论治,随着新的抗癌药物不断涌现,治疗方案不断优化,大肠癌的综合治疗将是未来抗癌的趋势。现将自2010年7月—2013年12月在本院治疗的84例大肠癌患者进行抗癌液联合FOLFOX方案治疗的结果作一个回顾性的研究总结。
1 资料与方法
1.1入选条件①经病理确诊的大肠癌;②年龄25~75岁,KPS评分≧60分;③有明确的可观测病灶,可经螺旋CT检测病灶大小;④未经化疗,手术后达到临床痊愈,时间距入组时间需在3周左右;⑤血常规、肝肾功能、心电图正常;⑥预期生存时间>3个月。
1.2治疗方法A组服用FOLFOX方案:草酸铂100~130 mg/m2, d1, iv drop,亚叶酸钙200 mg/m2, dl, iv drop, 5-FU 2400~2800 mg/m2, dl, 46h持续iv drop。每3周为一周期。间隔期服用抗癌液治疗:黄芪30 g,党参20 g,土茯苓15 g,白花蛇舌草12 g,败酱草9 g,三棱12 g,莪术12 g,炙甘草6 g。每日1剂,水煎取汁400 ml,分2次餐后温服。每3周为一疗程;B组: FOLFOX方案:草酸铂100~130 mg/m2, d1, iv drop,亚叶酸钙200 mg/m2, dl, iv drop, 5-FU 2400~2800 mg/m2, dl, 46h持续iv drop。每3周为一周期。
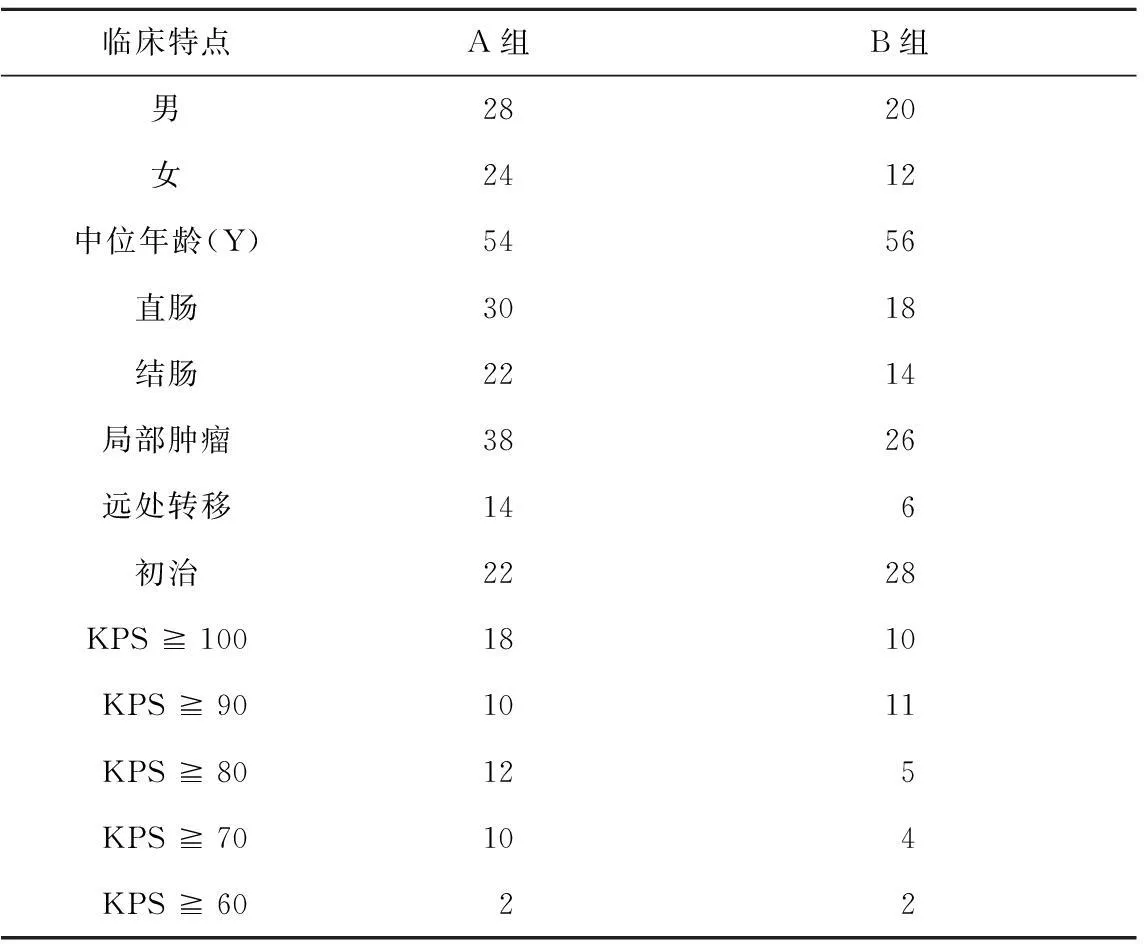
表1 入选患者基本情况
1.3诊断标准根据《临床诊疗指南—外科学分册》(中华医学会编著,人民卫生出版社),《NCCN结肠癌临床实践指南》(中国版,2009年第一版)。
1.4临床疗效评定标准疗效及毒性反应评价标准按WHO抗肿瘤药物客观疗效标准评价疗效:完全缓解(CR):肿瘤经过6个周期治疗后肿瘤完全消失并维持4周;部分缓解(PR):肿瘤经过6个周期治疗后肿瘤测量2个垂直最大径之积缩小达到50%或以上,并维持4周;稳定(SD):肿瘤缩小不足50%或增大不超过25%并维持4周;进展(PD):经过治疗后肿瘤继续增大超过25%。
总缓解率(RR)以“CR+PR”计算。疗效评价一般每化疗6周期进行1次。多脏器转移的患者总体疗效按单脏器最差疗效评价,评价为CR和PR患者四周后用相同办法确认。
1.5不良反应按WHO推荐抗癌药物常见不良反应分级标准评价[2]。
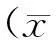
2 结果
2.1临床有效率治疗后两组近期疗效之间的比较,A组52例患者都接受6周期化疗,经6周期后评价疗效。52例患者中:近期有效率(RR )总体为65.4%,CR 18例(34.6% ),PR 16例(30.8%),初治患者的有效率为68.2%,局部肿瘤和远处转移病例有效率分别为63.2%和71.4%;B组32例患者都接受6周期化疗,经6周期后评价疗效。32例患者中近期疗效总有效率为37.5%,其中CR 1例(3.1%),PR 11例(34.4%),初治患者的有效率为42.9%,局部肿瘤和远处转移病例有效率分别为30.7%和66.7%,具体见表2。
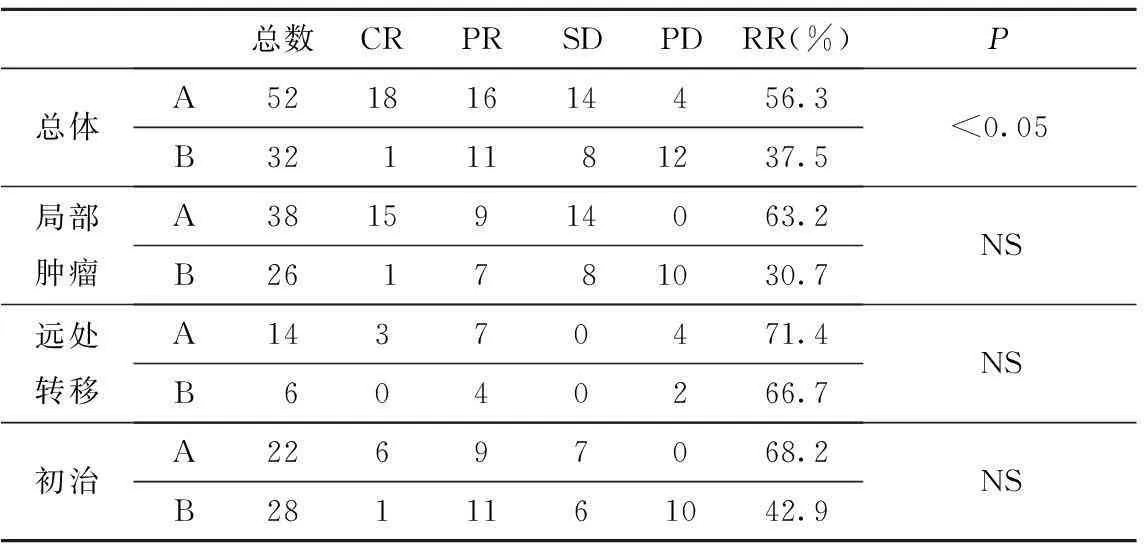
表2 两组间近期疗效对比
注:NS:无统计学意义
2.2治疗后两组KPS评分之间的比较A组KPS评分显著改善者22例(42.3%),改善者18例(34.6%),稳定者10例(19.2%),减退2例(3.8%);B组KPS评分显著改善者4例(12.5%),改善者8例(25%),稳定者6例(18.8%),减退14例(43.8%),具体见表3。

表3 治疗后两组KPS评分改善之间的比较
2.3两组患者不良反应情况A组患者共接受312周期化疗,均可评价不良反应。A组不良反应以消化道反应为主,骨髓抑制和神经毒性较少,骨髓抑制以白细胞减低为主,发生率为22.4%,其中大部分为轻度(I + II ),III+IV度占4.5%,部分会出现血小板减少,发生率为11.5%,其中大部分为轻度,III+IV度占3.8%,恶心呕吐的发生率为19.2%,脱发的发生率为18.9%,肝功异常的发生率为12.8%。周围神经毒性的发生率为19.2%;B组患者共接受192周期化疗,均可评价不良反应。不良反应以消化道反应、骨髓抑制和神经毒性为主,骨髓抑制以白细胞减低为主,发生率为51.6%,其中大部分为轻度(I + II ),III+Ⅳ度占20.3%,会出现血小板减少,发生率为50.0%,其中大部分为轻度(I + II ),III+IV度占12.5%,消化道反应的发生率为58.3%,脱发的发生率为39.6%,肝功异常的发生率为28.1%。周围神经毒性的发生率为50%,其中III+IV周围神经毒性的发生率为5.8%。两组相比,在粒细胞减少,消化道症状,脱发,肝功损害,神经毒性等方面A组的发生率要明显低于B组(P<0.05 ),详见表4。

表4 两组不良反应对比
2.4生存分析治疗后A、B两组比较:TTP为26周,P<0.05;OS为36个月,P<0. 05,60个月<0.01均有统计学意义(详见表5)
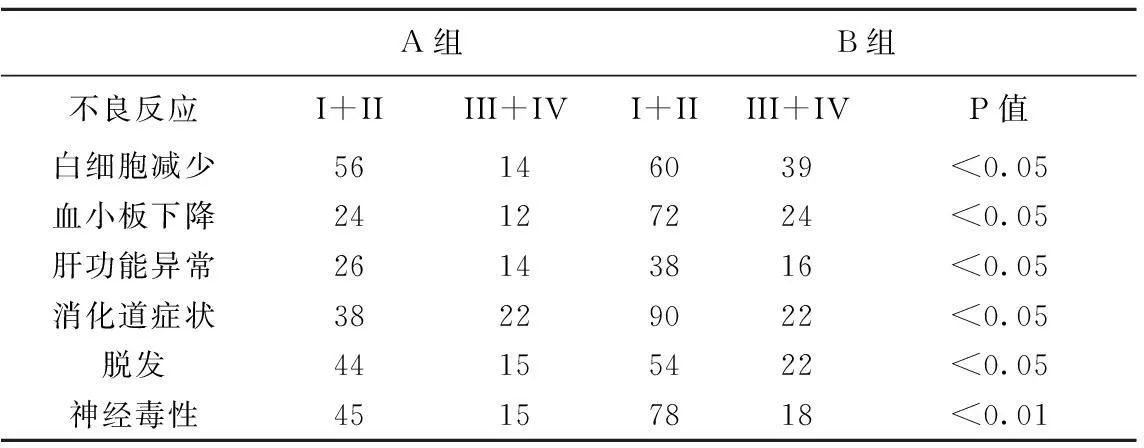
表5 两组生存数据对比
3 讨论
化疗在大肠癌的治疗过程中同样扮演着重要角色,FOLFOX方案[3]是一个以5-Fu为基础的一线方案,是国内外普遍使用,而且有效的治疗大肠癌的方案。中医药治疗大肠癌以辨证论治为主,辨证与辨病相结合。大肠癌的发病是大肠局部病变的全身表现,治疗是以中医的整体观念同时兼顾扶正与驱邪。从临床上来说,中医药治疗大肠癌体现在改善患者机能状况,联合化疗减毒增效,提高生活质量等方面。
抗癌液是全国名老中医宋光瑞教授的经验方,从古方“举元煎”(出自《景岳全书》)、“莪术散”(出自《寿世保元》)化裁而来。现代药理学研究表明,方中的许多单味药均有不同程度的抗肿瘤作用。黄芪味甘、性微温,归脾、肺经,功效补气升阳、生津养血、行滞通痹;党参性平、微温,归脾、肺经,功效大补元气、补脾益肺、生津安神。人参皂甙RH2在浓度为0.lμg/ml时具有较强的破坏肿瘤细胞活性作用,其机理是直接破坏、抑制瘤细胞DNA合成,提高机体的免疫力[4];土茯苓具有除湿、解毒、通利关节的功效,多用于痈肿瘰疠及邪毒的治疗。体外试验对子官颈癌培养株系JTC-26有抑制作用,抑制率在90%以上[5]。另外,土茯苓对AFB1所致的肝癌有抑制作用[6];白花蛇舌草性寒、味甘淡,功效清热解毒、利湿通淋。白花蛇舌草具有抗肿瘤作用[7],能抑制肿瘤细胞增殖,有诱导其凋亡的作用;败酱草味辛、苦,性微寒;归肝、胃、大肠经,具有清热解毒、消肿排脓和祛瘀止痛之功效。广泛用于肠痈、肠炎、痢疾及消化道肿瘤等。张永强等[8]研究了发现败酱草对U14荷瘤小鼠体内肿瘤有抑制作用,杨晓蕾[9]实验得出白花败酱草乙酸乙酯萃取获得的总黄酮部位具有体外诱导Hela细胞凋亡作用和对U14荷瘤小鼠的体内抗肿瘤活性,陈磊等[10]实验说明白花败酱草水提液可以诱导肿瘤细胞损伤;三棱味苦、辛,性平。归肝、脾经。功效破血行气,消积止痛。对人肺癌细胞AS49和小鼠肉瘤180有诱导细胞凋亡的作用[11]。而且随着用药剂量的增加,这种诱导作用表现出量效关系。叶建红等发现三棱抑癌作用的机制是诱导肿瘤细胞凋亡[12];莪术味辛、苦,性温,归肝、脾经,具有行气破血、消积止痛之功效,具有抗血管生成和抗肿瘤发生的作用[13]。其挥发油中的榄香烯抑制肿瘤细胞生长和下调Bcl-2基因及蛋白质表达的作用[14];甘草味甘,性平,归肺、脾、胃经,具有补脾益气,清热解毒,调和猪药的作用。严瑞琪等[15]发现甘草甜素(GL)对大鼠肝癌前病变有明显抑制作用。马靖等[16]报道,甘草提取物可诱导胃癌MGC803人肿瘤细胞凋亡。
黄芪补气升阳、生津养血,党参大补元气、补脾益肺、生津安神共为君药;三棱、莪术为臣药,破血行气、消积止痛;土茯苓、白花蛇舌草、败酱草共为佐药,清热解毒、利湿通淋、祛瘀止痛;炙甘草补虚、解毒,调和诸药为使药。全方八味药,君臣有序,佐使有节,使邪去而不伤正,标本兼治,共奏消积止痛、清热利湿之效。抗癌液组方紧扣病机,标本兼顾,抗癌液的有效性、科学性和先进性肯定而有根据,值得深入研究。
参考文献
[1]李世荣.实用结直肠癌外科学[M].北京:人民卫生出版社.2012:80-92.
[2]Miller AB, Hoogstraten B, Staquet M, Winkler A Reporting results of cancer treatment[J].Cancer,1981,47:207-214.
[3]胡文蔚,王赫,孙文辉.伊立替康联合氟尿啼陡亚叶酸钙治疗转移性大肠癌31例临床观察[J].中国癌症杂志,2008,18(1):77.
[4]潘敏求.中华肿瘤治疗大成[M].3版.石家庄:河北科学技术出版社,1996:124.
[5]李广勋.中药药理毒理与临床[M].天津:天津科技翻译出版公司,1992:42.
[6]严瑞琪,陈志英,覃国忠,等.当归等三种中药及联苯双酯对黄曲霉毒素B1致大鼠肝癌作用的影响[J].癌症,1986,5(2):141-145.
[7]Sanjiv Kumar YADAV,Shao Chin LEE Evidence for Oldenlandia diffusa-evoked cancer cell apoptosis through superoxide burst and caspase activation[J].Journal ofChinese Interative Medicine,2006,4(5):485-489.
[8]张永强,耿果霞,李青旺,等.败酱草总皂甙抗小鼠宫颈癌活性研究[J].动物医学进展,2011,32(3):69.
[9]杨晓蕾.败酱草总黄酮抗小鼠宫颈癌作用的研究[D].西安:西北农林科技大学硕士论文,2009.
[10]陈磊,张涛,田黎明,等.白花败酱草提取物对小鼠U14宫颈癌细胞的抑制作用[J].中国老年学杂志,2010,30(8):1091-1093.
[11]黄新炜,段玉峰,韩果萍,等.中药三棱的化学及药理研究进展[J].西安联合大学学报,2003,6(4):22-25.
[12]王喆,张瑾峰,付桂芳,等.莪术、三棱对人肺癌细胞凋亡的影响[J].首都医科大学学报,2001,22(4):304-305.
[13]Dorai T,Cao YC,Dorm B,et al.Therapeutic potential of Curcumin in human prostate cancerⅢ.Curcumin inhibits proliferation, induces apoptosis,and inhibits angiogenesis of LNCaP prostate cancer cells in vivo[J].Prostate, 2001,47(4):293-303.
[14]徐英辉,董斌,罗其中,等.榄香烯对大鼠胶质瘤C6细胞Bcl-2家族基因及蛋白表达的影响[J].中华医学杂志,2005,85(24):1700-1703.
[15]严瑞琪,黄小延,李俊丽,等.甘草甜素抑制致癌过程中对DNA损伤修复的影响[J].癌症,1995,14(4):245-248.
[16]马靖.甘草提取物体外选择性诱导几种人肿瘤细胞凋亡[J].癌症,2001,20(8):806-811.
doi:10.3969/j.issn.1003-8914.2016.08.003
文章编号:1003-8914(2016)-08-01060-03
收稿日期:(本文校对:宋太平2015-06-15)

