氦-氧机械通气在慢性阻塞性肺疾病急性加重期的作用
朱帅俊,陈冬梅,何鑫敏,翁钦永*
(1.福建医科大学附属协和医院重症医学科,福建 福州 350001;2.福建医科大学研究生院,福建 福州 350001)
氦-氧机械通气在慢性阻塞性肺疾病急性加重期的作用
朱帅俊1,陈冬梅1,何鑫敏2,翁钦永1*
(1.福建医科大学附属协和医院重症医学科,福建 福州 350001;2.福建医科大学研究生院,福建 福州 350001)
[摘要]目的探讨氦-氧机械通气对慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease, AECOPD) 患者气道峰压(peak airway pressure,P peak)、二氧化碳分压(partial pressure of carbon dioxide,PaCO2)、氧分压(partial pressure of oxygen,PaO2)以及炎症相关细胞因子白细胞介素8(interleukin 8 ,IL-8)和肿瘤坏死因子α(tumor necrosis factor,TNF-α)的作用。方法选择AECOPD机械通气患者60例,随机分为试验组和对照组各30例。所有患者采用改良后的密闭式呼吸机,试验组行氦-氧机械通气(60%氦∶40%氧),对照组行氮-氧机械通气(60%氮∶40%氧),观察2组治疗前和治疗后30、90、120 min患者P peak、PaO2、PaCO2的变化,并用酶联免疫吸附测定法分别检测2组4个时间点患者血清中IL-8和TNF-α的浓度。结果试验组P peak和PaCO2在治疗后30 min开始显著降低(P<0.05),随后维持稳定,但对照组较治疗前没有明显改善;试验组PaO2在治疗后30 min开始显著升高(P<0.05),随后维持稳定,而对照组较治疗前没有明显改善;试验组IL-8和TNF-α在治疗120 min后开始明显下降(P<0.05),而对照组始终没有得到改善。结论氦-氧机械通气能够显著降低AECOPD患者的气道压力,改善氧合,减少二氧化碳潴留,增加有效通气量,而且治疗达到一定时间后能降低炎症相关细胞因子IL-8和TNF-α的浓度,对慢性气道炎症有一定的调节作用,同时改良后的呼吸机实现了氦气的可循环利用,大大节约了治疗成本。
[关键词]肺疾病,慢性阻塞性;氦-氧机械通气;细胞因子类
doi:10.3969/j.issn.1007-3205.2016.05.007
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者一旦并发感染进入急性加重期, 呼吸困难显著加重, 呼吸肌疲劳度明显增加,二氧化碳分压(partial pressure of carbon dioxide,PaCO2)可明显增高, 部分患者在抗感染治疗同时, 需气管插管行有创机械通气以挽救生命[1]。机械通气作为治疗呼吸衰竭的最后有效手段,却多因采用正压通气方式, 很难避免机械通气所致肺损伤。氦气是一种小分子的惰性气体,结构稳定,具有低密度、高运动黏性系数的特性,氦气与氧气混合形成的氦氧混合气同样具有这样的特点[2]。自1935年氦氧混合气应用临床以来[3],多项研究表明,氦氧混合气具有减低气流在气道中的阻力、降低气道压、促进氧气向肺泡弥散及二氧化碳(carbon dioxide,CO2)的排除、减少呼吸作功、减少并发症等优点,能够用于急性重症哮喘、COPD、支气管肺发育不全和上气道阻塞性疾病的治疗[4-5],但目前国内相关研究多为动物实验或小样本临床试验。本研究通过改进呼吸机回路实现氦气循环利用,以慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease, AECOPD)患者为研究对象,观察氦-氧机械通气治疗后患者气道峰压(peak airway pressure,P peak)、动脉血氧分压(partial pressure of oxygen,PaO2)、PaCO2以及相关细胞因子的变化,旨在探讨氦-氧机械通气作为AECOPD患者常规治疗手段的可行性。
1 资料与方法
1.1一般资料选择2010年1月—2014年1月福建医科大学附属协和医院重症医学科收治的因AECOPD行有创机械通气患者60例。入选标准:①符合中华医学会呼吸病学会指定的AECOPD的诊断规范;②需机械通气治疗;③呼吸机参数吸入气中氧浓度分数(fraction of spiration O2,FiO2)维持在40%。排除标准:①呼吸机参数FiO2>40%或<40%;②血流动力学不稳定。随机分为试验组和对照组各30例。试验组男性21例,女性9例, 年龄45~85岁,平均(63.0±12.8)岁,对照组男性21例,女性9例, 年龄47~82岁,平均(65.7±11.4)岁。 2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
所有患者均签署知情同意书,本研究经医院伦理委员会审批(2013004)。
1.2方法
1.2.1呼吸机准备通过改进麻醉机(drag,德国)呼吸回路,实现氦气的循环利用。首先调节麻醉机空气流量为零,氦气接麻醉机一氧化二氮通路,改一氧化二氮通路为氦气通路,在试验开始前先予纯氧通气约2 h,并不断把氦气引入回路从而排尽呼吸回路内的氮气,呼吸管路“Y”形口接氧浓度测量仪,通过不断调整氦气和氧气的流量达到预设的氧浓度(40%)。
1.2.2呼吸参数设置容量控制模式:潮气量为8 mL/kg;呼吸频率为16 次/min;吸呼比为1∶2;FiO2为40%;呼吸末正压通气为 5 cmH2O;低压报警为≤10 cmH2O;高压报警为≥50 cmH2O。
1.3治疗2组均采用常规药物治疗(包括抗生素、支气管扩张剂、祛痰剂、糖皮质激素等)和机械通气治疗,待血流动力学稳定(未应用血管活性药物且维持在基础血压)和呼吸机参数稳定后开始下一步的治疗。试验组将氮氧通气换成氦氧通气(60%氦∶40%氧,FiO2为40%)(纯度>99.99%的氦来源于广东省深圳空气化工产品气体有限公司),对照组继续氮氧通气(60%氮∶40 %氧,FiO2为40%),记录所有患者治疗前和治疗后30、90、120 min 4个时间点的P peak,并抽取5 mL动脉血,其中1 mL用于血气分析,4 mL及时离心取上清液,采用酶联免疫吸附测定法检测所有患者血清中白细胞介素8(interleukin 8 ,IL-8)和肿瘤坏死因子α(tumor necrosis factor,TNF-α)浓度,IL-8和TNF-α检测试剂盒购于英国 Abcam 公司,均按照试剂盒说明书操作。
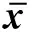
2 结 果
试验组P peak和PaCO2在治疗后30 min开始降低,之后稳定维持,但对照组变化不大;试验组的PaO2在治疗后30 min开始升高,之后稳定维持,而对照组变化不大;试验组的IL-8和TNF-α只在治疗后120 min明显下降,而对照组变化不大。 2组P peak、PaCO2和PaO2、IL-8和TNF-α在不同时点间、组间·时点间的交互作用差异均有统计学意义(P<0.01)。见表1。
表12组治疗前后P peak、PaO2、PaCO2、TNF-α和IL-8比较
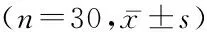
3 讨 论
氦氧混合气是氦气与氧气按一定比例混合后制成的一种低密度气体,首次应用于人类以来,至今已有70 多年的历史,最早潜水行业利用其来预防减压病的发生。随着对氦氧混合气研究的深入,发现它具有降低气道阻力、减轻呼吸肌疲劳、促进氧合等优点,甚至还具有一定生物化学作用和细胞保护作用,有报道它能降低生物新陈代谢率,减少能量消耗[6],减轻脏器缺血后炎症反应[7-8],减轻肺组织的炎症渗出[9],减轻生物体重要器官如心脏、大脑的缺血-再灌注损伤[10-11],降低机械通气使用率[12]等。但上述作用的具体机制尚不清楚。本研究创新性地实现了氦气的循环利用,旨在研究氦-氧机械通气对AECOPD患者P peak、PaO2、PaCO2以及细胞因子IL-8和TNF-α的影响,探讨氦-氧机械通气作为AECOPD常规治疗手段的可行性。
AECOPD患者因长期气道慢性炎症,中小气道变形、气道重塑非常明显, 加之分泌物较多而且黏稠,在进行传统机械通气治疗时往往P peak较高,而高气道阻力则会阻碍进行有效氧合和CO2的排出[13]。本研究结果显示,AECOPD患者氦-氧机械通气后各时间点P peak较对照组明显降低,同时各时间点PaCO2较对照组明显降低,PaO2较对照组也有较明显的改善。氦-氧机械通气之所以有上述效果,是因为气道阻力除了受气道内径的影响外,还受吸入气体的运动状态的影响,而氦氧混合气体具有低密度、雷诺系数小的特点,更倾向于层流运动,故在相同的气道内径情况下,吸入低密度氦氧混合气体进行机械通气与常规治疗相比,在降低气道压力和气道阻力方面具有显著的优势,从而改善氧合和促进CO2的排出。但AECOPD患者PaCO2、PaO2受到通气/血流比、弥散功能以及分流等众多因素影响,单靠氦氧混合气低密度、低阻力的物理特性,无法很好地解释氧合及CO2排出的改善。因此,推测氦氧混合气可能进一步改善肺组织弹性,令肺组织能最大限度地回缩,从而使通气/血流比失衡及弥散功能得到明显改善,一定程度上改善氧合,减少CO2潴留。相关文献亦有报道[14]。
IL-8主要由肺泡巨噬细胞、气道上皮细胞、中性粒细胞、淋巴细胞等分泌, 参与聚集和活化中性粒细胞和T淋巴细胞, 调节免疫反应, 促进中性粒细胞的炎症作用。TNF-α主要由单核细胞和巨噬细胞产生,可以强有力的激活中性粒细胞,刺激其分泌IL-8。有报道称COPD患者的气道炎症与IL-8及TNF-α释放增多有关,同时气道炎症的加重又会刺激IL-8及TNF-α释放增加,造成恶性循环[15]。本研究结果显示,AECOPD患者吸入氦氧混合气后120 min IL-8和TNF-α浓度较对照组显著降低,推测由于氦氧混合气降低气道压力,减少气压伤,一定程度上减轻气道炎症,从而减少IL-8、TNF-α等细胞因子的产生;但在吸入氦氧混合气后30 、90 min并没有发现这种改变,这是由于细胞因子生成及代谢需要一定反应时限。本研究设计起初,由于安全性考虑仅设计至120 min,但并没有观察到任何不良反应,这为以后的研究可以设计出更长时间的安全性提供了经验。
综上所述,氦氧混合气能降低AECOPD患者P peak、CO2潴留,改善氧合,减少损伤性细胞因子,减轻炎症的负面效应,较普通气体而言有其独特的优势,但因其制备困难, 价格昂贵,且具有高扩散性(能够从大多数严格密封的容器中逸出),导致其治疗成本过高,无法在临床中广泛开展。本研究通过改进呼吸机的回路将其改造成密闭式,实现了氦气的循环利用,将一桶150 L的高纯度氦气的使用时间由15 min延长到20 h,大大降低了氦氧混合气的使用成本。因此,本研究为氦-氧机械通气成为AECOPD常规治疗手段提供了理论依据和技术支持。
[参考文献]
[1]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007 年修订版)[J].中华结核和呼吸杂志,2013,36(4):255-264.
[2]肖永久,解立新.氦氧混合气Heliox在慢性阻塞性肺疾病治疗中的应用进展[J].中国呼吸与危重监护杂志,2010,9(4):436-438.
[3]李雪,陈龙,史源.氦氧混合气在临床应用研究进展[J/CD].中华临床医师杂志:电子版,2013,7(9):4030-4032.
[4]Gerbeaux P,Gainnier M,Arnal JM,et al. Effects of helium-oxygen mixtures on endotracheal tubes:an in vitro study[J]. J Biomech,2005, 38(1):33-37.
[5]游海平,张小霓,翁钦永.氦氧混合气在呼吸系统疾病中的应用[J].医学综述,2014,20(6):983-985.
[6]Singer D. Why 37 degrees C Evolutionary fundamentals of thermoregulation[J]. Anaesthesist,2007,56(9):899-902,904-906.
[7]Lucchinetti E,Wacker J,Maurer C,et al. Helium breathing provides modest antiinflammatory,but no endothelial protection against chemia-reperfusion injury in humans in vivo[J]. Anesth Analg,2009,109(1):101-108.
[8] 陈冬梅,翁钦永.氦氧机械通气对兔急性肺损伤模型的肺组织炎性反应和细胞凋亡的影响[J].中国临床医学,2013,20(6):751-754,758.
[9]Lucchinetti E,Wacker J,Maurer C,et al. Helium breathing provides modest antiinflammatory,but no endothelial protection against ischemia-reperfusion injury in humans in vivo[J]. Anesth Analg,2009,109(1):101-108.
[10]Pan Y,Zhang H,Acharya AB,et al.The effect of heliox treatment in a rat model of focal transient cerebral ischemia[J]. Neurosci Lett,2011,497(2):144-147.
[11]Huhn R,Heinen A,Weber NC,et al. Helium-induced late preconditioning in the rat heart in vivo[J]. Br J Anaesth,2009,102(5):614-619.
[12]徐伟,陆一鸣,陈尔真,等.氦氧混合气体治疗慢阻肺急性加重期的临床评价[J].中国急救医学,2007,27(8):685-687.
[13]解立新, 宋战平, 刘又宁.氦氧混合气联合雾化吸入药物治疗重症哮喘的协同作用[J].中华急诊医学杂志,2002,11(5):331-333.
[14]李志平,谢灿茂,郭禹标,等.慢性阻塞性肺疾病患者吸入氦氧混合气后肺功能改善的机制探讨[J].现代康复,2001,5(17):27-28.
(本文编辑:许卓文)
[收稿日期]2015-05-15;[修回日期]2015-06-29
[基金项目]福建省科技厅社会发展重点项目(2010Y0026)
[作者简介]朱帅俊(1980-),男,河南郏县人,福建医科大学附 *通讯作者。E-mail:wqy1961@yahoo.cn
[中图分类号]R563.9
[文献标志码]A
[文章编号]1007-3205(2016)05-0523-05
Effects of Helium-Oxygen Mechanical Ventilationin in patients with acute exacerbation of chronic obstructive pulmonary disease
ZHU Shuai-jun1, CHEN Dong-mei1, HE Xin-min2, WONG Qin-yong1*
(1.Department of Intensive Care Unit, Fujian Medical University Union Hospital, Fuzhou 350001,China;2.Department of Graduate School , the Affiliated First Hospital of Fujian Medical University, Fuzhou 350001, China)
【Abstract】ObjectiveTo investigate the effect of helium-oxygen mechanical ventilation on peak airway pressure(P peak), partial pressure of carbon dioxide(PaCO2), partial pressure of oxygen(PaO2), Interleukin 8(IL-8) and tumor necrosis factor α(TNF-α) in patients with acute exacerbation of chronic obstructive pulmonary disease(AECOPD). MethodsSixty cases of mechanical ventilation were selected and randomly divided into the experimental group and the control group,with 30 cases in each group. All patients were treated with modified closed ventilator. Experimental group was treated with helium-oxygen mechanical ventilation(60% helium vs 40% oxygen). Control group was treated with nitrogen-oxygen mechanical ventilation(60% nitrogen vs 40% oxygen), The changes of P peak, PaO2, PaCO2 were observed before treatment, 30 min, 90 min, 120 min after treatment. Enzyme linked immunosorbent assay were used to detect serum concentrations of IL-8 and TNF-α at four time points in 2 groups of patients. ResultsThe P peak and PaCO2 in experimental group were decreased significantly 30 min after treatment and then remained stability. But the control group did not improved significantly. The PaO2 in experimental group was increased significantly 30 min after treatment and then remained stability. But the control group did not improved significantly. The IL-8 and TNF-α in experimental group decreased significantly 120 min after treatment, while the control group did not improved significantly. ConclusionHelium-oxygen mechanical ventilation can significantly reduce AECOPD patients airway pressure, improve oxygenation and reduce carbon dioxide retention. When the treatment reaches a certain time, the helium oxygen mechanical ventilation can reduce concentrations of IL-8 and TNF-α, which has a certain regulating effect on chronic airway inflammation. At the same time, The improved ventilator can be achieved using the helium cycle, which greatly saves the cost of treatment.
[Key words]pulmonary disease, chronic obstructive; helium-oxygen mechanical ventilation; cytokines
属协和医院主治医师,医学硕士,从事危重症诊治研究。

